Médecine basée sur les preuves
Il n'y a pas de conclusion définitive à tirer de ces remarques. Il faut simplement se souvenir de l'extrême complexité des systèmes que l'on observe, de la relativité des connaissances que l'on peut en avoir, et de la distance fondamentale qui existe entre la pensée conceptuelle et la réalité. Notre analyse des phénomènes porte sur leur représentation dans notre mental et reste dépendante des conventions d'un jeu de langage. Ces dernières sont nécessaires à notre fonctionnement, mais limitent la portée de notre savoir.
Il n'y a pas de conclusion définitive à tirer de ces remarques. Il faut simplement se souvenir de l'extrême complexité des systèmes que l'on observe, de la relativité des connaissances que l'on peut en avoir, et de la distance fondamentale qui existe entre la pensée conceptuelle et la réalité. Notre analyse des phénomènes porte sur leur représentation dans notre mental et reste dépendante des conventions d'un jeu de langage. Ces dernières sont nécessaires à notre fonctionnement, mais limitent la portée de notre savoir.
Dans les systèmes complexes comme le métabolisme de la cellule myocardique, la distribution de la dépolarisation électrique ou la perfusion coronarienne, la connaissance exacte de tous les éléments en jeu dans la genèse d’un événement ne sera jamais possible. De plus, elle ne suffirait même pas à prédire sa survenue, qui restera aléatoire à nos yeux. La compréhension totale de l’ensemble des processus physiologiques est probablement inatteignable. Nous devons en quelque sorte renoncer à comprendre pourquoi un système complexe comme le cœur se comporte comme il le fait à tel moment de son existence [12].
Malgré cette incertitude fondamentale, on doit pouvoir proposer au patient des traitements que l’on a de bonnes de raisons de croire efficaces. C’est la raison pour laquelle on se fonde sur les preuves acquises au cours de nombreuses études contrôlées et randomisées (degré d’évidence supérieur), ou lors d’une seule étude randomisée et/ou de séries observationnelles (degré d’évidence modéré). Lorsque ces éléments ne sont pas disponibles, on se base sur l’opinion des experts ou sur le principe de précaution (degré d’évidence inférieur). Le niveau d’évidence (niveaux A, B et C) est donc une évaluation du degré de certitude dont on dispose pour fonder une recommandation. Les classes de recommandations (classes I, II et III) sont une estimation des bénéfices et des risques de la procédure ou du traitement envisagé (Figure 1.10).
- Niveau d'évidence A: données basées sur de multiples et larges études randomisées et contrôlées (RCT, randomised controlled trials) et/ou sur leurs méta-analyses;
- Niveau d'évidence B: données basées sur une seule étude randomisée et contrôlée ou sur de larges études observationnelles prospectives;
- Niveau d'évidence C: données basées sur des études rétrospectives, des consensus d'experts ou un principe de précaution;
- Recommandation de classe I: le bénéfice est largement supérieur au risque; la procédure ou le traitement sont utiles et efficaces; ils doivent (must) être appliqués;
- Recommandation de classe IIa: le bénéfice est probablement supérieur au risque; la procédure ou le traitement sont raisonnables et devraient (should) être appliqués;
- Recommandation de classe IIb: le bénéfice est douteux; la procédure ou le traitement peuvent être (may) envisagés;
- Recommandation de classe III: la procédure ou le traitement sont inefficaces ou dangereux et sont contre-indiqués.
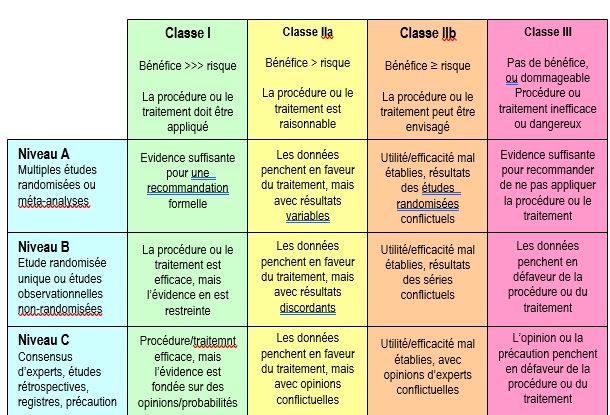
Figure 1.10 : Classification des recommandations et des niveaux d’évidence, selon le système adopté par les sociétés médicales (American Society of Anesthesiology, Society of Cardiovascular Anesthesiologists, European Society of Anaesthesiology, American Heart Association, American College of Cardiology, European Society of Cardiology, Society of Thoracic Surgeons, etc). Les classes de recommandations (classes I, IIa, IIb et III) sont une estimation des bénéfices et des risques de la procédure ou du traitement envisagé. Le niveau d’évidence (niveaux A, B et C) est une évaluation du degré de certitude dont on dispose pour fonder une recommandation.
Depuis les travaux publiés par la McMaster University (G Guyatt, Hamilton, Canada) au début des années 1990, la justification basée sur les données probantes (Evidence-based medicine, EBM) est considérée comme la manière la plus scientifique d'établir la validité d'une thérapeutique. Elle introduit une hiérarchie des preuves en plaçant l'expérimentation par assignation aléatoire (essai contrôlé et randomisé sur une large population, ou RCT, randomized-controlled trial) en tête de la fiabilité des sources, et en mettant en queue de valeur le jugement clinique et le raisonnement déductif [1,9]. Cette attitude largement partagée dans l'establishment médical mérite toutefois plusieurs commentaires.
- Le fait qu'une donnée apparaisse probante dépend de la grille de lecture qu'on adopte. Dans le cas de la médecine basée sur les faits, il s'agit du mode de penser rationnel et mécaniste de la science occidentale classique. Aussi rassurante qu'elle soit, la quantification rigoureuse d'un phénomène est un découpage arbitraire et conventionnel opéré sur une réalité fluide et mouvante en la morcelant en petites unités indépendantes que l'on peut manipuler mathématiquement.
- Conceptuellement, l'évidence n'en est une qu'au niveau local, dans l'enclave événementielle déterminée par le choix de la population investiguée, par les variables exclues et par la question posée. Cette situation est très différente de la "vraie vie" où chaque élément est noyé dans un réseau complexe d'interactions et de comorbidités. L'analyse linéaire du comportement de fragments isolés d'un système complexe ne peut pas rendre compte de ses propriétés émergentes en tant que tout organisé, car la science est une entreprise de simplification du réel [7]. Bien que classées inférieures aux essais randomisés dans la hiérarchie des sources, les études observationnelles ont l'intérêt incontestable d'investiguer les thérapeutiques dans la situation réelle des malades.
- L'odds ratio (rapport des chances, ou risque relatif) entre le groupe investigué et le groupe témoin se situe entre 0.5 et 0.8 dans la grande majorité des études randomisées. Le bénéfice de l'élément étudié est donc de 20 à 50%, ce qui reste assez modeste. Pour autant que l'essai soit correctement agencé, cette frilosité des résultats tient à la conception même de l'EBM. Au sein d'une causalité multifactorielle complexe comme celle de l'infarctus par exemple, il n'est pas concevable que la modification d'un seul facteur causal puisse à elle seule renverser la situation, car d'innombrables interactions et redondances interfèrent avec le résultat. La nature même du vivant est une limite à la portée de l'expérimentation par assignation aléatoire.
- Cette forme d'appréhension de la réalité n'est pas la seule dont dispose l'esprit humain. Le concept de "logique floue" et les mathématiques du chaos réhabilitent des mécanismes comme l'intuition et le jugement clinique, qui analysent les phénomènes dans leur globalité. Ces modalités, volontiers qualifiées de subjectives, sont fondamentales dans notre appréhension du réel. Nous les utilisons constamment pour proposer un traitement ou choisir une salade. Le raisonnement rationnel est en général la justification d'une option prise antérieurement au niveau subjectif. La croyance dans la primauté de l'évidence quantitative est une idée préconçue issue de l'adhésion inconditionnelle et sans esprit critique au paradigme déterministe de la science classique: la prétention d'objectivité repose en fait sur un choix premier non-objectif.
- Les études randomisées et contrôlées portant sur plusieurs milliers de malades sont d'une incontestable rigueur statistique, mais restent biaisées par la distribution aléatoire, donc indiscriminée, de la mesure évaluée au sein de la population choisie. L'étude POISE, par exemple, trouve une surmortalité associée aux béta-bloqueurs, mais chez les malades à qui on n'en aurait jamais donné parce que sans indication [4]. Lorsque l'effet primaire d'un médicament est inutile, seuls apparaissent ses effets secondaires. Or les risques associés à des substances dans les situations où elles sont sans indication perdent leur poids dans les situations où elles sont thérapeutiques. Il en est de même pour les techniques de monitorage. A cause de ce ratissage large, les RCT contredisent souvent les études prospectives ciblées qui portent sur les patients les plus susceptibles de bénéficier de la substance.
- Il existe toujours une zone d'indécidabilité, souvent appelée "zone grise", entre le seuil de valeur inférieur en dessous duquel une variable est clairement normale et le seuil de valeur supérieur au-dessus duquel elle est clairement pathologique (ou l'inverse selon la variable choisie). Selon que l'on privilégie la spécificité ou la sensibilité, l'étendue de la zone grise se déplace vers son extrémité pathologique ou physiologique, respectivement. Jusqu'à 25% des patients peuvent se trouver dans cette zone d'indécidabilité selon la situation étudiée [3]. Le sort des malades se trouvant dans cette zone relève du jugement clinique du praticien et non de l'évidence déductible d'un RCT.
- La médecine basée sur la preuve n'apporte de réponse qu'à une question déjà formulée. Elle ne permet pas d'explorer un domaine totalement nouveau. Elle est aveugle aux découvertes par sérendipité. Elle n’apporte pas non plus de réponse à des situations qui ne peuvent pas faire l’objet d’essais répétés, comme la mise en évidence d’évènements rares mais très dangereux. Accorder la priorité aux études contrôlées et randomisées prive la médecine d'idées originales et de découvertes inattendues.
- La combinaison des travaux issus de l’EBM et de leur publication dans des revues à comité éditorial (évaluation par des pairs) contribue à façonner un paradigme médical restrictif et dominateur qui tend à exclure toute théorie ou toute démarche qui ne serait pas conforme au dogme conventionnel. On est très loin de l’objectivité et de la neutralité auxquelles cette attitude se réfère pourtant avec insistance.
- Les résultats des RCT permettent de formuler des recommandations (Guidelines) qui sont une aide précieuse à la prise de décision thérapeutique, mais qui ne s'appliquent qu'à une population spécifique subissant une intervention donnée, et qui ne correspondent qu'à des conséquences prédéfinies (mortalité, diverses morbidités) à l'exclusion de toutes les autres (bien-être, indépendance, mobilité, etc). Toutefois, comme on l'a déjà relevé précédemment, près de la moitié des recommandations publiées en cardiologie ne sont pas issues de travaux ayant un haut degré d'évidence (degré d'évidence A), mais d'opinion d'experts, de registres et d'études rétrospectives (degré d'évidence C) [11]. Dans un domaine aussi complexe que la médecine, elles contiennent obligatoirement une part d'incertitude [5]. C'est au jugement clinique du praticien de décider si elles s'appliquent à un malade particulier. L'application des recommandations à des patients différents de ceux des études originales se solde en général par un résultat médiocre [10].
- L’EBM procure un faisceau de données externes "objectives" qui doivent se combiner simultanément à l’expertise du clinicien et aux données contextuelles (sociales, culturelles, psychologiques, etc) du patient. Une prise en charge efficace de ce dernier combine ces trois éléments ; elle n’est pas la simple application d’une recommandation, comme s’il s’agissait d’un règlement juridique. Un protocole clinique ne saurait en aucun cas remplacer le jugement du praticien ni le vécu du malade.
- L'EBM donne davantage de poids à la signification statistique qu'à la signification clinique, qui est celle qui compte pour le patient. Elle est valable pour des populations, non pour un individu donné. Elle est centrée sur la maladie, non sur le malade. Elle développe une attitude dogmatique pour un p < 0.05 et se concentre sur des marqueurs aisément quantifiables tels la mortalité ou l'incidence de morbidités bien définies. Elle rechigne à publier des résultats négatifs, et exclut de ses travaux les malades âgés, polymorbides et peu compliants qui faussent la pureté des résultats [9].
En opposition à l'EBM, la médecine "personnalisée", ou precision medicine, est en plein essor. Cette attitude analyse les particularités d'un patient individuel (variantes génomiques, constitution phénotypique, dépendances, situation psycho-sociale) et l'impact d'une action médicale sur son devenir personnel. Au lieu d'étudier comme l'EBM les résultats moyens sur une population vaste mais sélectionnée, elle prend en considération la réponse variable du malade au sein d'un groupe diagnostique par nature hétérogène [2]. Des logiciels issus de l'intelligence artificielle et du big data permettent déjà de grouper les malades en fonction d'ensembles phénotypiques par l'analyse de très nombreuses données cliniques, fonctionnelles et thérapeutiques [8]. Ce nouveau paradigme permettra sans doute une prise en charge individualisée plus efficace que la tendance "one size fits all" qui prévaut encore actuellement avec l'EBM. A l'idée que chaque patient est différent et demande une prise en charge adaptée, s'ajoute le fait que les mécanismes physiopathologiques sont multifactoriels et interdépendants. Il est vain de chercher à résoudre un problème complexe en ne visant qu'une donnée particulière. De même, la prise en charge globale d'un malade demande un ensemble de mesures (bundle of therapies) agissant en divers points du circuit nosologique. Bien qu'il puisse paraître banal, cet aspect de la réalité est largement scotomisé par la médecine basée sur les preuves. L'evidence-based medicine ne prend manifestement pas en compte la totalité des évidences.
Complexité et imprévisibilité
L’apparition d’une propriété émergente dans un système complexe, comme un infarctus ou une tachycardie ventriculaire dans le cas d’un coeur, est le résultat d’un tel nombre de combinaisons possibles que leur prévision pose des problèmes insurmontables quantitativement et qualitativement. Mais une relation causale non linéaire n'est pas une relation inexistante. L'absence de lien direct invite à la prudence, non à l'ignorance. L’absence de relation univoque entre l'ischémie peropératoire vue à l'ECG et l'infarctus postopératoire, par exemple, n'est pas une raison pour négliger le phénomène lorsqu'il se produit. En clinique, la prudence prime: mieux vaut prendre au sérieux une information non prouvée que scotomiser un signe potentiellement annonciateur d’accident. Nos interventions sur l’organisme humain croisent un nombre incalculable de processus, et leurs conséquences ne sont jamais totalement prévisibles. Comme le suggère Stuart Kaufman : « On ne peut jamais savoir si notre prochain pas ne sera pas celui qui déclenchera le glissement de terrain du siècle ; il vaut donc mieux avancer avec précaution. Nous ne pouvons pas connaître les conséquences réelles de nos actions. Tout ce que nous pouvons faire est d’agir de notre mieux au niveau local » [6]. Chaque détail du quotidien mérite le même soin, non par perfectionnisme mais par réalisme : en effet, chaque petit geste peut être celui qui fait s’effondrer le tas de sable et entraîne la catastrophe. Les théories de la complexité devraient donc nous inciter à la prudence et à la modestie, comme le démontrera le chapitre suivant (voir Chapitre 2, Sécurité et anesthésie).
Complexité et imprévisibilité
L’apparition d’une propriété émergente dans un système complexe, comme un infarctus ou une tachycardie ventriculaire dans le cas d’un coeur, est le résultat d’un tel nombre de combinaisons possibles que leur prévision pose des problèmes insurmontables quantitativement et qualitativement. Mais une relation causale non linéaire n'est pas une relation inexistante. L'absence de lien direct invite à la prudence, non à l'ignorance. L’absence de relation univoque entre l'ischémie peropératoire vue à l'ECG et l'infarctus postopératoire, par exemple, n'est pas une raison pour négliger le phénomène lorsqu'il se produit. En clinique, la prudence prime: mieux vaut prendre au sérieux une information non prouvée que scotomiser un signe potentiellement annonciateur d’accident. Nos interventions sur l’organisme humain croisent un nombre incalculable de processus, et leurs conséquences ne sont jamais totalement prévisibles. Comme le suggère Stuart Kaufman : « On ne peut jamais savoir si notre prochain pas ne sera pas celui qui déclenchera le glissement de terrain du siècle ; il vaut donc mieux avancer avec précaution. Nous ne pouvons pas connaître les conséquences réelles de nos actions. Tout ce que nous pouvons faire est d’agir de notre mieux au niveau local » [6]. Chaque détail du quotidien mérite le même soin, non par perfectionnisme mais par réalisme : en effet, chaque petit geste peut être celui qui fait s’effondrer le tas de sable et entraîne la catastrophe. Les théories de la complexité devraient donc nous inciter à la prudence et à la modestie, comme le démontrera le chapitre suivant (voir Chapitre 2, Sécurité et anesthésie).
| Médecine basée sur les données probantes |
|
La médecine basée sur les preuves (Evidence-based medicine) donne la priorité aux résultats des grandes études randomisées et contrôlées par rapport aux études observationnelles et aux opinions d'experts ou à l'analyse de registres.
- Degré d'évidence A: basé sur de nombreux et larges essais randomisés-contrôlés
- Degré d'évidence B: unique essai randomisé-contrôlé ou larges études observationnelles
- Degré d'évidence C: études rétrospectives, opinion d'experts, principe de précaution
Elle en déduit des recommandations cliniques classées en 4 catégories
- Classe I: la procédure ou le traitement sont utiles et efficaces, le bénéfice est clair - Classe IIa: la procédure ou le traitement sont raisonnables et devraient être appliqués
- Classe IIb: la procédure ou le traitement peuvent être envisagés, le bénéfice est douteux
- Classe III: la procédure ou le traitement sont inefficaces ou dangereux (risque > bénéfice)
Mais cette hiérarchie des preuves souffre de certaines faiblesses: priorité à la signification statistique par rapport à la signification clinique, dépendance du mode de penser rationnel et mécaniste de la science classique, validité restreinte à des populations hautement sélectionnées, ignorance du poids de l'intuition et du jugement clinique dans les décisions médicales, ignorance du contexte socio-culturel et psychologique du patient, extrapolation à la population générale de recommandations déduites de populations particulières, restriction des conséquences à des données quantifiables (ex: mortalité) à l'exclusion des aspects qualitatifs (ex: bien-être).
|
© CHASSOT PG Avril 2007. Mise à jour Janvier 2012, Juillet 2017, Décembre 2019
Références
- ANDERSEN H. Mechanisms: what are their evidence for in evidence-based medicine? J Eval Clin Pract 2012; 18:992-9
- BLACKSTONE EH. Precision medicine versus evidence-based medicine. Individual treatment effect versus average treatment effect. Circulation 2019; 140:1236-8
- CANNESSON M, LE MANACH Y, HOFER CK, et al. Assessing the diagnostic accuracy of pulse pressure variations for the prediction of fluid responsiveness. A “grey zone” approach. Anesthesiology 2011; 115:231-41
- DEVEREAUX PJ, YANG H, YUSUF S, et al, for the POISE Study Group. Effects of extended-release metoprolol succinate in patients undergoing non-cardiac surgery (POISE-trial): a randomised controlled trial. Lancet 2008; 371:1839-47
- IMBERGER G. Clinical guidelines and the question of uncertainty. Brit J Anaesth 2013; 111:700-2
- KAUFMAN S. At home in the Universe. The search for the laws of self-organisation and complexity. New York, Oxford University Press, 1995
- POPPER K. L'Univers irrésolu, plaidoyer pour l'indéterminisme. Hermann, Paris, 1984
- SHAH SJ, KITZMAN DW, BORLAUG BA, et al. Phenotype-specific treatment of heart failure with preserved ejection fraction. Circulation 2016; 134:73-90
- SHERIDAN DJ, JULIAN DG. Achievements and limitations of evidence-based medicine. J Am Coll Cardiol 2016; 68:204-13
- TINETTI ME, McAVAY G, TRENTALANGE M, et al. Association between guideline recommended drugs and death in older adults with multiple chronic conditions: population based cohort study. BMJ 2015; 351:h4984
- TRICOCI P, ALLEN JM, KRAMER JM, et al. Scientific evidence underlying the ACC/AHA clinical practice guidelines. JAMA 2009; 301:831-41
- ZWIRN HP. Les systèmes complexes. Mathématiques et biologie. Paris: Odile Jacob, 2006
