La voie endovasculaire présente de nombreux avantages par rapport à la technique à ciel ouvert: réduction des saignements, meilleure stabilité hémodynamique, absence de thoracotomie ou de sternotomie, de ventilation mono-pulmonaire, de clampage aortique, de CEC et d’anticoagulation. Elle réduit la mortalité de la cure d’anévrysme descendant à 1-2% (4-10% par thoracotomie), et le taux de paraplégie à 2-5% (au lieu de 3-10%) [3]. Dans les lésions de la crosse, elle diminue la mortalité à 4% (6-15% à ciel ouvert), mais sans réduire significativement le risque d'AVC (5-15%) [28]. Il en est de même dans les situations d’urgence (rupture traumatique, dissection B avec ischémie d’organes), où la mortalité est abaissée de 30% à 9% [17,22].
Endoprothèse de la crosse
L'endoprothèse est constituée d'un large tube implanté dans l'aorte ascendante (2-5 cm en aval de la jonction sino-tubulaire) complété par 1, 2 ou 3 stents connectés qui s'introduisent dans les vaisseaux de la gerbe. Les indications classiques de la chirurgie de la crosse sont l'anévrysme (diamètre ≥ 5.5 cm), la dissection, l'athérome térébrant dans la paroi et l'hématome intrapariétal (épaississement circonférentiel de ≥ 0.5 cm) [28]. Il en existe actuellement 4 modèles à 1 ou 2 embranchements (Zenith™, GORE TAG™, Valiant Mona LSA™ et Relay-Branchendo™), et un modèle à 3 embranchements pour stenting intravasculaire complet [16]. La prothèse endo-aortique est introduite par l'artère fémorale; les embranchements sont placés par canulations carotidiennes ou axillaires et rejoignent les orifices prévus à cet effet sur la prothèse principale. Le taux de succès immédiat est de 80-99%, mais plusieurs complications sont à craindre: endofuite (28% immédiat, 5% résiduel à 6 mois), AVC (5-15%), signes d'ischémie médullaire si la prothèse se continue dans l'aorte descendante (1-7%) [28].
La multiplicité des dénudations vasculaires (fémorale droite, carotidienne droite, carotidienne/sous-clavière gauche) et la longueur de l'intervention (4-5 heures) nécessitent une anesthésie générale avec intubation; celle-ci permet en outre un usage libéral de l'ETO. L'équipement consiste en un cathéter artériel radial droit (seul bras disponible), un cathéter central multilumière long en veine fémorale gauche et un introducteur veineux fémoral droit (pace-maker et voie de gros calibre). L'artère fémorale droite est utilisée par l'opérateur pour monter la prothèse principale. L'héparine est dosée pour un ACT de 250-300 secondes. Il est impératif de réduire le débit cardiaque par un pacing rapide (180-200 batt/min) pendant le déploiement de l'endogreffe car son extrémité proximale est à 2 centimètres de la jonction sino-tubulaire et le débit normal la ferait immanquablement reculer. La ligne artérielle radiale droite est momentanément perdue pendant le déploiement de la prothèse dans le tronc brachio-céphalique. Si la prothèse s'étend distalement dans l'aorte descendante, il est prudent d'installer un drainage lombaire du LCR (voir Protection médullaire). Selon la position de l'endoprothèse, le nombre d'embranchements et les bypass préalables entre carotides et sous-clavières (voir Opérations hybrides), la perfusion cérébrale est momentanément interrompue dans l'une ou l'autre des carotides comme lors d'une thrombendartérectomie carotidienne. La surveillance de la ScO2 (NIRS) est alors essentielle; une baisse de > 20% de celle-ci doit déclencher immédiatement le traitement adéquat (vasoconstricteur pour PAM > 80 mmHg, FiO2 0.8-1.0, Hb > 100 g/L, agent inotrope si l'ETO révèle une dysfonction du VG, etc). L'ETO offre de nombreux intérêts: contrôle de la position des guides et de la prothèse, du flux coronarien et de la contractilité segmentaire, d'une éventuelle insuffisance aortique ou d'un épanchement péricardique. Un soin particulier est porté au maintien de la normothermie de manière à extuber le patient sur table en fin d'intervention. Une CEC est prête en stand-by pendant toute l'intervention [16,28].
Endoprothèse de la crosse
L'endoprothèse est constituée d'un large tube implanté dans l'aorte ascendante (2-5 cm en aval de la jonction sino-tubulaire) complété par 1, 2 ou 3 stents connectés qui s'introduisent dans les vaisseaux de la gerbe. Les indications classiques de la chirurgie de la crosse sont l'anévrysme (diamètre ≥ 5.5 cm), la dissection, l'athérome térébrant dans la paroi et l'hématome intrapariétal (épaississement circonférentiel de ≥ 0.5 cm) [28]. Il en existe actuellement 4 modèles à 1 ou 2 embranchements (Zenith™, GORE TAG™, Valiant Mona LSA™ et Relay-Branchendo™), et un modèle à 3 embranchements pour stenting intravasculaire complet [16]. La prothèse endo-aortique est introduite par l'artère fémorale; les embranchements sont placés par canulations carotidiennes ou axillaires et rejoignent les orifices prévus à cet effet sur la prothèse principale. Le taux de succès immédiat est de 80-99%, mais plusieurs complications sont à craindre: endofuite (28% immédiat, 5% résiduel à 6 mois), AVC (5-15%), signes d'ischémie médullaire si la prothèse se continue dans l'aorte descendante (1-7%) [28].
La multiplicité des dénudations vasculaires (fémorale droite, carotidienne droite, carotidienne/sous-clavière gauche) et la longueur de l'intervention (4-5 heures) nécessitent une anesthésie générale avec intubation; celle-ci permet en outre un usage libéral de l'ETO. L'équipement consiste en un cathéter artériel radial droit (seul bras disponible), un cathéter central multilumière long en veine fémorale gauche et un introducteur veineux fémoral droit (pace-maker et voie de gros calibre). L'artère fémorale droite est utilisée par l'opérateur pour monter la prothèse principale. L'héparine est dosée pour un ACT de 250-300 secondes. Il est impératif de réduire le débit cardiaque par un pacing rapide (180-200 batt/min) pendant le déploiement de l'endogreffe car son extrémité proximale est à 2 centimètres de la jonction sino-tubulaire et le débit normal la ferait immanquablement reculer. La ligne artérielle radiale droite est momentanément perdue pendant le déploiement de la prothèse dans le tronc brachio-céphalique. Si la prothèse s'étend distalement dans l'aorte descendante, il est prudent d'installer un drainage lombaire du LCR (voir Protection médullaire). Selon la position de l'endoprothèse, le nombre d'embranchements et les bypass préalables entre carotides et sous-clavières (voir Opérations hybrides), la perfusion cérébrale est momentanément interrompue dans l'une ou l'autre des carotides comme lors d'une thrombendartérectomie carotidienne. La surveillance de la ScO2 (NIRS) est alors essentielle; une baisse de > 20% de celle-ci doit déclencher immédiatement le traitement adéquat (vasoconstricteur pour PAM > 80 mmHg, FiO2 0.8-1.0, Hb > 100 g/L, agent inotrope si l'ETO révèle une dysfonction du VG, etc). L'ETO offre de nombreux intérêts: contrôle de la position des guides et de la prothèse, du flux coronarien et de la contractilité segmentaire, d'une éventuelle insuffisance aortique ou d'un épanchement péricardique. Un soin particulier est porté au maintien de la normothermie de manière à extuber le patient sur table en fin d'intervention. Une CEC est prête en stand-by pendant toute l'intervention [16,28].
Endoprothèse thoraco-abdominale
L'endoprothèse permet de couvrir de l'intérieur des anévrysmes de l'aorte thoracique descendante ou de la crosse distale, des dissections localisées, ou des ruptures traumatiques de l'isthme dont la paroi externe est préservée (Figure 18.49, Figure 18.50).
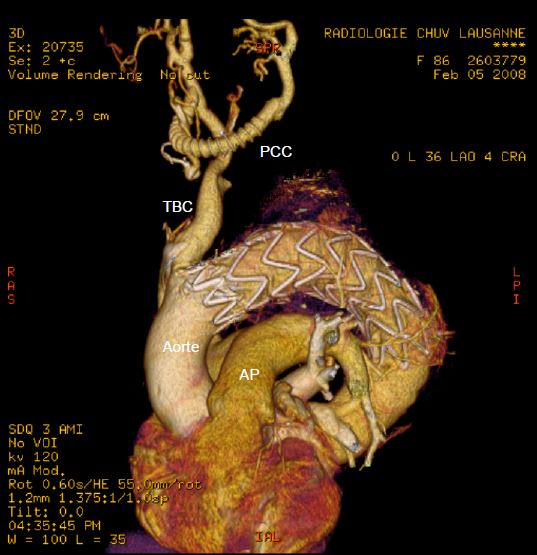
Figure 18.49 : Endoprothèse aortique mise en place dans la partie terminale de la crosse et la partie proximale de l’aorte descendante, pour occlure un anévrysme sacculaire de la crosse distale. Comme la prothèse couvre la sous-clavière gauche et la carotide commune gauche, un pontage carotido-carotidien (PCC) extrathoracique avec un tube en Dacron armé a été réalisé en premier lieu. Dans ce cas, l’anesthésie a été réalisée par un bloc cervical superficiel bilatéral et une infiltration fémorale. TBC : tronc brachio-céphalique.
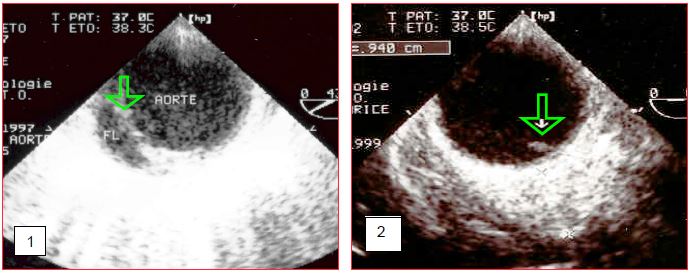
Figure 18.50 A : Images échographiques transoesophagiennes de lésions traumatiques de l'isthme aortique qui sont d’excellentes indications à une endoprothèse. 1: dissection traumatique de la paroi aortique (FL: fausse lumière); la lésion représente moins du tiers de la circonférence de l'aorte. 1: déchirement intimal traumatique.
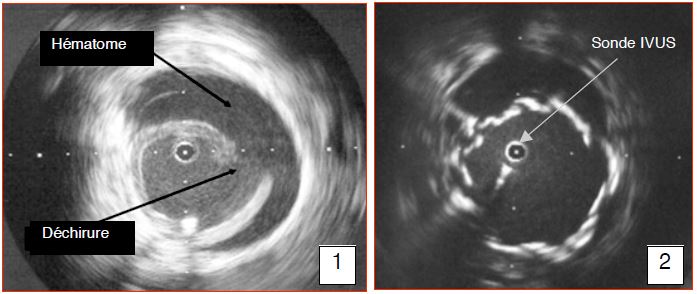
Figure 18.50 B : images échographiques intravasculaires (IVUS) d'une rupture traumatique de l'aorte thoracique. 1: déchirure pariétale avec son hématome périaortique. 2: déploiement de l'endoprothèse [12].
Le diamètre et la longueur du collet d'implantation proximal ou distal doivent être respectivement de < 40 mm et de > 20 mm; la prothèse doit être surdimensionnée de 10-15% par rapport au diamètre de l'aorte native aux points d'implantation [8]. Il peut arriver que l'artère sous-clavière gauche soit obstruée par la prothèse; dans ce cas, un pontage carotido-sous-clavier préalable permet de rétablir le flux dans le bras gauche mais surtout de rétablir l'apport sanguin à la partie céphalique de la moelle. Par contre, la structure étanche de la prothèse armée ne permet pas d'assurer la perméabilité des artères intercostales et médullaires, d'où le risque de lésions neurologiques (paraplégie) si l'étendue couverte est trop longue (> 20-30 cm); ce risque varie de 1% à 10% (moyenne 4%) selon le type de lésion et la longueur de la prothèse [5,6,15,26]. L'incidence d'AVC par embolisation cérébrale lors des manipulations des cathéters est de 1-3% [13].
Lorsque l’anévrysme s’étend dans la crosse ou dans l’aorte abdominale, on dispose de plusieurs types de prothèses fenestrées ou munies d’embranchements, qui maintiennent le débit dans les vaisseaux émergents de l’aorte. La technique chirurgicale est complexe et implique un site de canulation fémoral pour l'introduction de la prothèse elle-même et un site axillo-huméral gauche pour l'introduction des branches. Les prothèses sont souvent manufacturées sur mesure en fonction des données de l'angio-CT; elles possèdent des marquages radio-opaques qui permettent de les orienter en fonction de la position des vaisseaux ciblés repérés par angiographie (soustraction digitale). Des stents sont placés secondairement à travers les fenestrations dans le vaisseau revascularisé. Lorsque ces vaisseaux sont issus de la coque de l'anévrysme à distance de l'endoprothèse, on utilise de préférence des prothèses munies d'embranchements (tubes de Dacron) que l'on introduit dans l'artère visée depuis le haut par une canulation brachiale gauche (Figure 18.51) [13]. On peut aussi avoir recourt à des interventions hybrides (voir Opérations hybrides).
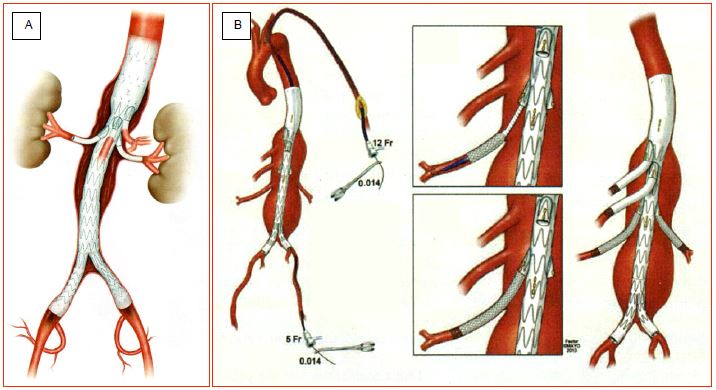
Figure 18.51: Exemples d'endoprothèses thoraco-abdominales avec embranchements. A: endoprothèse thoraco-abdominale multibranchée. B: manœuvres de mise en place d'une endoprothèse thoraco-abdominale par voie fémorale gauche (corps de la prothèse) et axillaire gauche (branches); des stents métalliques nus assurent l'ancrage et l'étanchéité à la jonction des branches et des vaisseaux reperfusés [D'après: Oderich GS, et al. Endovascular Today 2015; 11:11-8].
La mortalité périopératoire de l'endoprothèse dans la cure d'anévrysme thoraco-abdominal n'est pas très différente de celle par voie chirurgicale ouverte: 5.7% versus 8.3%; le risque de paraplégie est de 2-4.3% versus 4-7.5% dans les meilleures séries [15]. Le gain le plus marqué est la diminution de l'insuffisance rénale et des complications respiratoires [13]. Le risque de paraplégie dans les endoprothèses est lié à plusieurs phénomènes [10].
- Couverture par la prothèse des orifices des artères intercostales;
- Couverture de l'origine de l'artère sous-clavière gauche sans revascularisation préalable par la carotide gauche (perte de la vascularisation proximale de la moelle);
- Embolisation de matériel athéromateux dans les artères intercostales;
- Hypotension artérielle (PAM < 60 mmHg) pendant le positionnement et le largage de la prothèse;
- Obstruction de l'origine de l'artère iliaque interne par l'introducteur ilio-fémoral (perte de la vascularisation lombaire distale de la moelle);
- Cure préalable de lésion aortique abdominale avec compromission des artères iliaques internes et de la mésentérique inférieure;
- Suppression de deux étages de la vascularisation médullaire;
- Dissection aortique (à cause de l'absence de collatéralisation comme dans un anévrysme athéromateux d'installation lente).
Comme dans les interventions ouvertes, une stratégie multimodale de protection médullaire doit être mise en place selon un protocole institutionalisé (voir Tableau 18.7).
Anesthésie
Des investigations cardiologiques approfondies n'ont guère de retombées sur la mortalité ou sur l'incidence d'infarctus dans les cures d'anévrysme à ciel fermé, et ne sont indiquées que lors de coronaropathie instable ou d'insuffisance ventriculaire non compensée [14]. En cas de pose d'un drainage de LCR, les anticoagulants et les antiplaquettaires sont interrompus selon les recommandations pour la loco-régionale rachidienne (voir Tableau 8.12). Il n'y a pas de contre-indication au maintien de l'aspirine (< 250 mg/j). Les statines sont bénéfiques en chirurgie vasculaire; leur effet anti-inflammatoire est potentiellement utile pour diminuer le syndrome post-implantatoire, qui consiste en une réaction inflammatoire majeure avec fièvre, leucocytose, coagulopathie et élévation de la CRP. La prednisolone est souvent prescrite dans ce but.
La littérature ne rapporte pas de différence significative dans le devenir des malades opérés sous anesthésie générale (AG) ou sous anesthésie péridurale [13]. Cependant, la procédure est longue (≥ 5 heures), réclame une immobilité absolue pendant les repérages et les déploiements, et utilise généralement deux voies d'abord différentes. Il est également possible de procéder sous anesthésie locale et sédation [23]. D'une manière générale, la tendance est de pratiquer de plus en plus de cas sous anesthésie locale avec sédation ou sous péridurale, particulièremenet les malades qui souffrent de BPCO. Comme l'ETO n'est ni prudent ni tolérable en l'absence d'intubation, la surveillance échographique doit être réalisée par voie endovasculaire (IVUS). Dans tous les cas, il est primordial de maintenir la normothermie.
L'équipement consiste en un cathéter artériel radial droit et deux voies veineuses dont une de gros calibre (14-G), car les pertes sanguines moyennes sont de l'ordre de 700-800 mL [13]. Le saturomètre et la manchette à pression sont placés au bras gauche pour la surveillance du flux dans la sous-clavière gauche. Une voie centrale est indiquée de routine pour deux raisons : 1) l’instabilité hémodynamique peut nécessiter une perfusion de vasopresseurs ou de vasodilatateurs, 2) l’installation d’urgence sur le côté en cas de passage en thoracotomie gauche ne permet pas la mise en place de la voie centrale à la demande. Dans les cas complexes, la mise en place d'un introducteur permet des perfusions à haut débit et le passage d'un cathéter pulmonaire si l'indication en survient. L'ETO est très utile pour guider l'opérateur lorsqu'il monte le mandrin qui doit se positionner dans la vraie lumière et éviter la fausse lumière ou le cul-de-sac de l'anévrysme, et lorsqu'il met en place la prothèse pour contrôler son niveau par rapport à la lésion et aux vaisseaux de la gerbe aortique (Vidéo); elle permet le diagnostic et la réparation immédiate des endofuites (Vidéo) [23]. Mais elle implique une anesthésie générale.
Vidéo: Déploiement d'une endoprothèse dans l'aorte thoracique (vue long-axe de l'aorte descendante).
Vidéo: Endofuite au niveau du collet distal d'une endoprothèse de l'aorte thoracique descendante.
Vidéo: Déploiement d'une endoprothèse dans l'aorte thoracique (vue long-axe de l'aorte descendante).
Vidéo: Endofuite au niveau du collet distal d'une endoprothèse de l'aorte thoracique descendante.
Malgré l'absence de clampage de l'aorte et le maintien de la perfusion intercostale, il est prudent d’installer un drainage lombaire de LCR avant d'endormir le patient dans les cas à haut risque neurologique postopératoire opérés sous AG (anévrysmes thoraco-abdominaux étendus, dissection, cure d’anévrysme abdominal préalable, couverture de la sous-clavière gauche, prothèses longues de > 25 cm) (voir Protection médullaire) [11]. Un retrait de 10-15 mL/h doit permettre de maintenir la pression du LCR à 10 mmHg. Bien que le bénéfice de cette mesure soit difficile à évaluer lorsqu'elle est utilisée de manière routinière, et bien qu'il n'existe aucune étude contrôlée à ce sujet [27], le drainage abaisse significativement le taux de paraplégie lorsqu'il est combiné à un strict contrôle de la PAM (> 80 mmHg), à une revascularisation de la sous-clavière gauche et à un dégagement systématique de l'orifice des iliaques internes par les dispositifs d'introducteur dans les anévrysmes de type I, II ou III (voir Figure 18.38) [20]. Il implique toutefois un risque de complication de 2-6% [21]. Sous analgésie-sédation, le contrôle neurologique est facilité puisqu'il est assuré par le status clinique du patient.
Pour garantir la meilleure perfusion possible à la moelle et aux viscères situés distalement, la pression artérielle moyenne (PAM) doit reste ≥ 80 mmHg [9]. Lors du déploiement de la prothèse, il est cependant nécessaire de baisser la pression artérielle (PAM 40-50 mmHg, PAsyst < 80 mmHg) et le débit systolique pour éviter que le flux sanguin ne la propulse vers le bas et qu'elle s'ancre trop distalement dans l'aorte. A cet effet, on utilise plusieurs moyens [25].
- Pacing ventriculaire rapide à 180-220 batt/min. La sonde est introduite par voie veineuse jugulaire interne ou fémorale; elle entraine le VD. Les électrodes sont placées par voie épicardique en cas de sternotomie pour une intervention hybride. L'avantage est une induction et une récupération très rapides, avec un nadir de pression très bas (20-30 mmHg). Les complications possibles sont une fibrillation ventriculaire (placer au préalable des plaques de défibrillateur) et une tamponnade par perforation du VD [25]. Cette technique est réservée aux endoprothèses très proximales.
- Gonflement d'un ballon dans l'OD (introduit par voie veineuse fémorale) pour baisser abruptement la précharge; cette technique est moins efficace mais sans risque [19].
- Pause systolique par un bolus d'adénosine (24-90 mg iv); l'adénosine peut induire un bronchospasme [18].
- Phentolamine (Régitine®), bolus répétés de 1 mg.
- PEEP momentanée à 20 cm H2O qui freine le retour veineux; cette manœuvre a l’avantage d’être totalement réversible.
- Clévidipine (Cleviprex®), un bloqueur calcique d'action ultracourte, en investigation dans cette application.
Dès que la prothèse est en place, il est capital de maintenir une PAM ≥ 90 mmHg pour maximaliser le flux collatéral vers la moelle et diminuer le risque de paraplégie [4]. Bien qu'une attitude restrictive dans les indications à la transfusion soit de rigueur, la fragilité de la perfusion médullaire oblige à assurer le meilleur apport d'O2 possible; de ce fait, il est recommandé d'adopter un seuil transfusionnel de 100 gL d'Hb et de maintenir une saturation veineuse centrale > 75% [10].
Les mêmes recommandations hémodynamiques s'appliquent à la période postopératoire immédiate. La découverte d’une paraplégie (incidence: 3-5% des cas) [26] est une bonne indication à mettre en place un drainage lombaire en urgence, s'il n'a pas été introduit avant l'intervention [1]. Il est maintenu perméable 48-72 heures. Les anticoagulants et les antiplaquettaires ne sont repris qu'après le retrait du drain [13]. Plus la prothèse est longue, plus le risque de développer un syndrome postimplantatoire est grand. Celui-ci apparaît dans plus d'un tiers des cas et consiste en fièvre (38-39°C), leucocytose, coagulopathie et élévation de la CRP. Ces symptômes sont une réponse inflammatoire massive au matériel prothétique, aux lésions endothéliales et au stress chirurgical [2]. Le traitement consiste en stéroïdes à haute dose (méthylprednisolone 30 mg/kg); ils réduisent les marqueurs inflammatoires mais ne modifient pas la mortalité [7]. Les AINS sont contre-indiqués en raison des risques de dysfonction rénale.
| Endoprothèses de l’aorte thoracique descendante |
|
La prothèse est un tube de Dacron™ armé imperméable introduit par voie percutanée (cathétérisme fémoral). Conditions de réalisation :
- Vaisseau fémoral > 7.5 mm et axe ilio-aortique libre
- Collet d’amarrage ≤ 30 mm de diamètre et ≥ 15 mm de longueur
- Longueur de la lésion < longueur de la prothèse
- Rupture pariétale < 1/3 de la circonférence
- Contrôle de la mise en place par fluoroscopie, ultrasons intravasculaires (IVOS) et ETO
Indications : anévrysme, dissection, déchirure traumatique, athérome ulcéré.
Opération peu douloureuse (incision inguinale), hémodynamiquement stable (pas de clampage aortique), héparinisation systémique (héparine 100 U/kg iv), pertes sanguines significatives. Bien adapté aux malades âgés ou critiques, déconseillé chez les patients souffraant de syndrome de Marfan. Pour les prothèses complexes avec embranchements: canulations fémorale et axillaire.
Taux de succès immédiat : 98%. Taux d’endofuites (fuites entre la prothèse et la paroi) : < 10%. Taux de réinterventions à 8 ans : 30%. Mortalité opératoire 2-5 fois inférieure au remplacement chirurgical.
Anesthésie générale (immobilité, tolérance de l’ETO, durée 3-6 heures); ALR lombaire possible (incision inguinale). Monitorage : cathéter artériel radial droit, voie veineuse centrale, ETO. Maintien de la PAM à environ 80 mmHg.
Lors du déploiement de la prothèse, il est nécessaire de baisser la pression artérielle (PAM 40-50 mmHg) pour éviter que le flux sanguin ne la propulse vers le bas et qu'elle s'ancre trop distalement dans l'aorte.
- Pacing rapide (électrode intraveineuse stimulant le VD à 180-220 batt/min)
- Pause systolique (adénosine)
- Vasodilatation (phentolamine)
- Baisse du retour veineux (PEEP 20 cm H2O, ballonnet gonflé dans la VCI)
|
© CHASSOT PG, TOZZI P, BETTEX D, Octobre 2010, Dernière mise à jour, Décembre 2019
Références
- AZIZZADEH A, HUYNH TT, MILLER CC, SAFI HJ. Reversal of twice-delayed neurologic deficits with cerebrospinal fluid drainage after thoracoabdominal aneurysm repair. A case report and a plea for a national database collection. J Vasc Surg 2000; 31:592-8
- CHANG CK, CHUTER TA, NIEMANN CU, et al. Systemic inflammation coagulopathy and acute renal insufficiency following endovascular thoracoabdominal aortic aneurysm repair. J Vasc Surg 2009; 49:1140-6
- CHENG D, MARTIN J, SHENNIB H, et al. Endovascular aortic repair versus open surgical repair for descending thoracic aortic disease. J Am Coll Cardiol 2010; 55:986-1001
- CHEUNG AT, POCHETTINO A, McGARVEY ML, et al. Strategies to manage risk after endovascular stent repair of descending thoracic aortic aneurysms. Ann Thorac Surg 2005; 80:1280-9
- DAKE MD. Endovascular stent-graft management of thoracic aortic diseases. Eur J Radiol 2001; 39:42-9
- DAKE MD, MILLER DC, MITCHELL RS, et al. The "first generation" of endovascular stent-grafts for patients with aneurysms of the descending thoracic aorta. J Thorac Cardiovasc Surg 1998; 116:689
- DE LA MOTTE L, KEHLET H, VOGT K, et al. Preoperative methylprednisolone enhances recovery after endovascular aortic repair: a randomized, double-blind, placebo-controlled clinical trial. Ann Surg 2014; 260:540-8
- ERBEL R, ABOYANS V, BOILEAU C, et al. 2014 ESC Guidelines on the diagnosis and treatment of aortic diseases. Eur Heart J 2014; 35:2873-926
- ETZ CD, KARI FA, MUELLER CS, et al. The collateral network concept: a reassessment of the anatomy of spinal cord perfusion. J Thorac Cardiovasc Surg 2011; 141:1020-8
- ETZ CD, WEIGANG E, HARTERT M, et al. Contemporary spinal cord protection during thoracic and thoracoabdominal aortic surgery and endovascular repair: a position paper of the vascular domain of the European Association for Cardio-Thoracic Surgery. Eur J Cardiothor Surg 2015; 47:943-57
- FEDOROW CA, MOON MC, MUTCH WA, et al. Lumbar cerebrospinal fluid drainage for thoracoabdominal aortic surgery: rationale and practical considerations for management. Anesth Analg 2010; 111:46-58
- FERRARI E, TOZZI P, VON SEGESSER L. Thoracic aorta emergencies: is the endovascular treatment the new gold standard ? Interact Cardiovasc Thorac Surg 2006; 5:730-4
- FORT ACP, RUBIN LA, MELTZER AJ, et al. Perioperative management of endovascular thoracoabdominal aortic aneurysm repair. J Cardiothorac Vasc Anesth 2017; 31:1440-59
- GANAPATHI AM, ENGLUM BR, SCHECHTER MA, et al. Role of cardiac evaluation before thoracic endovascular aortic repair. J Vasc Surg 2014; 60:1196-203
- GREENBERG RK, LU Q, ROSELLI EE, et al. Contemporary analysis of descending thoracic and thoracoabdominal aneurysm repair: A comparison of endovascular and open techniques. Circulation 2008; 118:808-17
- HENLEY MD, ARORA H, FARBER MA; et al. Anesthetic considerations for 3-branch endovascular total aortic arch aneurysm repair. J Cardiothorac Vasc Anesth 2019; 33:1714-21
- JONKER FHW, GIACOVELLI JK, MUHS BE, et al. Trends and outcomes of endovascular and open treatment for traumatic aortic injury. J Vasc Surg 2010; 51:565-71
- KAHN RA, MOSKOWITZ DM, MARIN ML, et al. Safety and efficacy of high-dose adenosine-induced asystole during endovascular AAA repair. J Endovasc Ther 2000; 7:292-6
- MARTY B, CHAPUIS MORALES C, TOZZI P, RUCHAT P, CHASSOT PG, VON SEGESSER L. Partial inflow occlusion facilitates accurate deployment of thoracic aortic endografts. J Endovasc Ther 2004; 11:175-9
- MAUREL B, DELCLAUX N, SOBOCINSKI J, et al. The impact of early pelvic and lower limb reperfusion and attentive perioperative management on the incidence of spinal cord ischemia during thoracoabdominal aortic aneurysm endovascular repair. Eur J Vasc Endovasc Surg 2015; 49:248-54
- RONG LQ, KAMEL MK, RAHOUMA M, et al. Cerebrospinal-fluid drain-related complications in patients undergoing open and endovascular repairs of thoracic and thoraco-abdominal aortic pathologies: a systematic review and meta-analysis. Br J Anaesth 2018; 120:904-13
- SFYROERAS GS, RUBIO V, PAGAN P, et al. Endovascular management of malperfusion in acute type B aortic dissection. J Endovasc Ther 2011; 18:78-86
- SINISCALCHI G, TOZZI P, FERRARI E, et al. Endovascular repair of aortic arch aneuryms after achievement of local anesthesia. J Thorac Cardiovasc Surg 2007; 133:262-3
- SWAMINATHAN M, LINERBERGER CK, McCANN RL, MATHEW JP. The importance of intraoperative transesophageal echocardiography for endovascular repair of thoracic aortic aneurysms. Anesth Analg 2003; 97:1566-72
- TAGARAKIS GL, WHITLOCK RP, GUTSCHE JT, et al. New frontier in aortic therapy: focus on deliberate hypotension during thoracic aortic endovascular interventions. J Cardiothorac Vasc Anesth 2014; 28:843-7
- UCHIDA N. How to prevent spinal cord injury during endovascular repair of thoracic aortic disease. Gen Thorac Cardiovasc Surg 2014; 62:391-7
- WONG CS, HEALY D, CANNING C, et al. A systematic review of spinal cord injury and cerebrospinal fluid drainage after thoracic aortic endografting. J Vasc Surg 2012; 56:1438-47
- ZOLLER JK, GREGORY SH, STEVENS TW, et al. Anesthetic considerations for aortic arch stenting. J Cardiothorac Vasc Anesth 2019; 33:3163-75
