Fonction systolique
La fonction du VD est un déterminant majeur du pronostic clinique. Il est donc essentiel de pouvoir mesurer correctement sa performance systolique. Malheureusement, cette tâche est malaisée à cause de la forme complexe de ce ventricule, qui ne peut pas être ramené à une figure géométrique simple comme le VG. On ne peut donc pas calculer la FE à partir d’approximations du volume. D'autre part, les fortes trabéculations du VD gène l'identification de l'endocarde pour en prendre des mesures précises. De ce fait, les indices simples n'ont pas une bonne corrélation avec la FE mesurée à l’IRM (FE normale : 0.4-0.5). Seule la FE volumétrique calculée en 3D est adéquate. Par contre, l'œil d'un échocardiographeur entrainé évalue correctement la FE du VD à partir d'images 2D, et le résultat est bien corrélé au calcul basé sur l'enregistrement 3D; il est cependant inadéquat pour l'estimation du volume ventriculaire droit [23]. L'évaluation du VD en périopératoire est peu codifiée, parce que la plupart des données fonctionnelles provient d’examens transthoraciques pratiqués en respiration spontanée et n’est pas correctement validée pour l’ETO chez un malade ventilé en pression positive. Comme la précharge et la postcharge du VD varient avec la respiration, les mesures doivent être réalisées en fin d’expiration ou en apnée.
Les mesures élémentaires sont réalisées le plus souvent en vue 4-cavités 0-30°; la rotation du capteur à 15-30° et le pivotement de la sonde vers la droite permettent d'obtenir le plus grand développement de l'anneau tricuspidien et de la chambre d'admission (Figure 25.216) [13,15,20,25,47].
La fonction du VD est un déterminant majeur du pronostic clinique. Il est donc essentiel de pouvoir mesurer correctement sa performance systolique. Malheureusement, cette tâche est malaisée à cause de la forme complexe de ce ventricule, qui ne peut pas être ramené à une figure géométrique simple comme le VG. On ne peut donc pas calculer la FE à partir d’approximations du volume. D'autre part, les fortes trabéculations du VD gène l'identification de l'endocarde pour en prendre des mesures précises. De ce fait, les indices simples n'ont pas une bonne corrélation avec la FE mesurée à l’IRM (FE normale : 0.4-0.5). Seule la FE volumétrique calculée en 3D est adéquate. Par contre, l'œil d'un échocardiographeur entrainé évalue correctement la FE du VD à partir d'images 2D, et le résultat est bien corrélé au calcul basé sur l'enregistrement 3D; il est cependant inadéquat pour l'estimation du volume ventriculaire droit [23]. L'évaluation du VD en périopératoire est peu codifiée, parce que la plupart des données fonctionnelles provient d’examens transthoraciques pratiqués en respiration spontanée et n’est pas correctement validée pour l’ETO chez un malade ventilé en pression positive. Comme la précharge et la postcharge du VD varient avec la respiration, les mesures doivent être réalisées en fin d’expiration ou en apnée.
Les mesures élémentaires sont réalisées le plus souvent en vue 4-cavités 0-30°; la rotation du capteur à 15-30° et le pivotement de la sonde vers la droite permettent d'obtenir le plus grand développement de l'anneau tricuspidien et de la chambre d'admission (Figure 25.216) [13,15,20,25,47].
- Fraction de raccourcissement de diamètre : (Dtd – Dts) / Dtd. Le diamètre est mesuré dans le plus grand court-axe (largeur maximale du VD, perpendiculaire à son long axe) en vue 4-cavités (0-20°) (Vidéo) ou admission-chasse à 60° ; ce diamètre se trouve au niveau de la chambre d’admission. La valeur normale est 0.3 – 0.4. Les limites normales du Dtd sont 2.0-3.8 cm et celles du Dts 1.3-2.7 cm.
Vidéo: vue mi-oesophagienne 4-cavités 0-20°. La surface du VD est normalement < 0.7 fois la surface du VG.
- Fraction de raccourcissement de longueur: la mesure de la distance entre l’anneau tricuspidien et l’apex du VD en systole et en diastole (raccourcissement normal > 15 mm) permet d’en mesurer la fraction de raccourcissement systolique (normal : 0.35), mais cette mesure a deux inconvénients ; 1) elle peut surestimer la fonction réelle du VD parce que l’apex est plus ou moins entraîné par la contraction du VG selon les plans de coupe, et 2) les trabéculations de l’apex rendent difficile la définition de l’endocarde.
- Fraction de raccourcissement de surface (FAC : fractional area change) : (Std – Sts) / Std. La surface est mesurée en vue 4-cavités (0-20°) ou admission-chasse à 60°, en excluant les trabéculations. La valeur normale varie de 0.35 à 0.5; une valeur de 0.25-0.35 correspond à une dysfonction modérée; en-dessous de 0.25, la dysfonction est sévère [20,21]. Cette mesure ne concerne qu'une partie du ventricule, car aucune vue 2D ne permet d'obtenir la surface totale du VD. Elle est néanmoins la seule mesure directe de la fonction droite basée sur les dimensions du ventricule qui soit corrélée à la FE mesurée en 3D [45].
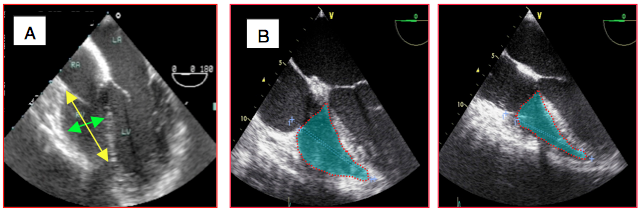
Figure 25.216 : Mesures bidimensionnelle simples du VD en vue 4-cavités 0°. A: diamètre et longueur de la cavité droite. B: mesure de la surface en diastole. C: mesure de la surface en systole (calcul du raccourcissement de surface). Les trabéculations sont incluses dans la surface dont le tracé suit l'endocarde.
Une fraction de raccourcissement en diamètre ou en surface < 0.25 signe donc une insuffisance ventriculaire droite sévère ; elle est associée à une aggravation de la mortalité périopératoire [24]. Cependant, ces indices ne sont pas sensibles et sont peu discriminants. On dispose d'autres modes de quantification fonctionnelle qui sont plus performants et plus robustes, tels le TAPSE, l'indice de Tei, la déformation tissulaire et l'imagerie tri-dimensionnelle.
Le déplacement systolique de l'anneau tricuspidien ou TAPSE (tricuspid annular plane systolic excursion) concerne le mouvement longitudinal de la partie latérale de l’anneau; cette partie a la course la plus ample et n'est mue que par la contraction longitudinale de la paroi libre du VD, alors que le côté septal est moins mobile et très influencé par la contraction du VG. L’intérêt de cette mesure est de porter précisément sur le raccourcissement longitudinal qui est le principal propulseur du volume systolique droit. On peut mesurer le TAPSE de plusieurs manières différentes (Figure 25.217).
- Mesure du déplacement de l'anneau en vue 4 cavités mi-oesophage 0°, ou en vue chambre d’admission transgastrique 120° en s'aidant du mode TM pour être plus précis dans la quantification. La deuxième vue est préférable parce que l’angle entre le faisceau Doppler et le déplacement de l’anneau est presque nul. Valeur normale en ETO: 1.2-2.0 cm.
- Mesure du déplacement de l'anneau latéral en vue 4 cavités MO 0° par rapport à la distance anneau – apex. Valeur normale en ETO: 1.2-2.0 cm (> 1.7 cm en ETT). La corrélation est bonne entre les deux mesures, mais la définition endocardique de l'apex est difficile à cause des trabéculations [29].
- Vélocité systolique (S') de l’anneau tricuspidien au Doppler tissulaire : en vue TG chambre d'admission à 100° ou admission-chasse à 120°, il est possible d’avoir un bon alignement avec l’anneau tricuspidien pour mesurer sa vélocité de déplacement longitudinal au Doppler tissulaire. La vélocité normale à l’ETO est 8-12 cm/s [4] et > 7 cm/s en ventilation contrôlée [27]. Une Vmax < 7 cm/s est associée à une FE < 0.3 [35]. Les vélocités longitudinales du VD, plus rapides à la base qu’à l’apex, sont en moyenne plus élevées que celles du VG à l'anneau mitral. En chirurgie cardiaque, la vélocité S' diminue d'environ 50% dès l'ouverture du péricarde et reste abaissée de 60% en postopératoire; ce phénomène est absent dans les intervention à péricarde fermé [37,43]. Le TAPSE n'est donc pas un marqueur idéal de la fonction droite en cas de péricardotomie.
- Pour pallier l'imprécision introduite par l'angle entre l'axe de déplacement de l'anneau et celui des ultrasons, on peut recourir à la technique de speckle-traking, parce qu'elle est indépendante de cet angle. Elle donne des valeurs normales de 1.7 cm pour le déplacement systolique de l'anneau au niveau latéral et de 1.0 cm au niveau septal [32]. Toutefois, cette mesure est mal corrélée à celle réalisée en imagerie bidimensionnelle [29].
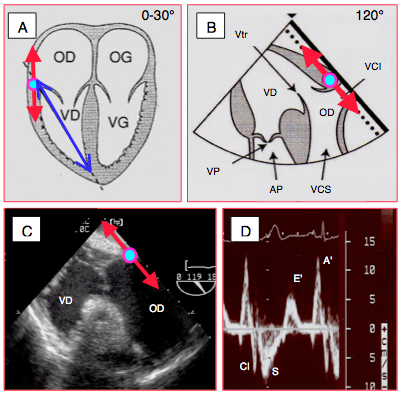
Figure 25.217 : Mesure du déplacement longitudinal de la partie latérale de l'anneau tricuspidien (TAPSE). A: en vue 4-cavités, l'alignement avec l'axe des ultrasons n'est pas satisfaisant; la mesure est approximative. En rouge: coulissage de la partie latérale de l'anneau. En bleu: déplacement en direction de l'apex. B: en vue transgastrique chambre d'admission-chasse 100-140° (B) ou chambre d'admission 100° (C), l'anneau coulisse le long du bord droit de l'écran et l'alignement avec l'axe des ultrasons est excellent. D: vélocité de déplacement systolique (S') au Doppler pulsé tissulaire centré sur l'anneau tricuspidien latéral en vue 4-cavités; la Vmax est de 8 cm/s, ce qui est encore normal en ventilation mécanique et en ETO. CI: contraction isovolumétrique.
Le déplacement du TAPSE et la Vmax de S' ont des valeurs plus basses lorsqu’ils sont mesurés par voie ETO que par voie transthoracique (norme ETT : Vmax 12-15 cm/s, dysfonction si Vmax < 10 cm/s), parce que l'axe des ultrasons est moins bon en vue 4-cavités mi-oesophagienne qu'en vue transthoracique apicale et parce que les vues transgastriques, où l'axe est excellent, visent une partie de l'anneau tricuspidien légèrement plus inférieure et moins latérale, donc moins mobile [31,41,42,45].
L'indice de Tei (MPI, myocardial performance index) est particulièrement bien adapté à la forme complexe du VD puisqu'il ne mesure que des durées et non des dimensions (voir Indices isovolumétriques) [40]. Il est le rapport entre la durée des phases isovolumétriques (contraction isovolumétrique + relaxation isovolumétrique) et la durée de l’éjection : (tCI + tRI) / tEj. La mesure du temps entre deux flux tricuspidiens est la durée totale (CI + RI + Ej) ; elle se pratique en vue 4 cavités à 0° ou en chambre d’admission-chambre de chasse à 60°. La durée du flux pulmonaire (tEj) se mesure en vue court axe de l’aorte ascendante à 0° ou en vue TG 40-50°. Ces deux mesures ne peuvent pas être simultanées, mais sont réalisées sur deux cycles cardiaques présentant le même intervalle R-R. On peut aussi calculer l’indice de Tei à partir du Doppler tissulaire de l’anneau tricuspidien en vue transgastrique chambre d'admission 100°: la durée de la CI est le temps entre la fin du déplacement A' et le début du déplacement systolique S, la durée de la RI est le temps entre la fin du S et le début du déplacement E', la durée d’éjection est la durée de la vélocité S (Figure 25.218). Cette mesure a l’avantage de se faire sur un seul cycle cardiaque, mais elle ne représente que la contraction longitudinale du VD. La valeur normale de l’indice de Tei pour le VD est de 0.3 [15]. La dysfonction sévère se caractérise par un indice > 0.4 au Doppler pulsé sur les flux, ou > 0.5 au Doppler tissulaire [20,45]. L'index de Tei peut être anormalement augmenté lorsque la POD est élevée, parce que la durée de la relaxation isovolumétrique est raccourcie, mais il est indépendant de la postcharge [30].
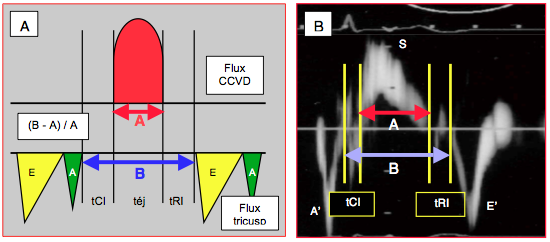
Figure 25.218 : Indice de Tei mesuré sur l'anneau tricuspidien latéral. A: représentation schématique conventionnelle du calcul à partir du flux tricuspidien et du flux dans la chambre de chasse droite. tCI: durée de la contraction isovolumétrique. Téj: durée d'éjection. tRI: durée de la relaxation isovolumétrique. B: calcul à partir du Doppler tissulaire. La durée des vélocités tissulaires remplace celle des flux.
La reconstruction 3D a fait d'immenses progrès ces dernières années et permet une mesure adéquate du volume ventriculaire droit, pour autant que les images 2D de base soient de bonne qualité. L'avantage de cette technique est de ne dépendre d'aucune approximation géométrique et d'englober la totalité du volume ventriculaire. Les valeurs admises comme normales ont été établies par voie transthoracique [22,38].
- Volume télédiastolique: homme 87 mL/m2, femme 74 mL/m2;
- Volume télésystolique: homme 44 mL/m2, femme 36 mL/m2.
La fraction d'éjection qu'on en déduit est de 45-60%. Une valeur inférieure à 45%, calculée en 3D, traduit une dysfonction du ventricule [20]. Le calcul de la FE à partir de l'imagerie bidimensionnelle n'est pas recommandée, car aucune vue 2D ne peut comprendre l'ensemble du VD [31,45].
La déformation (strain) et la vitesse de déformation (strain rate) de la paroi libre sont évaluées avec la technique de speckle-tracking (voir Doppler tissulaire et speckle-tracking). La déformation systolique longitudinale globale de la paroi libre en vue 4-cavités est normalement de - 29% ± 4.5% [11,20]. Une valeur < 20% dénote une dysfonction du VD et une valeur < 15% signe une décompensation droite [9,26,34]. La déformation longitudinale systolique est un test très sensible aux altérations fonctionnelles du VD. Une valeur abaissée à -14% est liée à une augmentation de morbi-mortalité chez les patients souffrant d'hypertension pulmonaire (OR 5.4) [33] et à une défaillance droite après implantation d'assistance ventriculaire gauche [12]. En chirurgie cardiaque, elle est altérée dès l'ouverture du péricarde. Après remplacement valvulaire aortique, elle est diminuée de 20% en postopératoire alors que la déformation gauche n'est pas modifiée [10]. Après pontage aorto-coronarien en CEC, elle baisse de – 22% à – 16%, alors que la déformation circonférentielle augmente et que la FE reste inchangée [8]. La limite en-dessous de laquelle la fonction droite est atteinte est de – 19% pour la paroi libre du VD, le septum étant trop influencé par la contraction du VG et la chambre de chasse étant physiologiquement hypercontractile [2,9]. La déformation systolique de la paroi libre en vue 4-cavités prend de plus en plus d'importance dans la quantification de la fonction droite, car elle se révèle être un des indices les plus sensibles et les plus fiables de la performance du VD (Vidéo).
Vidéo: déformation (strain) du VD en vue 4-cavités démontrant la contraction de la paroi libre et du septum.
Il existe encore d'autres indices de la fonction ventriculaire droite, mais ils sont moins utilisés et moins bien codifiés [36].
La déformation (strain) et la vitesse de déformation (strain rate) de la paroi libre sont évaluées avec la technique de speckle-tracking (voir Doppler tissulaire et speckle-tracking). La déformation systolique longitudinale globale de la paroi libre en vue 4-cavités est normalement de - 29% ± 4.5% [11,20]. Une valeur < 20% dénote une dysfonction du VD et une valeur < 15% signe une décompensation droite [9,26,34]. La déformation longitudinale systolique est un test très sensible aux altérations fonctionnelles du VD. Une valeur abaissée à -14% est liée à une augmentation de morbi-mortalité chez les patients souffrant d'hypertension pulmonaire (OR 5.4) [33] et à une défaillance droite après implantation d'assistance ventriculaire gauche [12]. En chirurgie cardiaque, elle est altérée dès l'ouverture du péricarde. Après remplacement valvulaire aortique, elle est diminuée de 20% en postopératoire alors que la déformation gauche n'est pas modifiée [10]. Après pontage aorto-coronarien en CEC, elle baisse de – 22% à – 16%, alors que la déformation circonférentielle augmente et que la FE reste inchangée [8]. La limite en-dessous de laquelle la fonction droite est atteinte est de – 19% pour la paroi libre du VD, le septum étant trop influencé par la contraction du VG et la chambre de chasse étant physiologiquement hypercontractile [2,9]. La déformation systolique de la paroi libre en vue 4-cavités prend de plus en plus d'importance dans la quantification de la fonction droite, car elle se révèle être un des indices les plus sensibles et les plus fiables de la performance du VD (Vidéo).
Vidéo: déformation (strain) du VD en vue 4-cavités démontrant la contraction de la paroi libre et du septum.
Il existe encore d'autres indices de la fonction ventriculaire droite, mais ils sont moins utilisés et moins bien codifiés [36].
- L’analyse de la pente d’accélération d’une insuffisance tricuspidienne (IT) traduit le dP/dt de la phase isovolumétrique ; on mesure le délai entre les vélocités de 1 m/s et 2 m/s, qui correspondent à un ?P de 12 mmHg (normal : < 30 ms). La norme est 400-900 mmHg/s, ce qui est 2-4 fois moins que pour le VG (Figure 25.219) [1]. Rapporter cette valeur à la pression systolique du VD la rend moins dépendante des conditions de charge [17]. Une valeur < 400 mmHg/s traduit une défaillance ventriculaire.
- L’accélération de la contraction isovolumétrique mesurée à l’anneau tricuspidien est actuellement l’indice le plus fiable parce que peu dépendant des conditions de charge, mais il implique un échantillonnage de haute fréquence au Doppler tissulaire (voir Figures 25.184 et 25.185) ; la mesure se pratique en vue TG admission ou admission-chasse à 100-140° (normal : 1.2-2.2 m/s2) [13,15,41,44].
- Si le patient est porteur d’un cathéter pulmonaire, les mouvements systoliques de celui-ci sont une estimation pratique de la performance systolique du VD ; en cas de dysfonction massive, la Swan-Ganz reste immobile.
- En cas de difficultés, l’IRM est d’un précieux secours, car elle offre la meilleure définition de la taille et de la fonction du VD.
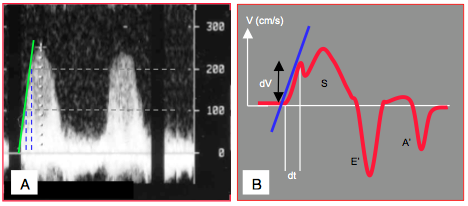
Figure 25.219 : Contraction isovolumétrique. En présence d'une insuffisance tricuspidienne, la pente ascentionnelle du jet d'IT représente le dP/dt intraventriculaire. A: mesure de la durée entre les vélocités de 1 et 2 m/s représentant un gradient de pression VD-OD de 4 et 16 mmHg respectivement selon l'équation de Bernoulli. Le dP est 12 mmHg et le dt la durée mesurée (normalement < 30 ms); le résultat est exprimé en mmHg/s. B: accélération de la contraction isovolumétrique (trait bleu) mesurée à l’anneau tricuspidien en vue TG admission ou admission-chasse à 100-140° (Doppler tissulaire ou strain rate); dV : différence de vélocité, dt : durée de la phase d’accélération. S : éjection systolique. E' : relaxation protodiastolique. A' : contraction auriculaire.
La dysfonction systolique sévère du VD est caractérisée par une fraction de raccourcissement de diamètre, une fraction de raccourcissement de surface et un TAPSE tous trois inférieurs à 25%.
Mais il n’est pas rare que les mesures échocardiographiques du VD soient inadéquates par défaut de visualisation correcte des pourtours ventriculaires. Pour le VD encore davantage que pour le VG, les différents indices doivent être intégrés dans le contexte d’une estimation globale de la fonction ventriculaire et de la clinique du patient. Un résultat isolé n’a guère de valeur. Comme sa paroi est mince, le VD se dilate lorsqu’il dysfonctionne ; la probabilité d’une insuffisance droite est minime si la taille du VD est normale. L’évaluation doit porter essentiellement sur l’épaississement de la paroi libre, car les fibres circulaires de la chambre d’admission et de l’apex sont en continuité avec celles du VG et bénéficient de contractilité de ce dernier ; d’autre part, la riche dotation de la chambre de chasse en récepteurs béta la rend hypercontractile en cas de perfusion catécholaminergique [7].
L’obstruction dynamique de la chambre de chasse en cas d’hypovolémie et de sur-stimulation béta est caractérisée par un collapsus systolique de la CCVD en vue admission-chasse à 60° (bien visible en mode TM), et par une pression systolique du VD calculée à l’insuffisance tricuspidienne de plus de 25 mmHg supérieure à la PAP du cathéter pulmonaire [6].
| Indices courants de fonction systolique du VD |
| La forme complexe du VD est ses importantes trabéculations compliquent les mesures bi-dimensionnelles - Evaluation visuelle (taille, dilatation, mouvements), contexte clinique - Contraction et épaississement de la paroi libre - Fraction de racourcissement de surface à 0° et 60° mi-œsophage: > 0.35 - TAPSE à 0° 4 cavités ou 100-120° transgastrique: ≥ 0.35 ou ≥ 15 mm - Indice de Tei: ≤ 0.3 - Vitesse de déplacement S' de l’anneau tricuspidien au Doppler tissulaire 120° TG: ≥ 10 cm/s - Déformation systolique longitudinale (longitudinal strain) de la paroi libre < 20% - Fraction d'éjection en 3D: 45-60% Dysfonction sévère du VD : fraction de raccourcissement de diamètre, fraction de raccourcissement de surface et TAPSE tous trois < 25% ; Vmax S (anneau tricuspide) < 6 cm/s, déformation longitudinale (paroi libre) < 15%. |
Contraction segmentaire
Comme la paroi du VD est mince, le diagnostic d'akinésie repose essentiellement sur la perte du mouvement radiaire concentrique, car l'épaississement est très difficile à distinguer. Il est d'ailleurs ardu d'identifier une hypokinésie par rapport à une contraction encore normale. D'autre part, la contraction du VD est assez inhomogène. La Vmax S du déplacement systolique varie de la base vers l'apex; elle est en moyenne de 11 cm/s dans le segment basal, de 8.5 cm/s dans le segment moyen et de 5 cm/s dans le segment apical [16,19]. Les zones basales et apicales du VD partagent des fibres circulaires avec le VG et peuvent conserver un mouvement systolique malgré une ischémie droite. La chambre de chasse conserve une activité importante lors de défaillance ischémique du ventricule [13]. On ne peut donc juger de la contractilité segmentaire avec certitude que sur la paroi libre, qui est vascularisée par les branches marginales de la coronaire doite [31,39].
Les différents segments du VD sont bien mis en évidence dans quatre vues (voir Figures 25.121 et 25.122).
- Vue 4-cavités: paroi latérale basale, médioventriculaire et apicale;
- Vue admission-chasse MO 60°: paroi inférieure basale, paroi latérale médioventriculaire, paroi antérieure infundibulaire;
- Vue transgastrique court-axe: parois inférieure, latérale et antérieure médioventriculaires;
- Vue admission TG 100°: parois inférieure et antérieure basales, médioventriculaires et apicales.
- Le septum est principalement vascularisé par l'artère interventriculaire antérieure (IVA) qui donne également la branche alimentant la bande modératrice (avec une collatéralisation possible de la paroi libre).
- La partie inféro-basale du septum dépend de l'artère interventriculaire postérieure en provenance de la coronaire droite (CD).
- La chambre de chasse est vascularisée par l'artère conale, première branche de la CD; dans 30% de la population, cette artère a une origine ostiale séparée.
- La paroi libre latérale et antérieure dépend des branches marginales de la CD.
- La paroi libre inférieure est vascularisée par l'interventriculaire postérieure issue de la CD.
Fonction diastolique
La fonction diastolique du VD est moins bien explorée que celle du VG, mais elle en est déduite par analogie. Comme pour celle du VG, elle est caractérisée par une altération de la Vmax du flux E tricuspidien, de la durée de sa décélération et du rapport E/A [14,15,25,46]. Ces valeurs sont de plus modifiées par l’âge, les conditions de charge et la respiration. Le rapport E/A s’inverse habituellement pendant l’inspirium de la ventilation mécanique. Comme la paroi du VD est mince, une augmentation de pression diastolique se traduit pas une dilatation ventriculaire (diamètre > 4.5 cm). La dysfonction diastolique droite est caractérisée par les points suivants.
- En cas de défaut de relaxation: diminution de la Vmax du flux E tricuspidien (< 0.3 m/s), augmentation de la durée de décélération du flux E (> 240 ms) et rapport E/A < 1.
- En cas de restriction: augmentation de la Vmax du flux E tricuspidien (> 0.6 m/s), diminution de la durée de décélération du flux E (< 140 ms) et de la relaxation isovolumétrique (< 70 ms), et rapport E/A > 2.
- Un rapport E/E’ > 6 traduit une POD > 10 mmHg.
- Une augmentation de la taille de la VCI et de la VCS, et une diminution de leur degré de collapsibilité respiratoire.
- Une augmentation des composantes rétrogrades A et V du flux en VCI ou en veine sus-hépatique (correspondant aux pics de pression "a" et "v" de la PVC).
- Un flux antérograde à travers la chambre de chasse droite en télédiastole, dû à la propagation de l’onde de la contraction auriculaire à travers un VD très restrictif et non-compliant qui transmet la pression sans amortissement (Figure 25.220A) [5].
- En cas d’insuffisance pulmonaire (IP), le Pt1/2 du flux de l'IP est < 150 msec et le rapport entre la Vmin et la Vmax de l’IP est < 0.5 (Figure 25.220) [3].
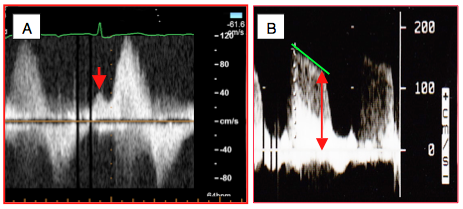
Figure 25.220 : Dysfonction diastolique restrictive du VD. A: petit flux télédiastolique dans la chambre de chasse droite (flèche rouge) dû à la propagation de l'onde A dans un ventricule très rigide. B: taux de décélération du flux d'une insuffisance pulmonaire entre la Vmax et la Vmin de l'IP (flèche rouge); le trait vert marque la pente de décélération de l'IP.
Les flux veineux cave inférieur et sus-hépatique en vue transgastrique à 60-90° présentent certaines caractéristiques par rapport à l’image normale (Figure 25.221).
- Le rapport de l’ITV des composantes rétrogrades par rapport aux composantes antérogrades augmente ; (ITVA + ITVV) / (ITVS + ITVD) > 1 ; les ondes rétrogrades A et V augmentent à l’inspirium spontané.
- Avec l'élévation de la POD, la composante S diminue et le rapport S/D est < 1.
- Une élévation de la POD (> 15 mmHg) se caractérise par une VCI dilatée présentant peu de variations respiratoires de son diamètre (index de collapsibilité < 10%) ; en ventilation mécanique, la mesure se fait en mode TM à la fin de l’expirium et en télédiastole, si possible à 2-3 cm de l'OD.
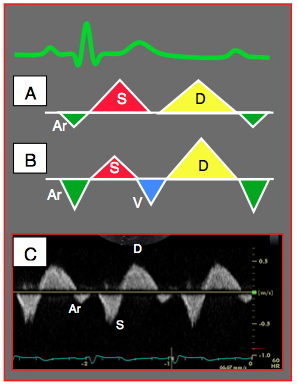
Figure 25.221 : Représentation du flux veineux cave inférieur. A: flux normal avec ses 3 composantes: S en systole, D en diastole et Ar pendant la contraction auriculaire (flux rétrograde). B: dysfonction diastolique et élévation de la POD; le flux S est diminué (S < D), le flux rétrograde Ar augmenté; présence d'un reflux "V" au lieu de la simple baisse du flux entre les composantes S et D (non lié à une insuffisance tricuspidienne). Dans l'IT, le flux V rétrograde est protosystolique. C: insuffisance tricuspidienne majeure; flux S inversé: présence d'un reflux massif pendant la systole. Alors que le flux "V" précédant est télésystolique-protodiastolique, le flux S inversé est holosystolique.
La cardiomyopathie restrictive et l'endofibroélastose sont des affections carcatérisées par une défaillance diastolique profonde, une physiologie restrictive et une dilatation auriculaire. La deuxième s'accompagne de thrombose apicale malgré une fonction systolique conservée. La dysfonction diastolique est un facteur de mauvais pronostic en chirurgie cardiaque, a fortiori lorsqu'elle est biventriculaire. Ainsi, lorsque la somme des vélocités E' de l'anneau mitral et de l'anneau tricuspidien est < 13 cm/s, le risque de morbi-mortalité cardiaque postopératoire est doublé (OR 2.07-2.41) [28].
| Fonction diastolique du VD |
| Moins étudiée et plus difficile à évaluer que celle du VG, la fonction diastolique droite est basée sur les mêmes phénomènes. - Flux tricuspidien: variation de la Vmax E, rapport E/A < 1 ou > 2 - Doppler tissulaire: baisse de E' - Rapport E/E' > 6: POD > 10 mmHg - Augmentation des flux rétrogrades Ar et V dans la VCI et les veines sus-hépatiques - Dilatation et non-collapsabilité respiratoire de la VCI |
© CHASSOT PG, BETTEX D. Mars 2011, Avril 2019; dernière mise à jour, Mars 2020
Références
- ANCONINA J, DANCHIN N, SELTON-SUTY C, et al. Measurement of right ventricular dP/dt. A simultaneous/comparative haemodynamic and Doppler echocardiographic study. Arch Mal Coeur Vaiss 1992; 85:1317-21
- CAMELI M, RIGHINI FM, LISI M, MONDILLO S. Right ventricular strain as a novel approach to analyze right ventricular performance in patients with heart failure. Heart Fail Rev 2014; 19: 603-10
- COHEN A, GUYON P, CHAUVEL C, et al. Relations between Doppler tracings of pulmonary regurgitation and invasive haemodynamics in acute right ventricular infarction complicating inferior wall left ventricular infarction. Am J Cardiol 1995; 75:425-30
- DAVID JS, TOUSIGNANT CP, BOWRY R. Tricuspid annular velocity in patients undergoing cardiac operation using transesophageal echocardiography. J Am Soc Echocardiogr 2006; 19:329-34
- DAVLOUROS PA, NIWA K, WEBB G, et al. The right ventricle in congenital heart disease. Heart 2006; 92(Suppl 1):i27-i38
- DENAULT AY, CHAPUT M, COUTURE P, et al. Dynamic right ventricular outflow tract obstruction in cardiac surgery. J Thorac Cardiovasc Surg 2006; 132:43-9
- DENAULT AY, HADDAD F, JACOBSOHN E, et al. Perioperative right ventricular dysfunction. Curr Opin Anaesthesiol 2013; 26:71-81
- DONAUER M, SCHNEIDER J, JANDER N, et al. Peroperative changes of right ventricular function in cardiac surgical patients assessed by myocardial deformation analysis and 3-dimensional echocardiography. J Cardiothorac Vasc Anesth 2020; 34:708-18
- DUNCAN AD, ALFIREVIC A, SESSLER DI, et al. Peroperative assessment of myocardial deformation. Anesth Analg 2014; 118:525-44
- DUNCAN AE, SARWAR S, KATEBY KASHY B, et al. Early left and right ventricular response to aortic valve replacement. Anesth Analg 2017; 124:406-18
- FINE NM, CHEN L, BASTIANSEN PM, et al. Reference values for right ventricular strain in patients without cardiopulmonary disease: A prospective evaluation and meta-analysis. Echocardiography 2015; 32:787-96
- GRANT A, SMEDIRA N, STARLING R, MARWICK T. Independent and incremental role of quantitative right ventricular evaluation for the prediction of right ventricular failure after left ventricular assist device implantation. J Am Coll Cardiol 2012; 60: 521-8
- HADDAD F, COUTURE P, TOUSIGNANT C, DENAULT AY. The right ventricle in cardiac surgery, a perioperative perspective: I. Anatomy, physiology and assessment. Anesth Analg 2009; 108:407-21
- HADDAD F, COUTURE P, TOUSIGNANT C, DENAULT AY. The right ventricle in cardiac surgery, a perioperative perspective: II. Pathophysiology, clinical importance and management. Anesth Analg 2009; 108:422-33
- HADDAD F, HUNT SA, ROSENTHAL DN, et al. Right ventricular function in cardiovascular disease, Part I. Circulation 2008; 117:1436-48
- HORTON KD, MEECE RW, HILL JC. Assessment of the right ventricle by echocardiography: a primer for cardiac sonographers. J Am Soc Echocardiogr 2009; 22:776-92
- KANZAKI H, NAKATANI S, KAWADA T, et al. Right ventricular dP/dt/P(max), not dP/dt(max), noninvasively derived from tricuspid regurgitation velocity is a useful index of right ventricular contractility. J Am Soc Echocardiogr 2002; 15:136-42
- KASPER J, BOLLIGER D, SKARVAN K, et al. Additional cross-sectional transesophageal echocardiography views improve perioperative right heart assessment. Anesthesiology 2012; 117:726-34
- KUKULSKI T, HUBBERT L, ARNOLD M, et al. Normal regional right ventricular function and its change with age: a Doppler myocardial imaging study. J Am Soc Echocardiogr 2000; 13:194-204
- LANG RM, BADANO LP, MOR-AVI V, et al. Recommendations for cardiac chamber quantification by echocardiography in adults: An update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. J Am Soc Echocardiogr 2015; 28:1-39
- LANG RM, BIERIG M, DEVEREUX RB, et al. Recommendations for chamber quantification. Eur J Echocardiography 2006; 7:79-108
- MAFFESSANTI F, MURARU D, ESPOSITO R, et al. Age-, body size-, and sex-specific reference values for right ventricular volume and ejection fraction by three-dimensional echocardiography: a multicenter echocardiographic study in 507 healthy volunteers. Circ Cardiovasc Imaging 2013; 6:700-10
- MAGUNIA H, SCHMID E, HILBERATH JN, et al. 2D echocardiographic evaluation of right ventricular function correlates with 3D volumetric models in cardiac surgery patients. J Cardiothorac Vacs Anesth 2017; 31:595-601
- MASLOW AD, REGAN MM, PANZICA P, et al. Precardiopulmonary bypass right ventricular function is associated with poor outcome after coronary artery bypass grafting in patients with severe left ventricular systolic dysfunction. Anesth Analg 2002; 95:1507-18
- MATHEW JP, SWAMINATHAN M, AYOUB CM. Clinical manual and review of transesophageal echocardiography, 2nd edition. New York: McGraw-Hill 2010, 571-89
- MERIS A, FALETRA F, CONCA C, et al. Timing and magnitude of regional right ventricular function : a speckle-tracking-derived strain study of normal subjects and patients with right ventricular dysfunction. J Am Soc Echocardiogr 2010; 23:823-31
- MICHAUX I, FILIPOVIC M, SKARVAN K, et al. Effects of on-pump versus off-pump coronary artery bypass graft surgery on right ventricular function. J Thorac Cardiovasc Surg 2006; 131:1281-8
- MUKAI A, SUEHIRO K, FUJIMOTO Y, et al. The sum of early diastolic annulus velocities in the mitral and tricuspid valve can predict adverse events after cardiac surgery. J Cardiothorac Vasc Anesth 2019; 33:149--56
- NAOUM EE, SCHOFIELD P, SHEN T, et al. Agreement between transesophageal echocardiographic tricuspid annular plane systolic excursion measurement methods in cardiac surgery. J Cardiothorac Vasc Anesth 2019; 33:717-24
- RENNER J, CAVUS E, GRUENEWALD M, et al. Myocardial performance index during rapidly changing loading conditions: impact of different tidal ventilation. Eur J Anaesthesiol 2008; 25:217-23
- RUDSKI LG, LAI WW, AFILALO J, et al. Guidelines for the echocardiographic assessment of the right heart in adults: A report from the American Society of Echocardiography. J Am Soc Echocardiogr 2010; 23:685-713
- SHEN T, PICARD MH, HUA L, et al. Assessment of tricuspid annular motion by speckle tracking in anesthetized patients using transesophageal echocardiography. Anesth Analg 2018; 126:62-7
- SHUKLA M, PARK JH, THOMAS JD, et al. Prognostic value of right ventricular strain using speckle-tracking echocardiography in pulmonary hypertension: a systematic review and meta-analysis. Can J Cardiol 2018; 34:1069-78
- SILVERTON N, MEINERI A. Speckle tracking strain of the right ventricle: an emerging tool for intraoperative echocaordiography. Anesth Analg 2017; 125:1475-8
- SKUBAS N. Intraoperative Doppler Tissue imaging is a valuable addition to cardiac anesthesiologist’s armamentarium: A core review. Anesth Analg 2009; 108:48-66
- SMOLAREK D, GRUCHALA M, SOBICZEWSKI W. Echocardiographic evaluation of right ventricular systolic function: the traditional and innovative approach. Cardiol J 2017; 24:563-72
- SULLIVAN TP, MOORE JE, KLEIN AA, et al. Evaluation of the clinical utility of transesophageal echocardiography and nonvasive monitoring to assess right vetricular function during and after pulmonary endarterectomy. J Cardiothorac Vasc Anesth 2018; 32:771-8
- TAMBORINI G, MARSAN N, GRIPARI P, et al. Reference values for right ventricular volumes and ejection fraction with real-time three-dimensional echocardiography: evaluation in a large series of normal subjects. J Am Soc Echocardiogr 2010; 23:109-15
- TAN CO, HARLEY I. Perioperative transesophageal echocardiographic assessment of the right heart and associated structures: a comprehensive update and technical report. J Cardiothorac Vasc Anesth 2014; 28:1112-33
- TEI C, NISHIMURA RA, SEWARD JB, et al. Non-invasive Doppler-derived myocardial performance index: correlation with simultaneaous measurements of cardiac catheterization. J Am Soc Echocardiogr 1997; 10:169-78
- THUNBERG CA, GAITAN BD, GREWAL A, et al. Pulmonary hypertension in patients undergoing cardiac surgery: pathophysiology, perioperative management, and outcomes. J Cardiothorac Vasc Anesth 2013; 27:551-72
- TOUSIGNANT CP, BOWRY R, LEVESQUE S, et al. Regional differences in color Tissue-Doppler-derived measures of longitudinal right ventricular function using transesophageal and transthoracic echocardiography. J Cardiothor Vasc Anesth 2008; 22:400-5
- UNSWORTH B, CASULA RP, YADAV H, et al. Contrasting effect of different cardiothoracic operations on echocardiographic right ventricular long-axis velocities, and implications for interpretation of post-operative values. Int J Cardiol 2013; 165:151-60
- VOGEL M, SCHMIDT R, KRISTIANSEN S, et al. Validation of myocardial acceleration during isovolumic contraction as a novel non-invasive index of right ventricular contractility. Circulation 2002; 105:1693—9
- WU VCC, TAKEUCHI M. Echocardiographic assessment of right ventricular systolic function. Cardiovasc Diagn Ther 2018; 8:70-9
- YU CM, SANDERSON JE, CHAN S, et al. Right ventricular diastolic dysfunction in heart failure. Circulation 1996; 93:1509-14
- ZWAAN HB van der, GELEIJNSE ML, McGHIE JS, et al. Right ventricular quantification in clinical practice: two-dimensional versus three-dimensional echocardiography compared with cardiac magnetic resonance imaging. Eur J Echocardiogr 2011; 12:656-64
