Les patients hypertendus sont très généralement sous une thérapie chronique préopératoire multi-médicamenteuse. Les inhibiteurs de l’enzyme de conversion (IEC), les antagonistes du récepteur de l’angiotensine II (ARA), les β-bloqueurs, les bloqueurs calciques et les diurétiques sont tous adéquats, et sont prescrits en monothérapie ou dans diverses combinaisons entre eux [25]. La thérapeutique initiale consiste généralement en un IEC ou un ARA, selon tolérance; les bloqueurs calciques et les β-bloqueurs sont plutôt une deuxième étape; les diurétiques font essentiellement partie de la trithérapie [19]. Ceci pose deux problèmes à l'anesthésiste: quelles en sont les implications physiopathologiques du médicament et quelle attitude adopter face à l'interruption du traitement ?
Les bloqueurs de l'angiotensine
Les inhibiteurs de l'enzyme de conversion, et les antagonistes du récepteur de l’angiotensine II pour les malades qui ne supportent pas les premiers, sont les antihypertenseurs de premier choix car ils baissent les résistances périphériques (vaisseaux résistifs) et le retour veineux (vaisseaux capacitifs) sans provoquer de tachycardie. Ils améliorent la survie des patients en insuffisance cardiaque congestive [5] et freinent le développement de l'hypertrophie et du remodelage ventriculaires [8]. Ils diminuent la mortalité lors d'infarctus avec dysfonction ventriculaire [35] et présentent un effet anti-ischémique lors d'angor silencieux [20]. Les antagonistes du récepteur à l’angiotensine II (sartans) ont les mêmes propriétés. Le système rénine-angiotensine est impliqué dans la régulation du volume circulant, de la pression sanguine et des circulations régionales; il est activé par la baisse du volume sanguin effectif. Alors que l'on en dépend peu en normovolémie, sa contribution au maintien de la pression artérielle devient cruciale en hypovolémie [12]. Lorsque le système rénine-angiotensine est bloqué, la pression artérielle dépend des deux autres régulations physiologiques: le tonus sympathique, système à régulation rapide, et la vasopressine endogène, système compensatoire lent qui agit sur les vaisseaux résistifs et non capacitifs [9,26].
L'anesthésie générale ou rachidienne inhibe l'activité sympathique. Si le patient est sous IEC/ARA, le débit cardiaque ne s'adapte plus aux variations de charge que par la vasopressine (régulation lente), et la pression devient dépendante de la précharge [6,26]. Il existe donc un risque majeur d'hypotension sévère à l'induction et d'amplification des oscillations de pression lors des variations de volume ou de stimulation centrale, particulièrement chez les malades hypovolémiques ou souffrant de dysfonction diastolique; cet effet est potentialisé par les diurétiques [11,22]. Si l'indication aux IEC est une insuffisance ventriculaire gauche congestive, l'incidence d'hypotension à l'induction est moins sévère parce que les variations de précharge modifient peu le débit d’un VG défaillant dont la courbe de Starling est aplatie (Figure 21.20) [7,15,24].
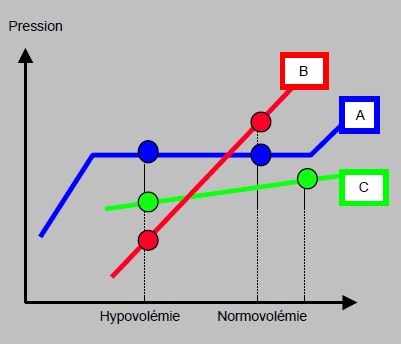
Figure 21.20 : Relation schématique entre la volémie et la pression artérielle. L'individu normal (A) maintient sa pression sur une large plage de volémie par l'action de l'angiotensine II: vasoconstriction des vaisseaux de résistance et de capacitance; la pression ne chute qu'en hypovolémie extrême. Chez le malade traité avec des IEC (B), la pression devient dépendante de la volémie et varie linéairement avec elle, parce que le mécanisme compensatoire de l'angiotensine II est bloqué. Le malade en insuffisance cardiaque traité avec des IEC (C) présente une dépendance identique mais sa courbe est plus plate à cause du couplage ventriculo-artériel: les variations de volémie modifient peu le débit du VG [d'après Coriat P. Renin angiotensin aldosterone systems blockade and perioperative left ventricular function. Semin Cardiothorac Vasc Anesth 2003; 7:55-8].
Par ailleurs, les IEC/ARA inhibent la vasoconstriction artériolaire efférente du glomérule, ce qui diminue la filtration glomérulaire en cas d'hypotension ou lors d’utilisation de substances qui inhibent la vasodilatation de l’artériole afférente comme l’aprotinine. Une étude clinique a démontré une association significative entre la combinaison d’aprotinine - IEC et l’insuffisance rénale postopératoire [23]. Cette crainte a disparu avec le retrait commercial de l’aprotinine.
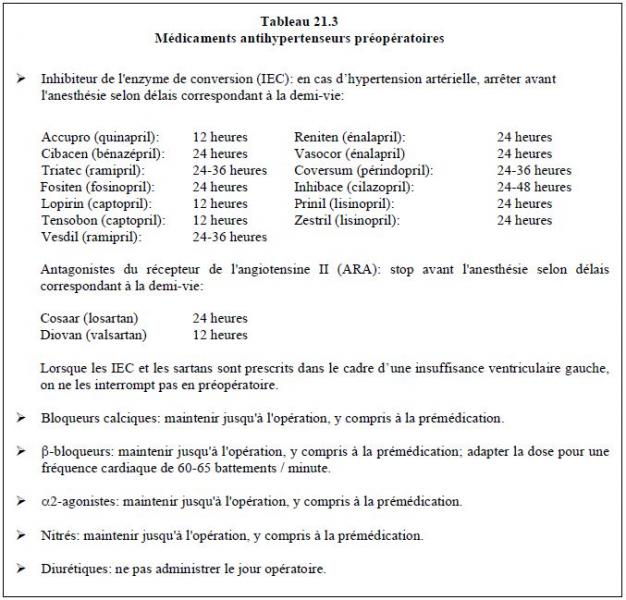
La littérature est assez contradictoire au sujet de l'interruption ou de la continuation des IEC/AA-II en périopératoire chez les hypertendus [14]. Le débat porte surtout sur l'incidence d'insuffisance rénale postopératoire. En effet, cette dernière peut être augmentée de manière marginale (OR 1.18) par le maintien des IEC [3], ou au contraire diminuée de 45% [4]. C'est probablement la gestion de l'hémodynamique peropératoire ou les combinaisons médicamenteuses qui font la différence. Récemment, une étude prospective en chirurgie non-cardiaque portant sur 4'802 patients hypertendus sous IEC/ARA comparés à 9'885 contrôles a révélé que l'interruption du traitement 24 heures avant l'opération diminue le risque cardiovasculaire et la mortalité (RR 0.82) ainsi que la probabilité d'épisodes hypotensifs (RR 0.80) par rapport à la continuation du traitement [30]. L'arrêt momentané des IEC/ARA semble donc conférer un avantage non seulement en terme de stabilité hémodynamique mais aussi en terme de mortalité, d'ictus et d'infarctus périopératoire. Comme il n'existe pas d'effet rebond à l'arrêt du traitement chez les hypertendus, il est recommandé de stopper les IEC/ARA 24 heures avant l'intervention [10,15]. Le risque de poussée hypertensive peropératoire n'est pas aggravé; d'ailleurs, les IEC n'en protègent pas le malade [12]. Lorsqu'on maintient les IEC/ARA, traiter l'hypotension survenue au cours de l'anesthésie peut être ardu, car la réponse adrénergique est atténuée et la nor-adrénaline peut manquer d’efficacité; dans les cas sévères, seule la vasopressine (Pitressine®) a un effet significatif. Ces remarques s'appliquent aussi aux ARA et aux inhibiteurs directs de la rénine (aliskiren). Les recommandations actuelles concernant le traitement de l'HTA préconisent de maintenir la PAsyst en dessous de 130-150 mmHg selon la classe d'âge; ceci entraîne un risque certain d'hypotension en peropératoire. Or la mortalité postopératoire à 30 jours augmente chez la personne âgée lorsque la PAsyst est < 120 mmHg en cours d'intervention [38]. Les recommandations pour le délai depuis la dernière prise, formulées en fonction des demi-vies d'élimination, sont indiquées dans le Tableau 21.3.
Si l'indication aux IEC/AA-II est une insuffisance ventriculaire gauche congestive, l'incidence d'hypotension à l'induction est moins sévère parce que la courbe de Frank-Starling de ces patients est beaucoup moins inclinée : les variations de précharge modifient peu le volume systolique du cœur défaillant. Lorsqu’ils sont prescrits dans le cadre de l'insuffisance congestive chronique, il est donc plus prudent de maintenir les IEC puisqu'ils améliorent la fonction ventriculaire gauche, même si la tolérance à l'hypovolémie peut en être réduite [15,24]. Un nouvel agent (Entresto®) constitué de l’association de valsartan et de sacubitril, un inhibiteur de la néprilysine (substance physiologique qui dégrade les peptides natriurétiques), est en passe de devenir un élément majeur dans le traitement de l'insuffisance ventriculaire. En l'absence de données concernant le périopératoire, il est prudent d'appliquer les mêmes règles que pour les ARA, en sachant qu'on est en présence de deux vasodilatateurs au lieu d'un. Dans l'attente d'une expérience clinique suffisante, il est prudent d'interrompre l'Entresto® 24 heures avant l'opération.
Les anti-calciques
Les bloqueurs calciques inhibent l'entrée du calcium dans les cellules musculaires lisses et induisent une vasodilatation artériolaire systémique et pulmonaire sans toucher les vaisseaux de capacitance [36]. Ils ne sont pas recommandés pendant la phase aiguë de l'infarctus. A part leur action anti-angineuse, leurs effets hémodynamiques sont variables selon les préparations. Il est recommandé de poursuivre les bloqueurs calciques jusqu'à l'intervention, bien que leur interruption ne paraisse pas occasionner d'ischémie aiguë et que leur maintien puisse augmenter le besoin en catécholamines et en volume, et prolonger l'effet des curares. Leurs effets inotropes et chronotropes potentialisent ceux des halogénés (risque de bradycardie et de dépression myocardique). Vasodilatateurs des vaisseaux de résistance mais non de capacitance, ils provoquent une hypotension qui est fonction du niveau des RAS. La nifédipine (Adalat®) et l'isradipine (Lomir®) induisent une tachycardie réflexe, alors que le diltiazem (Dilzem®) et le vérapamil (Isoptin®) ont des effets inotrope et chronotrope négatifs susceptibles d’induire une bradycardie sévère en cas d’administration simultanée de β-bloqueur ou d’amiodarone (Tableau 4.25) [39].

L’association d’un IEC (bénazépril, Lotensil®) et d’un anticalcique de type dihydropyridine (amlodipine, Alzar®, Lotrel® en combinaison avec bénazépril) s’est révélée être la meilleure combinaison pour diminuer le risque cardiovasculaire et l’infarctus myocardique chez des hypertendus à haut risque [21]. L’association de l’IEC avec un diurétique est moins efficace.
Les β-bloqueurs
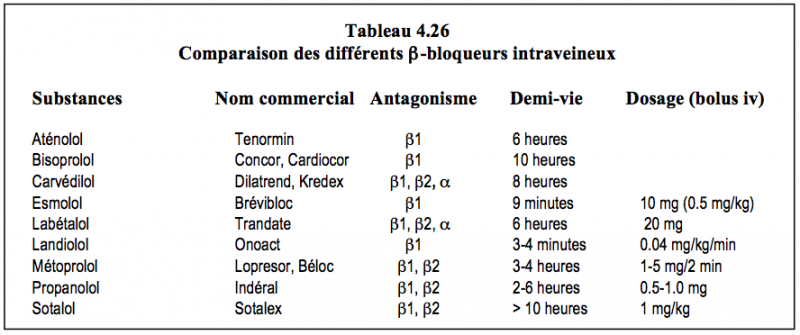
Dans le cadre d’une HTA, les β-bloqueurs freinent la sécrétion de rénine, diminuent la performance cardiaque systolique (sauf en administration chronique dans l'insuffisance cardiaque) et présentent un effet hypotenseur central [36]. Les β1-bloqueurs sont les seuls médicaments associés à une baisse de l'incidence d'événements ischémiques peropératoires en chirurgie coronarienne et non-cardiaque, probablement grâce à la baisse de la fréquence cardiaque qu’ils entraînent [13]. Il y a donc largement plus d'intérêt à les continuer jusqu'à l'opération qu'à les interrompre en préopératoire. De plus, l’interruption du β-blocage provoque un effet rebond et un risque ischémique accru dans les 48 heures. Il était de routine de remplacer, à dose équipotente, les β-bloqueurs de longue durée d'action par des substances d'activité courte et cardio-sélective comme le metoprolol (Loprésor® 50-100 mg). Actuellement, la tendance est de ne plus modifier le traitement en cours, et de le maintenir inchangé en préopératoire. L’effet pourra être prolongé à la demande par des doses répétées ou une perfusion d'esmolol (Brévibloc®, bolus de 10 mg répétés). Le but est d'obtenir une fréquence de 60-65 battements/minute. Le maintien des β-bloqueurs en périopératoire est également avantageux chez les patients en insuffisance cardiaque [2]. Alors qu'ils sont bénéfiques chez les malades déjà sous traitement, les β-bloqueurs n'ont aucun intérêt lorsqu'ils sont prescrits de manière indiscriminée ou aiguë en préopératoire chez des patients qui ne présentent pas d'autre risque qu'une hypertension bénigne; dans ces conditions, ils augmentent même la mortalité et le taux d'AVC [13,41]. Les différents β-bloqueurs ont des effets β1, β2 et α variables selon les substances (Tableau 4.26).
Les β-bloqueurs ne sont efficaces que pour autant que la fréquence cardiaque soit très strictement contrôlée. Même lorsque les patients sont au bénéfice d'un traitement chronique à long terme, l'incidence d'ischémie périopératoire n'est pas modifiée si la fréquence est identique à celle des malades non β-bloqués [31,34]. En effet, les malades β-bloqués depuis longtemps présentent une régulation à la hausse de leurs récepteurs β-adrénergiques (up-regulation), qui les rend hypersensibles à la stimulation catécholaminergique aiguë survenant au cours de la chirurgie ; l’effet inotrope et chronotrope est alors excessif, d’où un risque ischémique aggravé [18], que l'on retrouve dans certaines études de chirurgie vasculaire [30,33]. D’autre part, le remplacement d’un agent à longue durée d’action par un agent plus court augmente le risque d’un effet rebond qui survient dans la période postopératoire immédiate lorsque les prises d’entretien sont omises à cause de l’instabilité hémodynamique ou de l’impossibilité de la voie digestive [29] ; or c’est précisément la période la plus dangereuse. Le problème de la prise en charge des malades sous β-bloqueurs est la fixité de leur fréquence cardiaque, qui limite significativement l'adaptabilité du débit cardiaque aux variations de la demande métabolique et de la volémie peropératoire, même si la réponse neuro-humorale au stress n'est pas modifiée [42]. C'est ainsi que l'incidence d'hypotension et de bradycardie est très augmentée chez les patients β-bloqués, respectivement de 1.6 et 2.7 fois [13].
Les diurétiques
Les diurétiques entraînent un risque d'hypotension par hypovolémie et baisse de précharge [22]. Ils favorisent l'hypokaliémie, l'hyponatrémie, l’hypomagnésémie et l'alcalose métabolique. Il est préférable de ne pas les administrer le jour de l'intervention, de manière à conserver un volume circulant élevé; cette précharge haute facilite l'équilibre lors de l'induction et de la ventilation mécanique. Vu la haute teneur en K+ des solutions de cardioplégie, l’hypokaliémie n’est pas un risque significatif en chirurgie cardiaque, mais l’hypomagnésémie augmente le risque d’arythmies, particulièrement celui de fibrillation auriculaire.
Les β1-activateurs
Le fenoldopam induit une vasodilatation périphérique en stimulant les récepteur béta-dopaminergiques, notamment au niveau rénal où il provoque une augmentation du flux et une diurèse accrue. Il s’administre en perfusion à 0.03 – 0.3 mcg/kg/min après une dose de charge de 0.1 mcg/kg/min [16]. Il est indiqué essentiellement chez les patients souffrant de dysfonction rénale.
Les α-bloqueurs
Les α1-bloqueurs sont peu utilisés en-dehors du traitement de la poussée hypertensive aiguë à cause de la tachycardie réflexe et de l'hypotension orthostatique qu'ils occasionnent (phentolamine, prazocine). L'urapidil (Ebrantil®) est un antagoniste α1 sélectif; comme il possède en outre un effet α-2 stimulant et un effet sympathicolytique central de type sérotoninergique, il ne provoque pas de tachycardie.
L’α-blocage est pratique en association avec un β-blocage ; malheureusement, les deux effets ont des pharmacocinétiques différentes dans les substances qui les combinent ; c'est le cas du carvédilol (Dilatrend®, 12.5 mg per os) et du labétalol (Trandate®, 100-200 mg per os, 1-2 mg/min iv). Chez ce dernier, la puissance de l'effet β-bloqueur est 7 fois plus importante que celle de l'effet α par voie intra-veineuse et 3 fois par voie orale ; la durée d'action de l’effet α est plus courte que celle de l’effet β (2-4 heures) [33].
Les α2-agonistes
Les α2-agonistes centraux (clonidine, dexmédétomidine) limitent la tachycardie et l'hypertension, et induisent de plus une sédation et une analgésie; ces effets sont tout bénéfice en peropératoire, et diminuent l'incidence de complications cardiaques postopératoires [28]. Toutefois, ils inhibent la libération de nor-adrénaline aux terminaisons sympathiques, et interfèrent de ce fait avec l'activité de la dopamine, qui est atténuée, et celle de la dobutamine, qui est accentuée [27]. Les α2-agonistes ne doivent pas être arrêtés en préopératoire pour quatre raisons [40]:
- Leur omission entraîne un effet rebond ;
- Ils sont sédatifs ;
- Ils assurent une stabilisation hémodynamique relative pendant l'intervention ;
- Ils diminuent le risque ischémique (mais non celui d'infarctus ni de mortalité).
Autres substances
L'α-méthyl-dopa (Aldomet®) est un précurseur de l'α-méthyl-noradrénaline, qui stimule les récepteurs α2 centraux. Cet antihypertenseur n'est plus guère utilisé que pendant la grossesse vu sa sécurité dans cette situation.
Les dérivés nitrés doivent être maintenus aux dosages habituels jusqu'à l'intervention; ils sont administrés le matin du jour opératoire, car leur arrêt brusque peut induire une ischémie. La baisse de la précharge qu'ils occasionnent s'associe à la chute du tonus sympathique lors de l'induction de l'anesthésie; elle provoque une baisse souvent importante de la pression artérielle, qu'il faut compenser par du volume (cristalloïde, colloïde) ou de faibles doses d'éphédrine (2-5 mg iv: effet α veineux central prédominant). Quelle que soit l'instabilité hémodynamique qu'elle occasionne, une perfusion de dérivé nitré en cours doit être impérativement poursuivie jusqu'à la CEC.
Il existe encore une série de vasodilatateurs à action vasculaire directe. Ils sont passés de mode en traitement chronique à cause de la tachycardie qu'ils provoquent: hydralazine (Néprésol®), minoxidil (Loniten®), réserpine (Serpasil®), etc. La kétansérine (Sufrexal®) est un antagoniste des récepteurs HT2 de la sérotonine et un faible α1-bloqueur; il ne provoque pas de tachycardie ni d'effet shunt intrapulmonaire.
Traitement de la crise hypertensive
Le nitroprussiate de Na (Nipruss®) donne directement naissance à du NO•, contrairement aux dérivés de la nitroglycérine qui agissent par le biais de composés sulfydryls spécifiques. Le NO• formé active la guanylate cyclase (formation de GMPc) et freine l'augmentation de Ca2+ dans la cellule musculaire lisse vasculaire. La libération de NO• s'accompagne de celle de CN-; cet anion réagit avec la méthémoglobine (0.5% de l'Hb totale) pour former de la cyanméthémoglobine non-toxique, puis est converti en thiocyanate par transsulfuration par les rhodanases hépatiques. La capacité totale de ce système permet de détoxifier 50 mg de nitroprussiate [17]. Le risque d'accumulation de CN- débute pour une perfusion continue supérieure à 4-5 mcg/kg/min pendant 24 heures [37]; il se caractérise par un blocage progressif de la phosphorylation oxydative avec anoxie tissulaire et acidose lactique (lactate > 10 mM/L). Un signe caractéristique est le développement soudain d'une tachyphylaxie. Le traitement de l'intoxication est le suivant:
- Arrêt immédait de la perfusion de nitroprussiate;
- Ventilation à 100% O2, même en cas de saturation normale;
- Correction de l'acidose métabolique par du bicarbonate de Na;
- Bleu de méthylène, 1-2 mg/kg (amp. 10 mg/ml);
- Nitrite de Na 3%, 5 mg/kg iv;
- Thiosulfate de Na, 200 mg/kg iv (15 min);
- Hydroxycobalamine (vitamine B12) en perfusion (25 mg/h).
Le Nipruss® est un vasodilatateur artériolaire systémique et pulmonaire puissant, rapide, et efficace quelle que soit l'étiologie de l'hypertension. Il inhibe la vasoconstriction pulmonaire hypoxique et augmente la pression intracrânienne. La vitesse de démarrage de la perfusion est de 0.3 mcg/kg/min; la vitesse maximale de sécurité est de 10 mcg/kg/min pendant 10 minutes et 5 mcg/kg/min pendant 24 heures. Pendant la CEC, le Nipruss® garde son efficacité en hypothermie, mais les rhodanases hépatiques sont inhibées par le froid; le métabolisme est ralenti et les risques toxiques augmentés. Sa très large utilisation dans cette situation montre que ce risque est faible; cependant, la prudence réclame de mesurer fréquemment l'équilibre acido-basique en hypothermie et de traiter agressivement toute acidose métabolique suspecte (voir Chapitre 4 Vasodilatateurs).
Les dérivés nitrés libèrent du NO• par l'intermédiaire des groupes sulfhydryls de la cystéine présente dans la cellule musculaire lisse. Il n'y a aucune toxicité significative connue. Une veinodilatation des vaisseaux de capacitance s'installe dès les faibles doses et n'augmente pratiquement pas avec les concentrations croissantes de produit; cet effet diminue la précharge, la tension de paroi et le débit cardiaque; la mVO2 baisse essentiellement par ce biais. A doses élevées, une vasodilatation artériolaire dose-dépendante apparaît, qui est responsable d'une tachycardie réflexe lorsque l'hémodynamique de base est normale, mais non en cas d'insuffisance cardiaque. Alors qu'elle abaisse le débit cardiaque de l'individu normal, la nitroglycérine améliore la performance ventriculaire lors d'insuffisance cardiaque congestive. Son excellent effet vasodilatateur pulmonaire peut induire un effet shunt et une baisse de la PaO2. En administration continue, une tolérance se développe rapidement.
Au niveau du lit coronaire, les nitrés ont une action complexe [1] :
- Dilatation des petits vaisseaux proportionnellement plus importante que celles des vaisseaux épicardiques;
- Dilatation des collatérales;
- Renversement des spasmes coronariens;
- Amélioration du flux à travers les sténoses par relâchement de la vasoconstriction locale, indépendamment de l'intégrité endothéliale;
- Amélioration du rapport de flux sous-endocardique / sous-épicardique.
Comme hypotenseur, la nitroglycérine est indiquée s'il existe une composante de surcharge volumique ou d'ischémie coronarienne. A une vitesse de 1-2 mcg/kg/min, seule la précharge diminue; la vasodilatation artérielle apparaît à des dosages supérieurs à 3 mcg/kg/min.
Parmi les anticalciques, les dérivés dihydropyridines sont les plus utilisés comme anti-hypertenseurs sur les vaisseaux de résistance; les plus récents, tels la nicardipine et l'isradipine, sont dépourvus d'effets tachycardisant et cardiodépresseur; ce dernier devient cependant significatif en cas de β-blocage associé. Bien qu'ils aient moins d'effet anti-angineux que le diltiazem, ils sont préférables au nitroprussiate chez le patient coronarien, parce qu'ils ne provoquent pas de "vol" intramyocardique ni de tachycardie. A l'exception de la nicardipine dont la durée d'action en bolus i.v. est de 10-15 minutes, l'effet des dihydropyridines est plus lent et plus prolongé, donc moins aisément manipulable, que celui des nitrés. Le diltiazem (Dilzem®) est fréquemment utilisé en cas de tachycardie associée, vu son effet chronotrope négatif. La nicardipine (Loxen®) est un puissant vasodilatateur cérébral et coronarien qui ne provoque pas de syndrome de vol. Le vérapamil (Isoptin®) n'est pas recommandé dans le cadre de l'hypertension en chirurgie cardiaque à cause de son effet inotrope négatif marqué et du risque élevé de bloc atrio-ventriculaire complet (augmenté après CEC). La clevidipine (Cleviprex®) est un vasodilatateur artériel sélectif du réseau systémique et coronarien sans effet sur les vaisseaux de capacitance ni sur la précharge ; il ne provoque pas de tachycardie. Par voie iv, il a une demi-vie de 10 min (métabolisation par les estérases plasmatiques). Le dosage est 1-2 mg/h en perfusion, que l’on peut doubler toutes les 3-5 minutes jusqu’à l’effet désiré (dose maximale : 32 mg/h). Aussi efficace que le nitroprussiate sur la pression systémique sans en avoir le risque de toxicité, la clevidipine dilate les coronaires sans occasionner de vol [16].
Lorsqu'une poussée hypertensive survient dans le cadre d'une ischémie coronarienne aiguë, un dérivé à effet chronotrope et inotrope négatif est préférable aux dihydropiridines essentiellement vasodilatatrices et spasmolytiques: diltiazem (effets marqués) ou nifédipine (effets plus faibles). Dans le cadre d'une défaillance ventriculaire, le choix se porte sur un agent sans effet myocardique: isradipine ou nicardipine. Sur le réseau coronarien, les anticalciques ont un effet complexe [32]:
- Augmentation de l'apport en O2: augmentation du flux coronaire, vasodilatation, levée de spasme coronarien, amélioration de la perfusion sous-endocardique;
- Diminution de la demande en O2: diminution de la postcharge, diminution de la contractilité et baisse de la fréquence (vérapamil, diltiazem), modification du couplage électro-mécanique.
L’esmolol (Brevibloc®) est un β1-bloqueur sélectif, sans acivité sympathico-mimétique intrinsèque; sa courte durée d'action (10 minutes) est due à sa biotransformation rapide par les estérases des érythrocytes. Comme antihypertenseur, il se justifie chez le patient coronarien pour baisser la consommation d'oxygène dans le cadre d'une hyperactivité sympathique accompagnée d'une tachycardie et d'une fonction systolique normale. N'ayant pas d'effet vasodilatateur propre, il n'altère pas la vasoconstriction pulmonaire hypoxique.
L'urapidil (Ebrantil®) combine une activité d'α1-blocage périphérique, de stimulation α2 et de stimulation sérotoninergique centrale; il ne déclenche pas de tachycardie, ni d'effet shunt intrapulmonaire, ni d'augmentation de la pression intracrânienne. En bolus iv, son action s'installe en 5 minutes.
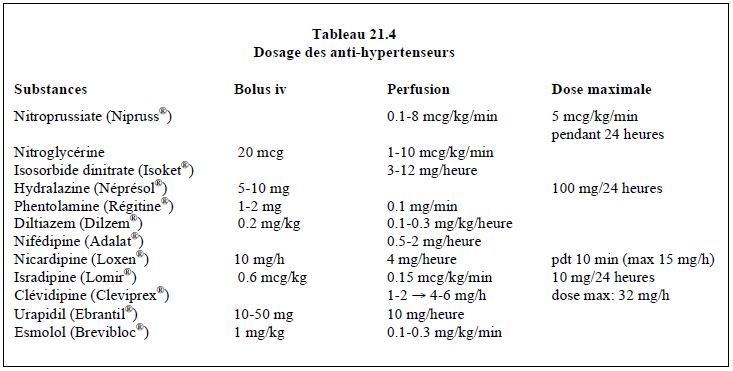
Les effets pharmacologiques et les dosages recommandés de ces différentes substances sont décrits dans les Tableaux 21.4 et 21.5.

Sous anesthésie, on est tenté de régler une poussée hypertensive par un simple approfondissement du sommeil et de l'analgésie. Cette technique est parfaitement adaptée à une légère hausse de pression chez les patients souffrant d'HTA modérée, mais elle est inadéquate dès qu'il s'agit de contrôler une hypertension majeure. Dans ce cas, le traitement doit reposer sur des agents vasodilatateurs spécifiques. Chez les malades dont l'hémodynamique est fragile, d'autre part, il est risqué d'utiliser les agents d'anesthésie pour baisser la pression, car cette manœuvre s'accompagne d'effets hémodynamiques délétères, comme une chute du débit cardiaque, un effet inotrope négatif ou une insuffisance de précharge.
| Traitement anti-hypertenseur |
|
Traitement préopératoire :
- β-bloqueurs : poursuivre en continu et maintenir la FC à 60-65 batt/min
- IEC/ARA : stop 12-24 heures en préopératoire si prescrits pour l’HTA ; maintenir en continu si prescrits pour insuffisance cardiaque
- α2-agonistes : maintenir le traitement
- Anticalciques : maintenir en périopératoire
- Dérivées nitrés : maintenir en périopératoire
- Diurétiques : pas d’administration le jour opératoire
Traitement de la crise hypertensive peropératoire :
- Phentolamine, bolus répétés 1 mg
- Nitroglycérine, bolus 20 mcg
- Nitroprussiate de Na, 0.3-3 mcg/kg/min
- Approfondissement de l’anesthésie/analgésie
- Isoflurane 5%
En cas d’ischémie myocardique associée:
- Nitroglycérine, perfusion 1-10 mcg/kg/min
- Esmolol, bolus répétés 10 mg
- Si spasmes coronariens : diltiazem 0.1-0.1 mg/kg/h
|
© CHASSOT PG, Septembre 2007, dernière mise à jour, Décembre 2018
Références
- ABRAMS J. Nitrates. In: PARMLEY WW, CHATTERJEE K. Cardiovascular Pharmacology. London, Wolfe-Mosby, 1994, 4.1 - 4.24
- ANDERSSON C, MÉRIE C, JØRGENSEN M, et al. Association of -blocker therapy with risks of adverse cardiovascular events and deaths in patients with ischemic heart disease undergoing noncardiac surgery. A Danish nationwide cohort study. JAMA Intern Med 2014; 174:336-44
- BANDEALI SJ, KAYANI WT, LEE VV, et al. Outcomes of preoperative angiotensin-converting enzyme inhibitor therapy in patients undergoing isolated coronary artery bypass grafting. Am J Cardiol 2012; 110:919-23
- BENEDETTO U, SCIARRETTA S, ROSCITANO A, et al. Preoperative angiotensin-converting enzyme inhibitors and acute kidney injury after coronary artery bypass grafting. Ann Thorac Surg 2008; 86:1160-5
- BRAUNWALD E. ACE inhibitors: a cornerstone in the treatment of heart failure. N Engl J Med 1991; 325:351- 3
- CARP H, VEDHERA R, JAYARAM A, et al. Endogenous vasopressin and renin angiotensin systems support blood pressure after epidural block in humans. Anesthesiology 1994; 80:1000-7
- COLSON , RYCKWAERT F, CALVET B, et al. Haemodynamic effect of anaesthesia in patients with congestive heart failure treated with ACE inhibitors. Anesthesiology 1993; 79:A88
- COLSON P, RYCKWAERT F. Angiotensin-converting enzyme inhibitors and the renin angiotensin system. Curr Opin Anaesthesiol 1995; 8:83-7
- COLSON P, RYCKWAERT F, CORIAT P. Renin-angiotensin system antagonists and anesthesia. Anesth Analg 1999; 89:1143-55
- COMFERE T, SPRUNG J, KUMAR MM, et al. Angiotensin system inhibitors in a general surgical population. Anesth Analg 2005; 100:636-44
- CORIAT P, RICHER C, DOURAKI T, et al. Influence of chronic angiotensin-converting enzyme inhibition on anesthetic induction. Anesthesiology 1994; 81:299-307
- CORIAT P. Renin angiotensin aldosterone systems blockade and perioperative left ventricular function. Semin Cardiothorac Vasc Anesth 2003; 7:55-8
- DEVEREAUX PJ, YANG H, YUSUF S, et al, for the POISE Study Group. Effects of extended-release metoprolol succinate in patients undergoing non-cardiac surgery (POISE-trial): a randomised controlled trial. Lancet 2008; 371:1839-47
- DISQUE A, NEELANKAVIL J. Con: ACE inhibitors should be stopped prior to cardiovascular surgery. J Cardiothorac Vasc Anesth 2016; 30:820-2
- FLEISHER LA, FLEISCHMANN KE, AUERBACH AD, et al. 2014 ACC/AHA Guideline on perioperative cardiovascular evaluation and management of patients undergoing noncardiac surgery: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. Circulation 2014; 130:e278-e333
- FONTES ML, VARON J. Perioperative hypertensive crisis: newer concepts. Int Anesthesiol Clin 2012; 50:40-58
- FRIEDERICH JA, BUTTER WORTH JF. Sodium nitroprusside: Twenty years and counting. Anesth Analg 1995; 81:152-62
- GILES JW, SEAR JW, FOEX P. Effect of chronic beta-blockade on peri-operative outcome in patients undergoing noncardiac surgery: an analysis of observational and case control studies. Anaesthesia 2004; 59:574-83
- HARTLE A, McCORMACK T, CARLISLE J, et al. The measurement of adult blood pressure and management of hypertension before elective surgery. Joint Guidelines from the Association of Anaesthetists of Great Britain and Ireland and the British Hypertension Society. Anaesthesia 2016; 71:326-37
- IKRAM H, LOW CJS, SHIRLAW TM, et al. Angiotensin converting enzyme inhibition in chronic stable angina: effects on myocardial ischemia and comparison with nifedipine. Br Heart J 1994; 71:30-3
- JAMERSON K, WEBER MA, BAKRIS GL, et al. Benazepril plus amlodipine or hydrochlorothiazide for hypertension in high-risk patients. N Engl J Med 2008;359:2417-28
- KHETERPAL S, KHODAPARAST O, SHANKS A, et al. Chronic angiotensin-converting enzyme inhibitor or angiotensin receptor blocker therapy combined with diuretic therapy is associated with increased episodes of hypotension in noncardiac surgery. J Cardiothorac Vasc Anesth 2008; 22:180-6
- KINCAID EH, ASHBURN DA, HOYLE JR, et al. Does the combination of aprotinin and angiotensin-converting enzyme inhibitor cause renal failure after cardiac surgery ? Ann Thorac Surg 2005; 80:1388-93
- KRISTENSEN SD, KNUUTI J, SARASTE A, et al. 2014 ESC/ESA Guidelines on non-cardiac surgery: cardiovascular assessment and management. Eur Heart J 2014; 35:2383-431
- MANCIA G, FAGARD R, NARKIEWICZ K, et al. 2013 ESH/ESC Guidelines for the management of arterial hypertension. The task force for the management of arterial hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC). Eur Heart J 2013; 34: 2159-219
- METS B. Management of hypotension associated with angiotensin-axis blockade and general anesthesia administration. J Cardiothorac Vasc Anesth 2013; 27:156-67
- O’HATA H, IIDA H, WATANABE YA, et al. Hemodynamic responses induced by dopamine and dobutamine in anesthetized patients premedicated with clonidine. Anesth Analg 1999; 89:843-8
- OLIVER W.C., DE CASTRO M.A., STRICKLAND R.A. - Uncommon diseases and cardiac anesthesia. In: KAPLAN JA. Cardiac Anesthesia, 4rd edition. Philadelphia, W.B.Saunders Co, 1999, pp 901-957
- REDELMEIER D, SCALES D, KOPP A. Beta blockers for elective surgery in elderly patients: population based, retrospective cohort study. BMJ 2005; 331:932-9
- ROSHANOV PS, ROCH WERG B, PATEL A, et al. Withholding versus continuing angiotensin-converting enzyme inhibitors or angiotensin II receptor blockers before noncardiac surgery. Anesthesiology 2017; 126:16-27
- SEAR JW, FOEX P, HOWELL SJ. Effect of chronic intercurrent medication with beta-adrenoreceptor blockade or calcium channel entry blockade on postoperative silent myocardial ischaemia. Br J Anaesth 2000; 84:311-15
- SINGH BN. Calcium channel blockade and cardiovascular therapeutics. In: PARMLEY WW, CHATTERJEE K. Cardiovascular Pharmacology. London, Wolfe-Mosby, 1994, 6.1 - 6.28
- SLADEN RN, KLAMERUS KJ, SWAFORD NWG, et al. Labetalol for the control of elevated blood pressure following coronary artery bypass grafting. J Cardiothorac Vasc Anesth 1990; 4:210-21
- SPRUNG J, ABDEMALAK B, GOTTLIEB A, et al. Analysis of risk factors for myocardial infarction and cardiac mortality after major vascular surgery. Anesthesiology 2000; 93:129-40
- SUTTON M. St J. Should angiotensin-converting enzymes inhibitors be used routinely after infarction ? Perspectives from the survival and ventricular enlargement trial. Br Heart J 1994; 71:115-8
- VANZWEITEN PA, VANWEZEL H.B. Antihypertensive drug treatment in the perioperative period. J Cardiothorac Vasc Anesth 1993; 7:213-26
- VESEY CJ, COLE PV. Blood cyanide and thiocyanide concentrations by long-term therapy with sodium nitroprusside. Br J Anaesth 1985; 57:148-55
- WHELTON PK, CAREY RM, ARONOW WS, et al. 2017 ACC/AHA/AAPA/ABC/ACPM/AGS/AphA/ASH/ASPC/NMA/PVNA Guideline for the prevention, detection, evaluation, and management of high blood pressure in adults: Executive summary. J Am Coll Cardiol 2018; 71:2199-269
- WIJEYSUNDERA DN, BEATTIE WS. Calcium channel blockers for reducing cardiac morbidity after noncardiac surgery: A meta-analysis. Anesth Analg 2003; 97:634-41
- WIJEYSUNDERA DN, BENDER JS, BEATTIE WS. Alpha-2 adrenergic agonists for the prevention of cardiac complications among patients undergoing surgery. Cochrane Database Syst Rev 2009; 4: CD004126
- WIJEYSUNDERA DN, DUNCAN D, NKONDE-PRICE, et al. Perioperative beta-blockade in noncardiac surgery: A systematic review for the 2014 ACC/AHA Guideline on perioperative cardiovascular evaluation and management of patients undergoing noncardiac surgery: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol 2014 ; 64 :2406-25
- ZAUGG M, TAGLIENTE T, LUCHINETTI E, et al. Beneficial effects of -adrenergic blockade in elderly patients undergoing non-cardiac surgery. Anesthesiology 1999; 91:1674-86
