Caractéristiques
Toute intervention en CEC porte transitoirement atteinte à la fonction myocardique systolique et diastolique; cette dysfonction sera d'autant plus sévère que la fonction préopératoire est abaissée et que l'opération pratiquée est à risque. La dysfonction post-CEC présente une évolution très particulière: elle s'améliore spontanément pendant la première heure après la mise en charge, puis s'aggrave pour atteindre le nadir entre la 4ème et la 6ème heure [34]. C'est la période à laquelle les médiateurs libérés (fraction C5a du complément, interleukine-6 et -8, TNF, etc) sont les plus élevés (Figure 7.51).
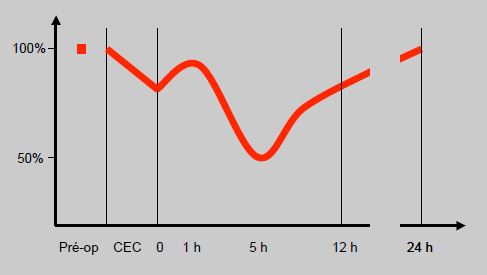
Figure 7.51 : Evolution de la fonction cardiaque après pontage aorto-coronarien en CEC [33]. Cette courbe est construite à partir de plusieurs références; pour cette raison, la performance myocardique, évaluée de manière différente et à des temps différents selon les études, n'est pas exprimée en unités mais en pourcentage de la valeur préopératoire [34].
La récupération prend en général 8 à 24 heures, mais parfois plusieurs jours; elle est d'autant plus lente que la fonction préopératoire était moins bonne. Cette situation contre-indique l'usage de β-bloqueurs pour régulariser une tachycardie, car ils révèlent brusquement la dysfonction sous-jacente et entraînent un effondrement hémodynamique. D'autre part, la CEC diminue de 30% l'activité des récepteurs β1-myocardiques, et augmente proportionnellement celle des récepteurs β dans la réponse sympathique aux catécholamines [39]. Cette activité diminue encore de 25% dans la période postopératoire immédiate [35]. Ceci explique la résistance aux amines de type β1 que l'on peut rencontrer en sortant de pompe, et l'efficacité de l'adrénaline, qui a des effets mixtes β et α.
De nombreux facteurs participent à la genèse de l'insuffisance cardiaque post-CEC. Les facteurs de risque sont liés au patient, à la CEC et à l’opération (Tableau 7.10).

La dysfonction systolique du VG se manifeste par une hypotension artérielle, un bas débit cardiaque (index < 2.2 L/min/m2), une augmentation de la différence artério-veineuse en O2 (> 5.5 ml/L), une désaturation veineuse centrale (SvO2 < 55%), une PAPO élevée (> 18 mmHg), une pression télédiastolique du VD > 10 mmHg, et souvent une bradycardie. Le ventricule est hypokinétique et dilaté à l'examen échocardiographique (Vidéos). Alors qu’elle est est de 1-2% lorsque la FE est > 0.4, la mortalité opératoire des PAC est de 9-12% en cas de dysfonction gauche après CEC (FE < 0.35) [43]. L'insuffisance droite isolée est associée à une mortalité de 8.2% (FE 0.2-0.3) à 16% (FE < 0.2) [4]. Lorsqu’elle est associée à une défaillance gauche, l’insuffisance ventriculaire droite entraîne une mortalité supérieure à 40% dans le postopératoire [25]. La fonction du VD est un meilleur critère pronostique que la valeur de la PAP, parce qu'un ventricule épuisé ne peut plus générer une pression élevée.
Vidéo: Défaillance du VG en vue 4-cavités 0°; le ventricule est dilaté, arrondi, sévèrement hypocontractile (FE < 15%), ses mouvements sont rigides; seul le segment basal latéral a une activité significative; les mouvements de la valve mitrale sont très faibles. Le VD est normal.
Vidéo: Défaillance du VG en vue long-axe 130° dans le même cas que la vidéo précédente; la pose d'une assistance ventriculaire est impérative.
Vidéo: Défaillance biventriculaire; le VG est dilaté, arrondi et sévèrement hypocontractile; présence d'une insuffisance mitrale de type restrictif. Le VD est dilaté, sa paroi libre se contracte insuffisamment. L'apex du coeur est constitué par le VD.
Vidéo: Défaillance du VG en vue 4-cavités 0°; le ventricule est dilaté, arrondi, sévèrement hypocontractile (FE < 15%), ses mouvements sont rigides; seul le segment basal latéral a une activité significative; les mouvements de la valve mitrale sont très faibles. Le VD est normal.
Vidéo: Défaillance du VG en vue long-axe 130° dans le même cas que la vidéo précédente; la pose d'une assistance ventriculaire est impérative.
Vidéo: Défaillance biventriculaire; le VG est dilaté, arrondi et sévèrement hypocontractile; présence d'une insuffisance mitrale de type restrictif. Le VD est dilaté, sa paroi libre se contracte insuffisamment. L'apex du coeur est constitué par le VD.
La présence ou l'aggravation d'une insuffisance mitrale (IM) est un signe pathognomonique, et un bon marqueur du degré de la dilatation ventriculaire et un excellent signe de la dysfonction aiguë du VG (Figure 7.52) (Vidéo).
Vidéo: Insuffisance mitrale majeure sur ischémie antérieure aiguë (vue mi-oesophagienne 2-cavités 90°) apparue après des pontages aorto-coronariens.
Vidéo: Insuffisance mitrale majeure sur ischémie antérieure aiguë (vue mi-oesophagienne 2-cavités 90°) apparue après des pontages aorto-coronariens.
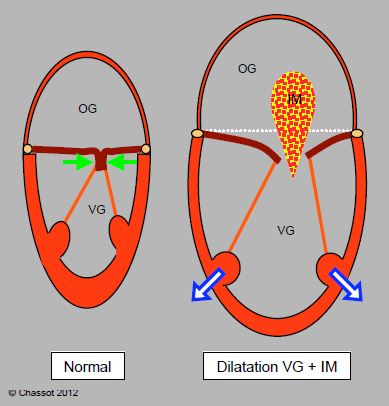
Figure 7.52 : Normalement, les feuillets mitraux s’affrontent par leurs bords libres sur une certaine hauteur (8-10 mm) : leur étanchéité est assurée par la pression intraventriculaire qui les plaquent l’un contre l’autre (flèches vertes). L’insuffisance du VG conduit à 3 phénomènes : la sphéricisation du VG, sa dilatation, et la dilatation de l’anneau mitral. L’écartement des piliers ne donne plus une course suffisante aux cordages pour permettre l'affrontement des feuillets mitraux; ces derniers sont alors retenus en dessous du plan de l'anneau mitral pendant la systole, et la valve fuit; l'insuffisance mitrale est dite restrictive. L'importance et la variation de l'insuffisance mitrale (IM) sont un bon critère du degré d'insuffisance ventriculaire gauche.
Toutefois, l'IM apparaissant après CEC ou l'aggravation d'une IM préalable, peuvent être l'indice de plusieurs pathologies dont la thérapeutique est différente et dont le diagnostic différentiel est important (voir Figure 11.53).
- Dilatation du VG: ventricule agrandi et dysfonctionnel, IM centrale de degré ≥ II (Vidéo). Traitement: catécholamines, inodilatateurs, soutien hémodynamique en CEC, contre-pulsion intra-aortique (CPIA).
- Excès de postcharge: IM centrale. Traitement: vasodilatateur.
- Ischémie segmentaire causant la dysfonction d'un pilier mitral (Vidéo). Traitement: nitroglycérine et noradrénaline, soutien hémodynamique en CEC, CPIA, réfection de pontage; anticalcique (Dilzem®) si spasme coronarien sur mammaire interne.
- Prolapsus mitral: IM excentrique avec bascule d'un feuillet dans l'OG (Vidéo). Traitement: réparation chirurgicale, baisse de la postcharge.
- Obstruction dynamique de la CCVG: aspiration du feuillet antérieur de la valve mitrale dans la chambre de chasse du VG et réouverture mésosystolique de la valve mitrale. Origine: hypovolémie, baisse de postcharge et sur-stimulation sympathique chez un malade souffrant d'hypertrophie concentrique du VG (Vidéo). Traitement: arrêt des catécholamines, hypervolémie, vasoconstriction, béta-blocage.
- Après plastie mitrale: juger de l'utilité d'une nouvelle reconstruction; seule une IM de degré I est acceptable (Vidéo).
Vidéo: Insuffisance mitrale sévère de type restrictif due à une dilatation et à une défaillance du VG.
Vidéo: Prolapsus de la commissure antérieure sur ischémie-rupture du muscle papillaire antérieur (vue 4-cavités 0°); l'IM excentrique est sévère (IM type II).
Vidéo: insuffisance mitrale excentrique sévère sur prolapsus du feuillet postérieur; le jet d'IM est dirigé vers le septum interauriculaire.
Vidéo: Sub-obstruction dynamique de la chambre de chasse gauche par le déplacement du feuillet mitral antérieur (SAM) en mésosystole; le feuillet se coude et vient au contact du septum interventriculaire en cours de systole (vue long-axe 140°). Ce mécanisme ouvre partiellement la valve mitrale, qui fuit dans l'OG en cours de systole.
Vidéo: Vue de la valve mitrale après plastie-résection du feuillet postérieur; le feuillet antérieur est seul à assurer la fermeture, il vient en butée sous la partie postérieure de l'anneau prothétique; il n'y a pas d'IM résiduelle.
Il est essentiel d'élucider le mécanisme de l'IM pour mettre en route le traitement correct. Après des pontages aorto-coronariens, l'IM et la dysfonction ventriculaire doivent faire suspecter une ischémie aiguë, qui se traduira à l'ETO par des akinésies segmentaires et à l'ECG par des surélévations du segment ST (voir Figure 7.49).
Une dysfonction diastolique accompagne ces évènements dans la moitié des cas; elle est parfois seule présente si la fonction systolique est satisfaisante. Son incidence oscille entre 10% et 54% des cas, ce qui représente une prévalence 5-7 fois plus élevée qu’en préopératoire [37]. Elle se traduit par des pressions de remplissage augmentées par rapport à la volémie réelle et une variation respiratoire très accentuée de la pression artérielle [6]. Son intensité a une valeur pronostique pour l'évolution fonctionnelle immédiate [3]. Cette baisse de compliance est due à plusieurs phénomènes.
- Œdème myocardique (accumulation liquidienne en CEC, absence de drainage lymphatique en flux dépulsé);
- Cardioplégie, hypothermie;
- Manipulations du cœur;
- Ischémie myocardique, syndrome de reperfusion, sidération myocardique;
- Syndrome inflammatoire systémique;
- Péjoration d’une dysfonction diastolique préalable : HVG, ischémie, cardiomyopathie;
- Compression externe (péricarde, poumons, pneumothorax).
A ces phénomènes s'ajoutent les conséquences hémodynamiques accompagnant la mise en charge et la fermeture de la paroi thoracique.
- Ventilation en pression positive (la compliance pulmonaire est abaissée en fin de CEC par oedème alvéolo-capillaire);
- Variations volémiques (hémorragies, hypovolémie);
- Fermeture du péricarde et du sternum (compression externe provoquant un "effet tamponnade");
- Réchauffement (augmentation de la consommation d'O2, frissons).
Dans les corrections de valvulopathies, l'aggravation hémodynamique momentanée dépend du type de pathologie. Les lésions ayant entraîné une dilatation ventriculaire (insuffisance aortique ou mitrale) induisent des dysfonctions sévères. Après correction d'une insuffisance mitrale, le VG est dans une situation difficile à cause de l'augmentation brusque de sa postcharge due à la suppression de la "soupape de pression" que représentait l'insuffisance valvulaire; il souffre également d’une baisse de précharge (recul sur la courbe se Starling) secondaire à la disparition du retour diastolique du volume de la régurgitation. Dans le cas de sténose mitrale, le problème est lié au petit volume ventriculaire gauche, dont la distensibilité est diminuée. Par contre, la baisse immédiate de la postcharge après correction de sténose aortique assure une récupération fonctionnelle rapide, dans la mesure où l'hypertrophie ventriculaire n'a pas gêné la préservation myocardique. Le RVA pour sténose serrée et la cure de CIA sont pratiquement les seules circonstances où le VG est dans une meilleure situation immédiatement après la CEC qu’avant l’opération.
Traitement de l'insuffisance ventriculaire gauche
La thérapeutique de l'insuffisance cardiaque post-CEC porte sur plusieurs points d'impact interdépendants : adéquation de la précharge, baisse de la postcharge (systémique et pulmonaire), stimulation inotrope, régulation du rythme cardiaque, assistance circulatoire [13,22].
- Précharge: l'insuffisance diastolique courante après CEC modifie la courbe de compliance des cavités cardiaques; les pressions de remplissage (PVC, PAPO) sont plus élevées pour le même volume intracavitaire. La courbe de Starling de l'insuffisance diastolique étant très redressée, le volume systolique est très dépendant de la précharge, et la tolérance à l'hypovolémie est très faible. La courbe de l'insuffisance systolique est au contraire très aplatie, traduisant le manque d'effet d'une augmentation de précharge sur le volume systolique. De toute manière, l’augmentation de précharge est limitée par le risque de dilatation ventriculaire, situation particulièrement dangereuse parce qu'elle augmente la mVO2, menace le flux sous-endocardique et effondre le débit cardiaque (Figure 7.53).
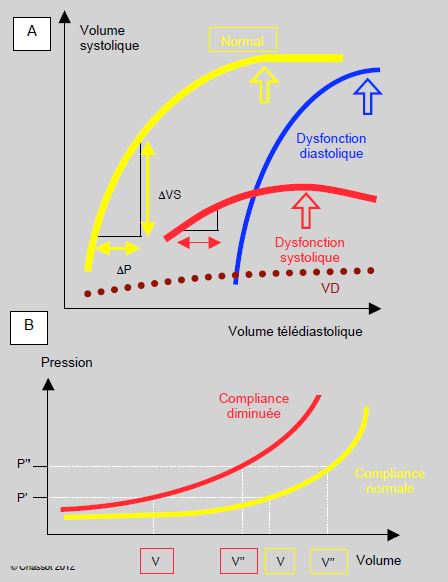
Figure 7.53 : Relations physiologiques de la précharge. A : Courbes de Frank-Starling du VG illustrant la relation entre la précharge et la performance systolique. Courbe normale (en jaune), courbe en cas de dysfonction systolique (en rouge), et en cas de dysfonction diastolique (en bleu). La courbe de Starling du VD (en pointillé) est très plate, ce qui signifie que le débit du VD normal ne dépend que très peu de la précharge. B : Courbe de compliance normale du VG (en jaune) et lors de dysfonction diastolique (en rouge). Dans ce deuxième cas, la pression P correspond à un volume ventriculaire plus petit (V’) que la norme (V); le sujet peut être hypovolémique avec une POD (PVC) ou une POG (PAPO) normale. La normovolémie d’un sujet souffrant de dysfonction diastolique (V’’ rouge) est une pression de remplissage (P’) qui correspond à une hypervolémie (V’’ jaune) chez un sujet normal.
- Postcharge basse: une vasoplégie survient dans 8-20% des cas après CEC. Les cause en sont multiples: IEC préopératoire, diabète, longue CEC, lésions d'ischémie-reperfusion, SIRS, protamine, etc; la CEC s'accompagne d'une sécrétion élevée de NO et d'une production abaissée de vasopressine [19,36]. Bien qu'elle soit bénéfique pour le VG, cette baisse de postcharge doit rester limitée car elle compromet la perfusion dans les coronaires et dans tous les organes. Traitement habituel:
- Phényléphrine (Néosynéphrine®): bolus 100 mcg; la dose maximale recommandée hors-CEC est de 1 mg; la raison en est l’absence totale d’effet inotrope béta de la substance qui ne fait qu’augmenter les RAS et la postcharge du VG, d’où le risque de défaillance gauche.
- Nor-adrénaline (Artérénol®): perfusion 0.02-0.5 mcg/kg/min; la stimulation des récepteurs β myocardiques (inotropes positifs) et le faible effet β1 assurent un appoint inotrope qui aident le VG lorsque sa postcharge augmente.
- Vasopressine (Pitressin®): en cas de choc distributif réfractaire (PAM < 55 mmHg, RAS < 600 dynes•s•cm-5), la vasopressine (1-4 U/h) améliore la situation [20]. A ces doses, la vasopressine provoque moins de vasoconstriction coronarienne, rénale et splanchnique que la noradrénaline pour le même résultat sur la pression systémique; elle n’augmente pas la RAP [30]. D’autre part, elle conserve ses propriétés vasoconstrictrices malgré l’hypoxie et l’acidose [31].
- Bleu de méthylène (1-2 mg/kg iv en 20 minutes): il peut rétablir le tonus vasculaire en moins de 2 heures dans les situations où les autres vasopresseurs sont restés inefficaces [18,26], mais il présente des risques à doses élevées (> 7 mg/kg (hémolyse, méthémoglobinémie, hypertension pulmonaire, neurotoxicité, vascoconstriction coronarienne et rénale) [44]. Son bénéfice est maximal s'il est administré tôt dans le déclenchement de l'hypotension [26]. La peau, les conjonctives et les urines apparaissent bleutées; la pulsoxymétrie n'est plus fiable et donne des valeurs de SaO2 plus basses que la réalité.
- Postcharge élevée: le risque est une dilatation du VG, un disruption des sutures aortiques et une augmentation des pertes sanguines. Le VG dysfonctionnel est particulièrement sensible à une augmentation d'impédance. Les vasodilatateurs utilisés en première ligne sont à prédominance artériolaire [21].
- Approfondissement de l'anesthésie (isoflurane 2-4%, propofol) et de l'analgésie.
- Phentolamine en bolus (Régitine® 1-2 mg iv).
- Nicardipine (Loxen®, Cardene® 0.5 mg/min iv).
- Clévidipine (Cleviprex 1-2 mg/h, à doubler ttes les 3-5 minutes jusqu’à l’effet désiré; dose max 32 mg/h).
- Nitroprussiate en perfusion (Nipruss® 0.1-5 mcg/kg/min).
- Nitroglycérine (bolus 50-100 mcg, perf 0.5-5.0 mcg/kg/min) si l'hypertension est associée à une élévation de précharge ou à une HTAP.
- Un inodilatateur comme un inhibiteur de la phosphodiestérase-3 (milrinone) ou le levosimandan est indiqué lorsque l'HTA est associée à une dilatation ventriculaire.
- Contrôle du rythme : Les arythmies doivent être traitées électriquement le plus rapidemnent possible. Le rythme idéal en sortant de CEC est un entraînement sinusal de 75-80 batt/minute.
- En cas de dissociation AV: pace-maker bicaméral, isoprénaline (bolus de 10 mcg). La synchronisation de la contraction auriculaire est d'autant plus importante qu'il existe des altérations de la compliance ventriculaire.
- FA ou tachyarythmie sus-jonctionnelle: cardioversion peropératoire (2-10 J par palettes internes); la cardioversion mérite d'être tentée, y compris chez un patient en FA chronique, car le rythme sinusal, même temporaire, améliore l'hémodynamique pendant les heures où elle est la plus compromise. La substance de première intention est l'amiodarone (Cordarone®), en perfusion de 10-15 mg/kg/24h; on débute par 150 mg/20 minutes iv, à répéter selon besoin. L'esmolol (Brevibloc®) est le seul β-bloqueur envisageable en postopératoire à cause de la briéveté de sa demi-vie (9 minutes); il faut néanmoins l'utiliser avec précaution, et seulement lorsque la tachycardie est excessive ou dangereuse en présence d'une fonction ventriculaire normale.
- Torsade de pointe, TV, spasme coronarien: défibrillation interne (5-50 J) ou externe (100-360 J), xylocaïne (1 mg/kg), magnésium (charge: 1-2 gm iv).
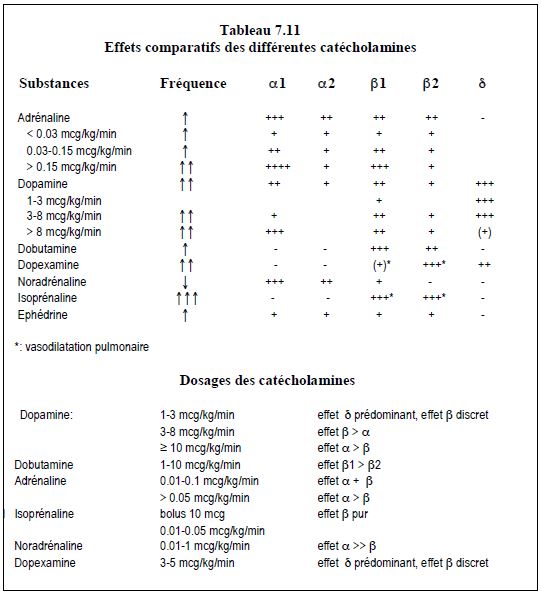
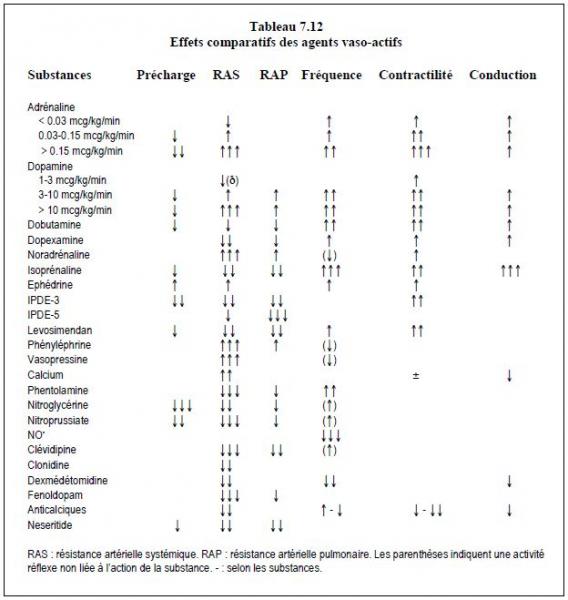
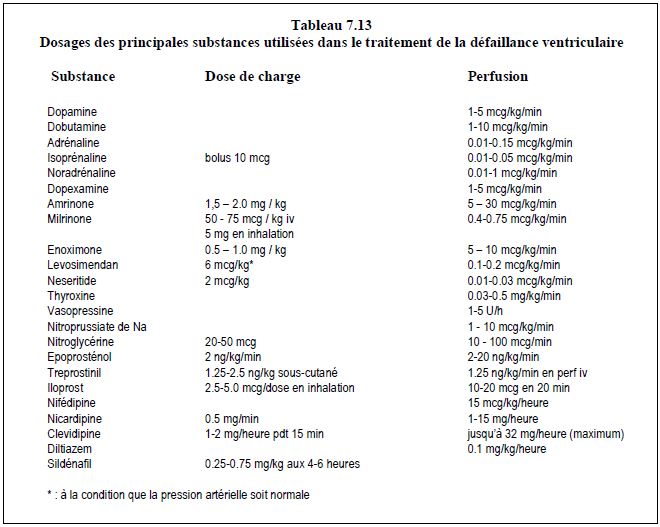
- Stimulation inotrope : si l'index cardiaque est inférieur à 2.2 l/min/m2 et la PAPO supérieure à 18 mm Hg, ou la fraction d'éjection inférieure à 0.5, il est nécessaire d'assurer un support inotrope. Le choix des agents cardiostimulateurs est décrit ci-dessous ainsi que dans les Tableaux 7.11, 7.12 et 7.13.
En salle d'opération, il est facile de compléter les traitements médicamenteux par un système d'assistance ventriculaire dont le but est de maintenir la circulation en déchargeant le ou les ventricules pour leur offrir une possibilité de récupération (voir Chapitre 12 Assistance ventriculaire).
- Contrepulsion intra-aortique (CPIA) : elle diminue la postcharge du VG et augmente la pression diastolique, donc la perfusion coronarienne. C’est la technique de premier choix pour soutenir un VG défaillant par dilatation (présence d'une IM degré > II/IV) ou par ischémie, mais elle ne fonctionne correctement que si le rythme est régulier et inférieur à 120 batt/min, et que si les résistances systémiques sont maintenues. Elle est contre-indiquée en cas d'insuffisance aortique, de dissection, ou d'athéromatose grave de l'aorte thoracique descendante.
- ECMO (Extra-Corporeal Membrane Oxygenation): une pompe centrifuge couplée à un oxygénateur et branchée sur les vaisseaux fémoraux assure une assistance à la fonction ventriculaire et aux échanges gazeux ; elle est indiquée pour 3-5 jours en cas de défaillance cardio-respiratoire.
- Assistance ventriculaire externe par un système à court terme, comme par exemple l'Abiomed BVS 5000i™ (flux pulsatile), l’Impella™ (flux continu) ou le TandemHeart™ (flux continu) ; les deux derniers sont introduits par voie percutanée sous repérage fluroscopique et/ou échocardiographique (voir Assistance extracorporelle).
- Quel qu’en soit le type, une assistance ventriculaire n’est pas un substitut aux agents inotropes ni au maintien de la précharge. En effet, la défaillance droite est fréquente en cas d’assistance gauche isolée, d’où la nécessité de NO, milrinone, adrénaline, levosimendan; d’autre part, le VD fournit la précharge du système d’assistance, dont le fonctionnement dépent directement du remplissage ventriculaire [22].
Stimulation inotrope
L’insuffisance ventriculaire chronique et le stress prolongé (longue CEC, instabilité hémodynamique continue en soins intensifs) conduisent à un remaniement des récepteurs myocardiques : baisse des récepteurs β1, augmentation des récepteurs β2 et α1 (inotropes positifs) [11,35]. Ces données ont des impacts majeurs sur la thérapeutique catécholaminergique.
- La réponse aux amines β1 est diminuée; la dopamine et la dobutamine atteignent rapidement leur plafond d’activité. L'adrénaline, qui stimule les récepteurs β1, β2 et α1, est la seule catécholamine efficace pour le traitement de la décompensation aiguë d'une insuffisance cardiaque chronique ou dans les situations critiques après CEC. La noradrénaline (effet α1 majeur et β1 secondaire) a davantage d’effet inotrope positif que sur un coeur normal à cause de l’excès de récepteurs α1.
- La déplétion chronique en nor-adrénaline du myocarde diminue l'efficacité des amines indirectes telles la dopamine ou l'éphédrine.
- Les inhibiteurs des phosphodiestérases-3 (amrinone, milrinone) sont efficaces lors d’insuffisance ventriculaire ou de β-blocage parce qu'ils agissent par une voie indépendante des récepteurs β ; il en est de même de la noradrénaline.
- La combinaison adrénaline + milrinone est le stimulant inotrope le plus efficace sur le ventricule défaillant, qu’il soit gauche ou droit.
- Le choix de l'agent inotrope a peu d'impact sur la morbi-mortalité à 30 jours, sauf pour le levosimendan dans certaines situations spécifiques [2,27].
Indépendamment de leur dosage, l'efficacité des catécholamines dépend donc de plusieurs éléments.
- La densité et la sensibilité des récepteurs membranaires;
- La répartition des types de récepteurs;
- L’activité de recapture synaptique;
- La disponibilité du Ca2+ sarcoplasmique;
- L'équilibre acido-basique (l’acidose inhibe leur action);
- La concentration locale de la substance, variable selon l’hémodynamique et le site d’administration (voie périphérique versus voie centrale);
- La durée de l’insuffisance cardiaque ou du choc cardiogène.
Les agents inotropes sont très largement utilisés, souvent de manière routinière et "prophylactique". En réalité, ils ne sont indiqués qu'en fonction des probabilités de dysfonction en sortant de CEC. Cette probabilité varie entre 35% (CEC < 60 minutes, FE > 0.65) et 100% (CEC > 150 minutes, FE < 0.35). Si, après la mise en charge, l'index cardiaque est inférieur à 2.5 l/min/m2 et la PAPO supérieure à 18 mm Hg, ou la fraction d'éjection inférieure à 0.5, il est nécessaire d'assurer un support inotrope.
Catécholamines
Les catécholamines ne sont pas toutes équivalentes, car elles présentent des différences dans la sélectivité de leurs actions au niveau des récepteurs (Tableaux 7.8, 7.11 et 7.12).
- Dopamine: agent idéal pour les sorties de pompe simples à cause de l'effet β1, du léger effet α (maintien des RAS) et de l'effet δ (augmentation du flux splanchnique et rénal) si le dosage reste < 5 mcg/kg/min. Au-delà de 5 mcg/kg/min, la vasoconstriction α augmente davantage que l'effet β et la dopamine devient essentiellement un vasopresseur. Cette variabilité la rend impropre à la gestion des défaillances ventriculaires sévères. La dopamine est bon marché, mais relativement tachycardisante aux faibles dosages.
- Dobutamine: stimulant exclusivement β, elle tend à baisser les RAS; les effets ne se modifient pas avec le dosage, mais obligent en général à adjoindre une perfusion de nor-adrénaline au-delà de 5 mcg/kg/min. La dobutamine est plus onéreuse mais moins tachycardisante que la dopamine.
- Adrénaline: effet équilibré α et β, très bon marché; au-delà de 0.5 mcg/kg/min, l’effet α domine sur l’effet β; elle induit une hyperglycémie et une acidose.
- Nor-adrénaline: effet essentiellement α vasoconstricteur artériolaire systémique; peu d'effet vasoconstricteur pulmonaire car les récepteurs α sont rares dans le lit pulmonaire. La noradrénaline présente un effet inotrope positif en cas d'insuffisance ventriculaire chronique à cause de la prépondérance de récepteurs α dans le myocarde dysfonctionnel.
- Isoprénaline: le plus puissant stimulant β1 et β2; tachycardisant et vasodilatateur artériel, l'isoprénaline est indiquée essentiellement dans les blocs AV et les bronchospasmes.
Les substances qui ont plusieurs actions, comme la dopamine, ne permettent pas de différencier les effets entre eux, surtout lorsque leur proportion varie selon le dosage. Les catécholamines à effet "pur" (dobutamine, noradrénaline) sont plus aisées à ajuster en fonction du paramètre hémodynamique sur lequel on veut agir. L'effet β2 (dobutamine, adrénaline) est responsable d'une vasodilatation, d’une hyperglycémie et d'une acidose métabolique. Quelle que soit la substance utilisée, l'augmentation de la contractilité se solde toujours par une augmentation de la mVO2. Seules les techniques d'assistance ventriculaire augmentent le débit sans élever le travail cardiaque.
Autres substances
Un inhibiteur des phosphodiestérases-3 (IPDE-3), qui catabolisent l’AMPc, augmente le taux cytoplasmique de cette dernière, donc conduit à une stimulation inotrope par augmentation de la [Ca2+]i systolique. Cette voie ne passe pas par les récepteurs β. Les IPDE sont des inodilatateurs : ils présentent un effet inotrope positif, et un effet vasodilatateur sur les vaisseaux de résistance (artères systémiques et pulmonaires) et de capacitance (grandes veines centrales). Ils ne provoquent pas de tachycardie (absence d’effet chronotrope). Les indications essentielles sont [17].
- La dysfonction gauche sévère avec dilatation ventriculaire pouvant profiter d’une baisse de postcharge ;
- L’insuffisance ventriculaire droite avec hypertension pulmonaire ;
- Les coeurs sévèrement déplétés en récepteurs β tels les insuffisances ventriculaires de longue durée, les greffons cardiaques, et les cas après une CEC prolongée ;
- Les patients β-bloqués.
La milrinone (Corotrop®) s'administre en perfusion (0.4-0.75 mcg/kg/min) précédée d'une dose de charge (50 mcg/kg). Cette dernière provoque une hypotension significative; une manière de procéder est d'injecter la dose de charge dans la CEC en cours de réchauffement, car l'hypotension est facile à maîtriser à ce moment. La combinaison adrénaline + milrinone est particulièrement efficace en cas d'insuffisance ventriculaire chronique, réfractaire ou accompagnée d'HTAP.
Le levosimendan (Simdax®) possède une activité inotrope anti-phosphodiestérase et une action de sensibilisation de la troponine C au calcium; c'est un vasodilatateur artériel parce qu’il ouvre les canaux KATP des cellules musculaires lisses des artérioles. Le levosimendan n’entraîne pas de tachycardie ni d’augmentation de la mVO2 [29]. Indications cliniques [40]:
- Insuffisance du VG avec RAS et/ou RAP élevées;
- Insuffisance droite avec HTAP;
- Revascularisation coronarienne avec défaillance ventriculaire réfractaire;
- Bas débit cardiaque chez les patients β-bloqués ou déplétés en récepteurs β;
- Probable inefficacité des autres agents inotropes.
Il s’administre en perfusion sur une seule période de 24 heures (0.1-0.2 mcg/kg/min), après une dose de charge de 12-24 mcg/kg; le traitement pour un adulte nécessite environ 12 mg (coût : environ 700 €). Comme son effet s'installe lentement, il est préférable de débuter la perfusion à l'induction [40]. Le lévosimendan est le seul agent inotrope qui diminue la mortalité (baisse de 20-30%) [32,33].
La thyroxine (T3) (tri-iodo-thyronine) améliore la performance ventriculaire par stimulation de l’adénylyl-cyclase (augmentation de l’AMPc) et par des voies différentes de l’AMPc ; elle est utile chez les malades dont le système neuro-humoral est épuisé, comme les malades de soins intensifs, les donneurs d'organe ou après les longues CEC [28]. Son action est contre-carrée par les anti-calciques. Les doses sont de 0.03-0.5 mcg/kg/min, ou de 0.0275 mcg/kg en 4 doses. Sa substitution donne des résultats contradictoires allant de l'amélioration du DC à l'absence d'effet [7].
La solution Glucose-Insuline-Potassium (GIK) semble profitable essentiellement aux patients ischémiques avec dysfonction ventriculaire sévère et diminution de récepteurs β myocardiques [41]. Elle pourrait diminuer la souffrance myocardique (baisse des CK-MB et des troponines postopératoires), mais ne semble pas avoir d’impact sur le devenir clinique [38]. Néanmoins, une étude récente démontre qu'une solution de 20 UI insuline + 10 mmol K+ dans 50 mL glucose 40% perfusée entre l'induction et la CEC améliore la protection myocardique; la fonction biventriculaire en sortant de pompe est supérieure à celle du placebo, le taux de troponine est plus bas, et le taux de complications cardiorespiratoires est plus faible (RR 0.6) [9]. Le régime peropératoire conseillé est : insuline 2-4 U/h, K+ 10-20 mmol/h, glucose 20% 10-15 g/h (50-75 ml/h). Le but est de maintenir une glycémie peropératoire de 6-8 mmole/L.
Le calcium (dose: 2-4 mg/kg) élève la concentration de Ca2+ extracellulaire et antagonise les effets de l'hyperkaliémie intra-myocardique après cardioplégie, mais n'améliore la fonction cardiaque que chez les patients hypocalcémiques (transfusion rapide de sang citraté) ou sous anticalciques. Il présente un antagonisme avec les stimulants béta et un synergisme avec les stimulants α (augmentation de la pression, mais pas d'effet inotrope). Une hypercalcémie aiguë lors de la revascularisation peut provoquer une surcharge intracellulaire aggravant les lésions ischémiques et la dysfonction diastolique, rigidifiant le myocarde (stone heart), et induisant une vasoconstriction des greffons artériels [42]. En cas de normocalcémie, les risques sont supérieurs aux bénéfices escomptés: bradycardie sinusale, ralentissement de la conduction AV, antagonisme avec les stimulants de l’AMPc (β-agonistes), spasme artériel, augmentation de la toxicité de la digitale, lésions cellulaires pancréatiques [23]. En sortant de CEC, la seule indication formelle au calcium est le renversement d’une hyperkaliémie résiduelle [23].
La conjonction d'une hypovolémie et d'une perfusion de catécholamines à effet β lors d'hypertorphie ventriculaire gauche concentrique peut induire un "effet CMO": comme dans la cardiomyopathie obstructive, la constriction de la chambre de chasse en systole et le basculement du feuillet mitral antérieur dans la CCVG (SAM: systolic anterior motion) créent un obstacle à l'éjection. Cette obstruction sous-aortique dynamique est fréquente après remplacement de la valve aortique pour sténose ou après plastie mitrale. Le diagnostic se pose à l'échocardiographie (Vidéo). Plus on augmente les amines, plus la situation de bas débit empire ! La seule thérapeutique est une baisse des amines β, une augmentation des RAS (amines α), un remplissage volumique et éventuellement un β-blocage [24].
Thérapeutique de l'insuffisance ventriculaire droite
L’insuffisance droite est secondaire à une affection propre du VD (infarctus, cardiomyopathie), à un défaut de cardioprotection en CEC ou à une augmentation de sa postcharge, ce qui est le plus fréquent. Cette hypertension pulmonaire a de nombreuses causes après une CEC.
- Péjoration d’une HTAP préexistante;
- Stase sur une dysfonction du VG, une valvulopathie mitrale résiduelle ou une inadéquation de la prothèse mitrale;
- Hypoventilation, hypoxie, hypercapnie, acidose respiratoire, atélectasies;
- Syndrome inflammatoire pulmonaire;
- Administration de protamine;
- IPPV et PEEP excessives;
- Compression mécanique des vaisseaux pulmonaires (tamponnade, pneumothorax, écarteur);
- Embolie pulmonaire.
Le traitement de l'insuffisance ventriculaire droite comprend plusieurs points (Tableau 7.14) [8,15].

- Optimisation de la précharge: le VD dysfonctionnel peut nécessiter une PVC jusqu’à 10-12 mmHg pour assurer son débit systolique. En revanche, si la défaillance a déjà entraîné une dilatation ventriculaire et une stase en amont, il faut au contraire diminuer la précharge : dérivés nitrés, diurétiques, position de contre-Trendelenburg.
- Baisse de la postcharge: comme le VD est très sensible à la postcharge, la diminution de l'impédance augmente efficacement le volume éjecté; on utilise à cet effet les substances qui présentent un effet vasodilatateur pulmonaire majeur. Les agents vasodilatateurs inhalés (NO, prostacycline, milrinone, nitroglycérine), l’hyperoxie (FiO2 0.8-1.0), l’hyperventilation normobarique et la correction de l’acidose ont l’avantage de n’avoir aucun effet systémique, alors que les hypotenseurs administrés par voie générale abaissent également la pression artérielle, ce qui accentue la dyskinésie septale et diminue la pression de perfusion coronarienne droite. Les vasodilatateurs sont plus efficaces en aérosols qu'en perfusion pour diminuer les RVP et améliorer la fonction du VD [10]. D’autre part, les substances inhalées sont distribuées préférentiellement aux zones bien ventilées, alors que les vasodilatateurs systémiques inhibent la vasoconstriction pulmonaire hypoxique et entraînent une hypoxémie. Les vasodilatateurs pulmonaires (NO, prostacyclines, IPDE-5) sont potentiellement dangereux dans les hypertensions pulmonaires liées à une stase gauche (défaillance du VG, maladie mitrale), car ils augmentent le flux et la congestion en amont de l’OG; le risque est un OAP. La baisse de la PAP n’est pas obligatoirement un succès thérapeutique, car elle peut être due à une perte fonctionnelle du VD (Traitement de l'hypertension pulmonaire: Tableau 7.15).
- Stimulation de la contractilité: amines sympathicomimétiques (dobutamine, adrénaline, isoprénaline), inhibiteurs de la phosphodiestérase-3 (amrinone, milrinone), sensibilisateur calcique (levosimandan). La dopamine et la digitale sont contre-indiquées parce qu’elles augmentent les RAP.
- Maintien du gradient de pression entre les deux ventricules (rapport PAM/PAPm ≥ 4.0) et de la géométrie du VD pour éviter le basculement septal vers la gauche et épauler la contraction du VD par celle du VG. Une dyskinésie septale entraîne la perte de 30-40% de l’efficacité éjectionnelle droite. Si le VD devient globulaire par un bombement vers la gauche, les myofibrilles longitudinaux, qui sont le moteur principal de l’éjection droite, perdent leur alignement normal et leur contraction devient moins efficace. L’augmentation de la postcharge gauche (vasoconstricteur systémique) tend à gonfler le VG et à rétablir la position normale du septum interventriculaire (arrondi vers la droite); de ce fait, l’assistance éjectionnelle au VD par le VG est rétablie (Vidéos et Figure 7.54).
Vidéo: dyskinésie septale en cas de surcharge de pression droite. La durée d’éjection du VD étant allongée à cause de la hausse de postcharge, la systole droite se prolonge pendant le début de la relaxation du VG et fait basculer le septum interventriculaire dans le VG en protodiastole; en protosystole, le septum est rectiligne.
Vidéo: vue court-axe d'une hypertrophie dilatative massive du VD avec basculement complet du septum dans le VG qui est devenu minuscule. Le VD ressemble à un "O" et le VG à une demi-lune, ce qui est l'inverse de la situation normale.
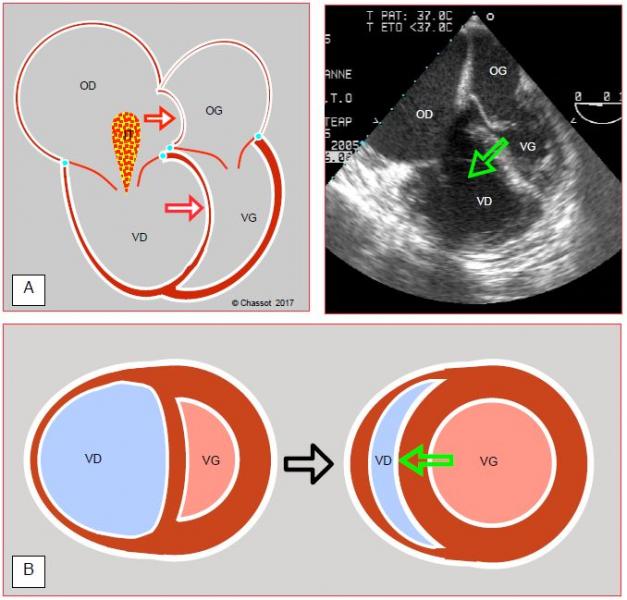
Figure 7.54: Défaillance ventriculaire droite. A: Le septum interventriculaire bombe dans le VG et en réduit considérablement le volume diastolique, comme en témoigne ici le rétrécissement de sa surface en diastole (la valve mitrale est ouverte). C’est l’effet Bernheim. Le septum interauriculaire bombe dans l’OG à cause de la surpression dans l’OD. IT : insuffisance tricuspidienne. A droite, vue échocardiographique transoesophagienne 4-cavités (HTAP chronique sur embolies pulmonaires). Le but du traitement vasoconstricteur systémique est d'augmenter la pression et le volume du VG pour que le septum reprenne sa place (flèche verte) et contribue à l'éjection du VD comme il le fait normalement. B: Vue court-axe de l'ensemble VD-VG; en insuffisance droite, le septum est repoussé dans le VG par la dilatation du VD. L'augmentation de postcharge du VG élève sa pression intraventriculaire et replace le septum dans sa position physiologique (flèche verte).
- Maintien de la perfusion coronaire droite: une perfusion de nor-adrénaline et/ou de vasopressine est indiquée afin de maintenir un gradient suffisant entre la pression aortique et la pression systolique du VD; la faible population de récepteurs α pulmonaires et l’absence de récepteurs à la vasopressine dans les poumons en l'absence d'HTAP chronique font que la pression systémique s’élève mais non la pression pulmonaire.
- Assistance ventriculaire externe par un ventricule artificiel ou par une contrepulsion intra-pulmonaire; la contre-pulsion intra-aortique peut être utile pour maintenir la pression de perfusion coronarienne.
- Non fermeture du péricarde et du sternum, ou réouverture en postopératoire. Lorsque la Ptd du VD est ≥ 15 mmHg, la paroi ventriculaire est en butée contre le péricarde; l’ouverture de celui-ci augmente la compliance du VD et relâche la compression opérée sur le VG par le bascule du septum interventriculaire. Cette technique permet de tolérer la dilatation due à la dysfonction droite sans augmentation de pression.
Le marqueur de l’efficacité du traitement n’est pas une baisse de la PAP, mais une baisse de la PVC et une augmentation du volume systolique (cathéter de Swan-Ganz).
Impact des agents inotropes sur la mortalité
Malgré leur bénéfice manifeste à court terme, l'utilisation routinière des agents inotropes tend à augmenter la mortalité ainsi que le risque d’infarctus (HR 2.1), d’ictus (HR 2.4), d’arythmie (HR 3.1) et d’insuffisance rénale (OR 7.9) [27]. Après revascularisation coronarienne, les catécholamines tendent à aggraver les lésions d’ischémie-reperfusion par surcharge de Ca2+ cytoplasmique et par augmentation de la mVO2. Toutefois, dans la situation particulière de la chirurgie cardiaque, les inotropes tendent à améliorer la survie (RR 0.73) si leur utilization est réduite au minimum de temps et de dosage nécessaire à maintenir momentanément le débit cardiaque en sortant de pompe [2]. Le levosimendan est le seul agent inotrope qui soit associé à une diminution de la mortalité à long terme (OR 0.35-0.82) en cardiologie, en soins intensifs ou en chirurgie cardiaque [2,16,32].
Magnésium
Le Mg2+ est le deuxième ion intracellulaire le plus abondant. Malheureusement, les taux sériques reflètent mal la magnésémie totale, puisque seul 1% du Mg total est sous forme ionisée dans le sérum. Le Mg2+ est nécessaire au fonctionnement de plusieurs ATPases; il participe au maintien du taux de K+ et de Ca2+ intracellulaires. L'hypomagnésémie est très courante chez les insuffisants cardiaques, chez les diabétiques, chez les malades recevant des diurétiques ou de la digitale, et à la fin de la CEC [1]. Du point de vue thérapeutique, le magnésium agit comme un bloqueur calcique: il diminue l'excès de Ca2+ sarcoplasmique et de radicaux libres lié à l'ischémie; il diminue l'incidence des arythmies ventriculaires et provoque une vasodilatation artérielle systémique et pulmonaire. Administré avant ou immédiatement au moment de la reperfusion après une période d'ischémie, il a tendance à diminuer la taille de l'infarctus, améliorer la fonction systolique, et diminuer la mortalité des patients dont la fonction gauche est conservée [45]. L'effet est perdu si l'administration a lieu ultérieurement [5].
Les effets secondaires, peu fréquents aux doses habituelles, sont une sédation, une paralysie musculaire, une baisse des résistances artérielles et une inhibition de la fonction plaquettaire [12]. Eliminé par les reins, le magnésium présente ces effets surtout chez les insuffisants rénaux. Un synergisme avec les dérivés nitrés et les inhibiteurs de l'enzyme de conversion peut conduire à des hypotensions sévères [14]. Vu son inocuité et son coût très faible, le magnésium (MgSO4 ou MgCl2, 2-4 gm iv chez l'adulte) est indiqué sans restriction en cas de troubles du rythme ventriculaire ou lors de défibrillations répétées; il peut être bénéfique en cas de vasoconstriction artérielle et en cours d'ischémie. L'administration de routine est coutumière avant et/ou après CEC.
| Dysfonction ventriculaire post-CEC |
|
Une intervention cardiaque en CEC porte transitoirement atteinte à la fonction ventriculaire. La fonction systolique et la fonction diastolique baissent progressivement pour atteindre leur nadir vers 5-6 heures après la CEC; la récupération prend 8 à 24 heures. Cette dysfonction est d’autant plus sévère que l’atteinte ventriculaire était préexistante et que l’opération était longue et complexe.
Thérapeutique de l’insuffisance gauche par ordre croissant d’importance:
- Optimalisation de la précharge, de la postcharge, de la fréquence et du rythme
- Dopamine jusqu’à 5 μg/kg/’
- Dobutamine (5-20 μg/kg/’) + noradrénaline (0.05 – 0.5 μg/kg/’)
- Adrénaline (0.01-0.3 μg/kg/’) + milrinone (0.5 μg/kg/’)
- CPIA
- Levosimendan (0.1-0.2 μg/kg/min pendant 24 heures)
- ECMO, assistance ventriculaire
Thérapeutique de l’insuffisance droite:
- Optimalisation de la précharge du VD
- Dobutamine (5-20 μg/kg/’)
- Milrinone (0.5 μg/kg/’) + adrénaline (0.01-0.3 μg/kg/’)
- Vasodilatateur pulmonaire : NO, iloprost (inhalation), nitroglycérine (0.1-5.0 μg/kg/’),
milrinone (aérosol 6 mg/h)
- Maintien de l'interaction ventriculaire et de la perfusion coronarienne : noradrénaline (0.05 – 0.5 μg/kg/’), CPIA
- Levosimendan (0.1-0.2 g/kg/min)
- Non-fermeture du péricarde et du sternum
- Assistance ventriculaire
|
© CHASSOT PG, GRONCHI F, Avril 2008, dernière mise à jour, Décembre 2019
Références
- AGLIO LS, STANFORD GG, MADDI R, et al. Hypomagnesemia is common following cardiac surgery. J Cardiothorac Vasc Anesth 1991; 5:201-8
- BELLETTI A, CASTRO ML, SILVETTI S, et al. The effect of inotropes and vasopressors on mortality: a meta-analysis of randomized clinical trrials. Brit J Anaesth 2015; 115:656-75
- BERNARD F, DENAULT A, BABIN D, et al. Diastolic dysfunction is predictive of difficult weaning from cardiopulmonary bypass. Anesth Analg 2001; 92:291-8
- BOOTSMA IT, DE LANGE F, KOOPMANS M, et al. Right ventricular function after cardiac surgery is a strong independent predictor for long-term mortality. J Cardiothorac Vasc Anesth 2017; 31:1656-62
- BOYD WC, THOMAS SJ. Pro: Magnesium should be administered to all coronary artery bypass graft surgery patients undergoing cardiopulmonary bypass. J Cardiothorac vasc Anesth 2000; 14:339-43
- BRUTSAERT DL, SYS SU, GILLEBERT TC. Diastolic dysfunction in post-cardiac surgical management. J Cardiothor Vasc Anesth 1993; 7(suppl 1):18-20
- CHOI YS, SHIM JK, SONG JW, et al. Efficacy of perioperative oral triiodothyronine therapy to prevent postoperative low triiodothyroninestate following valvular heart surgery. J Cardiothorac Vasc Anesth 2013; 27:1218-23
- DENAULT A, HADDAD F, JACOBSOHN E, et al. Perioperative right ventricular dysfunction. Curr Opin Anaesthesiol 2013; 26:71-81
- ELLENBERGER C, SOLOGASHVILI T, KREIENBÜHL L, et al. Myocardial protection by glucose-insulin-potassium in moderate- to high-risk patients undergoing elective on-pump cardiac surgery: a randomized controlled trial. Anesth Analg 2018; 126:133-41
- ELMI-SARABI M, DESCHAMPS A, DELISLE S, et al. Aerosolized vasodilators for the treatment of pulmonary hypertension in cardiax surgical patients: a systematic review and meta-analysis. Anesth Analg 2017; 125:393-402
- GERHARDT MA, BOOTH JV, CHESNUT LC, et al. Acute myocardial beta-adrenergic receptor dysfunction after cardiopulmonary bypass in patients with cardiac valve disease. Circulation 1998; 98:II275-II281
- GRIES A, BODE C, GROSS S, et al. The effect of intravenously administered magnesium on platelet function in patients after cardiac surgery. Anesth Analg 1999; 88:1213-9
- GRIFFIN MG, HINES RL. Management of perioperative ventricular dysfunction. J Cardiothorac Vasc Anesth 2001; 15:90-106
- GRIGORE AM, MATHEW JP. Con: Magnesium should not be administered to all coronary artery bypass graft surgery patients undergoing cardiopulmonary bypass. J Cardiothorac Vasc Anesth 2000; 14:344-46
- HARJOLA VP, MEBAZAA A, CELUTKIENE J, BETTEX D, et al. Contemporary management of acute right ventricular failure: a statement from the Heart Failure Association and the working group on pulmonary circulation and right ventricular function of the European Society of Cardiology. Eur J Heart Fail 2016; 18:226-41
- HARRISON RW, HASSELBLAD V, MEHTA RH, et al. Effect of levosimendan on survival and adverse events after cardiac surgery: a meta-analysis. J Cardiothorac Vasc Anesth 2013; 27:1224-32
- KIKURA M, SATO S. The efficacy of preemptive milrinone or amrinone therapy in patients undergoing coronary artery bypass grafting. Anesth Analg 2002; 94:22-30
- LAVIGNE D, Vasopressin and methylene blue: alternate therapies in vasodilatory shock. Semin Cardiothorac Vasc Anesth 2010; 14:186-9
- LEVIN MA, LIN HM, CASTILLO JG, et al. Early on-cardiopulmonary bypass hypotension and other factors associated with vasoplegic syndrome. Circulation 2009; 120:1664-71
- LICKER M, SCHWEIZER A. Vasopressin and postcardiopulmonary bypass refractory hypotension. Anesth Analg 1999; 88:695
- LIU H, FOX CJ, ZHANG S, KAYE AD. Cardiovascular pharmacology: an update. Anesthesiology Clin 2010; 28:723-38
- LOMBARD FW, GRICHNIK KP. Update on management strategies for separation from cardiopulmonary bypass. Curr Opin Anaesthesiol 2011; 24:49-57
- LOMIVOROTOV VV, LEONOVA EA; BELLETTI A, et al. Calcium administration during weaning from cardiopulmonary bypass: a narrative literature review. J Cardiothorac Vasc Anesth 2020; 34:235-44
- LOULMET DF, YAFFEE DW, URSOMANNO PA, et al. Systolic anterior motion of the mitral valve: a 30-year perspective. J Thorac Cardiovasc Surg 2012; 143:52-7
- MASLOW AD, REGAN MM, PANZICA P, et al. Precardiopulmonary bypass right ventricular function is associated with poor outcome after coronary artery bypass grafting in patients with severe left ventricular systolic dysfunction. Anesth Analg 2002; 95:1507-18
- McCARTNEY SL, DUCE L, GHADIMI K. Intraoperative vasoplegia: methylene blue to the rescue ! Curr Opin Anesthesiol 2018; 31:43-9
- NIELSEN DV, HANSEN KM, JOHNSEN SP, et al. Health outcomes with and without use of inotropic therapy in cardiac surgery. Anesthesiology 2014; 120:1098-108
- NOVITZKY D, FONTANET H, SNYDER M, et al. Impact of tri-iodo-thyronine on the survival of high-risk patients undergoing heart surgery. Cardiology 1996; 87:509-15
- PAGEL PS. Levosimendan in cardiac surgery: A unique drug for the treatment of perioperative left ventricular dysfunction or just another inodilator searching for a clinical application ? Anesth Analg 2007; 104:759-61
- PAPDOPOULOS G, SINTOU E, SIMINELAKIS S, et al. Perioperative infusion of low-dose of vasopressin for prevention and management of vasodilatory vasoplegic syndrome in patients undergoing coronary artery bypass grafting – a double-blind randomized study. J Cardiothorac Surg 2010; 5:17
- PATEL BM, CHITTOK DR, RUSSEL JA, WALLEY KR. Beneficial effects of short-term vasopressin infusion during severe septic shock. Anesthesiology 2002; 96:576-82
- PISANO A, MONTI G, LANDONI G. Levosimendan: new indications and evidence for reduction in perioperative mortality ? Curr Opin Anaesthesiol 2016; 29:454-61
- POLLESELLO P, PARISSIS J, KIVIKKO M, et al. Levosimendan meta-analyses: is there a pattern in the effect on mortality ? Int J Cardiol 2016; 209: 77-83
- ROYSTER RL. Myocrdial Dysfunction following Cardiopulmonary Bypass: Recovery patterns, predictors of initropic needs, theoretical concepts of inotropic administration. J Cardiothor Vasc Anesth 1993; 7 (Suppl 2): 19-25
- SCHWINN DA, LEONE BJ, SPAHN DR, et al. Desensitiation of myocardial b-adrenergic receptors during cardiopulmonary bypass. Circulation 1991; 84:2559-67
- SHAEFI S, MITTEL A, KLICK J, et al. Vasoplegia after cardiovascular procedures – Pathophysiology and targeted therapy. J Cardiothorac Vasc Anesth 2018; 32:1013-22
- SHI Y, DENAULT AY, COUTURE P, et al. Biventricular filling patterns after coronary artery bypass graft surgery. J Thorac Cardiovasc Surg 2006; 131:1080-6
- SHIM JK, YANG SY, YOO YC, et al. Myocardial protection by glucose-insulin-potassium in acute coronary syndrome patients undergoing urgent multivessel off-pump coronary artery bypass surgery. Br J Anaesth 2013; 110:47-53
- SMILEY RM, VUILLEMOZ Y. Cardiac surgery causes desensitization of the b-adrenergic system of immune lymphocytes. Anesth Analg 1992; 74:212-8
- TOLLER W, HERINGLAKE M, GUARRACINO F, et al. Preoperative and perioperative use of levosimendan in cardiac surgery: European expert opinion. Int J Cardiol 2015; 184:323-36
- VAN WEZEL HB, DEJONG SWM. Clinical use of glucose-insulin-potassium in cardiac surgery and acute myocardial infarction: an overview. Semin Cardiothorac Vasc Anesth 2003; 7:77-83
- VITEZ TS. Pro: Calcium salts are contraindicated in the weaning of patients from cardiopulmonary bypass J Cardiothor Vasc Anesth 1988; 2:567-70
- VROOM MB. Epidemiology and pharmacotherapy of acute heart failure. Semin Cardiothorac Vasc Anesth 2003; 7:3-12
- WEINER MM, LIN HM, DANFORTH D, et al. Methylene blue is associated with poor outcomes in vasoplegic shock. J Cardiothorac Vasc Anesth 2013; 27:1233-8
- WOODS KL, FLETCHER S. Long-term outcome after intravenous magnesium sulfate in suspected acute myocardial infarction: The second Leicester Intravenous Magnesium Intervention Trial (LIMIT-2). Lancet 1994; 343:816-9
