Une nouvelle conception a vu le jour il y a une quinzaine d’années, basée sur le rôle prépondérant des éléments cellulaires [3,5]. Elle permet de mieux comprendre comment la coagulation reste localisée au vaisseau lésé sans se répandre instantanément dans tout l’arbre vasculaire. Elle est basée sur le rôle déclencheur du facteur tissulaire (FT) mis à nu par une lésion endothéliale et sur celui du complexe FT/VIIa ancré à une cellule pariétale normalement abritée du courant sanguin par l’endothélium [4]. Elle implique deux types de cellules:
- La cellule tissulaire porteuse du FT (fibrocytes, myocytes, lipocyte, mononucléaire, macrophage, collagène);
- Le thrombocyte circulant, qui offre une surface phospholipique chargée négativement pour l’ancrage des facteurs de la coagulation.
La voie cellulaire comprend trois phases se recoupant partiellement: l’initiation, l’amplification et la propagation.
Initiation
Le contact entre deux types de cellules normalement séparées, les cellules sous-endothéliales et les thrombocytes, est la clef qui amorce le démarrage de la coagulation. Les cellules porteuses du FT entrent en relation avec les éléments sanguins lors d’une lésion endothéliale (traumatisme, rupture de plaque instable). Le FT, une glycoprotéine transmembranaire de 47’000 Da, active le facteur VII (FVIIa), qui lui adhère immédiatement. Ce complexe FT/VIIa active à son tour les facteurs IX (FIXa) et X (FXa). Ce dernier s’associe à son cofacteur, le facteur Va, qu’il a lui-même activé; le calcium (Ca2+) est requis pour cette séquence. L’ensemble Va/Xa forme le complexe prothrombinase, fixé à la cellule pariétale porteuse du FT. Ce complexe déclenche la transformation de la prothrombine (facteur II) en thrombine (facteur IIa) (Figure 8.2). Cette phase dure 5-7 minutes.
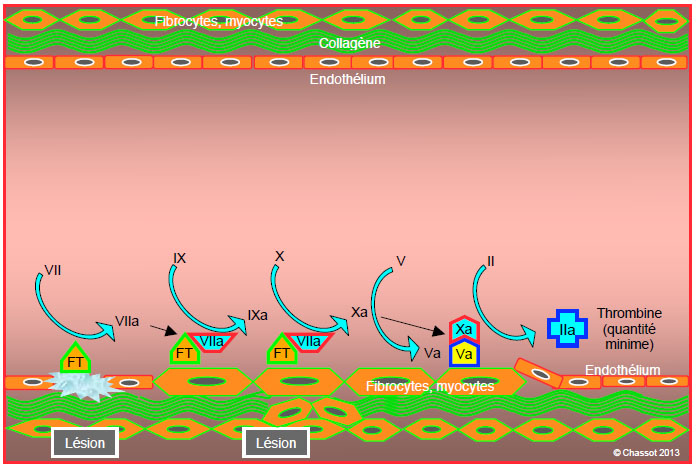
Figure 8.2: Phase d’initiation. Les cellules porteuses du facteur tissulaire (FT) sont mises au contact du sang lors d’une lésion endothéliale (traumatisme, rupture de plaque instable). Le FT active le facteur VII (fVIIa), qui lui adhère immédiatement. Ce complexe TF/VIIa active à son tour les facteurs IX (fIXa) et X (fXa). Ce dernier s’associe à son cofacteur, le facteur Va, qu’il a lui-même activé. L’ensemble Va/Xa forme le complexe prothrombinase, fixé à la cellule pariétale. Ce complexe déclenche la transformation de la prothrombine (facteur II) en thrombine (facteur IIa), en quantité encore minime pendant cette phase.
A ce stade, la thrombine apparaît en quantités minimes (concentration picomolaire) et ne conduit pas à la formation d’un caillot, car les thrombocytes, le facteur VIII et le facteur von Willebrand ne sont pas encore activés. Ils circulent dans le sang sous forme soluble et inactive. L’enchaînement décrit jusqu’ici reste localisé au niveau de la lésion endothéliale. Les molécules de facteur Xa qui s’échappent dans le courant sanguin sont rapidement inhibées par l’antithrombine (AT III), alors que le facteur IXa est bloqué beaucoup plus lentement par l’AT III. La prolifération du complexe FT/VIIa est limitée par son inhibiteur circulant (TFPI, tissue factor pathway inhibitor) (voir Systèmes régulateurs).
Amplification
La phase d’amplification se déroule à la surface des plaquettes. Elle ne commence que lorsque la lésion vasculaire est suffisante pour que les plaquettes soient activées et que le facteur von Willebrand franchisse la barrière endothéliale et adhère aux cellules porteuses de FT. La petite quantité de thrombine formée pendant la phase d’initiation a plusieurs fonctions (Figure 8.3) [3,5].
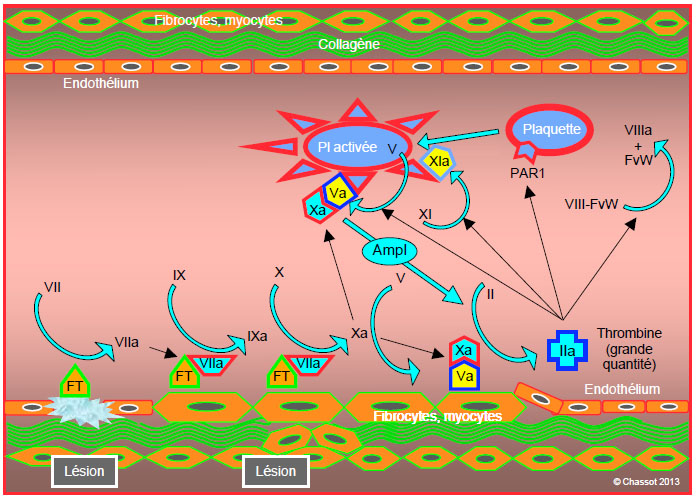
Figure 8.3: Phase d’amplification. La petite quantité de thrombine formée pendant la phase d’initiation a plusieurs fonctions: 1) activation de plaquettes par stimulation de leurs récepteurs à la thrombine (PAR1); 2) activation du facteur V des thrombocytes; le fVa se lie au fXa produit localement pour former un complexe prothrombinase (Va/Xa); 3) activation du facteur XI des plaquettes (XIa); 4) dissociation du complexe circulant formé par le facteur VIII et le facteur von Willebrand (VIII/FvW). La présence de complexe prothrombinase (Va/Xa) à la surface des plaquettes crée un système amplificateur (Ampl), puisqu’il transforme la prothrombine (fII) en thrombine (fIIa), elle-même à l’origine de l’activation plaquettaire. FT: facteur tissulaire.
- Activation des plaquettes par stimulation de leurs récepteurs à la thrombine (PAR-1, protease-activated receptor-1); elles changent de forme et développent des spicules.
- Activation du facteur V des thrombocytes, dont la forme activée (Va) apparaît à leur surface; le FVa se lie au FXa produit localement pour former un complexe prothrombinase (Va/Xa).
- Activation du facteur XI des plaquettes (XIa).
- Dissociation du complexe circulant formé par le facteur VIII et le facteur von Willebrand (VIII/FvW); le FvW, également présent dans les tissus sous-endothéliaux, permet l’adhésion de la plaquette sur le site de la lésion vasculaire par son récepteur GP Ib/V/IX. Le facteur VIIIa reste lié à la surface plaquettaire.
La présence de complexe prothrombinase (Va/Xa) à la surface des plaquettes crée un système amplificateur, puisqu’il transforme la prothrombine en thrombine, elle-même à l’origine de l’activation plaquettaire. Cette rétro-action positive augmente exponentiellement le nombre de plaquettes activées au niveau de la lésion vasculaire. La présence de calcium (Ca2+) est requise pour que le complexe prothrombinase (Va/Xa) convertisse la prothrombine en thrombine. La position centrale du facteur Xa comme déclencheur de l’amplification explique l’impact qu’ont sur la coagulation les substances qui l’inhibent directement, comme le rivaroxaban ou l’apixaban.
Propagation
La phase de propagation est caractérisée par la formation de fibrine et par l’installation d’un caillot au niveau de la lésion endothéliale. Elle a lieu à la surface des plaquettes (Figure 8.4) [3,5].
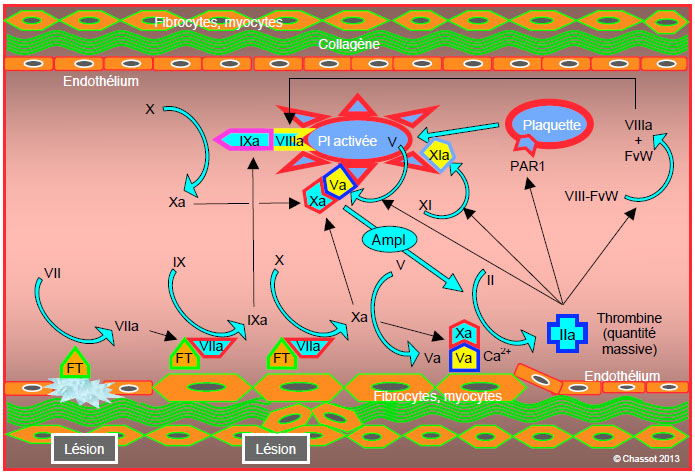
Figure 8.4: Phase de propagation, caractérisée par la formation de fibrine et par l’installation d’un caillot au niveau de la lésion endothéliale. Elle a lieu à la surface des plaquettes: 1) liaison du facteur IXa produit pendant la phase d’initiation, avec le facteur VIIIa dissocié du facteur von Willebrand (complexe IXa/VIIIa ou complexe ténase); 2) production de davantage de facteur Xa par le complexe IXa/VIIIa; 3) liaison du facteur Xa avec le facteur Va plaquettaire et formation de complexe prothrombinase Va/Xa en présence de Ca2+; 4) le facteur XIa favorise la formation de facteur IXa à la surface des thrombocytes, ce qui va augmenter l’apparition de facteur Xa; ce dernier a une place centrale dans la coagulaiton. Le résultat de cette activité est une flambée dans la production de thrombine (thrombin burst), assez puissante pour déclencher la transformation massive de fibrinogène en fibrine.
- Liaison du facteur IXa produit pendant la phase d’initiation, avec le facteur VIIIa dissocié du facteur von Willebrand; ce complexe IXa/VIIIa (complexe ténase) est situé à la surface des plaquettes.
- Production de davantage de facteur Xa par le complexe IXa/VIIIa.
- Liaison du facteur Xa avec le facteur Va plaquettaire et formation de complexe prothrombinase Va/Xa.
- Le rôle du facteur XIa est de favoriser la formation de facteur IXa à la surface des thrombocytes, ce qui va augmenter l’apparition de facteur Xa.
Il existe donc plusieurs boucles rétroactives positives. Le résultat de cette activité est une flambée dans la production de thrombine (thrombin burst), assez puissante pour déclencher la transformation massive de fibrinogène en fibrine. La plaquette est l’élément central de cette phase, car elle seule offre la surface adéquate et le positionnement requis pour forger les complexes ténase et prothrombinase. La fixation des plaquettes activées et agréguées au niveau de la lésion endothéliale survient en parallèle à la stimulation de la chaîne coagulatoire. La condition essentielle pour que ce système fonctionne est la présence d’une quantité suffisante de fibrinogène et de plaquettes.
La thrombine produite en masse clive les molécules de fibrinogène en monomères de fibrine qui vont spontanément polymériser en un gel agglutinant les thrombocytes (uncross-linked fibrin). Chaque molécule de thrombine peut activer 1'000 molécules de fibrinogène. Le degré de stabilité finale de l’ensemble thrombocytes-fibrine, qui détermine la qualité de l’hémostase et la fin du saignement, dépend des conditions locales: pH, température, concentration de calcium (Ca2+), quantité de thrombine, de plaquettes, de fibrinogène et de facteur XIII [6]. C’est le facteur XIII activé par la thrombine et le Ca2+ (XIIIa) qui assure l’essentiel de cette stabilité (Figure 8.5). Il crée des ponts entre les éléments de fibrine (cross-linked fibrin) et les rigidifie [2]. Un second facteur de stabilisation est l’inhibiteur de la fibrinolyse activé par la thrombine (TAFIa, thrombin-activated fibrinolysis inhibitor), qui réduit les points d’attache pour la plasmine. Ces deux facteurs protègent le thrombus de la fibrinolyse.
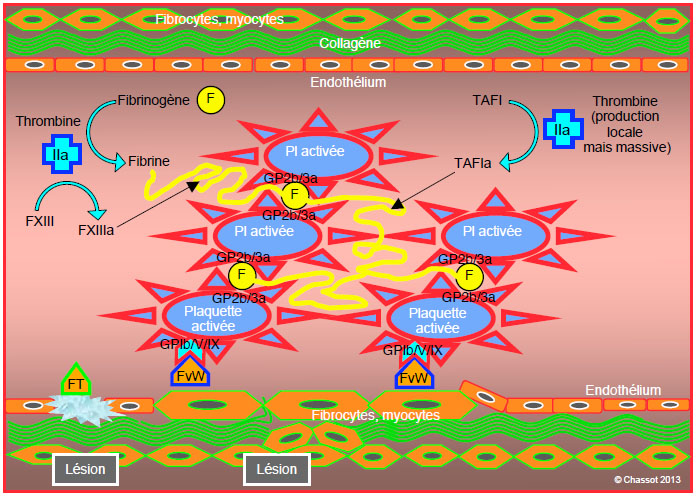
Figure 8.5: Formation de fibrine. Les plaquettes activées, fixées au niveau de la lésion endothéliale par le facteur von Willebrand (FvW) lié au récepteur GP Ib/V/IX, offrent son support mécanique à la chaîne coagulatoire. Elles sont agréguées par le lien entre leurs récepteurs GP IIb/IIIa et le fibrinogène (F). La thrombine (IIa) produite en masse clive les molécules de fibrinogène en monomères de fibrine qui vont spontanément polymériser en un gel agglutinant les thrombocytes (uncross-linked fibrin), dont le facteur XIIIa activé par la thrombine assure la stabilité; il crée des ponts entre les éléments de fibrine (cross-linked fibrin) et les rigidifie. Un second facteur de stabilisation est l’inhibiteur de la fibrinolyse activé par la thrombine (TAFIa, thrombin-activated fibrinolysis inhibitor), qui réduit les points d’attache pour la plasmine.
Plaquettes
Les plaquettes et les molécules de fibrinogène circulent de manière fluide dans le courant sanguin tant que l’endothélium est intact. Une rupture dans la continuité de ce dernier, qu’elle soit due à une brèche vasculaire ou à une rupture de plaque athéromateuse instable, met en contact avec le flux sanguin des éléments normalement camouflés dans la paroi du vaisseau : collagène, facteur von Willebrand (FvW), macrophages, lipides, etc. Ce phénomène va déclencher l’activation plaquettaire, qui procède en trois phases (Figure 8.6) [1].
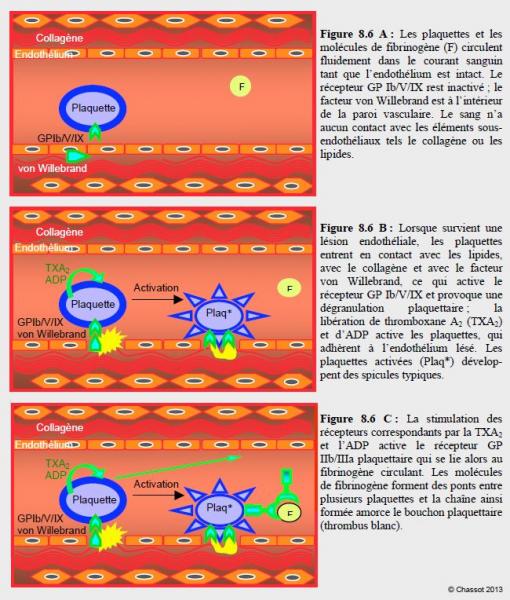
Figure 8.6 : Activation des plaquettes et formation d’un thrombus plaquettaire (thrombus blanc) lors de lésion endothéliale mettant à nu le collagène normalement recouverts d’endothélium : plaquettes et facteurs inactivés (8.6 A), phase d’initiation (8.6 B) et phase d’extension (8.6 C). Les agents antiplaquettaires (aspirine, clopidogrel, etc) agissent en bloquant la phase d’activation (ou initiation) des plaquettes. Plaq* : plaquette activée.
- Phase d’initiation, pendant laquelle les plaquettes adhèrent à la lésion ; le facteur von Willebrand est un des éléments principaux qui fixent la plaquette à la lésion vasculaire ;
- Phase d’extension, caractérisée par un recrutement et une agrégation d’autres plaquettes ; il se forme un thrombus blanc (plaquettes liées entre elles par des molécules de fibrinogène) ;
- Phase de perpétuation, marquée par la stabilisation du thrombus au moyen de la fibrine (thrombus rouge).
Lorsque survient une lésion endothéliale, les plaquettes entrent en contact avec le collagène et avec le facteur von Willebrand. La rencontre entre les structures sous-endothéliales et les thrombocytes circulants active spécifiquement le récepteur GP Ib/V/IX et provoque une dégranulation plaquettaire qui libère de la thromboxane A2 (TXA2), de l’adénosine-diphosphate (ADP) et de la thrombine. Ces substances stimulent à leur tour les récepteurs correspondants de chaque plaquette et ceux des thrombocytes voisins ; elles amplifient ainsi la réaction par recrutement de nouveaux éléments [7]. Les plaquettes activées changent de forme et développent des spicules typiques.
La stimulation des récepteurs plaquettaires par la TXA2, l’ADP et la thrombine transmet un signal intracellulaire qui conduit à une hausse du Ca2+ ionisé sarcoplasmique et à une baisse de la production d’AMP cyclique (cAMP) ; ce phénomène active les quelques milliers de complexes GP IIb/IIIa situés à la surface de chaque plaquette. Une fois activés, ces derniers se lient au fibrinogène circulant. Cette liaison forme des ponts entre plusieurs plaquettes et devient la colle qui agglutine les thrombocytes entre eux. La chaîne ainsi formée amorce le bouchon plaquettaire, squelette du futur caillot.
Lorsqu’elles sont stimulées, les plaquettes libèrent des agents activateurs de la coagulation (TXA2, ADP, sérotonine, thrombine) dont certains sont aussi des vasoconstricteurs locaux (TXA2, sérotonine), alors que l’endothélium sécrète des substances qui freinent l’activité plaquettaire et ont un effet vasodilatateur : le NO• (baisse du Ca2+ ionisé intracellulaire), la prostacycline PGI2 (augmentation du cAMP, modulation de la réponse au TXA2) et l’ecto-ADPase (suppression de la phase de recrutement plaquettaire).
Terminaison
Le caillottage doit rester limité à la zone de la lésion et ne pas se disséminer à tout l’arbre vasculaire. Plusieurs systèmes empêchent cette diffusion (voir Systèmes régulateurs) (Figure 8.7).
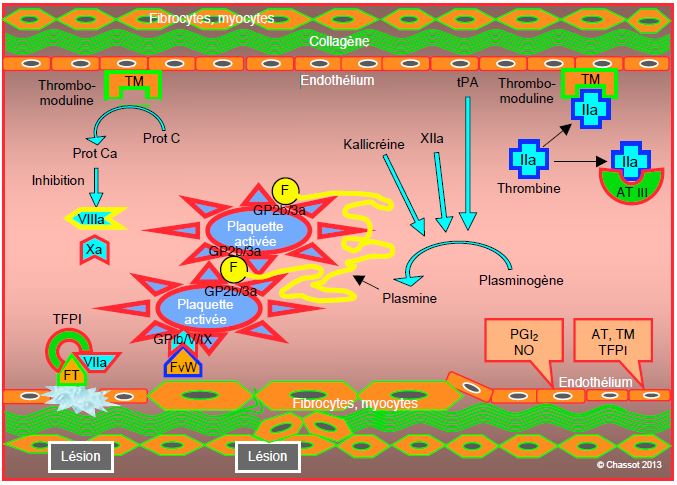
Figure 8.7: Limitation. Plusieurs systèmes empêchent la diffusion de la coagulation: 1) la thrombomoduline (TM) endothéliale inhibe la thrombine circulante; 2) le complexe TM-thrombine active la protéine C (Prot Ca) qui bloque les facteurs Va et VIIIa; 3) l’antithrombine III (AT III) inactive rapidement la thrombine et plus lentement le facteur IXa; 4) la prolifération du complexe FT/VIIa est limitée par son inhibiteur circulant (TFPI, tissue factor pathway inhibitor); 5) la fibrinolyse assure la dégradation progressive des amas de fibrine et la résorbtion du thrombus; elle est assurée par la plasmine issue du plasminogène sous l’action de la kallikréine, du facteur XIIa et de l’activateur endothélial (tPA, tissue plasmin activator). PG: prostaglandine.
- La thrombine est rapidement inactivée par l’antithrombine III (ATIII) et par la thrombomoduline (TM);
- Le complexe TM-thrombine active la protéine C qui bloque les facteurs Va et VIIIa;
- Le complexe FT/VIIa est limité par son inhibiteur circulant (TFPI, tissue factor pathway inhibitor) qui inhibe rapidement tout complexe circulant en-dehors de la zone lésée.
A plus long terme, la fibrinolyse assure la dégradation progressive des amas de fibrine et la résorbtion du thrombus.
Triade de Virchow
La triade de Virchow (Rudolf Virchow, 1821-1902) résume les trois éléments en jeu dans la thrombose: la paroi vasculaire, le sang et le flux sanguin. La thrombose artérielle et la thrombose veineuse n’ont pas la même genèse et sont rarement simultanées [8].
- Thrombose artérielle: elle est associée à une rupture de plaque athéromateuse qui met au contact du sang des éléments normalement abrités par l’endothélium: facteur tissulaire, collagène, macrophage, lipocytes, lipides. Le thrombus mural, initialement formé de plaquettes, crée une sténose qui provoque des forces de cisaillement (shear stress) et des turbulences, potentiellement génératrices de davantage de thrombus.
- Thrombose veineuse: typiquement associée à une hypercoagulabilité, elle est liée à une activité procoagulante de l’endothélium suite à une stimulation inflammatoire; le ralentissement du flux sanguin y est un élément capital.
| Voie cellulaire de la coagulation |
|
La coagulation se déroule en 3 phases (initiation, amplification et propagation) qui se développent à la surface de deux types de cellules :
- Cellules extravasculaires normalement isolée par l’endothélium (fibrocytes, macrophages)
- Plaquettes circulantes activées
1 - La lésion endothéliale met des cellules porteuses du facteur tissulaire (FT) au contact du sang. La chaîne de la coagulation est activée (initiation) :
- Formation de complexe FT/FVIIa (voie extrinsèque)
- Activation du facteur X en F Xa
- Formation de complexe Xa/Va (complexe prothrombinase)
- Transformation de la prothrombine (facteur II) en thrombine (F IIa) (quantité minime)
2 - La petite quantité de thrombine formée a plusieurs effets (amplification) :
- Activation de plaquettes
- Libération de F VIIIa (à partir de complexe avec le facteur von Willebrand)
- Activation de facteur V plaquettaire en F Va et de F IX en F IXa
- Formation de complexe Xa/Va (complexe prothrombinase)
- Rétroaction positive sur la transformation de F II en F IIa (thrombine) (grande quantité)
3 - La thrombine est produite en masse ; elle transforme le fibrinogène en fibrine, qui forme un caillot avec les plaquettes (propagation) :
- Formation de complexe IXa/VIIIa (voie intrinsèque)
- Formation de davantage de complexe Xa/Va (complexe prothrombinase)
- Rétroaction positive avec formation massive de F Xa et de thrombine
- Clivage du fibrinogène en fibrine, qui polymérise et forme un gel englobant les plaquettes
L’agrégation des plaquettes procède également en 3 phases :
- Adhésion à la lésion vasculaire par les récepteurs GP Ib/V/IX
- Recrutement de plaquettes et agrégation par liaison entre le récepteur GB IIb/IIIa et les
molécules de fibrinogène (thrombus blanc)
- Stabilisation par la fibrine (thrombus rouge)
|
© CHASSOT PG, MARCUCCI C, Décembre 2013, dernière mise à jour, Novembre 2018
Références
- ANGIOLILLO DJ, UENO M, GOTO S. Basic principles of platelet biology and clinical implications. Circ J 2010; 74:597-607
- BAGOLY Z, KONCZ Z, MUSZBEK L. Factor XIII, clot structure, thrombosis. Thromb Res 2012; 129:382-7
- HOFFMAN M. Remodeling the blood coagulation cascade. J Thromb Thrombolysis 2003; 16:17-20
- HOFFMAN M. A cell-based model of coagulation and the role of factor VIIa. Blood Reviews 2003; 17 (Suppl 1):S1-S5
- HOFFMAN M, MONROE DM. A cell-based model of hemostasis. Thromb Haemost 2001; 85:958-65
- INNERHOFER P, KIENAST J. Principles of perioperative coagulopathy. Best Pract Res Clin Anaesthesiol 2010; 24:1-14
- SAKHUJA R, YEH RW, BHATT DL. Antiplatelet agents in acute coronary syndromes. Curr Probl Cardiol 2010; 35:123-70
- WOLBERG AS, ALEMAN MM, LEIDERMAN K, MACHLUS KR. Procoagulant activity in hemostasis and thrombosis: Virchow’s triad revisited. Anesth Analg 2012; 114:275-85
