Surveillance hémodynamique
La surveillance hémodynamique comprend deux cathéters artériels: un cathéter fémoral qui est la mesure la plus proche de la pression aortique et dont la lecture reste fiable à basse température, et un cathéter radial qui renseigne sur la pression de perfusion cérébrale. Le côté où est placé ce dernier est choisi en fonction de la canulation de CEC: à droite lors de canulation fémorale ou ascendante, et à gauche lors de canulation sous-clavière. Toutefois, la canulation des deux artères radiales est la technique la plus courante [7]. La présence d'un cathéter fémoral est requise lors de double canulation de CEC pour perfusion simultanée du cerveau et des organes sous-diaphragmatiques (Figure 18.27).
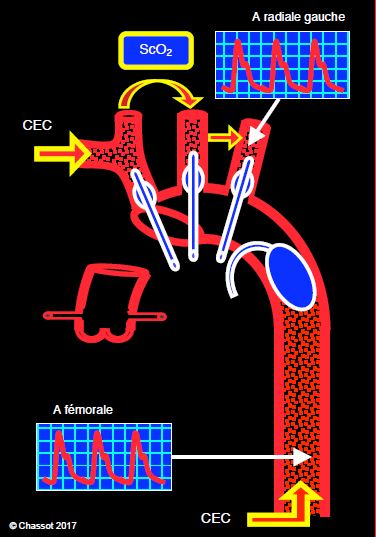
Figure 18.27 : Schéma des opérations sur la crosse aortique. La technique représentée ici combine les canulations artérielles de CEC dans l’artère sous-clavière droite et dans une artère fémorale. Lorsque l’aorte ascendante distale et la crosse sont ouvertes, le tronc brachio-céphalique, la carotide gauche et la sous-clavière gauche sont clampés à leur départ de la crosse par des ballonnets intravasculaires (en bleu). Le flux de la CEC (500-800 mL/min à 20°C, 1’000-1'500 mL/min à 28°) perfuse la carotide droite, puis la carotide gauche par l'intermédiaire du cercle de Willis et des anastomoses entre carotides externes. La pression de perfusion est mesurée dans l'artère radiale gauche, qui est perfusée par l’intermédiaire des collatérales entre la vertébrale et la sous-clavière gauches. Une canule artérielle placée en fémorale permet de continuer la perfusion des viscères sous-diaphragmatiques et de la moelle épinière (1’000-1'500 mL/min à 20°, 2’000-3'000 mL/min à 28°), l’aorte descendante étant clampée par une ballon intravasculaire (en bleu). Deux cathéters artériels sont nécessaires pour surveiller ces circulations séparées. ScO2 : saturation cérébrale en O2.
Un cathéter pulmonaire de Swan-Ganz est utile, autant pour la phase peropératoire que pour le suivi postopératoire. L'ETO offre une excellente vision de la fonction cardiaque et de la volémie, et permet de contrôler le flux aortique après la réparation. Une évaluation de la perfusion et de la fonction cérébrale est nécessaire. Plusieurs moyens sont à disposition.
Electro-encéphalographie
L'EEG ne reflète que l'activité corticale globale; des altérations à l'EEG sont visibles lorsque le flux sanguin cérébral a diminué de moitié. L'EEG est isoélectrique pour un flux sanguin de 15-20 mL/100g/min (valeur normale: 50 mL/100g/min). Une ischémie focale (embolie de gaz ou de matériel artériosclérotique, thrombus) peut échapper à cette surveillance. L'ischémie provoque une perte des signaux électriques rapides alpha (7-14 Hz) et béta (> 14 Hz), et une augmentation des signaux lents delta (0.5-3 Hz) et théta (4-7 Hz), puis une perte d'amplitude allant jusqu'au silence électrique [12]. Les modifications électriques surviennent avant les lésions cellulaires; les déficits neurologiques sont probables lorsqu'elles durent plus de 10 minutes. L'EEG est isoélectrique à ≤ 20°C.
Le système à 16 ou 20 canaux, encombrant et difficile à interpréter, est remplacé par un moniteur de fonction cérébrale type CSA (Compressed Spectral Array), qui affiche une analyse spectrale des ondes (transformation de Fourrier) et ne nécessite que quatre électrodes placées sur les apophyses mastoïdes et au milieu du rebord orbitaire frontal. Cette technique plus conviviale ne permet pas toujours de distinguer les ondes cérébrales des interférences comme l'activité cardiaque ou musculaire, l'effet des médicaments, de la température ou de la pCO2. Il est recommandé de n'arrêter la circulation que lorsque toute activité électrique a cessé.
Les potentiels évoqués (PE) du membre supérieur monitorent le cortex sensitif, mais sont un signal moins sensible de la réduction du flux sanguin cérébral que l'EEG. L'appareillage est encombrant et la valeur prédictive faible. Les potentiels évoqués moteurs surveillent la colonne antérieure de la moelle; la sensibilité est faible mais la spécificité est de 100% pour l'ischémie essentiellement médullaire. Plus intéressants sont les potentiels évoqués auditifs (PEA); la réponse auditive du tronc cérébral reflète l'activité neuronale entre le noyau cochléaire et le colliculus inférieur; elle n'est pas modifiée par les agents d'anesthésie, mais varie directement avec la température; elle est un excellent moyen de surveiller le degré d'inhibition neuronale par l'hypothermie [13].
L'index bispectral (BIS™) analyse 4 variables d'un tracé EEG bipolaire (amplitude, fréquence, composition et cohérence de phase); un algorithme (propriété du brevet et non explicité) le transforme en un nombre compris entre 0 (sommeil profond) et 100 (réveil) qui décrit la puissance relative dans un espace à 4 phases des bandes de fréquences les plus élevées de l'EEG/EMG [12]; ce chiffre représente la profondeur de l'anesthésie. Le point critique entre amnésie et souvenir se trouve vers 65 [16]. Bien qu’il puisse être utile pour éviter le réveil chez un patient curarisé, le BIS ne s’est pas révélé un instrument fiable pour garantir le sommeil (voir Chapitre 6 Index bispectral) [2]. D’autre part, le BIS™ est un moniteur global et non focal de l'activité cérébrale, même si quelques rapports ont indiqué un effondrement de sa valeur lors d’états hémodynamiques instables, d'épisodes de souffrance cérébrale ou d'AVC [4,23]. Une valeur de BIS basse (< 40) signale un approfondissement excessif de l'anesthésie, mais aussi à un dysfonctionnement cérébral momentané potentiellement lié à une baisse de l'apport en O2 (bas débit, hypotension, anémie, hypoxie). La conjonction d'une baisse du BIS < 40 et d'une chute de la PAM < 70 mmHg ("double low") est corrélée avec une augmentation de la mortalité à 30 jours après chirurgie cardiaque lorsqu'elle dure plus d'une heure (OR 1.73-1.99) [8]. Mais lors d’ischémie cérébrale contrôlée, la valeur du BIS™ est sans corrélation avec l'état neurologique [3]. Le BIS n’offre donc pas de garantie sur le degré de protection cérébrale.
Spectroscopie infrarouge
La spectroscopie infrarouge (Near-infrared spectroscopy ou NIRS) permet la mesure locale de la saturation de l'hémoglobine cérébrale en oxygène (ScO2) (voir Chapitre 6 Oxymétrie cérébrale). Les deux diodes des capteurs sont écartées de 3 cm environ; chaque capteur est placé sur l'angle fronto-temporal, de chaque côté du crâne. La longueur d'onde émise (760 – 930 nm) pénètre la boîte crânienne et se trouve dispersée par la substance cérébrale où une partie spécifique du spectre est absorbée par l'hémoglobine oxygénée (HbO2) et une autre par l'hémoglobine réduite (Figure 18.28).
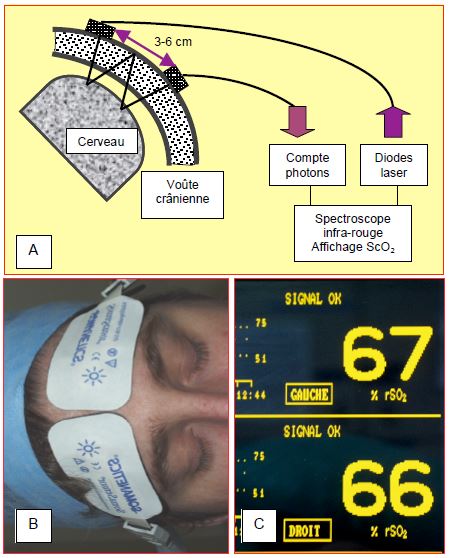
Figure 18.28 : Spectroscopie infrarouge et mesure de la saturation de l'hémoglobine cérébrale en oxygène (ScO2). A : Les deux diodes de chaque capteur sont écartées de 3 cm environ; chaque capteur est placé sur l'angle fronto-temporal, de chaque côté du crâne. La longueur d'onde laser émise (760 – 930 nm) pénètre la boîte crânienne et se trouve dispersée par la substance cérébrale où une partie spécifique du spectre est absorbée par l'hémoglobine oxygénée (HbO2) et une autre par l'hémoglobine réduite. La quantité de lumière réfléchie et le spectre d'absorption permettent de calculer la teneur en oxygène de la zone cérébrale explorée. B : électrodes de lecture en place au-dessus du rebord orbitaire sur la peau glabre du front ; elle doivent prendre l’angle fronto-temporal pour que les rayons des deux diodes soient concentriques. C : affichage de la ScO2 bilatérale.
La quantité de lumière réfléchie et le spectre d'absorption permettent de calculer la teneur en oxygène de la zone cérébrale explorée [15]. Les valeurs affichées, combinaison de valeurs artérielles, capillaires et veineuses, sont très voisines de la saturation veineuse cérébrale (SjO2) parce que les trois quarts du sang cérébral sont dans le réseau veineux et parce que l'appareil utilise les composantes non pulsatiles du spectre; la valeur normale oscille entre 60 et 75% [11]. Bien que l’évolution du chiffre et sa vitesse de variation soient plus significatives que sa valeur absolue, une ScO2 inférieure à 50% est clairement anormale. Il existe souvent une légère asymétrie entre les deux hémisphères, mais l’apparition d’une nouvelle asymétrie de plus de 10 points est pathologique. Une ischémie survenant dans une autre région que celle des lobes frontaux échappe cependant à la surveillance ; par contre, la technique permet de différencier l'état des deux hémisphères. La ScO2 s'élève en hyperoxie et en hypothermie (baisse du métabolisme), mais aussi en état de mort cérébrale [21]. A cause de la vasoconstriction hypothermique, les valeurs de ScO2 sont plus basses en régulation alpha-stat que pH-stat [10].
Dans les arrêts circulatoires hypothermiques, la dérive de la ScO2 permet de juger de la tolérance du cerveau à l’ischémie. A 20°C, la désaturation est d’environ 1%/min ; à 36°C, elle est de 20%/min. La ScO2 permet de régler le débit continu minimal de perfusion sous-clavière ou carotidienne qui assure les besoins cérébraux en hypothermie (10-15 mL/kg/min) [21]. Comme l’autorégulation est abolie pour plusieurs heures par l’hypothermie, la période dangereuse est celle du réchauffement, parce que la consommation cérébrale d’O2 devient dépendante de l’apport d’O2, donc de la pression artérielle. L’hémodynamique la plus adéquate est celle qui normalise la ScO2. La surveillance peropératoire de la saturation cérébrale par la ScO2 alerte l’anesthésiste sur un risque de souffrance cérébrale en cas de baisse soudaine. Les troubles cognitifs sont aggravés lors d’une diminution importante de la ScO2 [18].
La question majeure est celle de la définition d'un seuil en dessous duquel les déficits neurologiques sont certains. Celui-ci est encore mal établi. En chirurgie carotidienne, une baisse de 20 points ou plus a une sensibilité et une spécificité de 80% et une valeur prédictive négative de 98% pour l’apparition de troubles neurologiques, mais une valeur prédictive positive de seulement 37% pour la présence de déficits neurologiques postopératoires [9]. Lors d'un arrêt circulatoire hypothermique, le nadir est atteint en 15-20 minutes; une baisse à une valeur de 30% signe une ischémie cérébrale; si elle dure plus de 10 minutes, elle est associée à des dysfonctions cognitives. Le seuil d'irréversibilité n'est pas connu pour l'instant [14]. La ScO2 minimale tolérée est en général de 35-40%. Il faut prévoir une reperfusion cérébrale rapide lorsque cette valeur est dépassée (Figure 18.29).
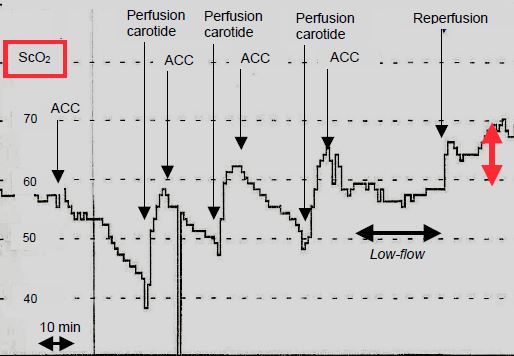
Figure 18.29 : Evolution de la saturation cérébrale en O2 (ScO2) au cours d’une perfusion carotidienne isolée (chirurgie de la crosse aortique). Pendant chaque arrêt circulatoire (ACC: arrêt circulatoire complet), la ScO2 baisse progressivement; la consommation en O2 persiste malgré l'hypothermie (20°C). Lors de chaque reperfusion par la canulation carotidienne, la ScO2 remonte et dépasse le niveau de base, car l'hypothermie diminue la CMRO2. La ScO2 est stable pendant une période de bas débit continu hypotherme (low-flow), puis dépasse sa valeur initiale à cause de la vasodilatation cérébrale (perfusion luxuriante, double flèche rouge).
L'évidence clinique suggère une corrélation entre la baisse de la ScO2 et les séquelles neurologiques [1,19]. Dans l'état actuel de nos connaissances, on peut utiliser les repères inspirés de la chirurgie carotidienne, bien qu’ils n’aient pas encore été validés.
- Baisse de 5-15 points : normal lors d’arrêt circulatoire;
- Baisse de < 20 points : faible probabilité de lésions neurologiques;
- Baisse de > 20 points : seuil d’alerte;
- ScO2 = 40%: limite de récupération neurologique certaine;
- ScO2 ≤ 30%: seuil de déficits neurologiques postopératoires.
En cours de perfusion cérébrale à bas débit, on cherche à maintenir la ScO2 à ≥ 60% et à éviter une chute de plus de 20% [22]. Le temps passé en dessous de 60% et le nadir de ScO2 inférieure à 60% sont tous deux directement associés aux déficits neurologiques ultérieurs [5]. La survenue d'une désaturation cérébrale implique quelques mesures correctives: double canulation carotidienne en cas de perfusion unilatérale par la sous-clavière, reprise de la perfusion en cas d'arrêt circulatoire total, augmentation du débit et de la pression artérielle, normalisation de la PaCO2 et augmentation de la FiO2 [24]. Une augmentation de la ScO2 à ≥ 75% n'est pas forcément de bon augure car elle reflète une perfusion excessive (hyperémie de reperfusion).
Saturation jugulaire
La saturation veineuse jugulaire (SjO2) s'obtient par canulation rétrograde de la jugulaire interne (cathéter oxymétrique 5.5 French); elle est fonction de l'extraction cérébrale en O2 et de l'activité métabolique globale et non unilatérale. Sa valeur normale est 60-75% [6]. Elle augmente en cas d'hyperémie, d'hypercapnie, de fistule artério-veineuse ou d'hypothermie. Elle diminue pour des raisons systémiques (désaturation artérielle, hypocapnie, anémie aiguë, hypotension) ou cérébrale (hypertension intracrânienne, hyperthermie, convulsions, vasospasme). La valeur critique se situe autour de 50% [20]. Une valeur < 40% est associée à une souffrance cérébrale ischémique et à des séquelles neurologiques [17]. Elle peut être utile pour confirmer la baisse de la demande métabolique avant un arrêt circulatoire.
| Monitorage pour la chirurgie de la crosse aortique |
|
Cathéter artériel fémoral + radial droit/gauche selon canulation de CEC.
Cathéter pulmonaire de Swan-Ganz et ETO.
Saturométrie cérébrale (ScO2)
- Seuil d’alerte : chute de > 20 points ou ScO2 < 40%
- Le temps passé < 60% et le nadir de ScO2 inférieure à 60% sont associés aux déficits neurologiques ultérieurs
- En hypothermie, la ScO2 doit s’élever
|
© CHASSOT PG, TOZZI P, BETTEX D, Octobre 2010, Dernière mise à jour, Avril 2018
Références
- ANDROPOULOS DB, STAYER SA, DIAZ LK, RAMAMOORTHY C. Neurological monitoring for congenital heart surgery. Anesth Analg 2004; 99:1365-75
- AVIDAN MS, ZHANG L, BURNSIDE BA, et al. Anesthesia awareness and the bispectral index. N Engl J Med 2008; 358:1097-108
- DEOGAONKAR A, VIVAR R, BULLOCK RE, et al. Bispectral index monitoring may not reliably indicate cerebral ischaemia during awake carotid endarterectomy. Br J Anaesth 2005; 94:800-4
- ENGLAND MR. The changes in bispectral index during a hypovolemic cardiac arrest. Anesthesiology 1999; 91:1947-9
- FISCHER GW, LIN HM, KROL M, et al. Noninvasive cerebral oxygenation may predict outcome in patients undergoing aortic arch surgery. J Thorac Cardiovasc Surg 2011; 141:815-21
- LAM AM, MAYBERG TS. Jugular bulb venous oxynerty monitoring. Anesth Clin North Am 1997; 15:533-47
- LINDSAY H, SRINIVAS C, DJAIANI G. Neuroprotection during aortic surgery. Best Pract Res Clin Anaesthesiol 2016; 30:283-303
- MAHESHWARI A, McCORMICK PJ, SESSLER DI, et al. Prolonged concurrent hypotension and low bispectral index ("double low") are associated with mortality, serious complications, and prolonged hospitalization after cardiac surgery. Br J Anaesth 2017; 119:40-9
- MILLE T, TACHIMIRI ME, KLERSY C, et al. Near infrared spectroscopy monitoring during carotid endarterectomy: which threshold value is critical ? Eur J Vasc Endovasc Surg 2004; 27:646-50
- MORIMOTO Y, NIIDA Y, HISANO K, et al. Changes in cerebral oxygenation in children undergoing surgical repair of ventricular septal defects. Anaesthesia 2003; 58:77-83
- NOLLERT G, SHINOKA T, JONAS RA. Near-infrared spectrophotometry of the brain in cardiovascular surgery. J Thorac Cardiovasc Surg 1998; 46:167-75
- RAMPIL IJ. A primer for EEG signal processing in anesthesia. Anesthesiology 1998: 89:980-1002
- RODRIGUEZ RA, EDMONDS HL, AUDEN SM, et al. Auditory brainstem-evoked responses and temperature monitoring during pediatric cardiopulmonary bypass. Can J Anaesth 1999; 46:832-9
- SCHWARTZ G, LITSCHER G. Transcranial cerebral oxymetry, transcranial Doppler sonography, and heart rate variability: useful neuromotitoring tools in anaesthesia and intensive care ? Eur J Anaesthesiol 2002; 19:543-9
- SCHWARZENBERGER J, THYS DM. Monitoring. In: THYS DM, ed. Textbook of cardiothoracic anesthesiology. New York, McGraw Hill Co, 2001, pp 316-353
- SECO M, EDELMAN JJB, VAN BOXTEL B, et al. Neurologic injury and protection in adult cardiac and aortic surgery. J Cardiothorac Vasc Anesth 2015; 29:185-95
- SHAABAN T, HARMER M, LATTO P. Jugular bulb oximetry during cardiac surgery. Anaesthesia 2001; 56:24-37
- SLATER JP, GUARINO T, STACK J, et al. Cerebral oxygen desaturation predicts cognitive decline and longer hospital stay after cardiac surgery. Ann Thorac Surg 2009; 87:36-44
- SLOAN TB, EDMONDS HL, KOHT A. Intraoperative electrophysiologic monitoring in aortic surgery. J Cardiothorac Vasc Anesth 2013; 27:1364-73
- STUMP DA, JONES TJJ, RORIE KD. Neurophysiologic monitoring and outcomes in cardiovascular surgery. J Cardiothorac vasc Anesth 1999; 13:600-13
- TAILEFER MC, DENAULT Y. Cerebral near-infrared spectroscopy in adult heart surgery: systematic review of its clinical efficacy. Can J Anesth 2005; 52:79-87
- URBANSKI PP, LENOS A, KOLOWCA M, et al. Near-infrared spectroscopy for neuromonitoring of unilateral cerebral perfusion. Eur J Cardiothorac Surg 2013; 43:1140-4
- WELSBY IJ, RYAN JM, BOOTH JV, et al. The bispectral index in the diagnosis of perioperative stroke: A case report and discussion. Anesth Analg 2003; 96:435-7
- ZHENG F, SHEINBERG R, YEE MS, et al. Cerebral near-infrared spectroscopy monitoring and neurologic outcomes in adult cardiac surgery patients: a systematic review. Anesth Analg 2013; 116:663-76
