La première transplantation cardiaque pédiatrique a été réalisée par Denton Cooley en 1984. Actuellement, il s'en pratique un peu moins de 500 par an, soit 10 fois moins que chez l’adulte [5]. Ce nombre est stable depuis une douzaine d'années. Chez l'enfant, les indications étiologiques principales sont par ordre de fréquence moyenne [2] :
- Cardiopathie congénitale (lésion inopérable, palliations épuisées); c'est l'indication la plus fréquente en-dessous de 1 an. La majorité des patients souffre de ventricule unique.
- Cardiomyopathie ( dilatative, restrictive, hypertrophique, maladie musculaire); indication la plus fréquente à partir de 1 an (50-60% des cas).
- Retransplantation (rejet irréversible, coronaropathie du greffon); indication tardive.
- Néoplasme cardiaque (rare).
Les indications fonctionnelles sont essentiellement l'insuffisance ventriculaire systémique terminale (stade D), le retard de croissance majeur lié à une insuffisance cardiaque (stade C), les arythmies intraitables et la cardiomyopathie restrictive assocée à une hypertension pulmonaire [11]. La greffe est contre-indiquée dans plusieurs situations [9].
- Maladie multisystémique irréversible, maladie cancéreuse;
- Hypertension pulmonaire sévère ou irréversible (RAP ≥ 5 U Wood); une transplantation pulmonaire ou une transplantation cœur-poumon est envisageable dans ce cas;
- Maladie cérébro-vasculaire grave;
- Le bas âge n'est pas une limite, puisque 25% des receveurs sont âgés de 20 jours à 12 mois [3].
- Incompatibilité ABO; l'immaturité du système immunitaire chez les enfants de moins d’un an et leur déficience en anticorps contre les antigènes du donneur permettent de transplanter des organes vitaux ABO-incompatibles avec une survie égale à celle des organes compatibles. Une plasmaphérèse pour extraction d'anticorps n'est nécessaire que dans 10% des cas [12]. En l'absence de donneur compatible, il est donc possible de greffer un petit enfant avec un cœur qui ne respecte pas le système ABO si son titre d'iso-agglutinines est ≤ 1:4 et sous un régime d'immunosuppression habituel (ATG, tacrolimus, mycophénolate mofétil et stéroïde).
La durée d'ischémie tolérable par le greffon entre le clampage de l'aorte chez le donneur et le déclampage de l'aorte chez le receveur est de 4-5 heures. La technique de transplantation est identique à celle de l'adulte: canulation aortique et bi-cave distale, résection du cœur in toto en ne laissant en place que la paroi postérieure de l'OG avec l'implantation des quatre veines pulmonaires (Figure 14.74). L'intervention comporte cinq anastomoses.
- Paroi postérieure de l'OG du greffon à la paroi postérieure de l'OG du receveur englobant l'abouchement des veines pulmonaires; cette reconstruction est parfois réalisée en deux parties pour chacun des deux groupes de veines pulmonaires droites et gauches.
- Aorte du greffon à l'aorte du receveur.
- VCS du greffon à la VCS du receveur.
- VCI du greffon à la VCI du receveur.
- Artère pulmonaire du greffon à l'AP du receveur; ces 3 dernières anastomoses peuvent se faire à cœur battant après déclampage de l'aorte pour racourcir la durée de l'ischémie du greffon.
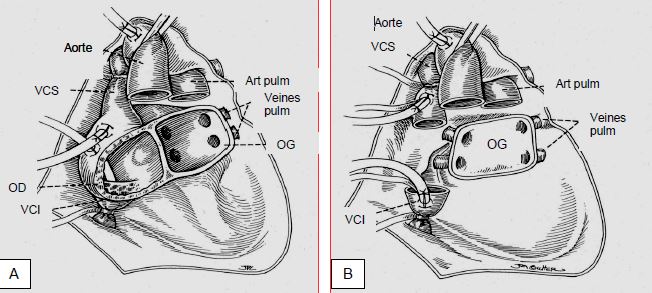
Figure 14.74 : Technique chirurgicale de la transplantation cardiaque. A: Méthode originale de Shumway; le corps des oreillettes du receveur est conservé; les oreillettes du donneur sont greffées par-dessus, aboutissant à un excès de tissu et de très grandes cavités auriculaires. B: Technique bicave de Sievers. Seule la paroi postérieure de l'OG est laissée en place avec les quatre veines pulmonaires; le corps de l'OD et de l'OG est réséqué; l'oreillette droite du greffon est anastomosée par ses veines caves aux veines caves supérieure et inférieure du receveur [Source : Estefanous FG, ed. Cardiac anesthesia. Principles and clinical practice. Philadelphia:Lippincott, Williams & Wilkins, 2001, p 643].
Dans les cardiopathies congénitales, le prélèvement chez le donneur doit comporter une bonne longueur d’aorte et de veines caves pour permettre une reconstruction adéquate, car les vaisseaux du donneur ne se trouvent pas forcément en face de ceux du receveur (transposition des gros vaisseaux, truncus arteriosus). Dans les hypoplasies du VG, tout l'arc aortique est reconstruit avec celui du donneur. Après des anastomoses cavo-pulmonaires (Glenn, Fontan), les veines caves sont reconstituées avec celles du donneur et anastomosées très distalement. La taille du greffon est plus ou moins bien appariée à celle du receveur, car le poids du donneur est choisi entre 80% et 160% de celui du receveur. La croissance du greffon chez le receveur est normale et suit celle de son hôte.
Dans la période postopératoire, la mortalité est d'autant plus élevée que l'âge de l'enfant est bas: 6% > 10 ans et 15% < 1 an. Les causes principales sont la défaillance du greffon, l'infection et l'insuffisance multi-organique. Par la suite, un tiers des décès est lié à la coronaropathie qui se développe dans le greffon. Passée la période immédiate à haut risque, la courbe d'attrition est plus faible, mais la survie dépend des indications [3,4,6,7,11].
- Survie moyenne: 80% à 5 ans et 70% à 10 ans [7,11].
- Après palliation pour cœur univentriculaire: survie à 1, 10 et 20 ans de 73%, 58% et 49%, respectivement [8].
- Après opération de Fontan: survie à 5 ans 71% [10].
- Perte de greffon pendant les 36 premiers mois: 6.4%; la survie est assurée par une assistance ventriculaire.
- Complications à long terme: insufffisance rénale chronique (39% des cas), crise de rejet (34%), infection (34%), vasculopathie (10%) [1,13].
Les protocoles d'immunosuppression varient considérablement selon les institutions, mais tous sont basés que les mêmes substances [9].
- Induction: méthylprednisolone, OKT3 (anticorps monoclonal), basiliximab, dacilizumab;
- Entretien: prednisone, cyclosporine, tacrolimus;
- Rejet: méthylprednisolone;
- Adjuvant: azathioprine, mycophénolate mofentil, sirolimus, everolimus.
Ces régimes comportent tous un volet peropératoire: corticostéroïdes avant le déclampage de l'aorte, ou azathioprine à l'induction et cyclosporine ou sérum anti-lymphocytaire après la mise en charge. De nombreux centres n’administrent que les stéroïdes en peropératoire, les autres médications n’intervenant qu’après 24 heures. Il est capital de respecter le protocole en vigueur (voir Chapitre 17 Immunosuppression).
Anesthésie pour la transplantation
La durée d'ischémie maximale tolérée par le greffon est de < 5 heures, comptées entre le clampage de l'aorte chez le donneur jusqu'à son déclampage chez le receveur. Comme ce dernier a déjà fait de longs séjours en soins intensifs et a souvent été opéré plusieurs fois, les accès vasculaires sont devenus difficiles. Il est donc important d'amener l'enfant assez tôt dans le bloc opératoire pour avoir le temps de l'équiper sans stress et sans avoir à faire attendre le greffon. Il est capital d'avoir une bonne connaissance du passé chirurgical de l'enfant pour choisir de manière adéquate les sites de ponction vasculaire (sacrifice d'une artère sous-clavière pour un shunt de Blalock, par exemple). Certains enfants sont sous perfusion d'inotrope ou de vasodilatateur; ces substances ne sont pas interrompues avant la CEC.
La technique d'induction est conçue pour un enfant en défaillance ventriculaire; elle est adaptée à sa pathologie propre en cas de cardiopathie congénitale [2]. Elle est basée sur une association de midazolam (0.05-0.1 mg/kg iv) et de fentanyl (5-10 mcg/kg iv). L'étomidate (0.1-0.3 mg/kg iv) est une excellente alternative, car il est dénué d'effet hémodynamique et son blocage de la synthèse du cortisol est sans conséquence vu les doses de stéroïdes reçues dans le cadre de l'immunosuppression. La kétamine n'est pas un bon choix, car son effet inotrope négatif direct, normalement masqué par la stimulation sympathique, devient apparent lorsque l'enfant est épuisé par une longue maladie cardiaque et sous perfusion de catécholamines. Le thiopental et le propofol sont à éviter à cause de la baisse de précharge et de l'effet cardiodépresseur. En l'absence de voie veineuse, une induction au masque et au sevoflurane est envisageable, mais demande beaucoup de doigté pour éviter un surdosage qui est vite atteint et qui est responsable d'un effet inotrope négatif important. Après intubation, si possible par voie nasale avec un tube à ballonnet, l'enfant est normoventilé sous un régime de basse pression endothoracique. Comme il ne souffre en principe pas d'HTAP sévère, il n'est pas nécessaire de l'hyperventiler. La transplantation étant souvent une urgence, l'enfant n'est pas toujours à jeûn; on peut alors procéder à une séquence rapide modifiée avec du vecuronium (0.3 mg/kg), du rocuronium (1.2 mg/kg) ou de la succinylcholine (1-2 mg/kg).
La technique d'induction est conçue pour un enfant en défaillance ventriculaire; elle est adaptée à sa pathologie propre en cas de cardiopathie congénitale [2]. Elle est basée sur une association de midazolam (0.05-0.1 mg/kg iv) et de fentanyl (5-10 mcg/kg iv). L'étomidate (0.1-0.3 mg/kg iv) est une excellente alternative, car il est dénué d'effet hémodynamique et son blocage de la synthèse du cortisol est sans conséquence vu les doses de stéroïdes reçues dans le cadre de l'immunosuppression. La kétamine n'est pas un bon choix, car son effet inotrope négatif direct, normalement masqué par la stimulation sympathique, devient apparent lorsque l'enfant est épuisé par une longue maladie cardiaque et sous perfusion de catécholamines. Le thiopental et le propofol sont à éviter à cause de la baisse de précharge et de l'effet cardiodépresseur. En l'absence de voie veineuse, une induction au masque et au sevoflurane est envisageable, mais demande beaucoup de doigté pour éviter un surdosage qui est vite atteint et qui est responsable d'un effet inotrope négatif important. Après intubation, si possible par voie nasale avec un tube à ballonnet, l'enfant est normoventilé sous un régime de basse pression endothoracique. Comme il ne souffre en principe pas d'HTAP sévère, il n'est pas nécessaire de l'hyperventiler. La transplantation étant souvent une urgence, l'enfant n'est pas toujours à jeûn; on peut alors procéder à une séquence rapide modifiée avec du vecuronium (0.3 mg/kg), du rocuronium (1.2 mg/kg) ou de la succinylcholine (1-2 mg/kg).
L'équipement est complété dès que le tube endotrachéal est sécurisé.
- Deux voies veineuses de large calibre;
- Cathéter artériel (éventuellement PiCCO);
- Voie veineuse centrale 2-3 lumières; certains centres évitent la jugulaire interne droite de manière à la laisser intacte pour les biopsies myocardiques ultérieures;
- ETO; indispensable pour évaluer la fonction biventriculaire, la volémie et les anastomoses après la greffe;
- NIRS; la ScO2 renseigne autant sur l'oxygénation cérébrale effective que sur le transport d'O2 aux tissus en général; elle est précieuse en cas d'arrêt circulatoire momentané;
- Le cathéter artériel pulmonaire de Swan-Ganz présente de graves inconvénients: cheminement impossible selon les pathologies, risque d'arythmie, nécessité de le retirer avant la greffe puis de le ré-avancer après la sortie de CEC, risque d'infection;
- Si nécessaire, cathéter transthoracique placé chirurgicalement dans l'OG après la CEC.
Le maintien de l'anesthésie est assuré par du fentanyl (50-75 mcg/kg) ou du sufentanil (5-7.5 mcg/kg) et du midazolam (0.05-0.1 mg/kg) ou du sevoflurane (< 1 MAC).
La dissection intrapéricardique et la cardiectomie peuvent être délicates et très hémorragiques à cause des interventions précédentes, particulièrement lors d’assistance ventriculaire préalable, et à cause de l'anatomie particulière, variable selon la pathologie de base. L'opération se déroule en CEC hypothermique (25-28°C), parfois avec des périodes d'arrêt circulatoire (< 30 minutes) pour certaines configurations d'anastomoses veineuses et aortique. La greffe proprement dite débute par l'anastomose de l'OG, suivie de celle de l'aorte, puis par la reconstruction des veines caves et de l'artère pulmonaire.
Le rythme cardiaque pour la sortie de pompe est idéalement 130-150 batt/min chez les nouveaux-nés ou les nourrisssons et 100-110 batt/min chez les plus grands enfants. A la mise en charge après CEC, la dysfonction biventriculaire est fréquente. Elle est liée à plusieurs problèmes [9].
Anesthésie d'un transplanté
La dissection intrapéricardique et la cardiectomie peuvent être délicates et très hémorragiques à cause des interventions précédentes, particulièrement lors d’assistance ventriculaire préalable, et à cause de l'anatomie particulière, variable selon la pathologie de base. L'opération se déroule en CEC hypothermique (25-28°C), parfois avec des périodes d'arrêt circulatoire (< 30 minutes) pour certaines configurations d'anastomoses veineuses et aortique. La greffe proprement dite débute par l'anastomose de l'OG, suivie de celle de l'aorte, puis par la reconstruction des veines caves et de l'artère pulmonaire.
Le rythme cardiaque pour la sortie de pompe est idéalement 130-150 batt/min chez les nouveaux-nés ou les nourrisssons et 100-110 batt/min chez les plus grands enfants. A la mise en charge après CEC, la dysfonction biventriculaire est fréquente. Elle est liée à plusieurs problèmes [9].
- Donneur: état hypodynamique, hypertension intracrânienne aiguë (tempête sympathique).
- Greffon: contusion myocardique traumatique, lésion d'ischémie et de reperfusion, qualité de la préservation de l'organe (prélèvement, durée, température, etc).
- Rejet hyperaigu: en général dû à une incompatibilité ABO; seule alternative: assistance circulatoire.
- Défaillance du VD: l'insuffisance droite est habituelle si les RAP du receveur étaient élevées avant l'intervention ou s'il bénéficiait d'une circulation de Fontan. Le support inotrope doit être généreux et axé sur la performance du VD: dobutamine, adrénaline et milrinone, lévosimendan. La ventilation veille à baisser les RAP: FiO2 0.8, discrète hypocarbie (PaCO2 30-35 mmHg, pH 7.5), NO (10-40 ppm), prostaglandine en aérosol (PGI2 5-50 ng/kg/min). Le VD peut également défaillir sur une obstruction mécanique: coudure anastomotique de l'AP, obstruction sur les veines pulmonaires.
- Bradycardie liée à la dénervation du cœur greffé: isoprénaline (0.01-0.03 mcg/kg/min), pace-maker [2].
- Pertes sangines: l'hémorragie reste souvent importante après l'administration de la protamine et réclame un éventail d'agents différents basés sur les tests de coagulation (ACT, thrombo-élastogramme, Rotem™, etc): antifibrinolytique, transfusions, fibrinogène, plaquettes, facteurs de coagulation.
- Si la défaillance droite ou l'œdème post-CEC l'impose, le sternum est laissé ouvert 24 heures, mais cette situation est particulièrement critique chez des patients immunosupprimés.
Anesthésie d'un transplanté
L'enfant transplanté cardiaque présente des caractéristiques particulières liées au greffon et à l'immunosuppression [3,9].
- Hypertension artérielle dans 65% des cas (due aux corcticostéroïdes et à la cyclosporine);
- Arythmies auriculaires et ventriculaires (55% des cas); 10-20% des enfants dépendent d'un pace-maker;
- Hyperlipidémie (26% des cas);
- Vasculopathie coronarienne (10% des cas) sur maladie endothéliale conduisant à une hyperplasie myo-intimale étendue;
- Dysfonction rénale (10%);
- Infection, lymphome, cholélithiase, pancréatite.
Ces données imposent des contraintes inhabituelles chez un enfant lors d'une anesthésie pour la chirurgie non-cardiaque [2].
- La prise en charge doit respecter une stricte asepsie.
- La précharge et la postcharge doivent rester très stables pour maintenir une perfusion coronarienne adéquate;
- La tachycardie est à éviter;
- Le cœur est dénervé et ne réagit qu'aux catécholamines endogènes circulantes, dont l'effet met plusieurs minutes à apparaître. Le cœur n'est sensible qu'aux stimulants directs (dobutamine, adrénaline, isoprénaline) et non aux agents indirects (dopamine, éphédrine). La tachy- bradycardie réflexe est absente.
- Dysfonction diastolique: son débit est très dépendant de sa précharge.
- La bradycardie ne répond pas à l'atropine, ni au glycopyrrolate ni à la scopolamine; la réponse systémique au glycopyrolate et à la néostigmine est conservée. Le pancuronium n'a pas d'effet cardio-accélérateur et les fentanils n'entrainent pas de bradycardie.
- L'immunosuppression est continuée de manière inchangée en périopératoire; si l'enfant est encore sous stéroïdes, une supplémentation périopératoire est prévue (hydrocortisone 1-2 mg/kg iv);
- L'antibiothérapie prophylactique est requise.
| Transplantation cardiaque |
|
Durée maximale d’ischémie du greffon : 5 heures (entre clampage de l’aorte chez le donneur et déclampage chez le receveur), de préférence < 3 heures
Amener l’enfant assez tôt en salle d’opération pour avoir le temps de l’induire et de l’équiper sans devoir faire attende le greffon. Comme l’enfant a souvent déjà été opéré, les canulations et la dissection du cœur peuvent être laborieuses et hémorragiques.
Induction fentanyl + midazolam ou etomidate. Eviter kétamine, propofol et thiopental.
Mise en charge : défaillance biventriculaire habituelle (dobutamine, adrénaline-milrinone, levosimendan, NO), bradycardie fréquente (isoprénaline, pace-maker)
Médications importantes peropératoires : antibiothérapie prophylactique, immunosuppression, facteurs de coagulation
Survie moyenne: 80% à 5 ans et 70% à 10 ans |
© BETTEX D, BOEGLI Y, CHASSOT PG, Juin 2008, dernière mise à jour Mai 2018
Références
- ALMOND CS, HOEN H, ROSSANO JW, et al. Development and validation of a major advers transplant event (MATE) score to predict late graft loss in pediatric hesart transplantation. J Heart Lung Transplant 2017; 24:S1053
- ANDROPOULOS DA. Heart and lung transplantation : anesthetic considerations. In : BISSONNETTE B, edit. Pediatric anesthesia. Basic principles, State of the art, Future. Shelton (CO): People’s Medical Publishing House (USA), 2011, 1792-806
- BOUCEK MM, AURORA F, EDWARDS LB, et al. Registry of the International Society for Heart and Lung Transplantation: tenth official pediatric heart transplantation report - 2007. J Heart Lung Transplant 2007; 26:796-807
- CHIN C, NAFTEL D, PAHL E, et al. Cardiac re-transplantation in pediatrics: a multi-institutional study. J Heart Lung Transplant 2006; 25:1420-4
- CLARK JB, PAULIKS LB, MYERS JL, et al. Mechanical circulatory support for end-stage heart failure in repaired and palliated congenital heart disease. Curr Cardiol Rev 2011 ; 7 :102-9
- COPELAND H, RAZZOUK A, CHINNOCK R, et al. Pediatric recipient survival beyond 15 post-transplant years: a single-center experience. Ann Thorac Surg 2014; 98:2145-50
- KIM JJ, MARKS SD. Long-term outcomes of children after solid organ transplantation. Clinics 2014; 69: 28-38
- MARRONE C, FERRERO P, URICCHIO N, et al. The unnatural history of failing univentricular hearts: outcomes up to 25 years after heart transplantation. Interact Cardiovasc Thorac Surg 2017; 25:892-7
- NASR VG, DINARDO JA. The pediatric cardiac anesthesia handbook. Oxford: Wiley-Blackwell, 2017; 199-215
- TABARSI N, GUAN M, SIMMONDS J, et al. Meta-analysis of the effectiveness of heart transplantation in patients with a failing Fontan. Am J Cardiol 2017; 119:1269-74
- THRUSH PT, HOFFMAN TM. Pediatric heart transplantation – indications and outcomes in the current era. J Thorac Dis 2014; 6:1080-96
- URSCHEL S, LARSEN IM, KIRK R, et al. ABO-incompatible heart transplantation in early childhood: an international multicenter study of clinical experiences and limits. J Heart Lung Transpant 2013; 32:285-92
- VANDERLAAN RD, MANIHIOT C, EDWARDS LB, et al. Risk factors for specific causes of death following pediatric heart transplant: an analysis of the registry of the International Society of Heart and Lung Transplantation. Pediatr Transplant 2015; 19:896-506
