Actuellement, 0.1% des accouchements concerne des parturientes souffrant de cardiopathie congénitale symptomatique [22]. Ces femmes ont une mortalité 22 fois plus élevée et un taux de complications cardiovasculaires 10 fois plus haut que celles qui n'en souffrent pas (OR 22.1 et 10.54, respectivement) [22]. En moyenne, la mortalité maternelle est de 4.8%, mais elle varie considérablement selon les pathologies: de < 1% dans les cardiopathies bien tolérées jusqu'à 38% dans les cas d'hypertension pulmonaire sévère (HTAP) ou de cyanose importante (SaO2 < 85%) [1]. Le décès survient souvent plusieurs jours après la délivrance. Le taux de complications cardiovasculaires pendant la grossesse oscille entre 11% et 33% (moyenne 12%): décompensation cardiaque, cyanose, poussée d’HTAP, thrombo-embolie, AVC, arythmie, endocardite [6,11,20]. Celui des complications obstétricales voisine 30% [6,22]. La cyanose présente avant la grossesse est un facteur aggravant le pronostic: alors qu'il n'est que de 15% chez les femmes non cyanosées, le taux de morbi-mortalité peut dépasser 50% lorsque la cyanose est marquée [6].
Environ 28% des nouveaux-nés souffrent d’un problème majeur : prématurité, faible poids de naissance, mort in utero ou décès périnatal [11]. La mortalité infantile moyenne est de 4%; elle s’élève jusqu’à 40-65% dans les cardiopathies cyanogènes sévères et le syndrome d’Eisenmenger (hypertension pulmonaire fixée), proportionnellement au degré d'hypoxie de la mère [6,7,18]. Le taux moyen de prématurité est de 16-20%, ce qui est plus de quatre fois supérieur aux taux normaux dans les pays occidentaux; dans les pathologies sévères, la prématurité survient dans 22-65% des cas [4,6]. Les complications fœtales (prématurité, poids de naissance bas, fausse-couche et décès) sont proportionnelles au bas débit utérin et au degré de cyanose de la mère: lorsque la SaO2 maternelle est > 90%, le taux de survie fœtale est de 92%, mais lorsque la SaO2 est < 85%, il n'est plus que de 12% [12,18].
Les principaux facteurs indépendants déterminant le pronostic expriment la gravité de la pathologie [5,7,18].
- Anamnèse d'événement cardiaque ou d’arythmie majeure;
- Insuffisance fonctionnelle de degré NYHA III-IV;
- Cyanose et hypoxie (SaO2 ≤ 90% au repos, Hb > 150 g/L avant la grossesse);
- Hypertension pulmonaire (PAPmoy > 35 mmHg);
- Dysfonction du ventricule systémique, VD sous-aortique;
- Obstruction sévère de la voie d'éjection gauche.
L’HTAP et la cyanose sévères sont donc une indication à un avortement thérapeutique en début de grossesse (Tableau 15.12) [21]. La transmission génétique à la descendance de la même maladie qu’un des parents est de 2-4% en moyenne, mais de 8% lors de CIV, de 15% lors de sténose aortique et de 50% lors de Marfan [23]. La contraception doit être basée sur des pilules à base de progestérone, car les oestrogènes comportent trop de risque de thrombo-embolie [2,3,23].
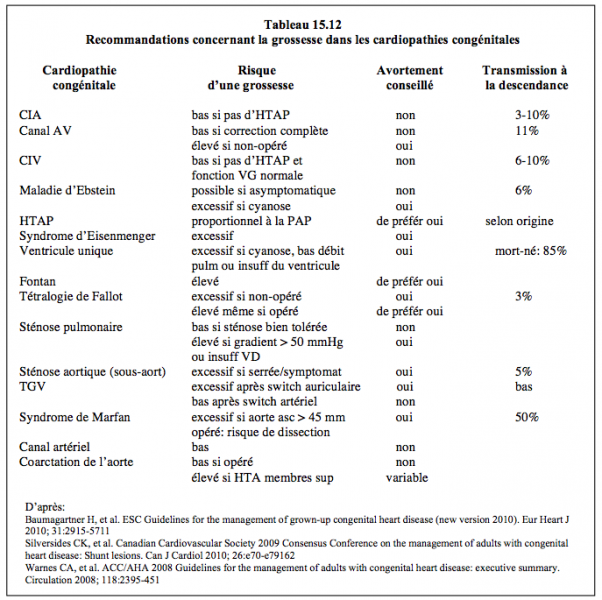
La grossesse provoque des modifications hémodynamiques importantes: le volume circulant augmente (+ 50%), les RAS baissent, le débit et la fréquence cardiaques s’élèvent (+ 30-40%) (voir Chapitre 22, Hémodynamique maternelle). Cette situation affecte considérablement les cardiopathies congénitales, mais induit des risques variables selon les pathologies (Tableau 15.13). Un shunt non-cyanogène G-D est en général bien toléré pour autant que la fonction ventriculaire gauche soit conservée et que la pression pulmonaire soit encore normale. Lorsqu’ils sont importants, toutefois, les shunts G-D peuvent décompenser le VG et s’accompagner d’hypertension artérielle pulmonaire (HTAP) ; dans ce cas, c’est le degré d’HTAP qui domine le pronostic [16]. Un shunt cyanogène D-G est augmenté par le stress du travail et de l'accouchement parce que les RAP augmentent sous l'effet de la décharge sympathique. En cas d'HTAP, les RAP sont fixes et ne baissent pas avec la vasodilatation artérielle de la grossesse; la composante D-G du shunt va augmenter et la malade se cyanoser; la mortalité maternelle en présence d'HTAP est de 30-70% selon les pathologies [24]. Elle survient souvent plusieurs jours après la délivrance [17]. Dans les lésions où le débit cardiaque est diminué par une sténose éjectionnelle, comme dans la coarctation de l'aorte, l'augmentation du débit cardiaque de la grossesse ne peut se faire que par le biais d'une élévation de la fréquence cardiaque, parce que le volume systolique ne peut pas augmenter; il faut éviter toute bradycardie chez ces patientes [14].

Hormis des dilatations de l'aorte ascendante, qui requièrent une césarienne, l'accouchement par voie basse est possible pour la plupart des cardiopathies congénitales, mais la décision reste fonction des pathologies et de l'éventuelle souffrance foetale. D'une manière générale, la phase de travail active avec ses manœuvres de Valsalva et ses autotransfusions à chaque contraction est potentiellement dangereuse; il est préférable d'accélérer le travail par forceps ou ventouse. L'analgésie péridurale est capitale pour limiter les décharges de catécholamines et assurer une stabilité hémodynamique, à la condition de procéder à une installation lente du bloc. L'addition d'un opiacé renforce l'effet antalgique et réduit les perturbations circulatoires par rapport à un anesthésique local seul; il est prudent de ne pas adjoindre d'adrénaline. La rachianesthésie, par contre, fait chuter brusquement les résistances artérielles systémiques et diminue la précharge de manière abrupte, ce qui est mal toléré dans les situations où la vasodilatation artérielle systémique aggrave la situation, comme en cas de shunt D-G et de shunt bi-directionnel avec hypertension artérielle pulmonaire ou sténose pulmonaire. Par contre, elle est recommandée dans les situations où il faut plutôt baisser les RAS comme les shunts G-D (CIA, CIV, canal artériel) [8,10]. Manipulée avec doigté, la combinaison rachi-péridurale est concevable si les RAS sont bien maintenues [8]. Lors d'HTAP ou de situations où il est souhaitable de baisser les RAP, une anesthésie générale avec hyperventilation et nébulisation de vasodilatateurs par inhalation est avantageuse; toutefois, une anesthésie péridurale avec un bloc d'installation très progressive donne d'excellents résultats, pour autant que la précharge du VD et les RAS soient correctement maintenues [8,13].
La SpO2 renseigne sur le degré de shunt D-G. Un cathéter artériel et une voie centrale (PVC) sont utiles pour ajuster les vasopresseurs et la volémie nécessaires au maintien de la pression de perfusion utérine et à l'équilibre d'un shunt D-G ou de la potentielle défaillance droite en cas d'hypertension pulmonaire. Chez les mères cyanosées, l'apport d'O2 et les RAS doivent être suffisants pour assurer la SaO2 la plus haute possible. La précharge peut varier considérablement au cours d'une délivrance: elle augmente brusquement par autotransfusion maternelle à chaque contraction utérine, et baisse dangereusement en cas d'hémorragie. Ces variations sont mal tolérées chez les congénitaux pour plusieurs raisons: une sténose limite le débit, une dysfonction ventriculaire empêche l'adaptation aux variations de volémie, un shunt soustrait une partie du volume circulant à la circulation systémique, une hypertension pulmonaire maintient un débit pulmonaire fixe et bas. L'hypovolémie se traduit alors par une désaturation artérielle.
Alors que la grossesse et l'accouchement se déroulent en général de manière aisée dans les affections de classe I et II (voir Tableau 15.13 et Chapitre 22, Catégories), il est capital que les patientes souffrant de pathologies graves (classe > II) soient suivies dans des centres spécialisés qui offrent toutes les compétences nécessaires en obstétrique, en anesthésie et en cardiologie congénitale [2,4,8,18].
Anesthésie pour les affections principales
Les recommandations peuvent être résumées brièvement (voir Tableau 15.10) (pour les détails, voir Chapitre 22 Cardiopathies congénitales) [10,14,17].
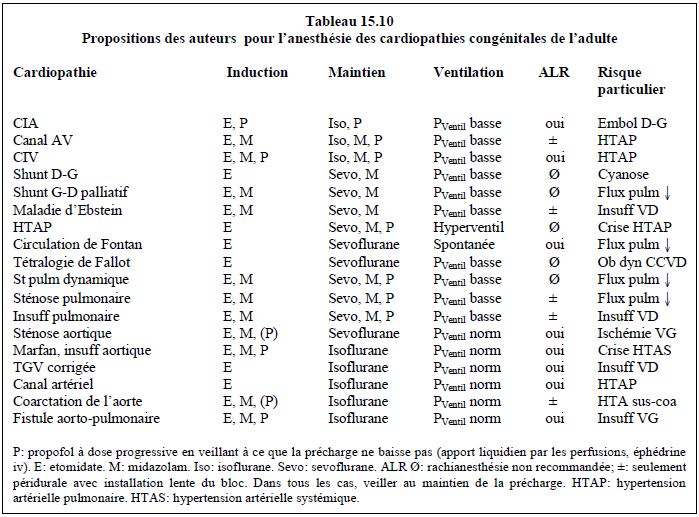
- CIA, CIV et tout shunt G-D simple: éviter toute augmentation des RAS ; la vasodilatation de la grossesse leur est favorable. Anesthésie rachidienne (péridurale et intrathécale) recommandée pour l'accouchement par voie basse et pour la césarienne; anesthésie générale possible pour la césarienne.
- Tétralogie de Fallot, shunt D-G: la baisse des RAS et le travail de l’accouchement aggravent la cyanose et sont responsables d’une hypoxémie fœtale. En cas d'hypovolémie, la composante D-G du shunt augmente, comme lors d'une baisse de pression systémique. L'anesthésie générale est préférée; halogéné avec esmolol et néosynéphrine en cas de crise hypoxique. La péridurale est possible avec une installation très progressive du bloc et un maintien de la précharge du VD et des RAS. La rachianesthésie est déconseillée (baisse excessive des RAS). En cas de crise hypoxique, on administre de l'esmolol pour diminuer la sténose dynamique de la CCVD et de la phényléphrine ou de la noradrénaline pour augmenter le débit pulmonaire par la CIV et les collatérales.
- Shunt palliatif ou correctif (Blalock-Taussig, Waterston): éviter la baisse des RAS, car elles déterminent le débit pulmonaire. Anesthésie générale recommandée; la péridurale est possible si l'installation du bloc est très progressive et la sympathicolyse minimale.
- Syndrome d'Eisenmenger (HTAP fixée): le débit pulmonaire est fixe et ne peut pas suivre une augmentation de la demande en O2. L’élévation du volume circulant augmente encore la PAP; la baisse des RAS aggrave la cyanose (augmentation de la composante D-G du shunt). La péridurale avec installation lente du bloc de manière à éviter la baisse des RAS est généralement préférée à l'anesthésie générale, qui a donné de moins bons résultats dans plusieurs séries [15]. La rachi-anesthésie est déconseillée [19]. Néanmoins, l'anesthésie générale permet l'hyperventilation (baisse des RAP par hypocapnie) et l'administration de vasodilatateurs pulmonaires par inhalation (NO, prostaglandines); comme le VD est hypertrophié à cause de la PAP élevée, l'augmentation de postcharge représentée par la ventilation en pression positive est négligeable. Il faut éviter tout ce qui augmente les RAP (hypoxémie, hypercarbie, douleur, acidose, hypothermie, N2O, desflurane) et maintenir les RAS élevées (noradrénaline). L'oxytocine augmente les RAP et baisse les RAS; comme tous les utérotoniques, elle doit être administrée avec infiniment de précaution (perfusion < 2 UI/min) et jamais en bolus [19].
- Circulation de Fontan: ce type de circulation s'accommode difficilement des exigences hémodynamiques de la grossesse; le taux de complications maternelles est de 10% et celui de fausses-couches de 30-50% [7,8]. La PVC doit rester élevée (précharge haute, volémie maintenue); la pression intrathoracique doit rester basse. La loco-régionale est clairement préférable à l'anesthésie générale (respiration spontanée). Vu le risque thrombotique, les malades sont en général anticoagulées. Toute augmentation des RAP est à éviter; les analogues de la prostaglandine sont proscrits et l'oxytocine ne doit être administrée qu'en perfusion très lente.
- Coarctation de l'aorte: maintenir la tachycardie et les résistances artérielles (RAS élevées). Anesthésie générale recommandée pour la césarienne; l'anesthésie péridurale est éventuellement possible pour un accouchement par voie basse; la rachi-anesthésie est contre-indiquée à cause de la baisse des RAS. Prévoir un cathéter artériel post-ductal pour surveiller la pression artérielle distale à la coarctation, puisqu’elle détermine la pression du système utéro-placentaire.
- Bicuspidie et anévrysme de l’aorte (syndrome de Marfan) : la poussée hypertensive du travail fait courir un grand risque de rupture ou de dissection. Un accouchement par voie basse sous péridurale et travail accéléré est possible lorsque le diamètre de l'aorte est < 40 mm (Marfan) ou < 45 mm (bicuspidie). Si la dilatation de l'aorte ascendante est supérieure à ces chiffres ou a augmenté en cours de grossesse, une césarienne sous AG est recommandée pour stabiliser la pression artérielle [9].
| Cardiopathies congénitales et grossesse |
|
Facteurs de mauvais pronostic:
- Anamnèse d'événement cardiaque ou d'arythmie majeure
- Status fonctionnel NYHA III-IV
- Hypoxie et cyanose : SaO2 ≤ 85% au repos, Hb > 150 g/L
- Hypertension pulmonaire: PAPmoy > 35 mmHg
- Dysfonction ventriculaire, VD systémique
- Obstruction sévère à l’éjection
Préférence pour l’anesthésie lors de l'accouchement:
- Shunt G-D : anesthésie rachidienne (rachianesthésie ou péridurale)
- Shunt D-G : anesthésie générale, péridurale* avec bloc très lent + vasoconstricteur
- Shunt palliatif G-D : anesthésie générale, péridurale* avec bloc lent + vasoconstricteur
- HTAP : anesthésie générale avec hyperventilation, péridurale* avec bloc lent + vasoconstr
- Sténose aortique, coarctation : anesthésie générale, péridurale* avec bloc lent + vasoconstr
- Circulation de Fontan: respiration spontanée, ALR rachidienne + maintien précharge
- Dilatation de l'aorte + IA: césarienne sous AG
- Maintien d’une précharge adéquate
- *: rachianesthésie déconseillée
|
© BETTEX D, CHASSOT PG, Janvier 2008, dernière mise à jour Décembre 2019
Références
- BAEHNER T, ELLERKMANN RK. Anesthesia in adults with congenital heart disease. Curr Opin Anaesthesiol 2017; 30:418-25
- BAUMGARTNER H, BONHOEFFER P, DE GROOT NMS, et al. ESC Guidelines for the management of grown-up congenital heart disease (new version 2010). Eur Heart J 2010; 31:2915-57
- BOUCHARDY J, PRÊTRE R. Cardiopathies congénitales: ptrise en charge du patient adulte. Forum Med Suisse 2014; 14:311-3
- BRICKNER E. Cardiovascular management in pregnancy: congenital heart disease. Circulation 2014; 130:273-82
- CHANDRASEKHAR S, COOK CR, COLLARD CD. Cardiac surgery in the parturient. Anesth Analg 2009; 108:777-85
- DRENTHEN W, PIEPER PG, ROOS-HESSELINK JW, et al. Outcome of pregnancy in women with congenital heart disease: a literature review. J Am Coll Cardiol 2007; 49:2303-11
- ELKAYAM U, GOLAND S, PIEPER PG, SILVERSIDES CK. High-risk cardiac disease in pregnancy. Part II. J Am Coll Cardiol 2016; 68:502-16
- FERNANDES SM, ARENDT KW, LANDZBERG MJ, et al. Pregnant women with congenital heart disease: cardiac, anesthetic and obstetrical implications. Expert Rev Cardiovasc Ther 2010; 8:439-48
- GOLAND S, BARAKAT M, KHATRI N, et al. Pregnancy in Marfan syndrome: maternal and fetal risk and recommendations for patient assessment and management. Cardiol Rev 2009; 17:253-62
- GOMAR C, ERRANDO CL. Neuroaxial anaesthesia in obstetrical patients with cardiac disease. Curr Opin Anaesthesiol 2005; 18:507-12
- KHAIRY P, OUYANG DW, FERNANDES SM, et al. Pregnancy outcomes in women with congenital heart disease. Circulation 2006; 113:517-24
- KOWALIK E, KLISIEWICZ A, BIERNACKA EK, et al. Pregnancy and long-term cardiovascular outcome in women with congenitally corrected transposition of the great arteries. Int J Gynaecol Obstet 2014; 125:154-7
- MARTIN JT, TAUTZ TJ, ANTOGNINI JF. Safety of regional anesthesia in Eisenmenger's syndrome. Reg Anesth Pain Med 2002; 27:509-13
- OSIBAMIRO-SEDUN A, JOHNSON C. Cardiac considerations for the obstetric patient. Sem Cardiothorac Vasc Anesth 2003; 7:167-73
- PIEPER PG, LAMEIJER H, HOENDERMIS ES. Pregnancy and pulmonary hypertension. Best Pract Res Clin Obstet Gynaecol 2014; 28:579-91
- PITKIN RM, PERLOFF JK, KOOS BJ, BEALL MH. Pregnancy and congenital heart disease. Ann Int Med 1990; 112:445-54
- RAY P, MURPHY GJ, SHUTT LE. Recognition and management of maternal cardiac disease in pregnancy. Br J Anaesth 2004; 93:428-39
- REGITZ-ZAGROSEK V, ROOS-HESSELINK JW, BAUERSACHS J, et al. 2018 ESC Guidelines on the management of cardiovascular disease during pregnancy. Eur Heart J 2018; 39:3165-241
- REX S, DEVROE S. Anesthesia for pregnant women with pulmonary hypertension. Curr Opin Anaesthesiol 2016; 29:273-81
- ROUINE-RAPP K, RUSSELL IA, FOSTER E. Congenital heart disease in the adult. Int Anesthesiol Clin 2012; 50:16-39
- STOUT KK, DANIELS CJ, VALENTE AM, et al. 2018 AHA/ACC Guideline for the management of adults with congenital heart disease. J Am Coll Cardiol 2019; 73:e81-192
- THOMPSON JL, KUKLINA EV, BATEMAN BT, et al. Medical and obstetric outcomes among pregnant women with congenital heart disease. Obstet Gynecol 2015; 126:346-54
- WARNES CA, WILLIAMS RG, BASHORE TM, et al. ACC/AHA 2008 Guidelines for the management of adults with congenital heart disease: executive summary. Circulation 2008; 118:2395-451
- WEISS BM, ZEMP L, SEIFERT B, HESS OM. Outome of pulmonary vascular disease in prenancy: a systematic overview from 1978 through 1996. J Am Coll Cardiol 1998; 31:1650-7
