Tous les agents d'anesthésie intraveineux sont responsables d'une baisse des performances hémodynamiques proportionnelle à leur dosage. Si la kétamine y fait exception, c'est à cause d'une forte stimulation sympathique centrale; lorsque cette dernière est absente, la kétamine a un effet cardiodépresseur important. D'une manière générale, les agents habituellement utilisés en anesthésie cardiaque (étomidate, midazolam, propofol, fentanils) ont des effets inotropes négatifs peu marqués; les modifications hémodynamiques sont plutôt liées aux effets de ces substances sur les mécanismes de contrôle vasomoteur central, sur la précharge et sur la postcharge (Tableau 4.3) [13].
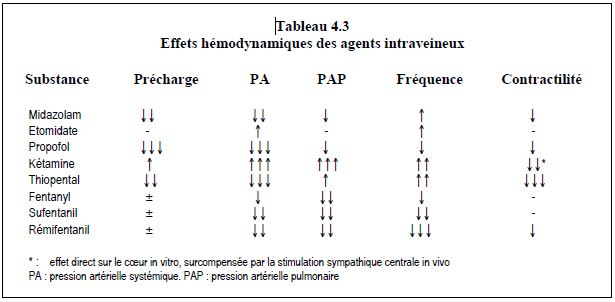
L'association d'un hypno-inducteur et d'un opiacé (propofol ou midazolam + fentanil) potentialise considérablement la dépression cardiocirculatoire, alors que chaque substance administrée séparément a peu d'effet. Par exemple, la pression artérielle systolique baisse de 25 mmHg avec du propofol pur et de 50 mmHg avec la combinaison propofol + fentanyl [5]. A dose équimolaire, le thiopental est l'agent qui inhibe le plus fortement la fonction myocardique; le propofol et le midazolam ont une position intermédiaire, alors que l'étomidate est certainement l'agent qui perturbe le moins l'hémodynamique (Figure 4.12 et Figure 4.13).
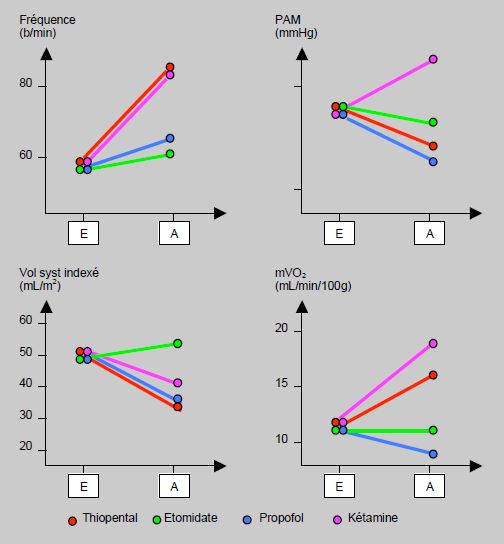
Figure 4.12: Effets hémodynamiques des agents d'induction intraveineux. E: patient éveillé avant l'induction; A: patient anesthésié après l'induction. Le minimum de perturbation est obtenu avec l’etomidate. Par ordre croissant d’effet hémodynamique: etomidate < propofol < kétamine < thiopental [d'après référence 13].
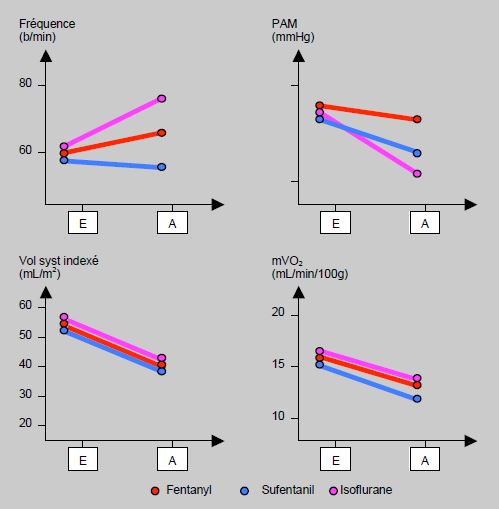
Figure 4.13: Effets hémodynamiques de l'isoflurane et des opiacés. E: patient éveillé avant l'induction; A: patient anesthésié après l'induction [d'après référence 13].
Les concentrations plasmatiques nécessaires à obtenir le sommeil sont très différentes pour chaque agent, passant de 3 micromoles/mL pour l'étomidate à 50 micromoles/mL pour le propofol et 100 pour le thiopental [13]. Le sommeil lui-même s'accompagne d'une baisse de l'activité sympathique centrale qui diminue invariablement les performances hémodynamiques, mais qui réduit aussi les besoins métaboliques de l'organisme. Dans ces conditions, l'équilibre est maintenu, même si le débit cardiaque est abaissé (IC < 2 L/min/m2). Mais cet équilibre est rompu en dessous d'un certain seuil, ce qui se traduit par la modification de plusieurs marqueurs, qui représentent autant de signaux d'alarme.
- Baisse du débit cardiaque: ↓ SvO2, ↑ lactate;
- Hypotension artérielle: ↓ saturation cérébrale (ScO2), ↓ segment ST, ↓ diurèse;
- Péjoration du rapport DO2/VO2 myocardique: modifications du segment ST, altérations de la cinétique segmentaire;
- Dépression myocardique: ↓ fraction d'éjection, dilatation ventriculaire.
Aucun des agents intraveineux n'a d'effet protecteur significatif sur le myocarde. Seuls les halogénés présentent une certaine capacité à diminuer les effets de l'ischémie myocardique (préconditionnement).
Midazolam
Le midazolam (Dormicum®) est très populaire comme agent d'induction et de maintien du sommeil, notamment à cause de l'amnésie qu'il occasionne. Cependant, son activité hypnogène est prolongée, retardant ainsi le délai d’extubation. De plus, il favorise le délire postopératoire. Comme toutes les benzodiazépines, il provoque une anxiolyse à faible dose, une sédation à dose plus importante, et le sommeil lorsque plus de 60% des récepteurs sont occupés. Il induit une sympathicolyse centrale associée à une baisse des catécholamines circulantes. Ses effets hémodynamiques, peu marqués en soi, deviennent significatifs en association avec un fentanil ou dans les situations où l’équilibre hémodynamique est très dépendant de la stimulation sympathique. Le pic de l'effet est atteint en 3 minutes [22].
- Diminution du tonus sympathique central: ↓↓ précharge, ↓ postcharge, ↓ DC; elle est d'autant plus délétère que le patient maintient son équilibre par cette stimulation neuro-humorale (insuffisance ventriculaire, choc cardiogène).
- Comme l'effet le plus important est la baisse de précharge, l'hypotension est beaucoup plus sévère si le malade est hypovolémique ou s'il dépend de la précharge pour maintenir son volume systolique (insuffisance diastolique, HVG, valvulopathie).
- Le midazolam provoque un abaissement simultané et parallèle du flux coronaire (- 24%) et de la mVO2 (- 26%) à 0.2 mg/kg; il ne modifie donc ni l'autorégulation coronarienne ni l’équilibre DO2/VO2 myocardique.
- La dose prescrite pour l'induction (0.3 mg/kg) abaisse la précharge (- 25%), les RAS (- 10%) et le dP/dt (- 10%); la pression artérielle et le volume systolique diminuent de 20%; il peut s'ensuivre une tachycardie réflexe. Une dose sédative (0.05 mg/kg) est sans effet hémodynamique significatif.
- Utilisation optimale en anesthésie cardiaque:
- Sédation pour cathétérisme artériel: 1-3 mg iv;
- Appoint à l'induction: 0.05-0.1 mg/kg;
- Induction : 0.2-0.3 mg/kg ;
- Maintien du sommeil en cours d'opération: bolus 0.1-0.2 mg/kg ou perfusion 1.0-2.0 mcg/kg/h ;
- Doses hypnogènes dès le réchauffement de la CEC: 5-15 mg.
Comme agent d'anesthésie, le midazolam exclut la possibilité de réveil rapide (fast-track). Il est plutôt réservé aux cas complexes nécessitant une ventilation postopératoire prolongée ou une assistance circulatoire.
Etomidate
L'étomidate (Hypnomidate®, Etomidat Lipuro®) ne provoque aucune altération significative, ni dans l'hémodynamique, ni dans l'équilibre DO2/VO2 myocardique. C'est l'inducteur de premier choix pour toutes les situations où la stabilité hémodynamique doit être garantie : valvulopathies décompensées, dysfonction ventriculaire, choc cardiogène, hypovolémie, etc (voir Figure 4.12 et Tableau 4.3) [30]. Le maintien de la réactivité sympathique et des baroréflexes est un avantage incontestable, mais il se double de l'inconvénient de ne pas amortir les poussées hypertensives secondaires à l'intubation, à la douleur ou à la stimulation chirurgicale viscérale. Une dose d’induction de 0.3 mg/kg ne provoque une apnée que dans 50% de la population ; de ce fait, la moitié des patients continue de ventiler malgré l'apparition du sommeil. D'autre part, l’étomidate provoque une stimulation extrapyramidale caractérisée par des mouvements athétosiques et une rigidité musculaire. Cet effet est atténué si l'étomidate est précédé d'un fentanil, mais il peut donner l’impression que le malade ne dort pas, alors qu’il survient précisément lorsque les taux intra-cérébraux de la substance sont suffisants pour induire le sommeil. L’étomidate abaisse la pression intracrânienne, ne présente aucune réaction allergique et ne libère pas d’histamine.
Le pic d'activité survient < 1 minute après l'administration intraveineuse de 0.3 mg/kg; la redistribution rapide de la substance, reflétée par son large volume de distribution apparente (5 L/kg), lui assure un effet clinique très court (2-3 minutes); ceci implique de répéter la dose d'induction avant l'intubation si l’on utilise un myorelaxant autre que le suxaméthonium ou le recuronium à double dose.
- A la posologie d'induction (0.15-0.3 mg/kg), l'étomidate ne modifie aucun des paramètres hémodynamiques usuels de manière significative (PA, VS, DC, RAS, RAP, PVC, PAPO) [24]; cependant, en cas d'association à de hautes doses d'opiacés, ces valeurs peuvent être abaissées momentanément de 10 à 15% [36].
- En comparaison avec le propofol, l'étomidate diminue d'un tiers le taux d'hypotension à l'induction et réduit de moitié l'utilisation de vasopresseurs [12].
- Un discret effet inotrope négatif a été trouvé chez l'animal pour des doses 10 fois supérieures aux doses cliniques [18]; cet effet, identique chez le coeur sain et le coeur défaillant, est totalement réversible par une stimulation béta; il est donc sans signification clinique.
- L'équilibre entre l'apport et la consommation d'O2 myocardique n'est pas altéré; il existe un léger effet vasodilatateur coronarien de type nitré.
- Utilisation optimale:
- Induction de l'anesthésie: 0.15-0.3 mg/kg;
- Approfondissement rapide du sommeil en cas de besoin soudain.
Le défaut majeur de l'étomidate est un blocage de la 11-β-hydroxylase nécessaire à la synthèse du cortisol à partir du cholestérol. Après un bolus de 0.3 mg/kg, la réponse à l’ACTH est maximalement abaissée à la 4ème heure et reste déficiente pour une durée de 12-24 heures [2,6,34]. Cet effet est cumulatif et dose-dépendant, mais entièrement réversible au-delà de 24 heures. Même chez les patients en état critique, cette insuffisance cortico-surrénalienne ne s’accompagne généralement ni d’une augmentation des besoins en agent vasopresseur [4,24], ni d'une aggravation du pronostic [15]. Si la déficience surrénalienne a une traduction clinique, une substitution avec 100 mg d’hydrocortisone (Solucortef®) toutes les 8 heures compense la dysfonction surrénalienne. Cette dépression de l’axe cortico-surrénalien a été découverte en premier lieu avec les doses itératives et les perfusions continues, mais elle survient déjà avec une seule dose d’induction [40]. Elle a fait couler beaucoup d'encre, parce que certains travaux rétrospectifs tendent à montrer qu'elle est associée à une aggravation des épisodes septiques, de l’incidence d’insuffisance polyorganique et parfois de la mortalité, notamment chez les patients de soins intensifs [16,21]. De plus, la corticothérapie ne semble pas modifier le pronostic dans ces cas [27]. Cependant, les principaux essais randomisés et contrôlés démontrent que la dépression surrénalienne due à l'étomidate n'est pas associée à une hypotension réclamant des vasoconstricteurs, ni à une prolongation de l'assistance ventilatoire, ni à une surmortalité, que ce soit à l'induction en chirurgie cardiaque ou lors d'intubation aux soins intensifs, y compris chez des patients septiques [14,23,39]. L'étude la plus récente (130 cas de chirurgie cardiaque randomisés etomidate ou propofol) ne montre aucune différence dans les besoins en vasopresseurs, ni dans la durée de la ventilation, ni dans la mortalité à 30 jours; dans la chirurgie valvulaire, l'utilisation de vasopresseurs est légèrement supérieure dans le groupe propofol [4]. De plus, 12-57% des patients sous propofol, thiopental, kétamine ou midazolam présentent également une dépression cortico-surrénalienne [4,17,24]. L'étomidate n'est pas non plus asssocié à une augmentation d'incidence de la fibrillation auriculaire [20].
L’étomidate est l’hypno-inducteur de premier choix dans les situations où l’hémodynamique est instable, quoique son usage soit discuté en cas de sepsis [25]. Son indication est basée sur une pondération des risques entre le danger d'un effondrement cardiocirculatoire à l'induction et celui d'un hypocorticisme iatrogène. Comparé à la kétamine ou au propofol, l’étomidate ne modifie pas la morbidité postopératoire, mais est associé à une plus grande stabilité hémodynamique [9,10,13,15,21,24]. Il reste la meilleure option pour l'induction des cas instables ou fragiles en chirurgie cardiaque [39]. Deux nouveaux dérivés sont testés actuellement, le carbo-étomidate et le méthoxycarbonyl-étomidate [1] ; leur particularité est de conserver les effets anesthésiants et la stabilité hémodynamique mais d’être dépourvu d’inhibition cortico-surrénalienne. Le second (ABP-700) est déjà en essai clinique (dose d'hypno-induction: 0.3 mg/kg); il est aussi stable que l'etomidate du point de vue hémodynamique, mais ne modifie aucunement la réponse à la stimulation par l'ACTH; il induit le sommeil en 30 secondes, puis est rapidement hydrolysé par les estérases sériques [37].
Propofol
Le propofol (Propofol Fresenius®) permet d’assurer l’induction et le maintien de l’anesthésie avec la même substance. Il a pris de plus en plus de place en anesthésie cardiaque avec la volonté de raccourcir la prise en charge en soins intensifs. Son intérêt majeur tient à ses capacités d'assurer un réveil rapide après une perfusion continue (demi-vie contextuelle: 6-10 minutes) et une extubation précoce dans des conditions confortables pour le malade. Son utilisation assure une continuité parfaite entre le sommeil en salle d'opération et la sédation aux soins intensifs. A l'induction, la combinaison d’une baisse de précharge (↓↓↓), de postcharge (↓↓) et de contractilité (↓) diminue la pression artérielle de 15 à 40% lors de l'administration de 1.0 - 2.5 mg/kg de propofol. Le mécanisme est lié à un effet vasodilatateur veineux important et artériel moins marqué, à un frein de la cardio-accélération et à une réduction de l'activité sympathique centrale [19,33]. De ce fait, le propofol est mal adapté aux patients dont l'équilibre hémodynamique est dépendant de la précharge (hypertrophie ventriculaire, insuffisance diastolique, valvulopathies) et du tonus sympathique (insuffisance systolique, valvulopathies décompensées). La baisse de pression systémique peut compromettre la pression de perfusion coronarienne chez le patient ischémique (Figure 4.12 et Tableau 4.3). Le pic de l'effet a lieu de < 1 à 2.5 minutes selon la dose et la vitesse d’injection.
- Baisse de la précharge: dans la baisse du volume d'éjection systolique (-20%), la vénodilatation centrale a beaucoup plus d'importance que l'effet inotrope négatif, qui est faible [8,35]. La variation respiratoire du volume systolique augmente de 30% à cause de la baisse du retour veineux [8]; le retentissement cardiocirculatoire du propofol est analogue à une hypovolémie soudaine, donc très dépendant de la volémie préalable du patient [26].
- Baisse de la postcharge: les RAS diminuent modérément; l'effet est maximal à la troisième minute ; il a davantage de retentissement en cas d'hypovolémie.
- Effet inotrope négatif faible: baisse de 10% du dP/dt lorsque le propofol est utilisé seul chez l'individu sain, plus marquée en cas d'association aux opiacés ou au N2O. Cet effet est dépendant de la dose et de la vitesse d'injection; il devient très significatif chez le patient âgé et en cas d'insuffisance ventriculaire [28]. Le VD y est particulièrement sensible: son Emax baisse de 45% [3]. Sur le myocarde isolé, la baisse de contractilité, variable selon les espèces animales, est plus importante que celle provoquée par l'étomidate mais inférieure à celle du thiopental [3,36]; l'hypoxie et l'ischémie renforcent cet effet [31].
- La baisse de précharge, de postcharge et de contractilité est potentialisée par la faible tachycardie compensatrice due au resetting du baroréflexe: la fréquence reste inchangée à des valeurs de pressions déjà basses. De plus, l'activité du système autonome sympathique est significativement déprimée [10].
- L'interaction avec les opiacés potentialise la vasodilatation des vaisseaux de résistance et de capacitance; l'effet hypotenseur est accentué. Les malades ayant une mauvaise fonction ventriculaire y sont plus sensibles que les patients sains [11].
- La baisse des conditions de charge ventriculaire diminue la consommation d'O2 du myocarde (-31%) et le flux coronaire (-26%); pour autant que la chute de la PAM ne compromette pas la perfusion coronarienne, l'autorégulation est préservée; le métabolisme myocardique n'est pas altéré [38]. L'absence de tachycardie est un avantage important dans les cas de coronaropathies. Cependant, lors d'hypovolémie, le propofol diminue la perfusion coronaire au-delà de la baisse de la mVO2. Il n'a pas d'effet protecteur myocardique de type préconditionnement.
- Bien que d'installation moins brutale, les modifications hémodynamiques induites par la perfusion continue (5 - 10 mg/kg/heure) sont superposables à celles du bolus d'induction.
- Utilisation optimale en anesthésie cardiaque:
- Induction par administration intraveineuse lente chez les patients hémodynamiquement stables avec fonction ventriculaire conservée.
- La dose d'induction standard (2.0-2.5 mg/kg) est diminuée de préférence à 0.5-1.5 mg/kg à raison de 30-40 mg/10 secondes, puis perfusion.
- Perfusion d'entretien pendant l'opération (5-12 mg/kg/heure, basé sur le poids du corps effectif), notamment dans les cas susceptibles d'être extubés dans un bref délai.
- Anesthésie iv à objectif de concentration (AIVOC) : la valeur-cible est 2-6 ng/mL à l’induction et 1-3 ng/mL pour l’entretien.
- Sédation postopératoire.
L'équilibre hémodynamique des malades souffrant de cardiopathie sévère dépend étroitement du tonus sympathique et des conditions de charge ventriculaire. Même s'il modifie peu la contractilité, le propofol est réservé préférentiellement aux cas normovolémiques, sans dysfonction systolique ni diastolique, et sans ischémie active. La baisse de précharge est un problème en cas de valvulopathie. L'administration doit être titrée de manière très progressive. Les concentrations-cibles de l’AIVOC correspondent aux valeurs basses des doses recommandées, telles qu’elles ont été définies pour des interventions de chirurgie générale, mais il n’existe aucun modèle fiable pour la CEC et la période post-CEC.
Barbituriques
Le thiopenthal (Pentothal®) est traditionnellement proscrit lorsque l’hémodynamique est compromise (Figure 4.12 et Tableau 4.3).
- Effet inotrope négatif: à une dose de 5 mg/kg, la fraction d'éjection baisse de 30% et le volume télédiastolique du VG augmente de 35% [7]. Cette baisse marquée et immédiate de la contractilité est dose-dépendante; elle est due à la diminution de la pénétration du Ca2+ dans la cellule pendant la phase de plateau du potentiel d'action. Les effets hémodynamiques dépresseurs sont particulièrement marqués chez les patients hypovolémiques ou en insuffisance cardiaque systolique et/ou diastolique.
- Baisse de la pression dans le système veineux capacitif et inhibition des baroréflexes: la pression de remplissage du VD diminue immédiatement; il y a séquestration liquidienne centrale. Cet effet est particulièrement à craindre chez les patients qu'une insuffisance diastolique rend extrêmement dépendants des conditions de remplissage; il est catastrophique en cas d'hypovolémie: le débit cardiaque chute de 69% [29]. Le β-blocage amplifie les effets de l'inhibition des baroréflexes.
- Effet chronotrope positif: accélération importante du rythme sinusal (10-35%) secondaire à une inhibition du système parasympathique et à une stimulation du système sympathique. Cette tachycardie importante provoque obligatoirement une augmentation de la mVO2, dangereuse pour le coronarien.
Son effet inotrope négatif, sa baisse de précharge et son blocage des baroréflexes font du thiopental un agent totalement inadapté au patient hémodynamiquement compromis. Dans un souci de sécurité, cette substance ne peut pas être recommandée de routine en anesthésie cardiaque.
Kétamine
La kétamine (Ketalar®) provoque une stimulation sympathique centrale caractérisée par une sécrétion augmentée de nor-adrénaline; elle est la cause d’une hypertension systémique (+ 40%) et pulmonaire (+ 45%), et d’une tachycardie importante (+ 50%). Même si le flux coronaire augmente parallèlement chez l'individu sain, l'élévation de la mVO2 occasionnée par ces deux phénomènes est largement excessive pour le patient coronarien (Figure 4.12 et Tableau 4.3). La kétamine a un effet inotrope négatif direct sur le myocarde qui est masqué par la stimulation sympathique, mais qui devient apparent en cas d'insuffisance cardiaque chronique et dans les situations où la réponse sympathique est inhibée, épuisée, ou déjà maximalement utilisée (patients de soins intensifs, cas septiques, par exemple) [32]. Bien qu'elle soit indiquée pour l'induction de patients en choc hypovolémique avec un cœur normal, la kétamine est contre-indiquée en cas de choc cardiogène (↓ contractilité), d'insuffisance ventriculaire (↑ postcharge), d'ischémie myocardique (↑ fréquence et postcharge) ou d’hypertension pulmonaire (↑ RAP). Elle peut être utile en appoint dans certains cas (potentialisation des hypnotiques et des opiacés) ou pour l’induction en cardio-pédiatrie.
- Utilisation optimale:
- Induction 1-2 mg/kg ;
- Appoint : 0.25 mg/kg; perfusion d'entretien: 10-45 mcg/kg/min.
| Effets hémodynamiques des agents d’anesthésie intraveineux |
|
Bien que chaque substance ait ses effets propres, les agents d’anesthésie provoquent en général un léger effet inotrope négatif, une baisse du tonus sympathique central, une modification de la précharge, de la postcharge et des baroréflexes. Tous abaissent les performances hémodynamiques mais diminuent aussi les besoins. Les effets cardiodépresseurs peuvent être masqués par une stimulation sympathique centrale (kétamine, N2O). Ils sont potentialisés par l’association avec des opiacés. La stabilité hémodynamique à l’induction avec les différents agents est par ordre décroissant : étomidate > midazolam > propofol > kétamine > thiopental.
Etomidate : pas de modifications hémodynamiques significatives, mais baisse de la synthèse de cortisol pour 12-24 heures (réversible) ; recommandé pour tous les cas complexes, instables ou en insuffisance ventriculaire. Pas de surmortalité ni de surmorbidité liée à l’insuffisance cortico-surrénalienne.
Midazolam : ↓↓ précharge, ↓ postcharge, ↓ DC du à la sympathicolyse centrale ; adéquat si doses progressives et induction lente, mais réveil prolongé.
Propofol : ↓↓↓ précharge, ↓↓ postcharge, ↓ contractilité, fréquence stable ; adéquat si doses progressives et induction lente chez malade hémodynamiquement stable et peu précharge-dépendants.
Thiopental : ↓↓ précharge, ↓ postcharge, ↓↓ contractilité, ↑ fréquence ; dangereux dans les cas instables ou en insuffisance ventriculaire ; le moins adapté à l’anesthésie cardiaque.
Kétamine : ↑ tonus sympathique central, ↑ RAS et RAP, ↑ fréquence, mais effet inotrope négatif propre important (apparaît en cas d’épuisement sympathique). Pas d’indications claires en-dehors de la pédiatrie.
|
© CHASSOT PG, BETTEX D, MARCUCCI C, Septembre 2010, dernière mise à jour, Septembre 2019
Références
- AUGOUSTIDES JGT. Integrating outcome benefit into anesthetic design: the promise of steroids and statins. J Cardiothorac Vasc Anesth 2011; 25:880-4
- AYA HD, CECCONI M, HAMILTON M, RHODES A. Goal-directed therapy in cardiac surgery: a systematic review and meta-analysis. Br J Anaesth 2013; 110:510-7
- AZARI DM, CORK RC. Comparative myocardial depressive effects of propofol and thiopental. Anesth Analg 1993; 77:324-9
- BASCIANI RM, RINDLISBACHER A, BEGERT E, et al. Anaesthetic induction with etomidate in cardiac surgery. A randomised controlled study. Eur J Anaesthesiol 2016; 33:417-24
- BILLARD V, MOULLA F, BOURGAIN JL, et al. Hemodynamic response to induction and intubation: propofol/fentanyl interaction. Anesthesiology 1994; 81:1384-93
- BRUTSAERT DL, SYS SU, GILLEBERT TC. Diastolic dysfunction in post-cardiac surgical management. J Cardiothor Vasc Anesth 1993; 7(suppl 1):18-20
- CORIAT P, PAMELA F, EVANS J, et al. Left ventricular function monitored by transesophageal 2-D echocardiography during induction of anesthesia. Anesthesiology 1986; 65:A26
- DE WIT F, VAN VLIET AL, DE WILDE RB, et al. The effect of propofol on hemodynamics: cardiac output, venous return, mean systemic filling pressure, and vascular resistances. Br J Anaesth 2016; 116:784-9
- EBERT TJ, KANITZ DD, KAMPINE JP. Inhibition of synpathetic neural outflow during thiopental anesthesia in humans. Anesth Analg 1990; 71:319-26
- EBERT TJ, MUZI M, BERENS R, et al. Sympathetic responses to induction of anesthesia in humans with propofol or etomidate. Anesthesiology 1992; 76:725-33
- HALL RI, MURPHY JT, LANDY-MORE R, et al. Myocardial metabolic changes during propofol anesthesia for cardiac surgery in patients with reduced ventricular function. Anesth Analg 1993;77:680-9
- HANNAM JA, MITCHELL SJ, CUMIN D, et al. Haemodynamic profiles of etomidate vs propofol for induction of anaesthesia: a randomised controlled trial in patients undergoing cardiac surgery. Br J Anaesth 2019; 122:198-205
- HOEFT A, BUHRE W. Anesthesia and the cardiovascular system. in: PRIEBE HJ, SKARVAN K. Cardiovascular physiology. London: BMJ Publishing Group, 1995, pp 272-306
- HOHL CM, KELLY-SMITH CH, YEUNG TC, et al. The effect of a bolus dose of etomidate on cortisol levels, mortality, and Health Services utilization: a systematic review. Ann Emerg Med 2010; 56:105-13
- JABRE P, COMBES X, LAPOSTOLLE F, et al. Etomidate versus ketamine for rapid sequence intubation in acutely ill patients: a multicentre randomized controlled trial. Lancet 2009; 374:293-300
- JACKSON WJ. Should we use etomidate as an induction agent for endotracheal intubation in patient with septic shock ? A critical appraisal. Chest 2005; 127:1031-8
- KENYON CJ, McNEIL LM, FRASER R. Comparison of the effects of etomidate, thiopentone and propofol on cortisol synthesis. Br J Anaesth 1985; 57:509-11
- KISSIN I, MOTOMURA S, AULTMANN DF, et al. Inotropic and anesthetic potencies of etomidate and thiopental in dogs. Anesth Analg 1983; 62:961-5
- KLOCKGETHER-RADKE AP, SCHULZE H, NEUMANN P, HELLIGE G. Activation of the K+ channel BKCa is involved in the relaxing effect of propofol on coronary arteries. Eur J Anaesthsiol 2004; 21:226-30
- KOMATSU R, MAKAROVA N, YOU J, et al. Etomidate and the risk of complications after cardiac surgery: a retrospective cohort analysis. J Cardiothorac Vasc Anesth 2016; 30:1516-22
- KOMATSU R, YOU J, MASCH EJ, et al. Anesthetic induction with etomidate, rather than propofol, is associated with increased 30-day mortality and cardiovascular morbidity after noncardiac surgery. Anesth Analg 2013; 117:1329-37
- MARTY J, NITENBERG A, BLANCET F. Effects of midazolam on the coronary circulation in patients with coronary artery disease. Anesthesiology 1986; 64:206
- McPHEE LC, BADAWI O, FRASER GL, et al. Single-dose etomidate is not associated with increased mortality in ICU patients with sepsis: analysis of a large electronic ICU database. Crit Care Med 2013; 41:774-83
- MOREL J, SALARD M, CASTELAIN C, et al. Haemodynamic consequences of etomidate administration in elective cardiac surgery: a randomized double-blind study. Br J Anaesth 2011; 107:503-9
- MURRAY H, MARIK PE. Etomidate for endotracheal intubation in sepsis: acknowledging the Good while accepting the Bad. Chest 2005; 127:707-8
- MUZI M, BERENS RA, KAMPINE JP, et al. Venodilatation contributes to propofol-mediated hypotension in humans. Anesth Analg 1992; 74:877-83
- PAYEN JF, DUPUIS C, TROUVE-BUISSON T, et al. Corticosteroid after etomidate in critically ill patients: A randomized controlled trial. Crit Care Med 2012; 40:29-35
- PEACOCK JE, LEWIS RP, TEILLY CS, et al. Effect of different rates of infusion of propofol for induction of anesthesia in elderly patients. Br J Anaesth 1990; 65:346-52
- PEDERSEN T, ENGBAEK J, KLAUSEN NO, et al. Effects of low-dose ketamine and thiopentone on cardiac performance and myocardial oxygen balance in high-risk patients. Acta Anaesthesiol Scand 1982; 26:235
- REICH DL, HOSSAIN S, KROL M, et al. Predictors of hypotension after induction of general anesthesia. Anesth Analg 2005; 101:622-8
- RIOU B, BESSE S, LECARPENTIER Y, et al. In vitro effects of propofol on rat myocardium. Anesthesiology 1992; 76:609-18
- RIOU B, LECARPENTIER Y, VIARS P. Inotropic effect of ketamine on rat cardiac papillary muscle. Anesthesiology 1989; 71:116-25
- ROBINSON BJ, EBERT TJ, O'BRIEN TJ, et al. Mechanisms whereby propofol mediates peripheral vasodilation in humans. Sympathoinhibition or direct vascular relaxation ? Anesthesiology 1997; 86:64-72
- SCHENARTS CL, BURTON JH, RIKER RR. Adrenocortical dysfunction following etomidate induction in emergency department patients. Academ Emeregency Med 2001; 8:1-7
- SCHMIDT C, ROOSENS C, STRUYS M, et al. Contractility in humans after coronary artery surgery. Echocardiographic assessment with preload-adjusted maximal power. Anesthesiology 1999; 91:58-70
- SPRUNG J, OGLETREE-HUGHES ML, MORAVEC CS. The effects of etomidate on the contractility of failing and nonfailing human heart muscle. Anesth Analg 2000; 91:68-75
- STRUYS MMRF, VALK BI, ELEVELD DJ, et al. A phase 1, single-center, double-blind, placebo-controlled study in healthy subjects to assess the safety, tolerability, clinical effects, and pharmacokinetics-phyrmacodynamics of intravenous cyclopropyl-methoxycarbonylmettomidate (ABP-700) after a single ascending bolus dose. Anesthesiology 2017; 127:20-35
- VERMEYEN KM, DE HERT SG, ERPELS FA, et al. Myocardial metabolism during anaesthesia with propofol-low dose fentanyl for coronary artery bypass surgery. Br J Anaesth 1991; 66:504-8
- WAGNER CE, BICK JS, JOHNSON D, et al. Etomidate use and postoperative outcomes among cardiac surgery patients. Anesthesiology 2014; 120:579-89
- WAGNER RL, WHITE PF. Etomidate inhibits adrenocortical function in surgical patients. Anesthesiology 1984; 61:647
