La transfusion sanguine fait l’objet d’un chapitre particulier (voir Chapitre 28) et ne sera abordée ici que sous trois aspects succincts : la gestion globale de l’épargne sanguine du patient (Patient blood management), les risques de la transfusion et les recommendations en chirurgie cardiaque.
Gestion globale de l’épargne sanguine
La transfusion sanguine n’est qu’une composante au sein d’une stratégie intégrée d’épargne sanguine qui considère le sang du malade comme un bien irremplaçable méritant une protection maximale. Elle repose sur une série de principes [5,9,25].
- Correction de l’anémie et/ou de la coagulopathie préopératoire;
- Economie des globules et facteurs de coagulation du patient, limitation des pertes sanguines;
- Seuils de transfusion restrictifs;
- Administration rationnelle et dirigée des produits sanguins;
- Utilisation d’algorithmes basés sur des examens de laboratoire réalisés en salle d’opération;
- Amélioration du DO2 tissulaire par optimisation hémodynamique et ventilatoire;
- Normothermie, normocalcémie, équilibre acido-basique.
Cette stratégie comprend de nombreuses mesures qui sont énumérées dans le Tableau 8.9 et détaillées dans le chapitre 28 (Stratégie globale de la gestion du sang) [2,8].

L'anémie préopératoire mérite une mention spéciale parce qu'elle est aussi facile à corriger qu'elle est dangereuse pour la survie. Une anémie modérée (100-120 g/L) est grevée d'une morbidité augmentée de 40% [25] et d'une mortalité augmentée de 16% [13]. Or elle est présente dans environ 30% des cas [13]. Le traitement préopératoire est simple, puisque la majeure partie des cas est due à une anémie ferriprive: fer, acide folique, vitamine B12, éventuellement EPO; la transfusion n'est pas une option cohérente, car un seul flacon augmente le risque périopératoire de 2-3 fois [24]. A cette anémie de départ, s'ajoute les pertes sanguines peropératoires et celles liées aux prélèvements pour les examens de laboratoire; ces derniers représentent en moyenne 450 mL en chirurgie cardiaque et 1'000 mL pour 2 semaines de soins intensifs [15].
Le but de la transfusion est d’améliorer le transport d’O2 vers les tissus (DO2), non de corriger le taux d’hémoglobine (Hb). Il se base sur le déséquilibre hémodynamique, sur le dysfonctionnement ischémique des organes et sur la réserve cardiopulmonaire du patient. Toutefois, l’Hb est un repère pratique qui reste très utilisé et qui permet de définir des critères simples. Pour autant que le malade soit normovolémique et la source d’hémorragie contrôlée, la transfusion est indiquée pour les valeurs d’Hb suivantes [1,2,3,4,12].
- Chez un individu sain dont l’hémodynamique est normale, la transfusion est indiquée si l’Hb est < 60 g/L.
- En périopératoire, une valeur d'Hb de 70-80 g/L est un seuil de transfusion raisonnable.
- Dans les populations à risque (ischémie coronarienne, insuffisance ventriculaire, AVC, néphropathie, âge avancé), le seuil de transfusion peut être relevé à 80-90 g/L ; il en est de même chez les patients fébriles, septiques ou souffrant de SDRA.
- Il est improbable que la transfusion améliore le DO2 lorsque l’Hb est ≥ 100 g/L, sauf en cas de cardiopathie cyanogène (shunt D-G, hypertension pulmonaire) ou de SDRA sévère.
Une poche de sang augmente le taux d’Hb d’environ 1 g/L et l’Ht de 3% chez un adulte. La transfusion érythrocytaire a une incidence sur la coagulation. En effet, elle améliore la fonction plaquettaire en augmentant la production de thromboxane et la libération d’ADP ; elle augmente aussi la production de thrombine [20]. De plus, la marginalisation des plaquettes dans le flux sanguin par la masse des érythrocytes qui reste au milieu du courant augmente les chances de fixation des thrombocytes à la paroi vasculaire [22].
Risques liés à la transfusion
Environ 1-4% des patients transfusés développent des complications. Les risques de la transfusion de produits sanguins peuvent se grouper en plusieurs rubriques (voir Chapitre 28 Risques) [4].
- Réaction transfusionnelle: allergie, réaction fébrile, surcharge de volume circulant (1-5%).
- Réaction liée aux consitutants des poches de sang (hyperkaliémie, hypocalcémie, etc).
- Immunomodulation (réactions liées aux leucocytes) : pneumopathie aiguë (TRALI, Transfusion-Related Acute Lung Injury), récidive cancéreuse, flambée inflammatoire, réaction greffe-contre-hôte (1:104).
- Réaction hémolytique ABO (1:105).
- Transmission de maladies bactériennes, virales ou liées au prion (1:106).
- Risque économique (coût, difficultés d’approvisionnement).
La transfusion est directement impliquée dans la morbi-mortalité postopératoire après chirurgie cardiaque. Une analyse comparative de la survie des patients qui reçoivent 1-2 poches de sang par rapport à ceux qui ne sont pas transfusés dans un collectif de 3'254 cas démontre une augmentation globale de la mortalité de 16% chez les transfusés ; le risque de décès est multiplié 1.7 fois (HR 1.67) à 6 mois, mais la différence n’est plus significative à 5 ans (HR 1.06) [21]. Les "dommages collatéraux" de la transfusion semblent pourtant se retrouver sur le long terme. Dans une série de 1'915 patients de chirurgie cardiaque suivis à 5 ans, la transfusion (34% du collectif) a entraîné une augmentation de mortalité de 70% (HR 1.7) sur le long terme, même après correction pour les comorbidités et les facteurs associés; en analyse multivariée, la transfusion reste un déterminant indépendant de la mortalité [7]. Une étude de suivi à 10 ans de 10'289 patients opérés de pontages aorto-coronariens a montré une réduction significative de la survie des malades transfusés qui est proportionnelle au nombre de poches de sang reçues (Figure 8.22A) [14]. Dans cette étude, le risque à long terme de 3 poches de sang est équivalent à celui d'une réopération, d'une maladie du tronc commun ou d'une fraction d'éjection basse; le risque de 6 unités de sang est le même que celui d'une insuffisance rénale ou d'une insuffisance ventriculaire. Une analyse du devenir à 7 ans de 8'724 patients a démontré une odds ratio respectivement de 3.38 et de 3.35 pour les infections et les complications ischémiques (infarctus, AVC, insuffisance rénale) chez les malades transfusés par rapport aux non-transfusés (Figure 8.22B) [18]. Cependant, ces observations concernent essentiellement les patients polytransfusés; en effet, l'administration de 1-2 poches de sang déleucocyté ne semble pas affecter le pronostic vital à long terme [16].
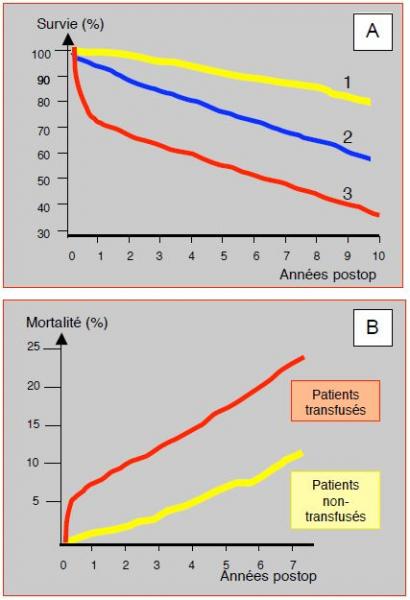
Figure 8.22 : Effet des transfusions sur la mortalité postopératoire en chirurgie cardiaque. A: Réduction de la survie à 10 ans des patients transfusés proportionnellement au nombre de poches de sang reçues au cours de pontages aorto-coronariens [13]. 1: aucune transfusion (trait jaune). 2: transfusion de 3 unités (trait bleu). 3: transfusion de 6 unités ou plus (trait rouge). B: Augmentation de la mortalité après chirurgie cardiaque chez les malades transfusés par rapport à ceux qui de le sont pas. La différence survient essentiellement pendant les six premiers mois, mais les courbes continuent à diverger légèrement à long terme [18].
Les comparaisons récentes entre seuils de transfusion restrictifs (Hb < 70 g/L) et libéraux (Hb > 90 g/L) ne montrent pas de différence de mortalité à court terme ni à long terme, ce qui signifie que l'attitude restrictive est sûre [4]. En chirurgie cardiaque, cependant, la situation semble différente. La stratégie restrictive tend à élever la mortalité cardiovasculaire (OR 1.64), bien qu'elle ne modifie pas le taux de complications ni de morbidité [17]; lors de syndrome coronarien aigu non-chirurgical, elle augmente le risque de morbi-mortalité (OR 1.78) [6]. Les patients de chirurgie cardiaque sont donc une population fragile qui mérite un seuil de transfusion de 80-90 g/L d'Hb plutôt qu'un seuil bas (Hb 70 g/L) convenant à une population non-cardiovasculaire. L'apparente discordance entre ces deux dernières études et celles qui sont citées précédemment tient au fait que, à taux égal d'Hb, les patients transfusés ont un moins bon pronostic que ceux qui ne l'ont pas été. En d'autres termes, l'anémie aiguë est dangereuse, et la transfusion qui la corrige aggrave la situation. La conclusion est d'éviter à tout prix l'anémie préopératoire et de limiter au maximum les pertes sanguines peropératoires.
Recommandations en chirurgie cardiaque
Quelques mesures simples peuvent considérablement diminuer la consommation de produits sanguins et modifier le pronostic des malades [19].
- Traiter l’anémie préopératoire. Trop de patients arrivent en salle d’opération avec une Hb à 100-110 g/L. Or un taux d’Hb < 120 g/L chez les femmes et < 130 g/L chez les hommes est responsable d’une aggravation de la morbi-mortalité périopératoire [23], et ce risque est doublé en cas de transfusion [10,11]. Un traitement de fer, de vitamine B12, d’acide folique et, si nécessaire, d’érythropoïétine (EPO) permet de normaliser les valeurs en préopératoire et d’aborder la chirurgie avec une meilleure réserve.
- Restreindre les transfusions : seuil restrictif (Hb < 80 g/L, Hb < 90 g/L chez les personnes âgées ou à risque).
- Limiter les pertes sanguines: hémostase rigoureuse, hémodilution normovolémique pré-CEC, récupération sanguine, ultrafiltration.
- Eviter la coagulopathie peropératoire : normothermie, équilibre acido-basique, calcium, antifibrinolytique. Utilisation routinière de la thromboélastographie pour évaluer les déficits en facteurs de coagulation et les compenser sélectivement : protamine, acide tranexamique, fibrinogène, PCC, facteur XIII.
- Améliorer la tolérance à l’anémie : FiO2 0.8-1.0, myorelaxation, anesthésie profonde, normovolémie.
| Transfusion sanguine |
|
Le but de la transfusion érythrocytaire est d’améliorer le DO2 tissulaire. Indications (patient normovolémique et hémorragie contrôlée) :
- La transfusion est indiquée si l’Hb est < 60 g/L
- En périopératoire, la transfusion est en général indiquée si l’Hb est < 70-80 g/L
- Dans les populations à risque (ischémie coronarienne, insuffisance ventriculaire, AVC,
néphropathie, âge avancé), le seuil de transfusion peut être relevé à 80-90 g/L
Il est improbable que la transfusion améliore le DO2 lorsque l’Hb est ≥ 100 g/L, sauf en cas de cardiopathie cyanogène (shunt D-G, hypertension pulmonaire) ou de SDRA sévère.
La transfusion augmente le risque d’infection, de SDRA et d’insuffisance rénale. Comme l'anémie, elle augmente la morbi-mortalité postopératoire d’environ 15% (en valeur relative). L'anémie aiguë est dangereuse, et la transfusion qui la corrige aggrave la situation. Il importe d'éviter l'anémie préopératoire et de limiter les pertes sanguines peropératoires.
|
© CHASSOT PG, MARCUCCI C, Décembre 2013, dernière mise à jour, Novembre 2018
Références
- APFELBAUM JL, NUTALL GA, CONNIS RT, et al. Practice guidelines for perioperative blood management. An updatesd report of the ASA task force on perioperative blood management. Anesthesiology 2015; 122:241-75
- BOER C, MEESTERS MI, MILOJEVIC M, et al. 2017 EACTS/EACTA Guidelines on patient blood management for adult cardiac surgery. J Cardiothorac Vasc Anesth 2018; 32:88-120
- CARSON JL, GUYATT G, HEDDLE NM, et al. Clinical practice guidelines from the AABB: red blood cell transfusion thresholds and storage. JAMA 2016; 316:2025-35
- CARSON JL, TRIULZI DJ, NESS PM. Indications for and adverse effects of red-cell transfusion. N Engl J Med 2017; 377:1261-72
- CLEVENGER B, MALLETT SV, KLEIN AA, RICHARDS T. Patient blood management to reduce surgical risk. Br J Surg 2015; 102:1325-37
- DOCHERTY AB, O'DONNELL R, BRUNSKILL S, et al. Effect of restrictive versus liberal transfusion strategies on outcomes in patients with cardiovascular disease in a noncardiac surgery setting: systematic review and meta-analysis. BMJ 2016; 352:i1351
- ENGOREN MC, HABIB RH, ZACHARIAS A, et al. Effect of blood transfusion on long-term survival after cardiac operation. Ann Thorac Surg 2002; 74:1180-6
- FERRARIS VA, BROWN JR, DESPOTIS GJ, et al. 2011 update to the Society of Thoracic Surgeons and the Society of Cardiovascular Anesthesiologists blood conservation clinical practice guidelines. Ann Thorac Surg 2011; 91:944-82
- GOODNOUGH LT, SHANDER A. Patient blood management. Anesthesiology 2012 ; 116 : 1367-76
- HABIB RH, ZACHARIAS A, SCHWANN TA, et al. Adverse effects of low hematocrit during cardiopulmonary bypass in the adult: should current practice be changed ? J Thorac Cardiovasc Surg 2003; 125:1438-50
- HABIB RH, ZACHARIAS A, SCHWANN TA, et al. Role of hemodilutional anemia and transfusion during cardiopulmonary bypass in renal injury after coronary revascularization: Implications on operative outcome. Crit Care Med 2005; 33:1749-56
- KLEIN AA, ARNOLD P, BINGHAM RM, et al. AAGBI Guidelines: the use of blood components and their alternatives. Anaesthesia 2016; 71:829-42
- KLEIN AA, COLLIER TJ, BRAR MS; et al. The incidence and importance of anaemia in patients undergoing cardiac surgery in the UK – the first Association of Cardiothoracic Anaesthetists national audit. Anaesthesia 2016; 71:627-35
- KOCH CG, LI L, DUNCAN AI, et al. Transfusion in coronary artery bypass grafting is associated with reduced long-term survival. Ann Thorac Surg 2006; 81:1650-7
- KOCH CG, REINEKS EZ, TANG AS, et al. Contemporary bloodletting in cardiac surgical care. Ann Thorac Surg 2015: 99: 779-84
- KOSTER A, ZITTERMANN A, BÖRGERMANN J, et al. No significant association between the transfusion of small volumes of leucocyte-depleted red blood cells amd mortality over 7 years of follow-up in patients undergoing cardiac surgery: a propensity score matched analysis. Anesth Analg 2018; 126:1469-75
- MURPHY GJ, PIKE K, ROGERS CA, et al. Liberal or restrictive transfusion after cardiac surgery. N Engl J Med 2015; 372:997-1008
- MURPHY GJ, REEVES BC, ROGERS CA, et al. Increased mortality, postoperative morbidity, and cost after red blood cell transfusion in patients having cardiac surgery. Circulation 2007; 116:2544-52
- NALLA BP, FREEDMAN J, HARE GMT, MAZER CD. Update on blood conservation for cardiac surgery. J Cardiothorac Vasc Anesth 2012; 26:117-33
- PEYROU V, LORMEAU JC, HERAULT JP, et al. Contribution of erythrocytes to thrombin generation in whole blood. Thromb Haemost 1999 ; 81 : 400-6
- SURGENOR SD, KRAMER RS, OLMSTEAD EM, et al. The association of perioperative red blood cell transfusions and decreased long-term survival after cardiac surgery. Anesth Analg 2009; 108:1741-6
- UIJTTEWAAL WS, NIJHOF EJ, BRONKHORST PJ, et al. Near-wall excess of platelets induced by lateral migration of erythrocytes in flowing blood. Am J Physiol 1993 ; 264 : H1239-44
- VAN STRATEN AH, HAMAD MA, VAN ZUNDERT AJ, et al. Preoperative hemoglobin level as a predictor of survival after coronary artery bypass grafting : a comparison with the matched general population. Circulation 2009 ; 120 :118-25
- WHITLOCK EL, KIM H, AUERBACH AD. Harms associated with single unit perioperative transfusion: retrospective population-based analysis. BMJ 2015; 350: h3037
- ZACHAROWSKI K, SPAHN DR. Patient blood management equals patient safety. Best Pract Res Clin Anaesthesiol 2016; 30:159-69
