Après 65 ans d'utilisation de la CEC, il est curieux de constater qu'il n'y a toujours pas de consensus clair ni de données évidentes (evidence-based) au sujet des valeurs de pression, de débit et d'hématocrite qui sont les plus souhaitables en pompe. Le plus souvent, ces éléments sont réglés en fonction des habitudes locales ou du principe de précaution. D'autre part, les critères utilisés pour juger de l'adéquation hémodynamique en pompe, telles les séquelles neurologiques ou la dysfonction rénale postopératoire, varient énormément selon les études, les définitions qu'on en donne et la sensibilité avec laquelle on les analyse. On peut dire que la perfusion optimale est celle qui s'accompagne de la meilleure survie des patients et de la meilleure fonction des organes, ainsi que de la moindre altération de la coagulation et de la moindre stimulation inflammatoire [13]. La plage de pression recommandée se situe entre 50 et 80 mmHg [9].
La pression artérielle moyenne (PAM) et l'équation du transport d'O2 (DO2) résument les différentes composantes hémodynamiques qui assurent la perfusion tissulaire:
DO2 = D(P) • (Hb • SaO2 • 1.36) + 0.003 PaO2
Où: D(P): débit de la pompe de CEC
Hb: concentration en hémoglobine (ou hématocrite)
SaO2: saturation artérielle à la sortie de l'oxygénateur
PaO2: pression partielle de l'O2 à la sortie de l'oxygénateur
Pression artérielle
Maintenir une pression moyenne relativement basse ou relativement haute présente des avantages et des inconvénients dans chacun des deux cas [13].
- Pression élevée (PAM 75-80 mmHg):
- Meilleure perfusion tissulaire (cerveau, rein, tube digestif);
- Meilleure adéquation aux besoins des malades hypertendus, âgés ou diabétiques;
- Assurance d’un flux satisfaisant lorsque l’autorégulation d’un organe est perturbée;
- Amélioration du flux collatéral pour les zones tissulaires à risque d'ischémie;
- Possibilité de débits de pompe plus élevés.
- Pression basse (PAM 50-60 mmHg):
- Moins de traumatisme pour les éléments figurés;
- Moins d'hémorragie et de retour sanguin par les artères bronchiques;
- Moins de volume aspiré et lésé dans les aspirations de cardiotomie;
- Moins de charge embolique cérébrale;
- Meilleure protection myocardique (réduction du flux coronarien collatéral).
Le critère primordial est le maintien d’une perfusion cérébrale adéquate. La pression de perfusion cérébrale (PPC) est la différence entre la PAM et la pression veineuse jugulaire (ou la PVC). Cela signifie que la PPC baisse non seulement si la PAM diminue, mais aussi si la PVC s'élève; ceci peut survenir lors de bascule du coeur pour avoir accès à sa face postérieure, de mauvais retour veineux, d'obstruction de canule, ou de position de Trendelenburg.
Le flux sanguin cérébral reste stable et indépendant de la PAM sur une plage d’autorégulation, en-dehors de laquelle il devient linéairement dépendant de la pression artérielle. Habituellement, la PAM considérée comme limite inférieure est 50 mmHg parce qu'elle correspond à la limite physiologique de l'autorégulation cérébrale. Mais il s'est avéré que cette limite est très variable entre les individus et selon les pathologies, et que sa valeur moyenne est de 66 mmHg en CEC [8,15]. L’autorégulation est gravement perturbée chez 20-25% des patients qui subissent une CEC [15], mais elle l’est aussi après un ictus ou chez les diabétiques et les hypertendus non traités [7,10]. D'autre part, l'autorégulation cérébrale est conservée jusqu'à 25-28°C en régulation alpha-stat sur une plage de pression de 30 à 100 mmHg, mais elle est abolie en mode pH-stat ou en dessous de 25°C [12,20]. De ce fait, les résultats neurologiques tendent à être meilleurs en mode alpha-stat et en hypothermie modérée [17].
Une PAM de > 75 mmHg réduit le risque d'hypoperfusion cérébrale dans les populations âgées, artérioscléreuses, polyvasculaires ou hypertensives, et améliore le flux collatéral lors d'AVC sur embolie [13]. Une première étude clinique randomisée avait démontré que les résultats neurologiques sont meilleurs lorsque la PAM est de 80-100 mmHg plutôt que 50-60 mmHg (taux de complications neurologiques 4.8% versus 12.9%) [4]. Il en est de même pour la fonction rénale, qui est mieux conservée si la PAM est ≥ 80 mmHg. Ces résultats ont été confirmé récemment: le risque d'AVC est de 3.8% lorsque la PAM est < 55 mmHg mais de 1.6% lorsqu'elle est maintenue > 65 mmHg [19]. Toutefois, une autre étude récente n'a pas trouvé de différence dans les séquelles neurologiques entre une PAM de 45 mmHg ou de 70 mmHg en CEC [21]. Cette incohérence incline à se fier à la plage d'autorégulation plutôt qu'à une valeur arbitraire de pression: une valeur de 75 mmHg est optimale pour 80% des patients [5]. La pression artérielle souhaitable est également fonction de la température. Elle est de 60-80 mmHg au-dessus de 29°C et de 50 mmHg à 28°C; 40-50 mmHg est acceptable en dessous de 28°C [4].
Comme il est l'organe le plus dépendant de l'apport d'O2, le cerveau est une excellente sentinelle des besoins de l'organisme. L'observation de sa saturation en O2 (ScO2) par un capteur externe (NIRS: near infrared spectroscopy) est un signal avancé de l'état du transport d'O2 (DO2) par le système circulatoire (voir Chapitre 6 Oxymétrie cérébrale) [9]. Mais la circulation cérébrale est autorégulée sur une large plage de pression artérielle, ce qui rend la ScO2 indépendante de l'hémodynamique. En-dehors de cette zone, par contre, la ScO2 devient dépendante de la PAM. La limite inférieure de l'autorégulation cérébrale est un bon critère de la limite inférieure de pression tolérable; malheureusement elle varie de 45 à 80 mmHg selon les individus [2]. D'autre part, l'autorégulation est perturbée en CEC chez 20-25% des patients en hypothermie (< 32°C) et chez environ 50% pendant le réchauffement [7,15]. En reliant les variations de la PAM à celles du flux sanguin cérébral (Doppler transcrânien) et à celles de la ScO2, il est possible de déterminer les limites de l'autorégulation d'un malade. A l'intérieur de la plage d'autorégulation, il n'y a pas de corrélation entre la PAM et le flux cérébral ou la ScO2; le coefficient de corrélation est zéro. Lorsque la PAM est inférieure au seuil d'autorégulation, il y a au contraire corrélation et l'index tend vers 1 [2,8]. On peut ainsi démontrer que l'ampleur de l'écart de PAM en-dessous du seuil d'autorégulation (index > 0.4) et la durée passée dans cette zone d'hypotension sont corrélées au risque d'AVC, d'insuffisance rénale et de décompensation ventriculaire (OR 1.36-6.57) [7,14]. A défaut de pouvoir déterminer le seuil d'autorégulation de chaque malade, la chute de la ScO2 de 20% en-dessous de sa valeur de base indique une baisse dangereuse du DO2, donc la nécessité d'augmenter la PAM, le débit de pompe et/ou l'hématocrite.
En conclusion, on ne peut pas formuler une récommandation générale valable dans toutes les circonstances, car la PAM doit être adaptée en fonction du cas, de la température, de la profondeur de l’anesthésie et des contraintes chirurgicales. Il est préférable qu’elle soit élevée (70-80 mmHg) dans une série de situations: personnes âgées ou polyvasculaires, hypertension, athéromatose aortique, diabète, maladies neurologiques ou rénales. Dans les cas sans risque particulier, elle peut être maintenue à environ 50-60 mmHg [9].
Débit de pompe
Il n’existe pas non plus de valeur magique pour le débit de pompe, mais il est réglé habituellement à 2.4 L/min/m2 (70 mL/kg/min) en normothermie (> 35°C) pour un Ht de 30-40%. Bien que cette valeur soit dans la fourchette basse de l’index cardiaque normal, le but est d'assurer les besoins métaboliques des tissus et la pression de perfusion dans les organes. Les premiers sont diminués par l'anesthésie et l'hypothermie, ce qui permet de baisser le débit sans compromettre l'équilibre tissulaire. Ainsi, le débit recommandé est de 1.8 L/min/m2 à 28° et de 1.0 L/min/m2 à 20° [13]. Le flux sanguin est maintenu constant dans le cerveau par autorégulation entre 1.0 et 2.5 L/min/m2, alors qu’il baisse dès 2.0 L/min/m2 dans le foie et les viscères [13]. En-dehors des plages d’autorégulation, le flux devient strictement pression-dépendant. En clinique, le débit de pompe est réglé en fonction de la SaO2 et de la SvO2 [9].
En utilisant la formule du calcul de la résistance, on peut facilement évaluer l'état des résistances artérielles systémiques:
RAS = (PAM – PVC) • 80 / DC
En l’occurrence, la PVC est considérée comme nulle puisque l’OD est en décharge et puisque le réservoir veineux est à la pression atmosphérique. Le débit cardiaque (DC) est remplacé par le débit de la pompe (valeur donnée par la machine).
Donc: RAS = PAM • 80 / D pompe
La pression et le débit sont en équilibre par l'intermédiaire des résistances artérielles périphériques. Ils ne doivent pas être réglés au détriment l'un de l'autre. Ainsi, il n'est pas logique que le perfusioniste baisse le débit de la pompe en dessous de la limite physiologique parce que la pression est trop haute, ou que l'anesthésiste administre un vasoconstricteur pour remonter la pression alors que le débit est trop bas. Dans la phase de réchauffement, il est important de maintenir un haut débit et un certain degré de vasodilatation pour favoriser les échanges thermiques tissulaires. Lors d'insuffisance aortique (IA) ou de shunt gauche-droit, la pression ne doit être maintenue que par le débit tant que l'aorte ou le shunt ne sont pas clampés; l’administration de vasopresseur ne ferait qu’aggraver l’IA ou augmenter le shunt. Le jeu des résistances artérielles, du débit de pompe et de la pression de perfusion réclame donc une collaboration et une communication permanentes au sein de l'équipe en charge du malade.
Transport d’O2
La consommation d'oxygène (VO2), qui est normalement de 150 mL/min/m2, baisse à 120-140 mL/min/m2 sous anesthésie normotherme et à 45 mL/min/m2 à 27° [3]. En CEC, la curarisation permet de la diminuer encore de 20-30% [6]. Ainsi, le débit recommandé à 28°C est de 1.8 L/min/m2, et à 20°C de 1.0 L/min/m2. La preuve de l'adéquation du débit est fournie par une SvO2 ≥ 70%. Le transport d’O2 (DO2 = D(P) • (Hb • SaO2 • 1.36) + 0.003 PaO2) peut être amélioré en augmentant le débit de pompe (DP), la FiO2, ou l’Ht (transfusion, hémoconcentration par ultrafiltration). Le DO2 critique est la valeur en dessous de laquelle la consommation d’O2 (VO2) devient dépendante du débit cardiaque (voir Figure 5.72). Chez l’homme endormi, elle est de 330 mL/min/m2 et en CEC, si elle existe, de 280-300 mL/min/m2 [16]. DO2 et VO2 restent normaux sur une plage d’Ht allant de 39% à 25% [11]. Un DO2 < 270 mL/min/m2 en CEC est le meilleur prédicteur d’insuffisance rénale postopératoire [18]. Mais il existe une hiérarchie des organes dans la dépendance au débit. Ainsi, le DO2 reste satisfaisant dans le cerveau et les reins lorsque le débit baisse jusqu’à 1.4 L/min/m2, alors qu’il est déjà insuffisant dans les viscères et les muscles lorsque le débit passe en dessous de 1.7-2.0 L/min/m2 [1]. Les viscères sont donc à haut risque d’ischémie parce qu’ils ne bénéficient pas d’un système d’autorégulation (Figure 7.24).
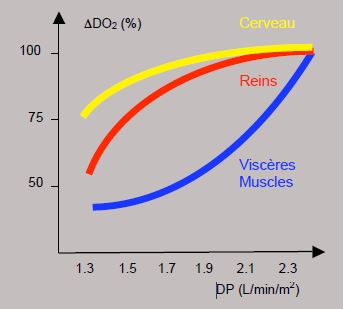
Figure 7.24 : Modifications de l’apport d’O2 (DO2) à différents organes en fonction du débit de pompe (DP). Le DO2 est bien maintenu dans le cerveau, et relativement bien dans les reins, jusqu’à un débit de 1.4 L/min/m2, mais il diminue dès que le débit est inférieur à 2.0 L/min/m2 dans les viscères et les muscles [1]. Ces derniers souffrent donc d’ischémie alors que le cerveau fonctionne normalement.
Le problème de l’hématocrite est discuté dans la section consacrée à l’hémodilution (voir Liquide d’amorçage).
| Hémodynamique et CEC |
|
La PAM doit être adaptée en fonction du cas, de la température, de la profondeur de l’anesthésie et des contraintes chirurgicales. Elle devrait être élevée (70-80 mmHg) dans une série de situations: personnes âgées ou polyvasculaires, hypertension, athéromatose aortique, diabète, maladies neurologiques ou rénales. La valeur moyenne oscille entre 50-60 mmHg (patients à risque faible) et 70-80 mmHg (patients à haut risque).
Le débit de pompe est réglé habituellement à 2.4 L/min/m2 (70 ml/kg) en normothermie (> 35°C) pour un Ht de 30-40%. En hypothermie, il peut être abaissé à 1.8 L/min/m2 à 28°C et à 1.0 L/min/m2 à 20°C, mais doit être augmenté pour compenser l’Ht si celui-ci est trop bas. Le débit est réglé en fonction de l'équilibre DO2/VO2; il est adéquat lorsque la SvO2 est ≥ 70%.
En CEC, le DO2 devient dépendant du débit de pompe en dessous de 300 mL/min/m2. Le DO2 reste satisfaisant dans le cerveau et les reins lorsque le débit baisse jusqu’à 1.4 L/min/m2, alors qu’il est déjà insuffisant en dessous de 1.7-2.0 L/min/m2 dans les viscères et les muscles, qui ne bénéficient pas d’un système d’autorégulation.
|
© CHASSOT PG, GRONCHI F, Avril 2008, dernière mise à jour, Décembre 2019
Références
- BOSTON US, SLATER JM, ORSZULAK TA, et al. Hierarchy of regional oxygen delivery during cardiopulmonary bypass. Ann Thorac Surg 2001; 71:260-4
- BRADY K, JOSHI B, ZWEIFEL C, et al. Real-time continuous monitoring of cerebral blood flow autoregulation using near-infrared spectroscopy in patients undergoing cardiopulmonary bypass. Stroke 2010; 41:1951-6
- FIACCADORI E, VEZZANI A, COFFRINI E, et al. Cell metabolism in patients undergoing major valvular surgery: relationship with intra and postoperative hemodynamics, oxygen transport, and oxygen utilization patterns. Crit Care Med 1989; 17:1286-91
- GOLD JP, CHARLESON MD, WILLIAMS-RUSSO P, et al. Improvement in outcomes after CABG. A randomized trial comparing intraoperative high versus mean arterial pressure. J Thorac Cardiovasc Surg 1995; 110:1302-11
- HORI D, NOMURA Y, ONO M, et al. Optimal blood pressure during cardiopulmonary bypass defined by cerebral autoregulation monitoring. J Thorac Cardiovasc Surg 2017; 154:1590-8
- IRISH CL, MURKIN JM, CLELAND A, et al. Neuromuscular blockade significantly decreases systemic oxygen consumption during hypothermic cardiopulmonary bypass. J Cardiothorac Vasc Anesth 1991; 5:132-7
- JOSHI B, BRADY K, LEE J, et al. Impaired autoregulation of cerebral blood flow during rewarming from hypothermic cardiopulmonary bypass and its potential association with stroke. Anesth Analg 2010; 110:321-8
- JOSHI B, ONO M, BROWN C, et al. Predicting the limits of cerebral autoregulation during cardioplumonary bypass. Anesth Analg 2012; 114:503-10
- KUNST G, MILOJEVIC M, BOER C, et al. 2019 EACTS/EACTA/EBCP guidelines on cardiopulmonary bypass in adult cardiac surgery. Br J Anaesth 2019; 123:713-57
- LANIER WL. Glucose management during cardiopulmonary bypass: cardiovascular and neurologic implications. Anesth Analg 1991; 72:423-7
- LIAM BL, PLOCHL W, COOK DJ, et al. Hemodilution and whole body balance during normothermic cardiopulmonary bypass. J Cardiothorac vasc Surg 1998; 115:1203-8
- MURKIN JM, MARTZKE JS, BUCHAN AM, et al. A randomized study of the iunfluence of perfusion technique and pH management strategy in 316 patients undergoing coronary artery bypass surgery. II Neurologic and cognitive outcomes. J Cardiothorac Vasc Surg 1995; 110:349-55
- MURPHY GS, HESSEL EA, GROOM RC. Optimal perfusion during cardiopulmonary bypass: an evidence-based approach. Anesth Analg 2009; 108:1394-417
- ONO M, BRADY K, EASLEY RB, et al. Duration and magnitude of blood pressure below cerebral autoregulation threshold during cardiopulmonary bypass is associated with major morbidity and operative mortality. J Thorac Cardiovasc Surg 2014; 147:483-9
- ONO M, JOSHI B, BRADY K, et al. Risks for impaired cerebral autoregulation during cardiopulmonary bypass and postoperative stroke. Br J Anaesth 2012; 109:391-8
- PAROLARI A, ALAMANNI F, GHERLI T, et al. Cardiopulmonary bypass and oxygen consumption : oxygen delivery and hemodynamics. Ann Thorac Surg 1999; 67:1320-7
- PATEL RL, TURTLE MR, CHAMBERS DJ, et al. Alpha-stat acid-base regulation during cardiopulmonary bypass improves neuropsychologic outcomes in patients udergoing coronary artery bypass grapfting. J Thorac Cardiovasc Surg 1996; 111:1267-79
- RANUCCI M, ROMITTI F, ISGRO G, et al. Oxygen delivery during cardiopulmonary bypass and acute renal failure after coronary opertaions. Ann Thorac Surg 2005; 80:2213-20
- SUN LY, CHUNG AM, FARKOUH ME, et al. Defining an intraoperative hypotension threshold in association with stroke in cardiac surgery. Anesthesiology 2018; 129:440-7
- SUNGURTEKIN H, BOSTON US, COOK DJ. Bypass flow, mean arterial pressure, and cerebral perfusion during cardiopulmonary bypass in dogs. J Cardiothorac Vasc Anesth 2000; 14:25-8
- VEDEL AG, HOLGAARD F, RASMUSSEN LS, et al. High-target versus low-target blood pressure management during cardiopulmonary bypass to prevent cerebral injury in cardiac surgery patients: a randomized controlled trial. Circulation 2018; 137:1770-80
