Les seuls moyens éprouvés pour diminuer les séquelles neurologiques lors d’arrêt circulatoire sont au nombre de trois:
- Limiter la durée de l’arrêt;
- Maintenir un débit sanguin cérébral minimal;
- Refroidir le cerveau.
L'hypothermie induite par la CEC est la technique prioritaire pour protéger le cerveau des lésions ischémiques dues à un arrêt circulatoire complet. Elle s’accompagne d’un refroidissement externe (salle d’opération à 16°C, éventuellement casque de chimiothérapie ou glace pilée autour de la tête) pour limiter les risques de réchauffement du cerveau pendant qu’il n’est plus perfusé. La tendance actuelle est de privilégier une perfusion cérébrale continue et suffisante pour ne nécessiter qu’une hypothermie modérée (25-28°C), afin d’éviter les effets délétères de l’hypothermie profonde et les risques d'hyperthermie au réchauffement cérébral.
Mesures chirurgicales
Pour maintenir un débit cérébral sélectif pendant l'ouverture de la crosse aortique, le chirurgien dispose de plusieurs techniques [2,23,33].
- Bas débit continu hypothermique (10-15 mL/kg/min) par la canule artérielle de CEC placée dans l'artère sous-clavière ou axillaire droite [18]. Le tronc brachio-céphalique, la carotide gauche et la sous-clavière gauche étant clampés à leur départ de la crosse, le flux perfuse la carotide droite, puis la carotide gauche par l'intermédiaire du polygone de Willis et des anastomoses entre carotides externes et artères vertébrales [11]. Le problème est que jusqu'à 40% des individus ont un polygone de Willis incomplet [29]. La pression de perfusion (environ 60 mmHg) est mesurée dans l'artère radiale gauche, perfusée par l’intermédiaire des collatérales entre la vertébrale et la sous-clavière gauche. La température de perfusion varie de 22° à 28°C selon les techniques. L'oxymétrie cérébrale (ScO2) vérifie l'adéquation de la perfusion dans les deux hémisphères; une différence de > 20% entre les deux côtés commande une perfusion supplémentaire de la carotide gauche. Dans le cadre d'un arrêt circulatoire hypothermique (18°C), cette perfusion unilatérale est en général suffisante. Une perfusion carotidienne bilatérale est préférable lorsque la température est maintenue à 25-28°C ou lorsque la durée excède 40 minutes (Figure 18.27) [7].
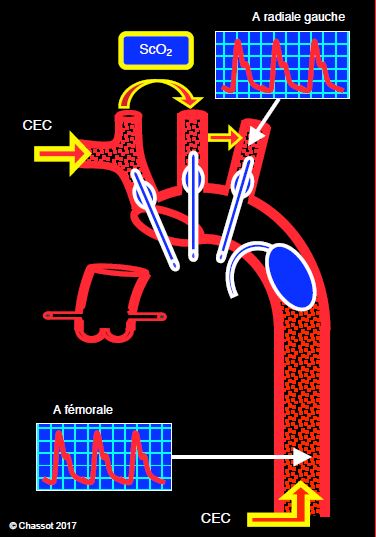
Figure 18.27 : Schéma des opérations sur la crosse aortique. La technique représentée ici combine les canulations artérielles de CEC dans l’artère sous-clavière droite et dans une artère fémorale. Lorsque l’aorte ascendante distale et la crosse sont ouvertes, le tronc brachio-céphalique, la carotide gauche et la sous-clavière gauche sont clampés à leur départ de la crosse par des ballonnets intravasculaires (en bleu). Le flux de la CEC (500-800 mL/min à 20°C, 1’000-1'500 mL/min à 28°) perfuse la carotide droite, puis la carotide gauche par l'intermédiaire du cercle de Willis et des anastomoses entre carotides externes. La pression de perfusion est mesurée dans l'artère radiale gauche, qui est perfusée par l’intermédiaire des collatérales entre la vertébrale et la sous-clavière gauches. Une canule artérielle placée en fémorale permet de continuer la perfusion des viscères sous-diaphragmatiques et de la moelle épinière (1’000-1'500 mL/min à 20°, 2’000-3'000 mL/min à 28°), l’aorte descendante étant clampée par un ballon intravasculaire (en bleu). Deux cathéters artériels sont nécessaires pour surveiller ces circulations séparées. ScO2 : saturation cérébrale en O2. La protection myocardiaque est assurée par cardioplégie itérative.
- Perfusion carotidienne sélective bilatérale: les carotides sont canulées dans le champ opératoire et perfusée par un circuit séparé de la CEC à raison de 6-10 mL/kg/min, à une pression de 40-70 mmHg (artère radiale) et une température de 20-28°C [7,10,17]. Le sang est évacué par les jugulaires. Cette technique peut être encombrante dans le champ opératoire; elle prolonge la durée de CEC et présente un risque significatif d'embolisation artérielle cérébrale (air, débris, athéromes délogés, etc). Par rapport à l'arrêt circulatoire hypothermique simple (ACH à 18°C), elle diminue la mortalité de 45% et les séquelles neurologiques de 20%; les résultats cérébraux sont meilleurs si l'hypothermie est modérée (21-24°C): OR 1.81-1.87 [35]. Elle permet un arrêt circulatoire de 60 minutes [8]. C'est la technique de préférence pour les arrêts de > 40 minutes. Grâce à la perfusion carotidienne continue, il est possible de limiter la profondeur de l'hypothermie à 24-28°C sans aggravation neurologique, mais cet avantage est contrebalancé par un risque ischémique plus grand pour les organes périphériques, notamment la moelle épinière (incidence de paraplégie: 3.2%) [26,30].
- Perfusion rétrograde: les veines jugulaires sont canulées et perfusées isolément depuis la CEC à raison de 200 – 500 mL/min à une pression maximale de 25 mmHg (mesurée par le bras latéral de l'introducteur de Swan-Ganz). Le risque d'oedème cérébral est important en cas de surpression. L'avantage est de "laver" les carotides par un flux rétrograde, ce qui élimine les risques emboliques, mais cette technique n’améliore pas le status neurologique postopératoire et ne diminue pas l’incidence d’AVC, car le sang chemine par des shunts davantage que par les capillaires. Elle est peu utilisée, essentiellement en complément d'un ACH pour maintenir l'homogénéité de l'hypothermie cérébrale [14,16,33].
- La position de Trendelenburg évite les embolisations d'air lorsque les vaisseaux sont ouverts ou manipulés, mais elle augmente la pression veineuse et peut de ce fait diminuer la pression de perfusion cérébrale effective (PPC) si elle est trop accentuée, puisque PPC = PAM – Pvein. La PPC est facile à calculer en mesurant la pression veineuse au bras latéral de l’introducteur de Swan-Ganz ; pour que la mesure de la PPC soit fiable, le capteur de pression doit être placé au niveau du conduit auditif externe.
- Arrêt circulatoire total en hypothermie profonde (18-20°C): voir Arrêt circulatoire.
Ces méthodes n'améliorent guère le status neurologique par rapport au simple arrêt en hypothermie profonde lorsque la durée de celui-ci est inférieure à 30-40 minutes; elles sont à considérer dans la chirurgie complexe de la crosse lorsque l'arrêt circulatoire dépasse 40 minutes [13]. Elles ne garantissent malheureusement pas une protection de la moelle, aussi sensible que le cerveau à l'ischémie. Le risque de paraplégie postopératoire est élevé (3-5%) [4]. C’est la raison pour laquelle on peut procéder à une canulation supplémentaire par l’artère fémorale afin d’assurer une perfusion de la moëlle et des viscères abdominaux ; un ballon occlusif introduit dans l’aorte thoracique descendante évite que le sang ne se déverse dans le thorax (Figure 18.27) [5]. Pour limiter les problèmes liés à l’hypothermie et les conséquences neurologiques du réchauffement, on peut maintenir la température de CEC à 28-30°C mais augmenter le débit de perfusion et l’assurer en continu pendant la prériode où la crosse est interrompue [28]:
- Débit cérébral : 800-1'200 mL/min par la canule sous-clavière;
- Débit splanchnique : 2’000-3'000 mL/min par la canule fémorale.
Mesures anesthésiques
Une longue série de substances a été utilisée dans le but d'offrir une neuroprotection pharmacologique, un effet de préconditionnement ou un silence électrique. Quelques unes sont largement employées, bien que l'évidence de leur bénéfice soit assez pauvre.
- Thiopental: les barbiturés diminuent la CMRO2 de 30%; ils améliorent la récupération des lésions focales, mais non celle de l'ischémie cérébrale globale [25,38]. Toutefois, lorsqu’elle est déjà réduite par l'hypothermie, la suppression de l'activité électrique cérébrale par un barbituré ne paraît pas apporter un avantage supplémentaire, si l'on en juge par l'absence de différence dans les séquelles neurologiques [32]. Son intérêt tient au fait qu'on ne dispose pas toujours de la preuve que l'EEG soit isoélectrique, que le refroidissement du cerveau n'est pas toujours homogène, et que son action est bénéfique sur les lésions focales de type emboliques, jamais exclues au cours des manipulations (embolies de bulles d'air ou de matériel athéromateux) [9]. La dose recommandée est 5-10 mg/kg administrée 3-5 minutes avant l'arrêt ; elle n’a pas d’incidence sur l’hémodynamique au réchauffement [31].
- Stéroïdes: par son effet stabilisateur sur les membranes cellulaires, la méthylprednisolone diminue l'oedème périfocal entourant les tumeurs et les zones traumatisées ou embolisées. Bien que son efficacité soit peu probable dans le contexte de l'ischémie, l'innocuité d'une dose isolée, même importante, peut justifier son utilisation prophylactique, car on ne peut jamais exclure de lésions emboliques, mais la preuve de son efficacité n’a jamais été apportée [21]. La dose est de 10-20 mg/kg, administrée 45 minutes avant l'arrêt.
- Mannitol: il diminue l'oedème cérébral et contribue à une amélioration de la perfusion parenchymateuse; sa capacité à capter les radicaux libres offre la possibilité de diminuer les lésions de reperfusion. Il s'administre 20 – 30 minutes avant l'arrêt à la dose de 0.5 g/kg.
- Bloqueurs calciques: la diminution du Ca2+ libre intracellulaire est un avantage contre les lésions de reperfusion; d'autre part, les anticalciques limitent la vasoconstriction artériolaire. Seule la nimodipine est efficace, car les autres substances ne traversent pas la barrière hémato-encéphalique [34].
- Magnésium: sous forme de sulfate ou de chlorure, il a une activité anticalcique prononcée et améliore la récupération neurologique dans certaines études [36]. La dose est 5-10 mmol 5 minutes avant l'arrêt.
L'anesthésiste a également son rôle dans les mesures à prendre pour diminuer la probabilité de lésions neurologiques lors de l'arrêt circulatoire.
- Normoglycémie: l'hyperglycémie altère profondément l'autorégulation cérébrale et augmente les substrats à disposition pour le métabolisme anaérobique en cas d'ischémie, ce qui accroît l'acidose intracellulaire et péjore le status neurologique [20]. On sait depuis longtemps que la récupération cérébrale est meilleure chez l'animal si la glycémie est inférieure à 15 mmol/L [22]. Si elle n'est pas traitée, l'hyperglycémie transitoire de stress (glycémie > 12 mmol/L) aggrave la mortalité et la récupération neurologique après chirurgie cardiaque [1]. Vu la résistance tissulaire à l'insuline en hypothermie, il est conseillé de régler la glycémie à 8-10 mmol/L déjà en normothermie [12,24] (voir Chapitre 4 Contrôle métabolique).
- Hématocrite: une valeur de 25-30% réduit le risque de lésions neurologiques
- Le refroidissement externe du cerveau par un casque de chimiothérapie ou de la glace pilée autour de la tête reste une mesure controversée parce qu’on n’a pas de preuves formelles de son efficacité clinique. Chez l'animal, elle favorise la récupération neurologique [27]. Elle limite le réchauffement du cerveau pendant l’arrêt, contribue à son hypothermie et améliore l’homogénéité du refroidissement sans prolonger la CEC, mais le crâne est une barrière importante aux échanges thermiques, qui sont peu importants si la salle d’opération est correctement refroidie [15,39]. La technique est sans risque à la condition d’éviter la compression des globes oculaires et les gelures aux points d’appui, même si le système est encombrant et interfère avec le fonctionnement des électrodes d’EEG ou de ScO2. Vu son innocuité, il est préférable d'en profiter pour assurer une hypothermie cérébrale la plus efficace possible. La glace est enlevée lorsque la température est de 32-34°C pour éviter l'hyperthermie cérébrale.
Il n'existe pas d'évidence claire que ces éléments prophylactiques modifient significativement la récupération cérébrale. Seules l'hypothermie, la perfusion continue et la brièveté de l'arrêt ont une incidence prouvée sur les résultats neurologiques à long terme. Toutefois, lorsqu'il survient, l'AVC est tellement catastrophique que le bénéfice du doute joue en faveur du maximum de protection. Habituellement, on combine plusieurs éléments en fonction de leur rapport risque / bénéfice potentiel.
L'arrêt circulatoire cérébral ne peut intervenir que lorsque la température est de 18-20°C et l'EEG isoélectrique depuis 3 minutes ; les pupilles sont alors en mydriase [6]. Il est probable que les lésions surviennent en partie lors de la reperfusion et de l'apport soudain d'oxygène: peroxydation des lipides, formation de radicaux libres superoxydes, chute de l'ATP, augmentation du calcium ionisé. Dans ce sens, les bloqueurs calciques et le magnésium pourraient avoir un effet bénéfique.
Le blocage neuro-musculaire et la profondeur de l'anesthésie doivent être adéquats pour éviter les frissons et diminuer au maximum toute consommation d'oxygène (VO2) périphérique. En CEC, la curarisation est susceptible de baisser la VO2 globale de 10-30% [19]. L’hématocrite est abaissé pour maintenir stable la viscosité, qui augmente avec la chute de température. La viscosité reste identique si la valeur de l’Ht en % est la même que celle de la température en °C. L'utilisation d'agents vasodilatateurs favorise un refroidissement harmonieux et évite l'apparition de gradients de température. Le refroidissement doit être lent pour être homogène: sa durée optimale pour le cerveau est de 20 minutes [3]. Lors du réchauffement, le gradient doit rester < 10°C entre le sang entrant et le sortant de l'échangeur thermique; dès que la température atteint 30°C, il doit même être < 4°C. La température maximale du sang ne doit pas dépasser 37°C et la vitesse de réchauffement ne doit pas excéder 1°C par 3-5 minutes afin d'éviter une hyperthermie cérébrale [37]. Il est prudent de sortir de pompe à une T° oesophagienne de 36°C. Tous les médicaments doivent être administrés dans la pompe avant l'arrêt de cette dernière, après quoi l'anesthésiste n'a plus aucune possibilité d'intervention. Avant de reperfuser l'aorte, il faut contrôler et corriger si nécessaire l'équilibre acido-basique dans le perfusat de CEC. Une hyperkaliémie suggère un dommage tissulaire.
| Protection cérébrale |
|
Priorités:
- Limiter la durée de l’arrêt
- Protéger le cerveau (hypothermie à 20-28°C, perfusion cérébrale continue)
- Maintenir la pression de perfusion (PAM 80 mmHg)
Durées d’arrêt circulatoire tolérables par le cerveau: 3-5 min à 37°, 12 min à 28°, 30 min à 20°.
Mesures de protection cérébrale:
- Perfusion sélective continue
- Hypothermie à 18-20°C, refroidissement et réchauffement homogènes et lents (1°/3-4 min), risque d’hyperthermie cérébrale au réchauffement
- Hypothermie modérée (28-30°C), perfusions cérébrale + viscérale continues par canulations sous-clavière droite et fémorale
- Position de Trendelenburg
- Normoglycémie, mannitol (↓ œdème cérébral)
- Anesthésie profonde (curarisation)
- Méthylprednisolone
- Non-prouvés (mais sans risque majeur): Mg2+, thiopental, nimodipine, propofol
|
© CHASSOT PG, TOZZI P, BETTEX D, Octobre 2010, Dernière mise à jour, Décembre 2019
Références
- ASCIONE R, ROGERS CA, RAJAKARUNA C, ANGELINI GD. Inadequate blood glucose control is associated with in-hospital mortality and morbidity in diabetic and nondiabetic patients undergoing cardiac surgery. Circulation 2008; 118:113-23
- BASSIN L, BELL D. Temporary extracorporeal bypass modalities during aortic surgery. Best Pract Res Clin Anaesthesiol 2016; 30:341-57
- BELLINGER DC, WERNOWSKY G, RAPPAPORT LA, et al. Cognitive developpment of children following early repair of transposition of the great arteries using deep hypothermic circulatory arrest. Pediatrics 1991; 87:701-7
- CASTHELY PA, BADACH M. Anesthesia for aortic arch aneurysm surgery. In: SIMPSON JI, ed. Anesthesia for aortic surgery. Boston, Butterworth-Heinemann 1997, 159-74
- COOK RC, GAO M, MACNAB AJ, et al. Aortic arch reconstruction: safety of moderate hypothermia and antegrade cerebral perfusion during systemic circulatory arrest. J Card Surg 2006; 21:158-64
- COSELLI JS, CRAWFORD ES, BEALL AC, et al. Determination of brain temperatures for safe circulatory arrest during cardiovascular operation. Ann Thorac Surg 1988; 45:638-45
- DE PAULIS R, CZERNY M, WELTERT L, et al. Current trends in canulation and neuroprotection during surgery of the aortic arch in Europe. Eur J Cardiothorac Surg 2015; 47:917-23
- DI MAURO M, IACO AL; DI LORENZO C, et al. Cold reperfusion before rewarming reduces neurologic events after deep hypothermic circulatory arrest. Eur J Cardiothorac Surg 2013; 43:168-73
- DRUMMOND JD. Do barbiturate really protect the brain? Anesthesiology 1993; 78:611-3
- ERBEL R, ABOYANS V, BOILEAU C, et al. 2014 ESC Guidelines on the diagnosis and treatment of aortic diseases. Eur Heart J 2014; 35:2873-926
- FRIST WH, BALDWIN JC, STARNES VA, et al. A reconsideration of cerebral perfusion in aortic arch replacement. Ann Thorac Surg 1986; 42:273-8
- FURNARY AP, GAO G, GRUNKEMEIER GL, et al. Continuous insulin infusion reduces mortality in patients with diabetes undergoing coronary artery bypass grafting. J Thorac Cardiovasc Surg 2003; 125-1007-21
- GEUBE M, SALE S, SVENSSON L. Con: routine use of brain perfusion techniques is not supported in deep hypothermic circulatory arrest. J Cardiothorac Vasc Anesth 2017; 31:1905-9
- GRIEPP RB, JUVONEN T, GRIEPP EA, et al. Is retrograde cerebral perfusion an effective means of neuronal support during deep hypothermic circulatory arrest ? Ann Thorac Surg 1997; 64:913-6
- GROCOTT HP, ANDREIW A. Con: Topical head cooling should not be used during deep hypothermic circulatory arrest. J Cardiothorac Vasc Anesth 2012; 26:337-9
- HAGL C, ERGIN MA, GALLA JD, et al. Neurologic outcome after ascending aorta – aortic arch operations: effect of brain protection technique in high-risk patients. J Thorac Cardiovasc Surg 2001; 121:1107-21
- HIRATZKA LF, BAKRIS GL, BECKMAN JA, et al. 2010 ACCF/AHA/AATS/ACR/ASA/SCA/SCAI/ SIR/STS/SVM Guidelines for the diagnosis and management of patients with thoracic aortic disease: Executive summary. Circulation 2010:121:1544-79
- HUSSAIN S, SVENSSON L. Surgical techniques in type A dissection. Ann Cardiothorac Surg 2016; 5:233-5
- IRISH CL, MURKIN JM, CLELAND A, et al. Neuromuscular blocked significantly decreases systemic oxygen consumption during hypothermic cardiopulmonary bypass. J Cardiothorac Vasc Anesth 1991; 5:132-4
- JAUCH EC, SAVER JL, ADAMS HP, et al. Guidelines for the early management of patients with acute ischemic stroke: a guideline for healthcare professionals from the AHA/ASA. Stroke 2013; 44:870-947
- KRUGER T, HOFMANN I, BLETTNER M, et al. Intraoperative neuroprotective drugs without beneficial effects ? Results of the German Registry for Acute Aortic Dissection type A (GERAADA). Eur J Cardiothorac Surg 2013; 44:939-46
- LEMAY ER. Insulin administration protects neurologic function in cerebral ischemia in the rat. Stroke 1988; 19:1411
- LINDSAY H, SRINIVAS C, DJAIANI G. Neuroprotection during aortic surgery. Best Pract Res Clin Anaesthesiol 2016; 30:283-303
- McALISTER FA, MAN J, NISTRITZ L, et al. Diabetes and coronary artery bypass surgery: An examination of perioperative glycemic control and outcomes. Diabetes Care 2003; 26:1518:24
- NUSSMEIER NA, ARLUNG C, SLOGOFF S. Neuropsychological dysfunction after cardio-pulmonary bypass: cerebral protection by a barbiturate. J Cardiothorac Vasc Anesth 1991; 5:584-9
- OKITA Y, MIYATA H, MOTOMURA N, et al. The Japan Cardiovascular Surgery Database Organization. A study of brain protection during total arch replacement comparing antegrade cerebral perfusion versus hypothermic circulatory arrest, with or without retrograde cerebral perfusion: analysis based on the Japan Adult Cardiovascular Surgery Database. J Thorac Cardiovasc Surg 2015; 149:S65-73
- O'NEILL B, BILAL H, MAHMOOD S, WATERWORTH P. It is worth packing the head with ice in patients undergoing deep hypothermic circulatory arrest ? Interact Cardiovasc Thorac Surg 2012; 15:696-701
- PANOS A, MYERS PO, KALANGOS A. Novel technique for aortic arch surgery under mild hypothermia. Ann Thorac Surg 2008; 85:347-8
- PAPANTCHEV V, STOINOVA V, ALEKSANDROV A, et al. The role of Willis circle variations during unilateral selective cerebral perfusion: a study of 500 circles. Eur J Cardiothorac Surg 2013; 44:543-53
- PREVENTZA O, COSELLI J, GARCIA A, et al. Moderate hypothermia at warmer temperatures is safe in elective proximal and total arch surgery: results in 665 patients. J Thorac Cardiovasc Surg 2017; 153:1011-8
- REID RW, WARNER DS. Pro: Arguments for use of barbiturates in infants and children undergoing deep hypothermic circulatory arrest. J Cardiothorac Vasc Anesth 1998; 12:591-4
- RUNG GW, WICKEY GS, MYERS JL, et al. Thiopental as an adjunct to hypothermia for EEG suppression in infants prior to circulatory arrest.. J Cardiothorac Vasc Anesth 1991; 5:337-42
- SECO M, EDELMAN JJB, VAN BOXTEL B, et al. Neurologic injury and protection in adult cardiac and aortic surgery. J Cardiothorac Vasc Anesth 2015; 29:185-95
- STEEN PA, NEWBERG LA, MILDE JH. Cerebral blood flow and neurologic outcome when nimodipine is given after complete cerebral ischaemia in the dog. J Cereb blood Flow Metab 1984; 4:82-9
- TIAN DH, WAN B, BANNON PG, et al. A meta-analysis of deep hypothermic circulatory arrest alone versus with adjunctive selective antegrade cerebral perfusion. Ann Cardiothorac Surg 2013; 2:261-70
- WESTERMAIER T, HUNGERHUBER E, ZAUSINGER S, et al. Neuroprotective efficacy of intra-arterial and intravenous magnesium sulfate in a rat model of transient focal cerebral ischemia. Acta Neurochir 2003; 145:393-9
- YAN TD, BANNON PG, BAVARIA J, et al. Consensus on hypothermia in aortic arch. surgery. Ann Cardiothorac Surg 2013; 2:163-8
- ZAIDAN JR, KLOCHANY A, MARTIN WA, et al. Effect of thiopental on neurological outcome following coronary artery bypass grafting. Anesthesiology 1991; 74:406-11
- ZHURAV L, WILDES TS. Pro: Topical head cooling should be used during deep hypothermic circulatory arrest. J Cardiothorac Vasc Anesth 2012; 26:333-6
