La tolérance de la moelle à l'ischémie est aussi faible que celle du cerveau; les lésions irréversibles y apparaissent dans les 5 minutes qui suivent l'interruption totale de la perfusion artérielle. Le clampage de l'aorte thoracique descendante fait donc courir un risque majeur de lésion médullaire liée à l'ischémie et à la reperfusion, qui peut progresser jusqu'à l'infarcissement irréversible entraînant une paraparésie ou une paraplégie. L'incidence de cet évènement tragique varie de 1-15% des cas selon les séries et selon l'étendue de la lésion [1,11]. Cette variation tient à la nature multifactorielle de l'ischémie, pour laquelle plusieurs éléments sont des prédicteurs de risque [7,13].
- Durée et niveau du clampage;
- Etendue de la lésion aortique;
- Anatomie de la perfusion médullaire;
- Age du patient (> 60 ans);
- Situation d'urgence ou de rupture;
- Chirurgie aortique préalable proximale ou distale à la lésion actuelle;
- Comorbidités: âge, hypertension artérielle, diabète, insuffisance rénale;
- Hypoperfusion peropératoire et/ou postopératoire (hypotension, anémie, hypoxie, bas débit);
- Non-utilisation d'un protocole multimodal de prévention de l'ischémie médullaire:
- Technique chirurgicale (CEC distale, hypothermie, réimplantation artérielle);
- Technique anesthésique (maintien de la PAM à ≥ 80 mmHg, préconditionnement);
- Neuroprotection (drainage du LCR, corticoïdes, magnésium, papavérine, etc);
- Monitorage (potentiels évoqués);
- Pour les endoprothèses:
- Couverture de paroi aortique de > 20 cm;
- Couverture de la sous-clavière gauche sans revascularisation;
- Obstruction iliaque interne par l'introducteur, obstruction de la mésentérique inférieure.
Vascularisation de la moelle
La moelle est vascularisée par deux artères spinales postérieures et une artère spinale antérieure, discontinues sur la longueur du rachis; elles sont issues des artères vertébrales, mais, depuis la région médiothoracique, elles ne reçoivent que des apports étagés par plusieurs artères intercostales, et 1 à 2 artères ilio-lombaires (Figure 24.13) [3].
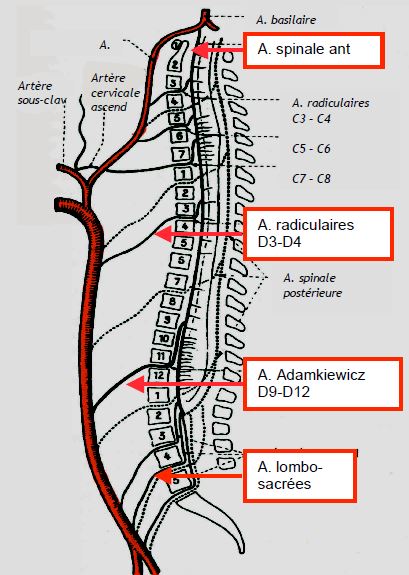
Figure 24.13 : Schéma anatomique classique de la vascularisation médullaire [d'après réf 3]. Le réseau artériel périmédullaire est nourrit essentiellement par trois sources: les artères vertébrales du côté céphalique, les artères iliaques internes du côté distal, et un certain nombre d'artères segmentaires au milieu, dont la plus importante est en général l'artère d'Adamkiewicz.
Les artères spinales postérieures sont plexiformes, alors que l'artère spinale antérieure est un long vaisseau unique et discontinu qui nourrit les cornes antérieures motrices de la moelle; ces dernières sont donc plus à risque en cas d’interruption du flux sanguin. Au niveau médiothoracique (D4-D9), la vascularisation dépend étroitement d'un vaisseau nourricier majeur, l'artère d'Adamkiewicz (arteria radicularis magna), issue entre D9-D12 dans le 70% des cas, le plus souvent à gauche, mais dont l'origine peut s'étendre de D5 à L2 [19]. La zone de D4 à D9 est la plus fragile; c'est aussi celle où le canal rachidien est le plus étroit [2]. Cependant, cette description anatomique classique ne fait pas apparaître le réseau complexe qui entoure la moelle. Celle-ci est en fait vascularisée par un vaste treillis de petits vaisseaux intrathécaux, périduraux et péri-vertébraux qui est alimenté par des collatérales en provenance des artères vertébrales, intercostales, lombaires et iliaques internes. Ce réseau est interconnecté longitudinalement et latéralement le long de la moelle et du rachis [6]. Il assure une certaine résilience à la perfusion médullaire lorsque certains vaisseaux nourriciers sont interrompus et peut réajuster sa répartition du flux vers les zones hypoperfusées, pour autant que son alimentation soit suffisante (pression artérielle élevée, débit cardiaque normal, hémoglobine normale). Cette flexibilité explique les disparités observées entre l'incidence de la paraplégie et l'étendue ou la durée du clampage aortique. Mais une situation de vol peut aussi s'installer lorsque l'anévrysme est ouvert et que des artères intercostales saignent dans le champ opératoire, drainant ainsi le débit du réseau vers l'extérieur.
La mesure directe de la pression dans le réseau collatéral révèle que celle-ci est de 25% inférieure à la pression aortique. D'autre part, elle baisse lorsque le flux est dépulsé comme pendant la CEC, même si la pression moyenne est identique [8]. La pression dans le réseau périmédullaire diminue en fonction du nombre d'artères segmentaires interrompues, mais elle se rétablit en 24-48 heures par le jeu des collatérales.
Pression de perfusion
La pression de perfusion locale de la moelle est égale à la différence entre la pression dans les artères du réseau médullaire et la pression ambiante entretenue par le liquide céphalo-rachidien (PLCR) et par la PVC, selon laquelle est la plus élevée des deux (Figure 24.14):
Pperfusion médullaire (PPm) = Pmoy aorte distale (PAMdist) – PLCR (ou PVC)
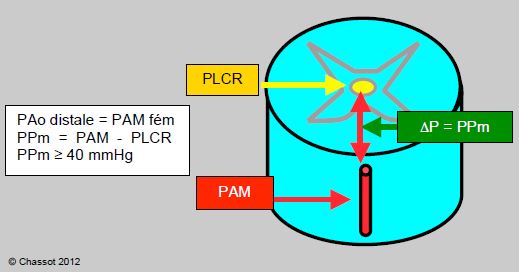
Figure 24.14 : La pression de perfusion médullaire (PPm) est définie par la différence qui règne entre la pression moyenne dans l'artère spinale antérieure (PAM) et la pression du LCR (PLCR). Ce ΔP doit rester supérieur ou égal à 50 mmHg. La PAM est la pression dans l'aorte distale, soit celle de la CEC fémorale. Le réseau collatéral implique cependant une perte de pression par rapport à la pression artérielle systémique.
La baisse de la pression de perfusion médullaire qui conduit à l’ischémie peut donc survenir sur deux mécanismes différents:
- Baisse de la pression artérielle dans l’aorte (hypotension, clampage);
- Augmentation de la pression du LCR et de la PVC.
La PPm minimale est de 50 mmHg [15]. La pression aortique moyenne doit donc être > 70 mmHg pour maintenir une perfusion médullaire adéquate, puisque la pression du LCR est de 10-15 mmHg et la pression du réseau collatéral plus basse que celle de l'aorte. En dessous de cette valeur, la pulsatilité normale de la moelle disparaît. En clinique, l'objectif de pression est plus facile à atteindre si les malades ont interrompu leur traitement anti-hypertenseur en préopératoire [13].
Lorsqu’on clampe l’aorte thoracique descendante, la pression distale est trop basse pour remplir ces conditions et la moelle souffre d’ischémie. De plus, l'hémorragie rétrograde par les artères intercostales qui saignent dans l'aorte ouverte dans le champ opératoire "vole" du sang au lit médullaire et aggrave l'ischémie [4,21]. Dans le réseau collatéral de la moelle, le flux dépend davantage de la pression artérielle que du débit cardiaque [10].
Clampage aortique
Trois facteurs principaux déterminent la gravité des séquelles neurologiques.
- Le niveau du clampage aortique;
- L’étendue du clampage aortique;
- La durée de l’ischémie médullaire.
Lorsque l’aorte est interrompue au niveau médiothoracique, la zone ischémiée correspond aux segments médullaires les plus fragiles parce que les plus dépendants de l’apport sanguin des branches intercostales et de l’artère d'Adamkiewicz (segments D3 à D10). La perfusion n’est assurée que par les collatérales issues de l’artère vertébrale et des premières intercostales depuis le haut et par les artères lombaires depuis le bas. La pression de perfusion résiduelle en-dessous du clamp dépend de la pression fournie par le VG au-dessus du clamp. Un des techniques pour rétablir une perfusion distale satisfaisante est d'établir un circuit de CEC fémoto-fémoral qui assure la vascularisation de la zone ischémiée (Figure 24.15).
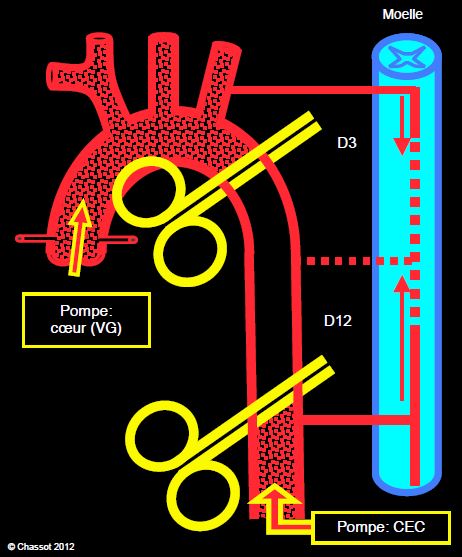
Figure 24.15 : Schéma d’une intervention sur l’aorte descendante dans sa partie médiothoracique. La perfusion de la crosse en amont du clamp est assurée par le VG, alors que la perfusion en aval du clamp est fournie par la pompe de CEC. La zone située entre les deux clamps n’est plus vascularisée. L’apport de sang pour la moelle épinière à ce niveau (D3-D12) dépend des collatérales venues de l’artère vertébrale et des artères lombaires ; si ce réseau est insuffisant, la moelle risque une ischémie, car ses vaisseaux nourriciers thoraciques (intercostales, artère d’Adamkiewicz) sont interrompus.
Il est évident que le risque augmente avec l’étendue de la zone aortique opérée. Comme l’anatomie de la perfusion médullaire est très variable selon les individus, le risque neurologique est toujours présent quel que soit le niveau de clampage de l’aorte. Il est le plus élevé au niveau médiothoracique, moins important au niveau diaphragmatique et le plus faible au niveau abdominal, mais il n’est jamais nul (Figure 24.16).
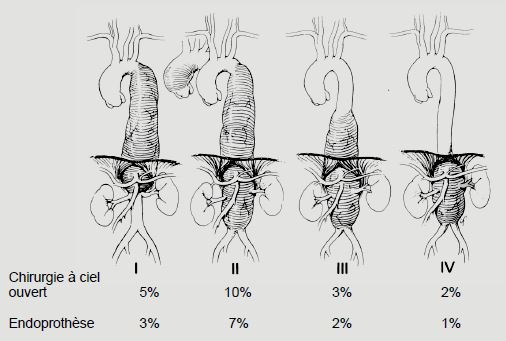
Figure 24.16 : Incidence de l’ischémie médullaire entrainant des paraplégies en fonction du type d’anévrysme, de son étendue, et du mode de chirurgie [d'après réf 1,7,12,17].
Les résultats sont largement dépendants de l'expérience du chirurgien, du volume de cas de l'institution et d'un protocole de prise en charge multimodale. Les chiffres mentionnés dans la Figure 18.38 sont un moyenne récente de centres qui ont une bonne expérience de ce genre de chirurgie [5,13]. Dans les situations d'urgence, le risque s'élève jusqu'à 15% [20].
Le deuxième facteur déterminant essentiel est la durée de l'ischémie. En dessous de 30 minutes, l'incidence des séquelles neurologiques est inférieure à 5%; au-delà de 60 minutes, elle dépasse 25% et peut atteindre jusqu'à 90% (Figure 24.17) [16,18].
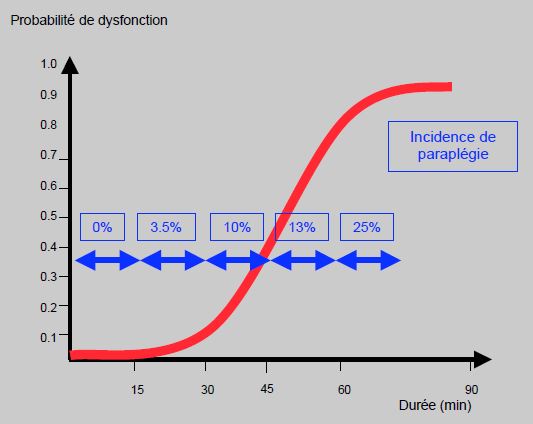
Figure 24.17 : Courbe de la tolérance ischémique de la moelle représentant la probabilité de paraplégie ou de paraparésie en fonction de la durée de l'interruption du flux sanguin [d'après réf 14,16,18].
En l'absence de complications ou de pathologies associées, la limite de durée "sûre" chez l'adulte est de 20 - 25 minutes de clampage. Au-delà de ce temps, des techniques de vicariance ou de protection doivent être envisagées [13].
D'autres facteurs entrent encore en ligne de compte comme éléments de risque pour les séquelles neurologiques.
- L'âge, particulièrement au-delà de 65 ans.
- L'anatomie vasculaire et la présence de collatérales (absentes dans les cas aigus mais développées dans les situations chroniques).
- La longueur du segment aortique remplacé (nombre d’artères et de collatérales exclues).
- Le remplacement préalable de l’aorte abdominale (perte de collatérales lombaires).
- La pression de perfusion médullaire (PPm) en dessous du clamp; le flux dans les collatérales est pression-dépendant, directement proportionnel à la PPm.
- L'utilisation de technique protectrices médullaires (drainage du LCR) ou de techniques de perfusion continue (CEC partielle).
La moelle court un risque ischémique également au moment du déclampage à cause de l’hypotension artérielle, de l’hypercarbie, de l’acidose métabolique et de l’œdème médullaire lié aux lésions de reperfusion [9].
| Ischémie médullaire |
|
Le risque d’ischémie médullaire et de paraplégie est fonction de :
- Faible collatéralisation de l’artère spinale antérieure
- Etendue de la lésion et du remplacement aortique (anévrysme thoraco-abdominal, cure de AAA préalable)
- Durée du clampage
- Age (> 65 ans)
- Hypoperfusion peropératoire (hypotension, hypovolémie, hypoxie, anémie)
- Technique chirurgicale (réimplantation intercostale, CEC distale)
- Technique d’anesthésie (contrôle hémodynamique, drainage lombaire)
Pression de perfusion médullaire : PPm = PAM - Pression LCR.
Les deux conditions essentielles pour diminuer le risque ischémique médullaire sont la réduction du temps de clampage et le maintien de la pression de perfusion de la moelle.
|
© CHASSOT PG, Juin 2008, dernière mise à jour, Juin 2018
Références
- ACHER C, WYNN MM. Outcomes in open repair of the thoracic and thoracoabdominal aorta. J Vasc Surg 2010; 52:3S-9S
- AFIFI S. Pro: Cerebrospinal fluid drainage protects the spinal cord during thoracoabdominal aortic reconstruction surgery. J Cardiothorac Vasc Anesth 2002; 16:643-9
- DJINDJIAN R. Arteriography of the spinal cord. Am J Roentgenol 1969; 107:461-78
- DRENGER B, PARKER SD, FRANK SM, BEATTIE C. Changes in cerebrospinal fluid pressure and lactate concentration during thoracoabdominal aortic aneuvrysm surgery. Anesthesiology 1997; 86:41-7
- ERBEL R, ABOYANS V, BOILEAU C, et al. 2014 ESC Guidelines on the diagnosis and treatment of aortic diseases. Eur Heart J 2014; 35:2873-926
- ETZ CD, KARI FA, MUELLER CS, et al. The collateral network concept: a reassessment of the anatomy of spinal cord perfusion. J Thorac Cardiovasc Surg 2011; 141:1020-8
- ETZ CD, WEIGANG E, HARTERT M, et al. Contemporary spinal cord protection during thoracic and thoracoabdominal aortic surgery and endovascular repair: a position paper of the vascular domain of the European Association for Cardio-Thoracic Surgery. Eur J Cardiothor Surg 2015; 47:943-57
- ETZ CD, ZOLI S, BISCHOFF MS, et al. Measuring the collateral network pressure to minimize paraplegia risk in thoracoabdominal aneurysm resection. J Thorac Cardiovasc Surg 2010; 140:S125-30
- FEDOROW CA, MOON MC, MUTCH AC, GROCOTT HP. Lumbar cerebrospinal fluid drainage for thoracoabdominal aortic surgery: Rationale and practical considerations for management. Anesth Analg 2010; 111:46-58
- GELMAN S. The pathophysiology of aortic cross-clamping and unclamping. Anesthesiology 1995; 82:1026-60
- GHARAGOZLOO F, NEVILLE RF, COS JL. Spinal cord protection during surgical procedures on the descending thoracic and thoracoabdominal aorta: A critical overview. Sem Thorac Cardiovasc Surg 1998; 10:73-86
- GREENBERG RK, LU Q, ROSELLI EE, et al. Contemporary analysis of descending thoracic and thoracoabdominal aneurysm repair: A comparison of endovascular and open techniques. Circulation 2008; 118:808-17
- LINDSAY H, SRINIVAS C, DJAIANI G. Neuroprotection during aortic surgery. Best Pract Res Clin Anaesthesiol 2016; 30:283-303
- LIVESAY JJ, COOLEY DA, VENTEMIGLIA RA, et al. Surgical experience in descending thoracic aneuvrysmectomy with and without adjuncts to avoid ischemia. Ann Thorac surg 1984;39:37-46
- OKA Y, MIYAMOTO T. Prevention of spinal cord injury after cross-clamping of the thoracic aorta. Japan J Surg 1984; 14:159-62
- SHENAQ SA, SVENSSON LG. Paraplegia following aortic surgery. J Cardiothorac Vascul Anesth 1993; 7:81-94
- SINHA A, CHEUNG AT. Spinal cord protection and thoracic aortic surgery. Curr Opin Anaesthesiol 2010; 23:95-102
- SVENSSON LG, CRAWFORD ES, HESS KR, et al. Experience with 1509 patients undergoing thoracoabdominal aortic operations. J Vasc Surg 1993; 17:357-70
- WADOUH F, LINDERMANN EM, ARNDT CF, et al. The arteria radicularis magna as a decisive factor influencing spinal cord damage during aortic occlusion. J Thorac Cardiovasc Surg 1984; 88:1-10
- WILLIAMS JB, PETERSON ED; ZHAO Y, et al. Contemporary results for proximal aortic replacement in North America. J Am Coll Cardiol 2012; 60:1156-62
- WOLOZYN TT, CORRADO P, MARINI P. et al. Cerebrospinal fluid drainage does not counteract the negative effect of sodium nitroprusside on spinal cord perfusion pressure during aortic cross-clamping. Curr Surg 1989; :489
