Le phénomène de préconditionnement a laissé entrevoir de nouvelles perspectives pour protéger le myocarde contre l'ischémie, mais ces promesses n’ont pas toujours été tenues. Le préconditionnement consiste en une amélioration de la tolérance à l'ischémie par de brefs épisodes d'occlusion du flux (entre 1 et 5 minutes) suivis de périodes de reperfusion (de 1 à 30 minutes) ; la durée de la protection pour une ischémie ultérieure est de 1 à 2 heures [39,45]. Expérimentalement, cette technique permet de réduire la taille de l'infarctus de 50-80%. Il existe plusieurs formes de préconditionnement.
- Préconditionnement ischémique par occlusion itérative de la coronaire (par exemple par le ballon d’angioplastie).
- Préconditionnement pharmacologique : il s’est avéré que certaines substances comme les gaz halogénés, le nicorandil ou la cyclosporine A ont des effets protecteurs similaires lorsqu’elles sont administrées avant l’épisode ischémique.
- Postconditionnement : les occlusions itératives ou les halogénés sont également efficaces lorsqu’ils sont administrés après l’épisode ischémique, pendant la période de reperfusion.
- Préconditionnement à distance : l’occlusion artérielle itérative d’un membre par une manchette à pression induit une protection contre l’ischémie ultérieure d’autres organes.
Aspects physiopathologiques
De multiples études expérimentales menées chez de nombreuses espèces de mammifères ont démontré une meilleure récupération fonctionnelle après une période d’ischémie ou une diminution de la taille de l’infarctus après ligature coronaire, lorsque l’ischémie est précédée de clampages itératifs de courte durée ou lorsque les animaux testés sont endormis sous halogénés [7,46,69]. L’halothane, l’isoflurane, le desflurane et le sevoflurane ont tous un effet important s'ils sont administrés avant la période d'ischémie et pendant la reperfusion immédiate du myocarde [14]. Cet effet protecteur a été décrit avec quatre catégories d’agents anesthésiques : les halogénés, les opiacés, le xénon et l’hélium [18,21,58].
Le préconditionnement par les halogénés est lié à plusieurs mécanismes cellulaires partiellement élucidés, mais qui convergent vers deux phénomènes principaux (Figure 5.146) [14,21,35, 48,51,58,67,68] :
- L’ouverture des canaux potassiques dépendants de l’ATP (KATP) situés sur les membranes des mitochondries et sur celles de la cellule. Cette ouverture déclenche un courant potassique repolarisant vers l’intérieur de la cellule ; celui-ci conduit à une diminution de la charge en calcium ionisé (Ca2+) du cytoplasme cellulaire et du cytosol des mitochondries (d’où préservation du fonctionnement mitochondrial). Le NO à faible concentration ouvre également les canaux potassiques.
- L'occlusion des canaux de perméabilité des mitochondries (MPTP : mitochondrial permeability transition pore). Normalement fermés, ceux-ci s'ouvrent et relâchent des radicaux libres toxiques (ROS : reactive oxygen species) au sein de la cellule lors de la reperfusion. Les ROS provoquent une peroxydation des lipides et des lipoprotéines. L’ouverture des canaux MPTP permet également aux cations de rentrer dans la mitochondrie et d'en modifier le fonctionnement (surcharge calcique, effacement des cristae, déplétion en ATP). Le NO à faible concentration ferme les canaux MTPT, mais il les ouvre à forte concentration. Leur fermeture préserve donc la cellule des dégâts causés par la libération des ROS, du cytochrome c et des caspases mitochondriaux.
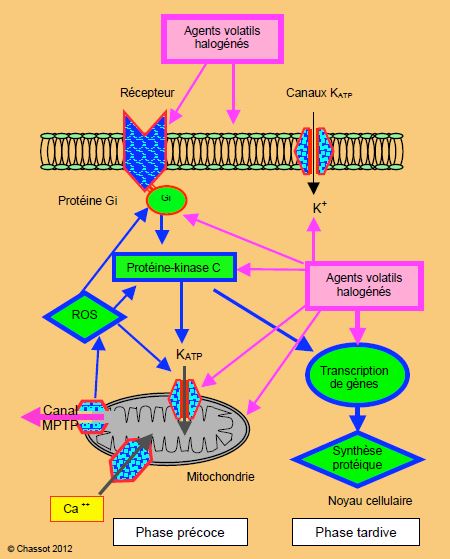
Figure 5.146 : Mécanismes possibles du préconditionnement ischémique par les agents volatils halogénés. Une substance déclenche une cascade de transductions intracellulaires qui aboutit à un effecteur qui assure une protection contre les effets de l'ischémie. L'ouverture des canaux potassiques (KATP) est un premier mécanisme. Les halogénés agiraient par modulation de la protéine G, par stimulation de la protéine-kinase C, par action directe sur les canaux KATP, et/ou par production de ROS (substrats réactifs à l'oxygène: anions superoxyde tels H2O2, H-, O2-, peroxynitrite) par les mitochondries, qui activent les canaux KATP. Deuxièmement, les canaux MTPT sont maintenus fermés par les agents préconditionnants, ce qui empêche la libération de cytochrome et de ROS dans le cytoplasme par la mitochondrie. Produits en petites quantités, les ROS sont cardioprotecteurs, mais sont toxiques en forte concentration [58,68].
La protection contre les effets de l'ischémie est attribuée à l'effet de sommation de la baisse du Ca2+ mitochondrial, de la régulation des ROS, de la préservation de la fonction mitochondriale, de la conservation des réserves énergétiques et de l'interférence avec les mécanisme apoptotiques. Ces phénomènes correspondent à la phase précoce de la cardioprotection, dont la durée est limitée à 1-2 heures. Il existe une deuxième phase, tardive, qui survient à 24 heures et dure jusqu'à 3 jours; elle offre moins de protection, et dépend d'un effet sur la transcription des gènes au niveau du noyau cellulaire, qui induit la synthèse de protéines à capacité cytoprotectrice ayant la propriété de moduler l'activation de l'apoptose [16].
Le post-conditionnement, qui permet également d'améliorer la tolérance myocardique à l’ischémie, est basé sur les mêmes mécanismes d’ouverture des canaux KATP et de fermeture des pores MPTP, auxquels s’ajoutent un blocage de la contracture post-ischémique (baisse du Ca2+ intracytoplasmique) et l’activation de kinases anti-apoptose [13,21]. Pour être efficace, l’agent doit être présent dans les secondes qui suivent la reperfusion. D’autres substances ont le même effet : facilitateurs des canaux KATP (nicorandil, adénosine), bloqueur des canaux MPTP (cyclosporine A).
Certains facteurs et certaines substances interfèrent avec les mécanismes du préconditionnement.
- L’hyperglycémie abolit l’effet protecteur du préconditionnement, probablement par une inhibition des canaux KATP [34] ;
- L’effet protecteur des halogénés disparaît avec l’âge, bien que le myocarde sénescent soit particulièrement sensible à l’ischémie [5,55] ;
- Le myocarde en insuffisance ventriculaire ou profondément remodelé par l’hypertrophie ne semble plus réceptif aux effets bénéfiques des halogénés [58] ;
- Le thiopental et la kétamine bloquent le préconditionnement [43,67] ;
- Les inhibiteurs COX-2, les sulfonylurées, les β-bloqueurs et l’aprotinine interfèrent avec le fonctionnement des canaux KATP et bloquent le précondionnement [1,20,21,44,49].
Aspects cliniques
Certains malades décrivent de l'angor au début de l'effort (angor d'échauffement), alors que les efforts subséquents sont asymptomatiques ; il s'agit d'une forme de préconditionnement ischémique spontané.
En recherche clinique, ce phénomène s’est révélé être une réalité qui peut modifier le choix des agents d’anesthésie. En effet, l’isoflurane, le desflurane et le sevoflurane présentent un effet protecteur contre l’ischémie myocardique, pour autant que la concentration inspirée soit de 1 – 1.5 MAC, que la substance soit administrée au moins trente minutes avant l’événement ischémique et pendant au moins 10 minutes [25,33,67]. L’effet maximal est obtenu avec une administration continue, y compris pendant la CEC [9]. En chirurgie de revascularisation coronarienne, de nombreuses études cliniques ont démontré un certain effet protecteur : le résultat est une meilleure récupération de la fonction myocardique, une diminution des lésions ischémiques, et un abaissement des marqueurs de lésions cellulaires (troponine T ou I, BNP, CK-MB) ou de réaction inflammatoire (TNFα) par rapport aux malades endormis avec des agents intraveineux [8,11,19,31,62]. La fonction contractile immédiate est mieux préservée et le séjour en soins intensifs postopératoires est raccourci [15,56]. Cette cardioprotection est également observée dans la chirurgie à coeur battant [8,23]. En pratique, l'effet maximal est obtenu en utilisant l’isoflurane, le desflurane ou le sevoflurane (1-1.5 MAC) en continu avant, pendant et après la CEC pour bénéficier de l’effet additif du pré- et du post-conditionnement [16,37]. Cependant, le seul résultat clair à ce jour est une meilleure récupération de la fonction myocardique et un abaissement des marqueurs de lésions cellulaires (troponine T ou I, CK-MB) ou de réaction inflammatoire (TNFα) [12,31,62]. Les effets sur la mortalité sont marginaux ou douteux [2,46].
Une dizaine de méta-analyses a été publiée à ce jour [47]. Toutes confirment les bénéfices cellulaires des halogénés par rapport à une anesthésie entièrement intraveineuse lors de pontages aorto-coronariens en CEC: baisse des biomarqueurs de l'ischémie (CK-MB, troponines, BNP) et meilleure reprise fonctionnelle immédiate des ventricules [56]. Mais toutes ne trouvent pas un impact notable sur la morbidité ni la mortalité des patients [3,50,57,65]. Certaines tendent à démontrer que le sevoflurane ou le desflurane, qui paraissent les agents les plus efficaces, réduisent les risques d’infarctus de moitié et ceux de décès de 30-70% par rapport aux agents intraveineux [3,4,17,22,37,38]. Une des plus récentes atteste une baisse du taux de mortalité (OR 0.55) et de complications postopératoires, particulièrement pulmonaires (OR 0.71) [61]. Malgré la fragilité des résultats cliniques obtenus jusqu'ici [46,50], il n'en reste pas moins que la tendance du préconditionnement à baisser la morbidité myocardique en chirurgie de revascularisation coronarienne pousse à recommander leur utilisation comme agent d'anesthésie principal lors de pontages aorto-coronariens [47].
Si l’effet bénéfique des halogénés est bien démontré en chirurgie cardiaque, il n’en est pas de même en chirurgie générale. Seuls des cas de chirurgie vasculaire semblent tirer avantage des volatils par rapport aux agents intraveineux, sous forme d’une diminution des troponines postopératoires [13]. Mais aucune étude n'a prouvé d'effet protecteur des halogénés sur la morbi-mortalité dans le contexte de la chirurgie non-cardiaque [41,61]. Ceci n'est pas illogique, puisque le préconditionnement agit comme un modulateur des effets de l'ischémie/reperfusion; en-dehors du cadre d'un clampage/déclampage coronarien, cet effet spécifique a peu de chance d'apparaître [10]. Par ailleurs, les halogénés agissent favorablement sur la mVO2 et le système sympathique dans le cadre de l'ischémie coronarienne, ce qui biaise les résultats en faveur de ces substances dans tout contexte chirurgical.
Le sevoflurane ayant également un effet protecteur sur la fonction rénale [31], il s'est avéré que l'effet préconditionnement se traduit par une réduction de 11-18% de l'incidence de néphropathie postopératoire [66]. A la question de savoir s'il existe un préconditionnement pour d’autres organes, on a effectivement pu démontrer un effet analogue sur le foie, le cerveau et le poumon, mais les recherches sont moins avancées que sur le cœur.
Les opiacés stimulants les récepteurs δ ont probablement un effet de préconditionnement [53]. La morphine, par exemple, potentialise l'effet de l'isoflurane [40]. Aux doses utilisées en clinique, aucun des agents intraveineux (propofol, etomidate, midazolam) n’a un effet comparable [11,12]. Les barbiturés et la kétamine ont un effet antagoniste [43,67]. Le propofol possède certaines propriétés cardioprotectrices apparemment différentes de celles des halogénés, ce qui complique singulièrement les comparaisons entre anesthésie sous agents volatils et anesthésie intraveineuse [30].
Parmi les substances de la pharmacopée cardiologique, le nicorandil (Dancor®) s'est avéré avoir un effet protecteur lors d'angioplastie [32,52] ; cette substance augmente la perméabilité des canaux potassiques KATP. Par contre, d'autres substances ont un effet freinateur sur le préconditionnement ; en clinique, elles auront tendance à aggraver les lésions ischémiques. Il s'agit de l’aprotinine, des inhibiteurs COX-2 sélectifs, et des anti-diabétiques oraux (sulfonylurées, glitazones) qui inhibent les canaux potassiques [1,20]. Ces deux dernières catégories de substances, déjà responsables d’une augmentation de mortalité en chirurgie cardiovasculaire, doivent donc être stoppées plusieurs jours avant l'opération chez les ischémiques ; dans le cas du diabète, les sulfonylurées sont remplacées momentanément par de l'insuline.
Préconditionnement à distance
Le précontionnement à distance (Remote ischemic preconditioning) consiste à induire des ischémies dans une masse musculaire squelettique en vue d’augmenter la résistance d’un autre organe par voie neurogène ou humorale. La transmission se fait probablement par le biais de médiateurs neuronaux ou humoraux encore mal identifiés [27,28]. Quelques études cliniques démontrent un bénéfice à cette technique simple, inoffensive et peu coûteuse. Le gonflement d’une manchette à pression au bras gauche avant la CEC (3-4 épisodes itératifs de 5 minutes à 200 mmHg) diminue le taux de troponine I postopératoire de 17% ainsi que les complications cardiaques (HR 0.35) et la mortalité (HR 0.27) [59]. Bien qu'elle trouve une réduction des troponines et des CK-MB, une méta-analyse de 30 études cliniques ne parvient cependant pas à mettre en évidence un bénéfice en terme d'infarctus ou de mortalité [63]. L'effet favorable est présent lorsque l’anesthésie est conduite sous halogéné (isoflurane) mais il semble absent sous annesthésie intraveineuse au propofol [36,63]. Malheureusement, deux grands essais cliniques randomisés et contrôlés (ERICCA, 1612 patients, et RIPHeart, 1385 patients) n’ont démontré aucun bénéfice du préconditionnement à distance avant chirurgie cardiaque en CEC sur aucun paramètre examiné (troponine, FA, insuffisance rénale, séjour hospitalier, mortalité) [26,42].
Postconditionnement
Alors que le préconditionnement n’est praticable que lorsque l’ischémie est programmée au cours d’une intervention, le postconditionnement présente l’intérêt d’agir au cours de la revascularisation qui suit un infarctus, par nature imprévisible : il est facile de procéder à des gonflements répétés du ballon d’angioplastie une fois la coronaire reperméabilisée. Lors d'angioplaste coronarienne, les premières études ont mis en évidence une réduction significative des biomarqueurs (20-30%) et de la taille de l'infarctus résiduel (36%), mais pas d'effet sur la morbi-mortalité [6]. Un travail ultérieur sur des patients souffrant de STEMI revascularisés par angioplastie d'urgence a révélé une réduction de moitié du taux d'infarcissement, d'AVC et de mortalité (HR 0.49), particulièrement lorsque l'occlusion coronarienne est totale [54]. Certaines études ont montré une réduction de la taille des lésions en cas de STEMI [60,64], mais les résultats globaux sont pour l’instant plutôt inconsistants, voire négatifs [24].
Conclusion
Les données liées au préconditionnement sont assez touffues et semblent manquer de cohérence, car les résultats dépendent d’une multitude de facteurs qui rendent les études mal comparables : population de malades, localisation et collatéralisation des lésions myocardiques, mode d’administration de l’halogéné, technique d’anesthésie, contrôle hémodynamique, qualité de la cardioplégie, technique chirurgicale, autres agents à effet protecteur, etc [46]. La majorité des études montre une nette diminution de la souffrance ischémique myocardique. Toutefois, l’impact clinique de ce bénéfice n’est pas encore formellement prouvé. On est dans une situation identique à celle du pari de Pascal (Blaise Pascal, 1623-1662) : si la protection myocardique offerte par les halogénés est significative, on en bénéficie en les utilisant comme agents pour assurer l’anesthésie, et si elle ne l’est pas, on ne perd rien à utiliser ces substances plutôt que des agents intraveineux. Même si les évidences cliniques et expérimentales parlent essentiellement pour une amélioration de la reprise fonctionnelle immédiate et pour une diminution des lésions ischémiques cellulaires sans preuve manifeste d’un impact à long terme sur la morbi-nortalité, il est justifié de préférer un halogéné comme agent d'anesthésie pour la chirurgie de revascularisation coronarienne car on a tout à y gagner [29]. Bien que les données prouvant un impact en chirurgie non-cardiaque soient insignifiantes, il n’est pas interdit d’extrapoler les résultats obtenus en chirurgie cardiaque à la chirurgie générale vu les bénéfices potentiels. En l'état actuel de nos connaissances, on peut donc soutenir que le maintien de l’anesthésie par des halogénés chez le coronarien présente probablement des avantages supérieurs à ses risques, particulièrement en chirurgie de revascularisation et dans certaines catégories de patients [2].
| Le préconditionnement |
|
Le préconditionnement est une amélioration de la tolérance à l'ischémie par de brefs épisodes d'occlusion du flux suivis de périodes de reperfusion. Un effet protecteur identique est possible avec 4 agents anesthésiques (halogénés, opiacés, xénon, hélium) et certaines substances (nicorandil, cyclosporine); seuls les halogénés ont une activité clinique prouvée. Certaines substances inhibent le préconditionnement: anti-COX2, sulfonylurée, thiopental, kétamine, aprotinine, béta-bloqueurs.
Postconditionnement: protection anti-ischémique lorsque l'agent n'est administré qu'à la reperfusion.
Préconditionnement à distance: épisodes itératifs d’ischémie musculaire (manchette à pression sur un membre) qui diminuent les effets d’une ischémie ultérieure d’autres organes.
En chirurgie de revascularisation coronarienne, les halogénés améliorent la récupération de la fonction myocardique, minimisent les lésions tissulaires et diminuent peut-être le risque d'infarctus; l'effet est maximal si l'halogéné est utilisé tout au long de l'opération, y compris en CEC. La morbidité et la mortalité pourraient être diminuées.
Conclusion clinique: chez le coronarien, le maintien de l’anesthésie par des halogénés présente des avantages de protection myocardique par rapport aux agents intraveineux.
|
© CHASSOT PG Août 2010, dernière mise à jour Novembre 2018
Références
- ALCINDOR D, KROLIKOWSKI JG, PAGEL PS, et al. Cycloxygenase-2 mediates ischemic, anesthetic and pharmacologic preconditioning in vivo. Anesthesiology 2004; 100:547-54
- BETTEX DA, WARNER P, BOSSHART M, et al. Role of sevoflurane in organ protection during cardiac surgery in children: a randomized controlled trial. Interact Cardiovasc Thorac Surg 2015; 20:157-65
- BIGNAMI E, BIONDI-ZOCCAI G, LANDONI G, et al. Volatile anesthetics reduce mortality in cardiac surgery. J Cardiothorac Vasc Anesth 2009; 23:594-9
- BIGNAMI E, GRECO T, BARILE L, et al. The effect of isoflurane on survival and myocardial infarction: A meta-analysis of randomized controlled studies. J Cardiothorac Vasc Anesth 2013; 27:50-8
- BOENGLER K, SCHULZ R, HEUSCH G. Loss of cardioprotection with ageing. Cardiovasc Res 2009; 83:247-61
- BREWOOD D, KRANKE P, KULIPERS M, et al. Remote ischemic conditioning to protect against ischemia-reperfusion injury: a systemtic review and meta-analysis. PLoS One 2012; 7:e42179
- CASON BA, GAMPERL AK, SLOCUM RE, HICKEY RF. Anesthetic-induced preconditioning: previous administration of isoflurane decreases myocardial infarct size in rabbits. Anesthesiology 1997; 87: 1182-90
- CONZEN PF, FISCHER S, DETTER C, PETER K. Sevoflurane provides greater protection of the myocardium than propofol in patients undergoing off-pump coronary artery bypass surgery. Anesthesiology 2003; 99:826-33
- DE HERT SG. Cardioprotection with volatile anesthetics: clinical relevance. Curr Opin Anesthesiol 2004; 17:57-62
- DE HERT SG. Cardiac troponins and volatile anaesthetics in on-pump coronary surgery. How much longer do we need to state the obvious? Eur J Anesthesiol 2016; 33:393-5
- DE HERT SG, BROECKE PW, MERTENS E, et al. Sevoflurane but not propofol preserves myocardial function in coronary artery patients. Anesthesiology 2002; 97: 42-9
- DE HERT SG, CROMHEECKE S, TEN BROECKE PW, et al. Effects of propofol, desflurane and sevoflurane on recovery of myocardial function after coronory surgery in elderly high-risk patients. Anesthesiology 2003; 99:314-23
- DE HERT SG, LONGROIS D, YANG H, et al. Does the use of a volatile anesthetic regimen attenuate the incidence of cardiac events after vascular surgery ? Acta Anaesthesiol Belg 2008; 59:19-25
- DE HERT SG, TURANI F, MATHUR S, STOWE DF. Cardioprotection with volatile anesthetics: mechanisms and clinical implications. Anesth Analg 2005; 100:1584-95
- DE HERT S, VAN DER LINDEN PJ, CROMHEECKE S, et al. Choice of primary anesthetic regimen can influence intensive care unit length of stay after coronary surgery with cardiopulmonary bypass. Anesthesiology 2004; 101:9-20
- DE HERT S, VAN DER LINDEN PJ, CROMHEECKE S, et al. Cardioprotective properties of sevoflurane in patients undergoing coronary surgery with cardiopulmonary bypass are related to the modalities of its administration. Anesthesiology 2004; 101:299-310
- DE HERT S, VLASSELAERS D, BARBE R, et al. A comparison of volatile and non volatile agents for cardioprotection during on-pump coronary surgery. Anaesthesia 2009; 64:953-60
- DE KLAVER MJ, MANNING L, PALMER LA, RICH GF. Isoflurane pretreatment inhibits cytokine-induced cell death in cultured rat smooth muscle cells and human endothelial cells. Anesthesiology 2002; 97: 24-32
- EL AZAAB SR, ROSSEEL PM, DE LANGE JJ, et al. Effect of sevoflurane on the ex vivo secretion of TNF-alpha during and after coronary artery bypass surgery. Eur J Anaesthesiol 2003; 20:380-4
- FORLANI S, TOMAI F, De PAULIS R, et al. Preoperative shift from glibenclamide to insulin is cardioprotective in diabetic patients undergoing coronary artery bypass surgery. J Cardiovasc Surg 2004; 45:117-2
- FRÄSSDORF J, DE HERT S, SCHLACK W. Anaesthesia and myocardial ischaemia/reperfusion injury. Br J Anaesth 2009; 103:89-98
- GARCIA C, JULIER K, BESTMANN L, et al. Preconditioning with sevoflurane decreases PECAM-1 expression and improves one-year cardiovascular outcomes in coronary artery bypass graft surgery. Br J Anaesth 2005; 94:159-65
- GUARRACINO F, LANDONI G, TRITAPEPE L, et al. Myocardial damage prevented by volatile anaesthetics: A multicenter randomized controlled study. J Cardiothorac Vasc Anesth 2006; 20:477-83
- HAHN JY, SONG YB, KIM EK, et al. Ischemic postconditioning during primary percutaneous coronary ontervention. The effects of postconditioning on myocardial reperfusion in patients with ST-segment elevation myocardial infarction (POST) randomized trial. Circulation 2013; 128:1889-96
- HAROUN-BIZRI S, KHOURY SS, CHEHAB IR, KASSAS CM, BARAKA A. Does isoflurane optimize myocardial protection during cardiopulmonary bypass? J Cardiothorac Vasc Anesth 2001; 15: 418-21
- HAUSENLOY DJ, CANDILIO L, EVANS R, et al. Remote ischemic preconditioning and outcomes of cardiac surgery. N Engl J Med 2015; 373:1408-17
- HAUSENLOY DJ, YELLON DM. Ischaemic conditioning and reperfusion injury. Nat Rev Cardiol 2016; 13:193-209
- HEUSCH G, BOTKER HE, PRZYKLENK K, et al. Remote ischemic conditioning. J Am Coll Cardiol 2015; 65:177-95
- HILLIS LD, SMITH PK, ANDERSON JL, et al. 2011 ACCF/AHA Guideline for coronary artery bypass graft surgery: Executive summary. Anesth Analg 2012; 114:11-45
- JAKOBSEN CJ, BERG H, HINDSHOLM KB, et al. The influence of propofol versus sevoflurane anesthesia on outcome in 10’535 cardiac surgical procedures. J Cardiothorac Vasc Anesth 2007; 21:664-71
- JULIER K, DA SILVA R, GARCIA C, et al. Preconditioning by sevoflurane decreases biochemical markers for myocardial and renal dysfunction in coronary artery bypass graft surgery. Anesthesiology 2003; 98:1315-27
- KANEKO T, SAITO Y, HIKAWA Y, et al. Dose-dependent prophylactic effect of nicorandil, an ATP-sensitive potassium channel opener, on intra-operative myocardial ischaemia in patients undergoing major abdominal surgery. Br J Anaesth 2001; 86:332-7
- KEHL F, KROLIKOWSKI JG, MRAOVIC B, et al. Is isoflurane-induced preconditioning dose related? Anesthesiology 2002; 96: 675-80
- KEHL F, KROLIKOWSKI JG, MRAOVIC B, et al. Hyperglycemia prevents isoflurane-induced preconditioning against myocardial infarction. Anesthesiology 2002; 96:183-8
- KERSTEN JR, SCHMELING TJ, PAGEL PS, et al. Isoflurane mimics ischemic preconditioning via activation of KATP channels. Anesthesiology 1997; 87:361-8
- KOTTENBERG E, THIELMANN M, BERGMANN L, et al. Protection by remote ischemic preconditioning during coronary artery bypass graft surgery with isoflurane but not propofol – a clinical trial. Acta Anaesthesiol Scand 2012; 56:30-8
- LANDONI G, BIONDI-ZOCCAI GGL, ZANGRILLO A, et al. Desflurane and sevoflurane in cardiac surgery: A meta-analysis of randomized clinical rials. J Cardiothorac Vasc Anesth 2007; 21:502-11
- LANDONI G, GRECO T, BIONDI-ZOCCAI G, et al. Anaesthetic drugs and survival: a Bayesian network meta-analysis of randomized trials in cardiac surgery. Br J Anaesth 2013; 111:886-96
- LAWSON CS, DOWNEY JM. Preconditioning: State of the art myocardial protection. Cardiovasc Res 1993; 27:542-50
- LUDWIG LM, PATEL HH, GROSS GJ, et al. Morphine enhances pharmacological preconditioning by isoflurane. Anesthesiology 2003; 98:705-11
- LURATI BUSE GA, SCHUMACHER P, SEEBERGER E, et al. Randomized comparison of sevoflurane versus propofol to reduce perioperative myocardial ischemia in patients undergoing noncardiac surgery. Circulation 2012; 126:2696-704
- MEYBOHM P, BEIN B, BROSTEANU O, et al. A multicenter trial of remote ischemic preconditioning for heart surgery. N Engl J Med 2015; 373:1397-407
- MULLENHEIM J, FRADORF J, PRECKEL B, VOLKER T, SCHLACK W. Ketamine, but not S(+)-ketamine, blocks ischemic preconditioning in rabbitt hearts in vivo. Anesthesiology 2001; 94:630-6
- MUNCH-ELLINGSEN JA, GROVER GJ, GROSS GJ. Blockade of KATP channel by glibenclamide aggravates ischemic injury and counteracts ischemic preconditionning. Basic Res Cardiol 1996; 91:382-53
- MURRY CE, JENNINGS RB, REIMER KA. Preconditionning with ischemia: A delay of lethal cell injury in ischemic myocardium. Circulation 1986; 74:1124-36
- PAGEL PS. Myocardial protection by volatile anesthetics in patients undergoing cardiac surgery: A critical review of the laboratory and clinical evidence. J Cardiothorac Vasc Anesth 2013; 27:972-82
- PAGEL PS, CRYSTAL GJ. The discovery of myocardial preconditioning using volatile anesthetics: a history and contemporary clinical perspective. J Cardiothorac Vasc Anesth 2018; 32:1112-34
- PAK-SOO CK MATHEW H, MA D. Ischaemic conditioning strategies reduce ischaemia/reperfusion-induced organ injury. Br J Anaesth 2015; 114:204-16
- PIRIOU V, CHIARI P, KNEZYNSKI S, et al. Prevention of isoflurane-induced preconditioning by 5-hydroxydecanoate Gadolinium. Anesthesiology 2000; 93:756-64
- PIRIOU V, MANTZ J, GOLDFARB G, et al. Sevoflurane preconditioning at 1 MAC only provides limited protection in patients undergoing coronary artery bypass surgery: a randomised bi-centre trial. Br J Anaesth 2007; 99:624-31
- PRATT PF, WANG C, WEIHRAUCH D, et al. Cardioprotection by volatile anesthetics: new applications for old drugs ? Curr Opin Anesthesiol 2006; 19:397-403
- SAITO S, MIZUMURA T, TAKAYAMA T, et al. Antiischemic effects of nicorandil during coronary angioplasty in humans. Cardiovasc Drug Ther 1995; 9(suppl 2):257-63
- SIGG DC, COLES JA, GALLAGHER WJ, et al. Opioid preconditioning: Myocardial function and energy metabolism. Ann Thorac Surg 2001; 72:1576-82
- SLOTH AD, SCHMIDT MR, MUNK K, et al. Improved long-term clinical outcomes in patients with ST-elevation myocardial infarction undergoing remote ischaemic conditioning as an adjunct to primary percutaneous coronary intervention. Eur Heart J 2014; 35:168-75
- SNIECINSKI R, LIU H. Reduced efficacy of volatile anesthetic presconditioning with advanced age in isolated rat myocardium. Anesthesiology 2004; 100:589-97
- STRAARUP TS, HAUSENLOY DJ, ROLIGHED LARSEN JK. Cardiac troponins and volatile anaesthetics in coronary artery bypass graft surgery. Eur J Anaesthesiol 2016; 33:396-407
- SYMONS JA, MYLES PS. Myocardial protection with volatile anaesthetic agents during coronary artery bypass surgery: a meta-analysis. Br J Anaesth 2006; 97:127-36
- TANAKA K, LUDWIG NM, KERSTEN JR, PAGEL PS, WARLTIER DC. Mechanisms of cardioprotection by volatile anesthetics. Anesthesiology 2004; 100:707-21
- THIELMANN M, KOTTENBERG E, KLEINBONGARD P, et al. Cardioprotective and prognostic effects of remote ischaemic preconditioning in patients undergoing coronary artery bypass surgery: a single-centre randomised, double-blind, controlled trial. Lancet 2013; 382:597-604
- THUNY F, LAIREZ O, ROUBILLE F, et al. Post-conditioning reduces infarct size and edema in patients with ST-segment elevation myocardial infarction. J Am Coll Cardiol 2012; 59:2175-81
- UHLIG C, BLUTH T, SCHWARZ K, et al. Effects of volatile anesthetics on mortality and postoperative pulmonary or other complications in patients undergoing surgery. Anesthesiology 2016; 124:1230-45
- VAN DER LINDEN PJ. Cardioprotective effects of volatile anesthetics in cardiac surgery. Anesthesiology 2003; 99:516-7
- XIE J, ZHANG X, XU J, et al. Effect of remote ischemic preconditioning on outcomes in adult cardiac surgery: a systematic review and meta-analysis of randomized controlled studies. Anesth Analg 2018; 127:30-8
- XUE F, YANG X, ZHANG B, et al. Postconditioning the human heart in percutaneous coronary intervention. Clin Cardiol 2010; 33:439-44
- YU CH, BEATTIE WC. The effects of volatile anaesthetics on cardiac ischemic complications and mortality in CABG: A meta-analysis. Can J Anaesth 2006; 53:906-18
- ZARBOCK A, KELLUM JA, VAN AKEN H, et al. Long-term effects of remote ischemic preconditioning on kidney function in high-risk cardiac surgery patients. Anesthesiology 2017; 126:787-98
- ZAUGG M, LUCHINETTI E, SPAHN DR, et al. Differential effects of anesthetics on mitochondrial KATP channel activity and cardiomyocyte protection. Anesthesiology 2002; 97:15-23
- ZAUGG M, LUCHINETTI E, UECKER M, PASCH T, SCHAUB MC. Anaesthetics and cardiac preconditioning: signaling and cytoprotective mechanisms. Part I. Brit J Anaesth 2003 ; 91:551-65
- ZAUGG M, SCHAUB MC, FOËX P. Myocardial injury and its prevention in the perioperative setting. Br J Anaesth 2004; 93:21-33
