D'une manière générale, la gestion d'une opération ou d'une hémorragie sous anticoagulant dépend de la combinaison des risques.
- Risque hémorragique faible, risque thrombotique élevé: mesures locales (compression, hémostase chirurgicale ou endoscopique), maintien de l'anticoagulation;
- Risque hémorragique élevé, risque thrombotique faible: arrêt des anticoagulants, antagonisme en cas de menace vitale;
- Risque hémorragique et risque thrombotique élevés: interruption minimale des anticoagulants, antagonisme prudent, solution au cas par cas.
- Degré d'urgence: les lésions menaçant la vie ou les intervention urgentes très hémorragipares réclament un renversement immédiat de l'anticoagulation. Lorsque l'intervention peut attendre 1-2 jours, la simple interruption du traitement suffit vu la demi-vie assez courte des nouveaux anticoagulants oraux (4-16 heures); ceci ne s'applique pas aux agents anti-vitamine K (AVK) dont la durée d'action dépasse 4-5 jours.
Dans les cas complexes, il est toujours prudent de consulter un hématologue.
Délais préopératoires
De manière simplifiée, le taux sérique d’un médicament baisse à 12.5% de sa valeur initiale après 3 demi-vies et à 3% après 5 demi-vies. La demi-vie d’élimination des substances (voir Tableau 8.2) conditionne donc le délai qu’il faut prévoir entre l’interruption du traitement et l’acte chirurgical. Alors qu’il existe des recommandations pour les délais à respecter lors de traitement avec les héparines et les anti-vitamine K, on ne dispose pas de suffisamment de données sur les nouveaux anticoagulants oraux (NACO) pour pouvoir promulguer des règles fondées sur l'évidence concernant leur gestion préopératoire. Pour l’instant, on est contraint de se satisfaire de propositions formulées par des groupes d’experts ; elles sont basées sur la pharmacocinétique de ces substances [6,16,19,20,26,32]. Les délais d’interruption préopératoire minimaux habituellement proposés sont les suivants (risque hémorragique standard, fonctions hépatique et rénale normales) (voir Tableau 8.12).
- Héparine non-fractionnée 4-6 h
- HBPM prophylactique 12 h (24 heures si clairance créatinine < 50 mL/min)
- HBPM thérapeutique 24 h (48 heures si clairance créatinine < 50 mL/min)
- Fondaparinux (Arixtra®) 48 h (4-6 jours si clairance créatinine < 50 mL/min)
- Dabigatran (Pradaxa®) 48 h (3-5 jours si clairance créatinine < 50 mL/min)
- Apixaban (Eliquis®) 48 h (3-4 jours si clairance créatinine < 50 mL/min)
- Edoxaban (Savaysa®, Lixiana®) 48 h (3-5 jours si clairance créatinine < 50 mL/min)
- Rivaroxaban (Xarelto®) 5-10 mg 24 h (2-3 jours si clairance créatinine < 50 mL/min)
15-20 mg 48 h (3-4 jours si clairance créatinine < 50 mL/min) - Sintrom®, Coumadine® 5 jours (contrôle INR à J-5 et J-1)
- Marcoumar® 10 jours (contrôle INR à J-10 et J-1)
- Désirudine (Iprivask®) 10 h
- Bivalirudine (Angiox®) 4-10 h
- Danaparoïde (Orgaran®) 48 h
- Argatroban (Argatroban Inj®) 4 h
En comptant un délai de 3 demi-vies et en prenant les valeurs hautes pour la demi-vie plasmatique de chacune des substances, on peut donc recommander, de manière simplifiée, d’attendre 48 heures avant une opération à faible risque hémorragique pour tous les NACO, sauf pour le rivaroxaban à 5-10 mg/j dans les interventions simples chez des malades sans comorbidité, où ce délai peut être ramené à 24 heures. Par contre, un délai de 5 demi-vies est recommandé pour la chirurgie à risque hémorragique élevé, pour l'ALR rachidienne ou les blocs profonds (inclus blocs périclaviculaires), chez les malades âgés et chez les patients qui prennent des substances retardant l'élimination des NACO comme l'amiodarone [1,6,15,19,23,26,30]. Après un délai de 48 heures, en effet, environ 15% des patients démontrent encore une activité anticoagulatoire significative [10]. En cas d’insuffisance rénale, ces délais sont doublés pour les substances dont l'élimination rénale est importante (HBPM et dabigatran 80%, edoxaban 45%), ou augmentés d'au moins 24 heures pour les autres (rivaroxaban 35%, apixaban 25%). Vu le manque d’expérience clinique avec les nouveaux anticoagulants oraux et vu leur absence d’antagoniste disponible (sauf pour le dabigatran), il est nécessaire de rester extrêmement prudent avec les indications à l’ALR rachidienne chez les patients recevant l’un de ces médicaments [1]. Les interventions mineures sans risque hémorragique (dentisterie, ophthalmologie, chirurgie de paroi, etc) se déroulent sans interruption des NACO, en prenant toutefois soin d’opérer lorsque le taux sérique est bas (entre 8 et 18 heures après la dernière prise) [3,20].
Concentrations résiduelles
Le taux résiduel de dabigatran et de rivaroxaban est d’environ 30-50 ng/mL après 4 demi-vies ; dans les études RE-LY (dabigatran) et ROCKET-AF (rivaroxaban), ce taux a permis d’opérer les malades sans augmentation du risque hémorragique [29]. Avec les tests spécifiques anti-Xa pour chacun des nouveaux agents, il est possible d’obtenir une concentration sérique de la substance et d’avoir une bonne estimation du risque hémorragique ainsi que du délai d’attente (pour autant que la fonction rénale soit normale) [12,29]. Les valeurs suivantes font l'objet d'un consensus dans la littérature actuelle.
- Taux résiduel < 30 ng/mL : risque hémorragique minime (adéquat pour la chirurgie majeure);
- Taux résiduel 30-50 ng/mL: risque acceptable pour la chirurgie faiblement hémorragique;
- Taux 50-200 ng/mL : attendre 12-24 heures;
- Taux 200-400 ng/mL : attendre > 24 heures (en général 48 heures);
- Taux > 400 ng/mL : renvoi.
Le test est répété toutes les 12 ou 24 heures jusqu’à ce que le taux passe en-dessous du seuil de sécurité fixé à 30-50 ng/mL, cette valeur étant pour l’instant assez arbitraire. Ces recommendations s’entendent pour des malades dont la fonction rénale est normale, subissant des interventions sans risque hémorragique excessif.
Il n'existe jusqu'ici qu'une seule étude qui permette de justifier les délais préopératoires par les taux plasmatiques résiduels de NACO (422 malades, dont 60% de chirurgie majeure) [14]. On peut synthétiser ses résultats de la manière suivante.
- Une interruption de 25-48 heures laisse 38% des patients avec une concentration > 30 ng/mL et 7% avec > 100 ng/mL;
- Avec une interruption de 49-72 heures, 95% des patients ont un taux < 30 ng/mL et aucun n'a un taux > 50 ng/mL;
- Les prédicteurs d'une concentration résiduelle > 30 ng/mL sont: un délai trop court, une clairance de la créatinine < 50 mL/min, un traitement antiarythmique (amiodarone, verapamil), et une substitution par héparine;
- Une activité anti-Xa ≤ 0.1 UI/mL pour les xabans et un TT normal pour le dabigatran permettent d'exclure un taux résiduel d'anticoagulant, alors que le TP et l'aPTT n'ont pas de valeur prédictive significative.
Les délais de 48 heures pour une opération simple et de 72 heures pour une opération à risque sont donc justifiés par ces résultats. Toutefois, deux remarques s'imposent ici.
- Les taux sériques de NACO sont extrêmement variables selon les individus pour les mêmes dosages et pour les mêmes délais d'attente: entre 0 et 48 heures, ces taux varient de < 30 ng/mL à > 200 ng/mL [14].
- Il n'y a pas de corrélation claire entre les taux sériques et le risque hémorragique, probablement parce que ce dernier est trop multifactoriel. Toutefois, les substances qui interfèrent avec le métabolisme des NACO et en prolongent l'activité anticoagulante (amiodarone, phénytoïne, fluconazole, rifampicine) augmentent significativement le risque de saignements spontanés [5,23].
Gestion périopératoire détaillée
La gestion des anticoagulants en préopératoire peut se résumer comme suit (Tableau 8.7A, voir aussi Tableaux 8.11 et 8.12) [1,6,8,9,11,13,16,19,24,26,29,30,33,34].
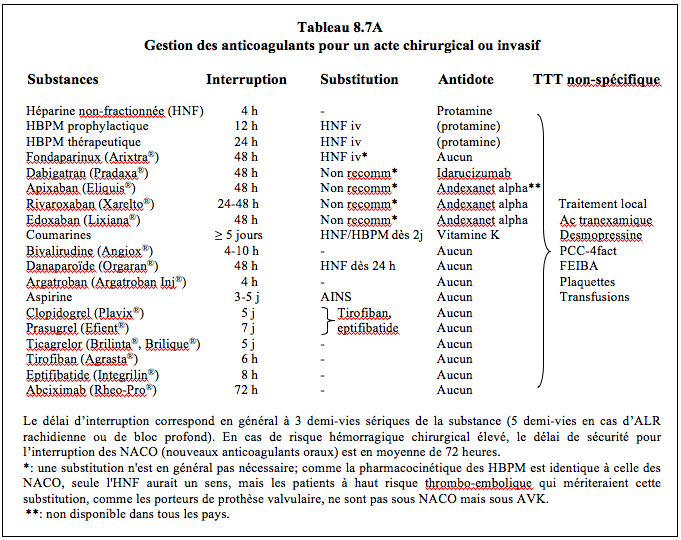
- Héparine non-fractionnée (HNF); interruption de la perfusion 4-6 heures préopératoires. En chirurgie cardiaque lors de syndrome coronarien aigu ou de thrombose de prothèse valvulaire: continuation de la perfusion jusqu’à l’induction. Idem pour la bivalirudine.
- Contrôle: aPTT, ACT.
- Antidote spécifique: protamine.
- Héparines de bas poids moléculaire (HBPM); la durée de l’interruption est fonction de la dose sous-cutanée.
- HBPM prophylactique (10’000-12’000 UI/24 h): interruption 12 heures.
- HBPM thérapeutique (≥ 20’000 UI/24 h): interruption 24 heures; éventuelle substitution par HNF intraveineuse pendant 12-20 heures.
- Contrôle de l’effet résiduel : effet anti-Xa.
- Antidote partiel: protamine.
- Délai doublé en cas d'insuffisance rénale.
- Fondaparinux (Arixtra®): interruption de 48 à 72 heures selon le risque hémorragique de la chirurgie.
- Délai étendu à 4-6 jours si la clairance de la créatinine est < 50 mL/min.
- Contrôle de l’effet résiduel : effet anti-Xa.
- Substitution par HNF intraveineuse réservée aux cas à très haut risque thrombo-embolique et délai prolongé.
- Pas d’antidote spécifique.
- Anti-vitamine K (AVK); arrêt préopératoire de 5 jours (warfarine, acénocoumarol) à 10 jours (phenprocoumone). Une valeur d’INR < 2.0 est en général suffisante pour procéder à une chirurgie à risque hémorragique modéré, alors qu’un INR < 1.5 est requis pour une chirurgie majeure. Contrôler l’INR 24 heures avant la chirurgie. L’interruption des AVK n’est pas nécessaire avant la chirurgie dermatologique, la dentisterie, l’ophthalmologie (cataracte), l’endoscopie ou la pose de pace-maker (algorithme décisionnel: voir Figure 8.15) [7].
- Substitution seulement si risque thrombo-embolique élevé (prothèse valvulaire cardiaque, anamnèse d'AVC, INR visé ≥ 3.0): HNF ou HBPM dès 48-72 heures après la dernière dose (voir ci-dessous). Dans les autres cas (INR visé < 3.0), la substitution n'est plus recommandée.
- Antidote spécifique: vitamine K (Konakion®) 2.5-5 mg iv/12 h en cas d’urgence; l’effet n’est obtenu qu’après 12 heures. Si opération élective et INR 1.5 - 2.0 : 1-2 mg vitamine K per os.
- Antidote non-spécifique (indiqué en cas d’hémorragie intra-crânienne ou d’hémorragie massive): complexe prothrombinique à 4-facteurs (PCC prothrombin complex concentrate) ; il est beaucoup plus efficace que le PFC et n’impose pas le risque d’une surcharge de volume [21].
- Dabigatran (Pradaxa®); adaptation du délai d’interruption préopératoire en fonction de la clairance de la créatinine et du risque hémorragique de l’intervention. Le risque hémorragique chirurgical est le même en arrêtant le dabigatran 48 heures avant l’intervention qu’en stoppant la warfarine pendant 5 jours [18]. Lors d'intervention sans interruption de l'anticoagulant, le risque hémorragique est 4 fois moindre sous dabigatran que sous warfarine [4].
- Délai d’interruption préopératoire: 48 ou 72 heures selon le risque hémorragique de la chirurgie (Cl créat > 50 mL/min), 3-5 jours si clairance créatinine < 50 mL/min.
- Contrôle de l’effet résiduel : temps de thrombine dilué (dTT, Hemoclot™), temps d'écarine; TT: sensible mais pas quantitatif.
- Antidote: idarucizumab (Praxbind®) (voir Antagonisme).
- Rivaroxaban (Xarelto®), apixaban (Eliquis®), edoxaban (Lixiana®); l’interruption du traitement pendant 48 heures est en général suffisante, vu leur courte demi-vie.
- Délai étendu à 72 heures en cas d’opération à risque hémorragique élevé ou d’ALR rachidienne.
- Délai supplémentaire de 24 heures si la clairance de la créatinine est < 50 mL/min ou si le patient est sous amiodarone (Cordarone®) [23].
- Délai diminué à 24 heures pour le rivaroxaban à 10 mg/j pour une opération simple chez un patient sans comorbidité.
- Délai de 24 heures pour le rivaroxaban à 2x 2.5 mg/j.
- Contrôle de l’effet résiduel : activité anti-Xa. TP prolongé : persistance de l’effet (non-quantitatif). TT, TPT, fibrinogène, facteur XIII et D-dimères ne sont pas influencés [2].
- Pas d’antidote spécifique pour l'instant (en préparation) ; les complexes prothrombiniques 4-facteurs sont probablement efficaces (voir Antagonisme).
La grande variabilité interindividuelle et l’effet de l’âge ou de l’insuffisance rénale induisent des variations de 1 à 4 dans le taux résiduel de rivaroxaban 12 à 24 heures après la dernière prise ; le taux de 50 ng/mL, considéré comme valeur limite autorisant la chirurgie, est atteint en 12 à 48 heures selon les patients; le seuil de sécurité pour la chirurgie hémorragique est à 30 ng/mL [27]. Cette grande variabilité oblige à beaucoup de prudence en cas de risque hémorragique élevé ou lors d'anesthésie loco-régionale rachidienne (Figure 8.11A).
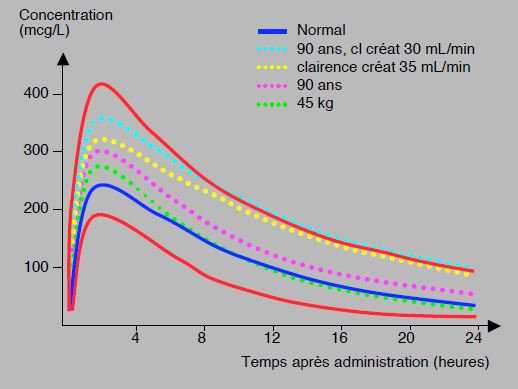
Figure 8.11 A: Profils de concentration du rivaroxaban (20 mg 1 x/j) en fonction du temps dans différentes situations: patients de 90 ans en insuffisance rénale (pointillé turquoise), patients avec une clairance de la créatinine de 35 mL/kg (pointillé jaune), patients de 90 ans (pointillé violet), patients de 45 kg (pointillé vert). La courbe d’un individu standard est représentée en bleu. En rouge, courbes des 5ème et 95ème percentiles; la valeur supérieure représente environ 3 fois la valeur inférieure [modifié d’après réf 27].
Chez les malades à risque ou dans les cas d’urgence, la durée de l’interruption préopératoire peut être décidée en fonction du taux plasmatique (dosé par l’effet anti-Xa). Comme l’effet clinique est proportionnel à ce taux, il n’y a pas lieu de prévoir une substitution lorsque le délai d’attente est prolongé à cause d’une insuffisance rénale, puisque le malade est suffisamment anticoagulé par l'effet résiduel.
En se basant sur leur demi-vie, on peut formuler une recommandation simple pour le délai d’interruption préopératoire des nouveaux anticoagulants oraux (NACO) [25,29,32,35,36].
- Opération urgente: attendre au moins 1 demi-vie;
- Opération à risque hémorragique nul ou faible : pas d’interruption, mais préférence pour intervenir 8-10 heures après la dernière prise;
- Opération à risque hémorragique faible ou modéré: attendre 3 demi-vies (48 heures);
- Opération à risque hémorragique élevé: attendre 5 demi-vies (72 heures);
- Anesthésie loco-régionale (ALR) rachidienne, blocs profonds (inclus blocs périclaviculaires): attendre 5 demi-vies ;
- Chirurgie en cas d'insuffisance rénale: attendre > 5 demi-vies (3-5 jours) ;
- Dans l’attente d’antidote pour tous les NACO, on est contraint à une attitude plutôt conservatrice et prudente; l'ALR rachidienne et les blocs profonds sont déconseillés [1];
- La substitution par une héparine n'est pas nécessaire.
Comme les nouveaux anticoagulants ont une forte composante d'excrétion rénale (totale pour le fondaparinux et le dabigatran, moitié pour l'edoxaban, un tiers pour le rivaroxaban et un quart pour l'apixaban), les délais d'interruption préopératoire sont allongés en conséquence en cas d'insuffisance rénale modérée (clairance à la créatinine 30-50 mL/min) ou majeure (clairance à la créatinine 15-30 mL/min).
- Fondaparinux: 4-6 jours (selon le risque hémorragique);
- Dabigatran: 3-5 jours (idem);
- Xabans: 3-5 jours (idem).
Les NACO sont contre-indiqués lorsque la clairance à la créatinine est < 15 mL/min (dabigatran < 30 mL/min).
Anesthésie loco-régionale
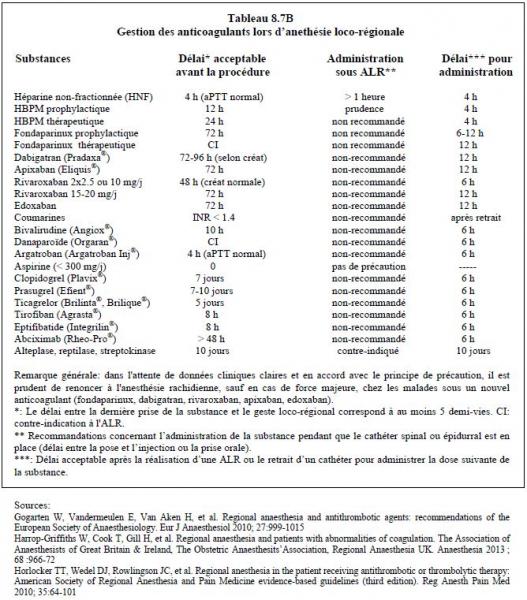
L’anesthésie loco-régionale (ALR) rachidienne ne doit être envisagée que lorsqu’il est hautement probable que l’effet anticoagulant de la substance a complètement disparu, soit après 5 demi-vies d’élimination [25,28]. La péridurale, la rachi-anesthésie et les blocs profonds ou périclaviculaires doivent être pratiqués avec une extrême prudence chez les patients sous NACO vu l’absence de données cliniques claires sur le sujet et la possibilité d’une alternative moins risquée (anesthésie générale) [33,35]. Dans l'attente d'une meilleure évidence et en accord avec le principe de précaution, il est prudent de limiter l'anesthésie rachidienne aux cas de force majeure chez les malades sous un nouvel anticoagulant (fondaparinux, dabigatran, rivaroxaban, apixaban, edoxaban) [1]. Ces recommandations sont intentionnellement conservatrices pour trois raisons: 1) l'ALR rachidienne n'est pas un acte thérapeutique, 2) elle présente des risques intrinsèques, et 3) elle possède des alternatives plus sûres [25,28]. Les délais recommandés doivent être adaptés au risque hémorragique propre de la chirurgie et à la fonction rénale pour les substances à élimination rénale. Le délai recommandé entre la dernière dose d’anticoagulant et le retrait du cathéter épidural est le même que le délai prévu entre la dernière dose et la ponction rachidienne. Il est recommandé d’attendre 12 heures après la ponction ou après le retrait du cathéter péridural avant de démarrer le traitement avec un anti-thrombine ou un anti-Xa [1,15,30,33,37]. En cas de ponction hémorragique, ce délai est repoussé à 24 heures [10]. Après thrombolyse, la loco-régionale est proscrite pendant 10 jours. Ces données sont résumées dans le Tableau 8.7B [15,17,22]. Elles s’entendent pour des ponctions atraumatiques; il est clair que le risque d’hématome spinal est directement fonction du nombre d’essais. Pour les opérations sous anticoagulant comme la chirurgie cardiaque, une ponction hémorragique commande le renvoi de l’intervention de 24 heures.
Postopératoire
La reprise postopératoire de l'anticoagulation est impérative car le risque thrombotique est accru après l'intervention, mais elle est conditionnée par la qualité de l'hémostase et par les éventuelles conséquences d'une hémorragie (saignement en espace clos). L’héparine ou l’HBPM est recommencée 12-48 heures après la fin de l’intervention, en général avec une dose prophylactique; le dosage thérapeutique est atteint au 2ème jour, sauf en cas de prothèse mécanique, de sténose mitrale rhumatismale ou d'anamnèse d'AVC embolique qui doivent être protégées en permanence par une anticoagulation pleinement efficace. Le délai pour la reprise de l’héparine dépend du risque hémorragique, de la qualité de l’hémostase et du degré de menace thrombo-embolique [8,9]. Les AVK peuvent être redémarrés dans les premières 24 heures, car leur effet ne se fera sentir qu'au-delà de 3 jours. Les NACO, par contre, sont efficaces 1-3 heures après leur ingestion. Avec les premiers, il est judicieux d'utiliser une HBPM à dose prophylactique pendant 72 heures chez les malades à haut risque thrombo-embolique. Avec les seconds, la substitution est inutile, voir dangereuse; le délai de reprise est de 12-72 heures: en moyenne 24 heures si le risque hémorragique est faible et 48-72 heures s'il est élevé [1,6,33]. Il est concevable de débuter par un dosage plus faible pendant quelques jours si la situation est inquiétante. Lorsque l'hémostase est difficile, il faut attendre 2 à 3 jours avant la reprise, mais lorsque le risque thrombo-emblique est élevé, il est important de les recommencer le plus vite possible, soit le lendemain de l'intervention, ou de substituer provisoirement par une héparine [31,35].
Cependant, interrompre les NACO pendant 48-72 heures avant une opération hémorragique et les reprendre 48-72 heures après laisse un trou de 4-6 jours sans traitement, ce qui est dangereux chez un malade à risque thrombo-embolique élevé. Dans ce cas, il est probablement indiqué de substituer l'anticoagulation par une héparine pour protéger le malade [1]. Malgré son administration intraveineuse, l'héparine non-fractionnée présente l'avantage d'une courte demi-vie (1-2 heures) et de la disponibilité d'un antagoniste (protamine).
Après des interventions majeures, il faut tenir compte du fait que la fonction rénale peut être perturbée pendant de nombreux jours et que la dose de NACO doit y être adaptée. Tant que la voie orale est exclue, une HBPM de remplacement est recommandée; comme la pharmacocinétique des HBPM et des NACO est analogue, il ne doit pas y avoir de superposition des deux thérapeutiques. Les NACO n'existant que sous forme orale, ils sont broyés et administrés par une sonde gastrique si l'alimentation n'est pas possible. Ceci n'est toutefois pas envisageable pour le dabigatran dont les capsules ne doivent pas être ouvertes; dans ces conditions, il faut envisager une substitution par une HBPM [26].
| Gestion périopératoire des anticoagulants |
|
D’une manière générale, les délais d’interruption préopératoire sont basés sur la demi-vie de la substance ; ils sont doublés en cas d’insuffisance rénale pour les substances éliminées par les reins.
- Opération urgente : attendre au moins 1 demi-vie
- Opération à risque hémorragique modéré : attendre 3 demi-vies
- Opération à risque hémorragique élevé, ALR rachidienne : attendre 5 demi-vies
Une substitution par de l’HNF est envisagée dans les cas à risque thrombo-embolique élevé si l’interruption dure > 48 heures.
Délais recommandés :
- Héparine non-fractionnée 4-6 h
- HBPM (prophylactique) 12 h
- HBPM (thérapeutique) 24 h (48 h si Cl créat < 50 mL/min)
- Fondaparinux 48 h (4-6 jours si Cl créat < 50 mL/min)
- Dabigatran 48 h (3-5 jours si Cl créat < 50 mL/min)
- Apixaban 48 h (3-4 jours si Cl créat < 50 mL/min)
- Edoxaban 48 h (3-5 jours si Cl créat < 50 mL/min)
- Rivaroxaban 5-10 mg 24 h (3 jours si Cl créat < 50 mL/min)
- Rivaroxaban 15-20 mg 48 h (3-4 jours si Cl créat < 50 mL/min)
- Sintrom®, Coumadine® 5 jours (contrôle INR à J-5 et J-1)
- Marcoumar® 10 jours (contrôle INR à J-10 et J-1)
En comptant un délai de 3 demi-vies et en prenant les valeurs hautes pour la demi-vie plasmatique de chacune des substances, on peut recommander, de manière simplifiée, d’attendre 48 heures pour tous les NACO, sauf pour le rivaroxaban 10 mg/j dans les interventions simples chez des malades sans comorbidité où ce délai peut être ramené à 24 heures. Pour les situations à haut risque hémorragique et pour l’ALR rachidienne, il est recommandé de prolonger ce délai à 72 heures. Le délai pour le retrait du cathéter est le même que celui pour la pose. La présence d'une insuffisance rénale (clairance créatinine 15-50 mL/min) prolonge le délai préopératpoire de 72 à 120 heures, selon le risque hémorragique et le degré d'élimination rénale des substances (dabigatran 80%, edoxaban 50%, rivaroxaban 33%, apixaban 25%). Le délai pour la reprise de l’anticoagulant dépend du risque hémorragique, de la qualité de l’hémostase et du degré de menace thrombo-embolique, mais il est en général de 12-48 heures. Dans les cas complexe, il est toujours prudent de consulter un hématologue.
|
© CHASSOT PG, MARCUCCI C, Décembre 2013, dernière mise à jour, Novembre 2019
Références
- ALBALADEJO P, BONHOMME F, BLAIS N, et al. Management of direct oral anticoagulants in patients undergoing elective surgeries and invasive procedures: update guidelines from the French Working Group on Perioperative Hemostasis. Anaesth Crit Care Pain Med 2017; 36:73-6
- BARRETT YC, WANG Z, et al. Clinical laboratory measurement of direct factor Xa inhibitors: anti-Xa assay is preferable to prothrombin time assay. Thromb Haemost 2010; 104:1263-71
- BONHOMME F, HAFEZI F, BOEHLEN F, HABRE W. Management of antithrombotic therapies in patients scheduled for eye surgery. Eur J Anaesthesiol 2013; 30:449-54
- CALKINS H, WILLEMS S, GERSTENFELD EP, et al. Uninterrupted Dabigatran versus Warfarin for ablation in atrial fibrillation. N Engl J Med 2017; 376:1627-36
- CHANG SH, CHOU IJ, YEH YH, et al. Association between use of non-vitamin K oral anticoagulants with and without concurrent medications and risk of major bleeding in nonvalvular atrial fibrillation. JAMA 2017; 318:1250-9
- DOHERTY JU, GLUCKMAN TJ, HUCKER WJ, et al. 2017 ACC Expert consensus decision pathway for periprocedural management of anticoagulation in patients with nonvalvular atrial fibrillation. J Am Coll Cardiol 2017; 69:871-98
- DOUKETIS JD. Perioperative management of patients who are receiving warfarin therapy: an evidence-based and practical approach. Blood 2011; 117:5044-9
- DOUKETIS JD, BERGER PB, DUNN AS, et al. The perioperative management of antithrombotic therapy. American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th edition). Chest 2008; 133:299S-339S
- DOUKETIS JD, SPYROPOULOS AC, SPENCER FA, et al. Perioperative management of antithrombotic therapy : Antithrombotic therapy and prevention of thrombosis, 9th ed. American College of Chest Physicians Evidence-Based Clinical Practice Guidelines, Chest 2012 ; 141 (2 suppl) : e326S-e350S
- DUBOIS V, DINCQ AS, DOUXFILS J, et al. Perioperative management of patients on direct oral anticoagulants. Thromb J 2017; 15:14
- EHRA – European Heart Rhythm Association. EHRA practical guide on the use of non-vitamin K antagonistst oral anticoagulants in patients with atrial fibrillation. www.escardio.org/EHRA, 2018
- FARAONI D, LEVY JH, ALBALADEJO P, et al. Updates in the perioperative and emergency management of non-vitamin K antagonist oral anticoagulants. Critic Care 2015; 19:203
- GAVILLET M, ANGELILLO-SCHERRER A. Quantification of the anticoagulatory effect of novel anticoagulants and management of emergencies. Cardiovasc Med 2012; 15:170-9
- GODIER A, DINCQ AS, MARTIN AC, et al. Predictors of pre-procedural concentrations of direct oral anticoagulants: a propsective multicentre study. Eur Heart J 2017; 38:2431-9
- GOGARTEN W, VANDERMEULEN E, VAN AKEN H, et al. Regional anaesthesia and antithrombotic agents: recommendations of the European Society of Anaesthesiology. Eur J Anaesthesiol 2010; 27:999-1015
- GSLA/ AGLA. Groupe de Travail Lipide et Athérosclérose, Société Suisse de Cardiologie. 2017 Antithrombotiques. Aperçu pratique sur l'utilisation des antithrombotiques lors de maladies cardiovasculaires. www.gsla.ch
- HARROP-GRIFFITHS W, COOK T, GILL H, et al. Regional anaesthesia and patients with abnormalities of coagulation. The Association of Anaesthesists of Great Britain & Ireland, The Obstetric Anaesthesits’Association, Regional Anaesthesia UK. Anaesthesia 2013 ; 68 :966-72
- HEALEY JS, EIKELBOOM J, DOUKETIS J, et al. Periprocedural bleeding and thromboemblic events with dabigatran compared with warfarin. Circulation 2012; 126: 343-8
- HEIDBUCHEL H, VERHAMME P, ALINGS M, et al. European Heart Rythm Association Practical Guide on the use of non-vitamin K antagonist anticoagulants in patients with non-valvular atrial fibrillation. Europace 2015 ; 17:1467-507
- HEIDBUCHEL H, VERHAMME P, ALINGS M, et al. Updated European Heart Rythm Association Practical Guide on the use of non-vitamin K antagonist anticoagulants in patients with non-valvular atrial fibrillation. Executive summary. Eur Heart J 2017; 38:2137-49
- HICKEY M, GATIEN M, TALJAARD M, et al. Outcomes of urgent warfarin reversal with frozen plasma versus prothrombin complex concentrate in the emergency department. Circulation 2013; 128:360-4
- HORLOCKER TT, WEDEL DJ, ROWLINGSON JC, et al. Regional anesthesia in the patient receiving antithrombotic or thrombolytic therapy: American Society of Regional Anesthesia and Pain Medicine evidence-based guidelines (third edition). Reg Anesth Pain Med 2010; 35:64-101
- KASERER A, SCHEDLER A, JETTER A, et al. Risk factors for higher-than-expected residual rivaroxaban plasma concentrations in real-life patients. Thromb Haemost 2018; 118:808-17
- KOVAKS RJ, FLAKER GC, SAXONHOUSE SJ, et al. Practical management of anticoagulation in patients with atrial fibrillation. J Am Coll Cardiol 2015; 65:1340-60
- LEITCH J, VAN VLYMEN J. Managing the perioperative patient on direct oral anticoagulants. Can J Anesth 2017; 64:656-72
- MAR PL, FAMILTSEV D, EZEBOWITZ MD, et al. Periprocedural management of anticoagulation in patients taking novel oral anticoagulants: Review of the literature and recommendations for specific populations and procedures. Int J Cardiol 2016; 202:578-85
- MUECK W, LENSING AWA, AGNELLI G, et al. Rivaroxaban. Population pharmacokinetic analyses in patients treated for acute deep-vein thrombosis and exposure simulations in patients with atrial fibrillation treated for stroke prevention. Clin Pharmacokinet 2011; 50:675-86
- NAROUZE S, BENZON HT, PROVENZANO DA, et al. Interventional spine and pain procedures in patients on antiplatelet and anticoagulant medications. Guidelines from the ASRA, ESRA, AAPM, INS, NANS and WIP. Reg Anesth Pain Med 2015; 40:182-212
- PERNOD G, ALBALADEJO P, GODIER A, et al. Management of major bleeding complications and emergency surgery in patients on long-term treatment with direct oral anticoagulants, thrombin or factor Xa inhibitors : proposals of the Working Group on Perioperative Haemostasis (GIHP) – March 2013. Arch Cardiovasc Dis 2013 ; 106 :382-93
- RAVAL AN, CIGARROA JE, CHUNG MK, et al. Management of patients on non-vitamin K antagonist oral anticoagulants in the acute care and periprocedural setting. Circulation 2017; 135:e604-e633
- SAMAMA MM, CONTANT G, SPIRO TE, et al. Laboratory assessment of rivaroxaban : a review. Thrombosis Journal 2013; 11:11
- SIÉ P, SAMAMA CM, GODIER A, et al. Chirurgies et actes invasifs chez les patients traités au long cours par un anticoagulant oral anti-IIa ou anti-Xa direct. Propositions du Groupe d’intérêt en hémostase périopératoire (GIHP) et du Groupe d’études sur l’hémostase et la thrombose (GEHT). Ann Fr Anesth Réanim 2011 ; 30 : 645-50
- SPAHN DR, BEER JH, BORGEAT A, CHASSOT PG, et al. New oral anticoagulants in anesthesiology. Transf Med Hemother 2019; 46:282-93
- SPAHN DR, BORGEAT A, KERN C, CHASSOT PG, et al. Traitement par le rivaroxaban. Recommandations du groupe d'expert de la SSAR. www.sgar-ssar.ch, 2019
- TURPIE AG, KREUTZ R, LLAU J, et al. Management consensus guidance for the use of rivaroxaban - an oral, direct factor Xa inhibitor. Thromb Haemost 2012; 108:876-86
- WEITZ JI, QUINLAN DJ, EIKELBOOM JW. Periprocedural management and approach to bleeding in patients taking dabigatran. Circulation 2012; 126:2428-32
- WYSOKINSKI WE, McBANE RD. Periprocedural bridging management of anticoagulation. Circulation 2012 ; 126 :486-90
