Séquelles neurologiques post-CEC
La chirurgie cardiaque est malheureusement grevée d’un risque neurologique majeur, longtemps attribué à la seule CEC. Les troubles neurologiques postopératoires sont habituellement classés en deux catégories.
- Le type I comprend les lésions focales (AVC, AIT) et l’encéphalopathie anoxique (coma);
- Le type II consiste en séquelles neuropsychologiques diffuses (détérioration des fonctions cognitives, troubles de la mémoire et de l’attention, retards dans l’activité psychomotrice, délire, convulsions) sans signe de focalisation.
Leur prévalence varie beaucoup en fonction de la manière dont on les identifie : status clinique, tests neuro-psychologiques, IRM fonctionnelle, présence ou non de groupe contrôle dans les études d’incidence (voir Chapitre 23 Complications neurologiques et Facteurs de risque).
L'incidence des lésions neurologiques de type I est de 1-5% (moyenne 2%), allant de 1.6% lors de pontage aorto-coronariens simple, à 3-6% lors de remplacement valvulaire aortique et jusqu'à 17% en cas de chirurgie coronarienne et carotidienne combinée [64,73]. Leur mortalité est de 21%. Les dysfonctions neuro-psychologiques sont beaucoup plus fréquentes (1-34%), mais elles sont réversibles dans 80% des cas [9,54]. La grande variabilité dans l'incidence des séquelles de type II vient de la nature et de la disparité des tests utilisés et de leur sensibilité très variable.
Les facteurs de risque majeurs pour les complications neurologiques de type I sont sont les facteurs associés au patient : athéromatose de l'aorte ascendante, anamnèse d'AVC, sténose carotidienne, vasculopathie périphérique, diabète, hypertension artérielle et âge avancé (> 75 ans) [53,55]. L'incidence des séquelles neurologiques passe de 0.9% en dessous de 65 ans à 9% au-dessus de 75 ans [82]. Les lésions de type I sont liées à des micro- et macro-embolisations cérébrales, qui sont directement proportionnelles aux manipulations de l'aorte et aux aspirations de cardiotomie (Figure 7.26) [21,22,36].
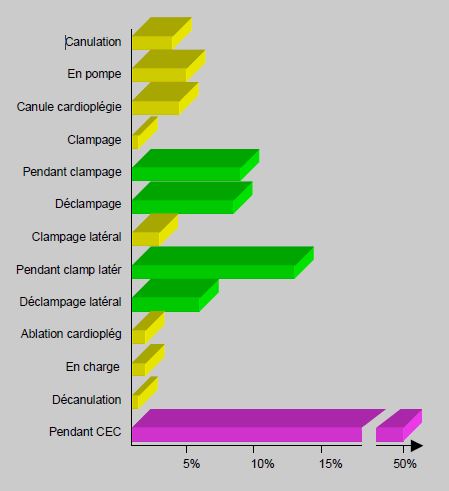
Figure 7.26 : Fréquence des embolies cérébrales diagnostiquées par Doppler transcrânien au cours de la CEC. On voit que la moitié survient lors des diverses manipulations de l'aorte. L'autre moitié est distribuée au hasard pendant toute la durée de la pompe, sans être associée à aucun évènement chirurgical [75].
- La moitié des embols détectés au Doppler transcrânien a lieu pendant les manoeuvres instrumentales sur l'aorte [75].
- Plus la CEC dure, plus les embols sont nombreux; ceci est probablement lié à l'effet de "sablage" du jet de la canule aortique contre la paroi athéromateuse de l'aorte ascendante [14].
- Le status neurologique est influencé par l’importance du sang aspiré par la cardiotomie et retransfusé au malade sans lavage préalable.
Cependant, on n’a jamais démontré une relation claire entre l'importance de ces embols au Doppler transcrânien et la détérioration du status neurologique. Ils sont jusqu’à 6 fois moins nombreux lors de chirurgie à cœur battant, sans que cela ne modifie significativement les troubles neurologiques postopératoires, sauf chez les patients avec des antécédants d'AVC qui ont un meilleur pronostic avec l'OPCAB [1,7,46,48].
Les lésions de type II sont secondaires à plusieurs phénomènes : hypoperfusion cérébrale globale, anémie, micro-embolisation, œdème cérébral, hyperthermie et réaction inflammatoire [33]. Les dysfonctions cognitives sont davantage déterminées par la composition des microembolies que par leur nombre, à cause des variations dans l’intensité de la réaction inflammatoire induite localement selon la nature de l’embolie (air, lipide, microparticule, etc) [36]. Mais ces altérations cognitives relèvent aussi d’un lent déclin psychique lié à l’âge et à la maladie cérébrovasculaire (vasculopathie, diabète); elles sont essentiellement liées à la pathologie préexistante, souvent infraclinique, et au syndrome de stress post-traumatique mal supporté par les personnes âgées ou fragiles [9,35].
On a souvent désigné la CEC comme la principale coupable des séquelles neurologiques, parce que les manipulations qui lui sont associées sont responsables d’une partie des embolisations cérébrales et des dysfonctions cognitives. Cependant, l'expérience des coeurs battant (OPCAB : off-pump coronary artery bypass) a montré que l'absence de CEC ne réduit pas ces complications à zéro. On s'attend à ce que l'absence de clampage aortique et de jet par la canule de CEC diminue l'incidence des embols de matériel athéromateux: le nombre total d'évènements emboliques est effectivement abaissé au Doppler transcrânien [12,48]. Mais il n'y a pas de différence significative sur le taux d'AVC dans les méta-analyses comparant la chirurgie cardiaque avec et sans CEC [17,61]. Une diminution des AVC cliniques n'a été retrouvée que dans des études non randomisées, chez des octogénaires, ou chez des patients avec une aorte athéromateuse [24,72,90]. L'incidence des lésions de type I au cours de la chirurgie coronarienne à coeur battant reste d'environ 2% [18]. Dans les cas d'athéromatose étendue de l'aorte ascendante, l'OPCAB évite le clampage de l'aorte et diminue probablement les risques d'AVC emboliques, mais seule l'absence totale de manipulation de l'aorte, en procédant à des greffons entièrement artériels, peut vraiment diminuer l'incidence d'ictus [15].
Les troubles neuropsychologiques cognitifs ne sont pas non plus liés exclusivement à la CEC, puisque son absence ne les réduit pas: l'incidence des lésions de type II est inchangée lors de pontages à cœur battant [42,49,83]. Elle n’est atténuée après OPCAB que chez les malades à risque neurologique élevé, mais non chez les patients sans facteurs de risque particulier [83,84].
Gestion de la CEC
Le status neurologique postopératoire est dépendant de la pression de perfusion en pompe en-dehors d’une certaine zone moyenne (50-80 mmHg) au sein de laquelle le niveau de la PAM ne fait pas de différence. Par exemple, une étude clinique randomisée a clairement démontré que les résultats neuro-cognitifs sont meilleurs lorsque la PAM est de 80-100 mmHg plutôt que 50-60 mmHg [31]. A pression moyenne basse et en pH-stat, le taux d'embolies cérébrales a tendance à augmenter parce qu'une plus grande proportion du flux sanguin est dirigé vers le cerveau à cause de la vasodilatation hypercapnique [78]. Toutefois, le maintien de l'autorégulation cérébrale jusqu'à 40 mmHg de pression moyenne en hypothermie modérée (28°) et normocapnie (alpha-stat) fait que les caractéristiques de pression et de flux pendant la CEC ont relativement peu d'influence sur le devenir des patients lorsqu'il s'agit de malades sans risques neurologiques particuliers [4]. Certaines circonstances suppriment l'autorégulation et rendent le flux cérébral totalement pression-dépendant: ce sont l'hypothermie profonde (< 25°C), les heures qui suivent un arrêt circulatoire total hypothermique, le diabète, et la présence d'un ancien AVC [73]. D'autre part, 20% des patients ont une autorégulation perturbée en CEC, particulièrement pendant le réchauffement, ce qui rend leur oxygénation cérébrale pression-dépendante [58]. Chez les personnes âgées, la rigidité de l’arbre vasculaire augmente la pression différentielle (pression pulsée = PAs – PAd), accroît le stress vasculaire cérébral et réduit la plage d’autorégulation (voir Chapitre 5 Couplage ventriculo-artériel). La valeur de la pression pulsée est un prédicteur indépendant d’AVC après chirurgie cardiaque [8].
Bien que le débit soit en général prioritaire par rapport à la pression, il semble qu'une pression élevée (> 60 mmHg) associée à un débit faible (< 1.2 L/m2) soit moins délétère du point de vue neurologique qu'une basse pression (< 30 mmHg) accompagnée d'un haut débit (> 2 L/m2) [19]. Idéalement, la PAM devrait être située entre 50 et 90 mmHg, de manière proportionnelle à l’âge du patient (PAM = âge). Elle doit en tous les cas rester au-dessus de la valeur-plancher de la zone d'autorégulation (voir Hémodynamique). Malheureusement, celle-ci varie entre 40 et 80 mmHg (moyenne 66 mmHg) selon les individus et les circonstances [13,41]. Une valeur de 75 mmHg est probablement optimale pour 80% des patients. La saturométrie cérébrale (ScO2, voir ci-dessous) offre une possibilité d'accès à cette donnée et permet d'adpter la PAM aux besoins cérébraux de l'individu.
Outre une gestion optimale de l'apport d'O2 au cerveau par l'adéquation de la pression artérielle, du flux sanguin et de l'hématocrite, l'anesthésiste peut influencer l'incidence des complications neurologiques par le choix des médicaments qu'il utilise, parce que les halogénés et la dexmédétomidine ont des effets neuroprotecteurs, contrairement au propofol [9]. Les statines et les stéroïdes ne réduisent pas significativement les séquelles neuro-cognitives [44,88].
La manière de gérer la CEC a une influence modeste sur les résultats neurologiques. La régulation de l'équilibre acido-basique selon mode alpha-stat, qui préserve l'autorégulation cérébrale (donc une certaine vasoconstriction) et maintient l'apport d'oxygène à basse pression de perfusion (PAM de 45 mmHg), offre de meilleurs résultats que le système pH-stat, qui maintient une vasodilatation par hypercarbie relative et favorise les embolisations [60,77]. Les lésions de type II sont moins fréquentes en mode alpha-stat (incidence de 27%) qu'en mode pH-stat (incidence de 44%) [54]. Le flux sanguin cérébral est diminué de moitié en alpha-stat à 28°, et les défaillances neurologiques sont également réduites de moitié lorsque la durée de la CEC excède 90 minutes [75]. Le mode pH-stat n'a probablement un sens que lors du refroidissement et du réchauffement des cas opérés en hypothermie profonde (< 20°) et arrêt circulatoire complet, parce que la vasodilatation cérébrale assure alors une meilleure homogénéité de la température dans le cerveau [3,38].
L'hypothermie offre une certaine protection puisqu'elle diminue le métabolisme cérébral et les effets de la réaction inflammatoire systémique (voir Chapitre 24 Effets cérébraux de l’hypothermie) [86]. On a pu démontrer une baisse du taux d'AVC en hypothermie (1.5% à < 28°C) par rapport à la normothermie (4.5% à > 35°C), mais la limite de la protection possible offerte par l'hypothermie tient à la prédominance des évènements emboliques dans la genèse des séquelles neurologiques. De plus, l'influence de la température sur les lésions de type II reste très controversée. Le problème majeur survient au réchauffement, parce que le cerveau devient transitoirement hypertherme (38-39°) [10]. Cet effet rebond est d'autant plus prononcé que le réchauffement est plus rapide; il aggrave profondément la susceptibilité des neurones à l'ischémie et agrandit l'étendue des lésions focales [40,54]. Les séquelles neurologiques sont d'ailleurs proportionnelles à la chute de la saturation veineuse jugulaire pendant le réchauffement [20]. Les altérations neuropsychologiques de type II diminuent lorsque le réchauffement est plus lent [32]. La vitesse de réchauffement ne devrait donc pas dépasser 1°C par 5 minutes, ni le gradient de température artère – oesophage la valeur de 2-3°C [11]. La température du sang ne doit pas être supérieure à 37°C [71]. En clinique, la température cérébrale est mesurée par la température tympanique ou par la température rhino-pharyngée en appuyant la sonde nasale contre les cellules ethmoïdales.
L'hématocrite est sans relation avec le status neurologique postopératoire chez le jeune adulte, pour autant que l'Hb reste supérieure à 50 g/L [85]. Chez les personnes âgées, les troubles cognitifs après pontages aorto-coronariens sont plus importants lorsque l’Ht minimal est 15-17% que lorsqu’il est > 25% [23]. Chez les enfants, la comparaison entre un Ht bas (21%) ou élevé (28%) en CEC démontre que le score neurologique et développemental mental sont nettement supérieurs dans le deuxième cas [39]. L'utilisation de circuits de CEC miniaturisés (MECC: minimal extracorporeal circuit) réduit la quantité de liquide d'amorçage, diminue le contact du sang avec les surfaces étrangères et supprime le réservoir veineux (contact du sang avec l'air). De ce fait, l'hémodilution et la réaction inflammatoire sont moindres; l'incidence des troubles cognitifs est abaissée [9,71]. Certaines substances comme l'aprotinine ou les stéroïdes ont un effet inhibiteur sur l'activation leucocytaire et sur la libération de kallikréine; elles tendent à diminuer l'incidence des séquelles neurologiques [26,52].
Les séquelles neurologiques semblent échapper à tout contrôle. Quelques points dans la gestion de la CEC permettent toutefois d'en diminuer la probabilité.
Les séquelles neurologiques semblent échapper à tout contrôle. Quelques points dans la gestion de la CEC permettent toutefois d'en diminuer la probabilité.
- Réduire la durée de CEC;
- Adapter la pression et le débit de CEC en fonction de la saturométrie cérébrale (ScO2);
- Maintenir la PAM > 75 mmHg;
- Maintenir la température proche de la normothermie;
- Maintenir l'hématocrite > 25%;
- Ajuster le dosage des agents d'anesthésie en fonction de l'âge et de la fragilité;
- Eviter les anticholinergiques centraux et les benzodiazépines.
Face à l'importance du problème, on cherche à mettre en oeuvre tous les moyens possibles qui puissent diminuer la fréquence et l'importance des séquelles neurologiques. Mais la situation est ambivalente. En effet, si l'hypoperfusion est la cause principale des troubles neurologiques, il faut maintenir un haut débit et une haute pression en CEC, alors que si l'embolie est le facteur primordial, il faut au contraire diminuer le flux sanguin au cerveau [75]. D'autre part, les différentes techniques ont peu d'effet sur les troubles neurologiques, hormis l'absence totale de manipulation de l'aorte ascendante lorsqu'elle est fortement athéromateuse.
| Séquelles neurologiques |
|
Il existe deux types de lésions neurologiques postopératoires:
- Type I: accident vasculaire cérébral avec séquelles neurologiques
- Type II: troubles cognitifs, réversibles en quelques semaines ou mois
Incidence d’ictus: de 1.6% après pontage aorto-coronarien simple, à 5% après RVA et jusqu’à 17% en cas de chirurgie carotidienne combinée. Incidence de troubles cognitifs réversibles: 20-50%.
Les deux mécanismes principaux sont l’embolisation et l’hypoperfusion. L’embolisation est à l’origine de 80% des lésions de type I chez l’adulte, alors que l’hypoperfusion est plus fréquemment en cause chez l’enfant. La PAM nécessaire à limiter les séquelles neurologiques chez les patients à risque est 70-80 mmHg. Leurs dégâts sont aggravés par la réaction inflammatoire systémique et par les lésions d’ischémie/reperfusion.
Les troubles neurologiques sont d’origine multifactorielle, mais le poids de l’évidence tend à montrer que les facteurs de risque liés au patient (athéromatose, anamnèse d’AVC, troubles cognitifs préopératoires) sont plus importants que ceux liés à l’intervention (opération en CEC ou à cœur battant, embolies, clampage aortique, etc). Les troubles cognitifs après chirurgie cardiaque sont davantage liés au déclin de l’âge et à la maladie cérébro-vasculaire qu’à des évènement peropératoires, hormis les manipulations de l'aorte ascendante lorsqu'elle est fortement athéromateuse.
|
Protection cérébrale
Le but de la protection cérébrale est de réduire les sources de lésions comme l’embolie et l’hypoperfusion, et d’augmenter la tolérance aux agressions comme l’ischémie et l’inflammation. Il n’existe malheureusement pas de recette magique à cet effet. Hormis la baisse du métabolisme par l’hypothermie et le maintien d’une perfusion équilibrée, on ne dispose d’aucun moyen clairement efficace pour améliorer le pronostic neurologique. Par contre, il existe toute une série de mesures qui tendent à diminuer les facteurs de risque et à augmenter la marge de sécurité. La protection cérébrale porte donc sur plusieurs domaines (pour davantage de détails, voir Chapitre 24 Protection cérébrale en chirurgie cardiaque et Protection en cas d’arrêt circulatoire).
- Maintien de la pression de perfusion cérébrale; PAM 60-80 mmHg [56]. En réalité, seuls 20% des AVC (lésions de type I) sont liés à une diminution de la pression de perfusion chez l’adulte, le reste correspondant à des lésions emboliques [66]. Chez les enfants, par contre, les accidents emboliques sont plus rares, et la majeure partie des séquelles neurologiques est liée à l'ischémie cérébrale, notamment à cause de la fréquence des périodes d'arrêt circulatoire [47]. La PAM a davantage d’impact sur les troubles neurocognitifs (lésions de type II).
- Maintien de l'oxygénation systémique; chaque baisse de 10 mmHg de la PaO2 minimale enregistrée augmente le risque d'AVC de 20% (OR 1.23); un nadir de PaO2 < 80 mmHg est directement associé à des séquelles neurologiques [28].
- Diminution du taux d'embolies liées à la CEC de différentes manières [1,71]:
- Eviter le clampage de l'aorte ascendante lorsqu'elle est athéromateuse, modification du site de canulation, pontages tout-artériels;
- Utilisation très restrictive des aspirations de cardiotomie;
- Lavage et filtrage du sang aspiré avant sa retransfusion ou sa réinjection dans le circuit de CEC;
- Dispositifs de protection contre l'embolisation de matériel athéromateux ou calcifié lors de chirurgie de la valve aortique: panier-filtre de récupération dans l'aorte ascendante (Embol-X™), double panier introduit dans les carotides primitives par cathétérisme artériel (Sentinel™), plaque-filtre placée dans la crosse à l'origine des carotides (Embrella™, cathétérisme carotidien), plaque-filtre placée dans la crosse couvrant l'origine des 3 vaisseaux de la gerbe (TriGuard™, cathétérisme fémoral); ils tendent à réduire le volume des lésions cérébrales mais non leur incidence [45,67].
- Diminution du risque d’embolie gazeuse par l’insufflation continue de CO2 dans le péricarde pour y remplacer l’air ambiant par un gaz mieux soluble dans le sang (sans effet clair sur les séquelles neurologiques) [36];
- Débullage soigneux avant la mise en charge.
- Echographie épiaortique; dans les groupes à risque comme les patients souffrant de vasculopathie artériosclérotique ou les malades âgés, l'échographie épiaortique permet d'identifier les lésions dangereuses de l'aorte ascendante et de modifier la technique chirurgicale en conséquence (évitement des plaques les plus emboligènes, canulation sous-clavière ou fémorale) et de diminuer l'incidence des accidents emboliques [55].
- Maintien d’une perfusion cérébrale minimale (bas débit antérograde continu) pendant une période d'arrêt circulatoire [79].
- Pression veineuse basse, particulièrement lors de canulation isolée de la veine cave supérieure (mesure par le bras latéral de l'introducteur ou par la lumière proximale du cathéter de PVC).
- Diminution de la durée de CEC et, le cas échéant, de la période en arrêt circulatoire total.
- Hypothermie modérée (28-32°); réchauffement homogène et lent (1° / 5 min, T° maximale du sang: 37°C).
- Hémodilution modérée : maintien de l’Ht ≥ 26%. Chaque chute de l'Hb de 10 g/L et chaque poche de sang transfusée augmentent le risque d'ictus de 30% (OR 1.28-1.37) [6].
- Maintien de la normoglycémie (glycémie < 10 mmol/L), régulation de l'équilibre acido-basique en mode alpha-stat, éviter l'hypercalcémie [71].
- Amélioration de la biocompatibilité des circuits; oxygénateurs à membrane, circuits héparinés, mini-circuits sans interface air-sang [71].
- Moyens pharmacologiques pour diminuer la réaction inflammatoire systémique et l'oedème cérébral qu'elle engendre: corticostéroïdes, aprotinine à hautes doses, inhibiteurs du complément (pexelizumab); aucun effet clairement prouvé.
Lors d’un arrêt circulatoire en CEC, plusieurs mesures permettent de limiter les dégats cérébraux (voir Chapitre 18 Protection cérébrale) [79].
- Hypothermie cérébrale: elle permet d’étendre la durée d’un arrêt circulatoire de 4 minutes (37°C) à 12 minutes (28°C) et 35 minutes (18°C) sans risquer de séquelles neurologiques majeures [43,50]. Le refroidissement doit être homogène et lent (0.5°/min).
- Perfusion cérébrale sélective continue (10-15 mL/kg/min).
- Hypothermie modérée (28-30°C) accompagnée de perfusions cérébrale et viscérale continues par canulations sous-clavière droite et fémorale.
- Position de Trendelenburg.
- Normoglycémie (diminution des séquelles).
- Anesthésie profonde (curarisation), halogénés (préconditionnement).
- Réchauffement homogène et lent (1°/5 min) sinon risque d’hyperthermie cérébrale (T° maximale du sang: 37°C).
- Non-prouvés : magnésium, thiopental, nimodipine, stéroïdes, mannitol.
En résumé, les séquelles neurologiques (type I) sont liées en premier lieu à la charge embolique, alors que l'hypotension joue un rôle plus modeste chez l'adulte (un quart des cas) et agit préférentiellement sur les troubles cognitifs (type II). La CEC y contribue certainement, mais elle n'en est qu'un facteur causal parmi de nombreux autres, comme le prouve la comparaison avec les opérations réalisées à coeur battant. La manipulation d'une aorte ascendante athéromateuse est probablement le geste le plus dangereux. Si les résultats des études de suivi sont peu discriminants, c'est entre autre parce que les déficits neurologiques préopératoires sont mal investigués et que les courbes d'attrition de la fonction cérébrale des populations de contrôle n'existent souvent pas. Hormis les recommandations de bon sens pour maintenir un apport d'O2 normal, force est de constater que le degré d'évidence des mesures possiblement neuroprotectrices est très faible [36].
| Protection cérébrale en CEC |
|
Quelques moyens permettent de limiter les risques de séquelles neurologiques après chirurgie cardiaque:
- Diminuer le risque de macroembolies (athéromes) et de microembolies (débris, air, lipides)
- Limiter les clampages aortiques ou les éviter (cœur battant, pontages tout artériels)
- Limiter la durée de CEC et la durée du clampage aortique
- Assurer la perfusion cérébrale (PAM > 70 mmHg) et le transport d’O2 (Ht > 26%)
- Contrôler la température (hypothermie modérée et réchauffement lent)
- Maintenir la normoglycémie et un contrôle acido-basique de type alpha-stat
- Utiliser de nouvelles technologies de CEC (mini-CEC, matériaux biocompatibles)
- Visualiser l’aorte ascendante (échographie épiaortique) et surveiller l’oxygénation
cérébrale (ScO2)
- Administrer une neuroprotection pharmacologique (efficacité très relative)
Les facteurs de risque liés au patient (athéromatose, anamnèse d’AVC, troubles cognitifs pré-opératoires) sont plus importants que ceux liés à l’intervention (opération en CEC ou à cœur battant).
A l’exception des manœuvres responsables d’embolies athéromateuses comme les manipulations de l’aorte ascendante, les mesures étudiées jusqu’ici (circuits de CEC, débit de pompe, régulation du pH et de la glycémie, hypothermie, protection pharmacologique, etc) n’ont pas fourni d’évidence incontestable de leur efficacité sur la prévention des troubles neurologiques. Seule une prise en charge multimodale peut garantir le "meilleur résultat possible" dans l’état actuel de nos connaissances.
Lors d’un arrêt circulatoire complet, les seuls moyens éprouvés pour diminuer les séquelles neurologiques sont au nombre de trois:
- Maintenir un débit sanguin cérébral minimal
- Limiter la durée de l’arrêt
- Refroidir le cerveau à 18-20°C
|
Surveillance cérébrale
La question majeure est évidemment celle du diagnostic: comment évaluer le moment où le cerveau est en danger au cours d'une CEC ? Plusieurs techniques sont envisageables [30]: EEG, potentiels évoqués, BIS™, Doppler transcrânien, saturation veineuse jugulaire et spectroscopie proche de l'infrarouge (NIRS).
L'EEG ne reflète que l'activité corticale globale. Des altérations à l'EEG sont visibles lorsque le flux sanguin cérébral a diminué de moitié; l'EEG est isoélectrique pour un flux sanguin de 15-20 mL/100g/min (valeur normale: 50 mL/100g/min). Une ischémie focale peut échapper à cette surveillance. Le système à 16 ou 20 canaux, encombrant et difficile à interpréter, est en général remplacé par un moniteur de fonction cérébral de type CSA (Compressed Spectral Array), qui affiche une analyse spectrale des ondes et ne nécessite que quatre électrodes (voir Figure 19.5). L’EEG est surtout utile pour déterminer le niveau de refroidissement cérébral avant un arrêt circulatoire; l’interruption de la perfusion doit survenir 5-10 minutes après l’obtention du silence électrique [36].
Les potentiels évoqués auditifs (PEA); la réponse auditive du tronc cérébral reflète l'activité neuronale entre le noyau cochléaire et le colliculus inférieur; elle n'est pas modifiée par les agents d'anesthésie, mais varie directement avec la température. Elle est un excellent moyen de surveiller le degré d'inhibition neuronale par l'hypothermie, mais le système est complexe et demande la présence d'un technicien spécialisé [65].
L'index bispectral (BIS™) analyse 4 variables d'un tracé EEG bipolaire (amplitude, fréquence, composition et cohérence de phase); un algorithme le transforme en un nombre compris entre 0 (sommeil profond) et 100 (éveil). Ce nombre décrit la profondeur de l'anesthésie, mais non le fonctionnement neuronal [62]. La réponse dépend du type d'anesthésie; avec le propofol ou les halogénés, la valeur du BIS prédit adéquatement la réponse au stimulus chirurgical, mais les opiacés ne montrent aucune relation dose-effet [69]. L'hypothermie (28-30°C) est responsable d'une chute de la valeur du BIS, même lorsque la concentration d'halogéné reste stable [37]. Une valeur > 80 est fréquente pendant le réchauffement [2]. Toutefois, les protocoles basés sur le BIS ne se sont pas révélés supérieurs à ceux basés sur la concentration expiratoire d’halogéné pour prévenir l’éveil peropératoire; le BIS ne permet ni de modifier la concentration de gaz halogéné ni de diminuer l’incidence de réveil en cours d’intervention [5]. Son efficacité est donc incertaine [81]. L'expérience clinique révèle un effondrement du BIS (valeur 10-15) lors d'épisodes de souffrance cérébrale ou d’instabilité hémodynamique sévère, mais cette concordance n'en fait pas pour autant un signe d'alarme puisqu'il survient en conséquence de l'état de choc cardiocirculatoire [29,87].
Le Doppler transcrânien (DTC) permet de mesurer le flux sanguin dans une grande artère, en général la cérébrale moyenne et permet d'y calculer le flux, mais l’appareillage est encombrant, instable, et non fiable chez environ 25% des malades [30]. Un Doppler ne mesure que la vélocité des hématies, non leur nombre; ainsi l'hémodilution, qui accélère le flux, peut faire croire à une augmentation de l'apport d'oxygène, alors qu'elle a diminué. Son utilisation comme monitorage suppose que la vélocité du flux reflète effectivement le débit sanguin total, que le diamètre du vaisseau ne se modifie pas, et que le capteur reste absolument stable. Les variations de l'Hb, de la viscosité, de la température, de la PaCO2, et les agents d'anesthésie interfèrent considérablement avec la mesure [27]. Les embols sont aisément détectés par la technique, notamment lors du clampage aortique; ils apparaissent sous forme de HITS (High-intensity transient signals) dont la morphologie donne une clef sur l'origine (bulle, athérome, etc) [63].
La saturation veineuse jugulaire (SjO2) est fonction de l'extraction cérébrale en O2 et de l'activité métabolique globale et non unilatérale. Sa valeur normale est 60-75%. La valeur critique se situe autour de 50% [75]. Une valeur < 40% est associée à une souffrance cérébrale ischémique et à des séquelles neurologiques [70]. Elle augmente en cas d'hyperémie, d'hypercapnie ou de fistule artério-veineuse. Elle diminue pour des raisons systémiques (désaturation artérielle, hypocpanie, anémie aiguë, hypotension) ou cérébrale (hypertension intracrânienne, hyperthermie, vasospasme). Elle peut être utile pour confirmer la baisse de la demande métabolique avant un arrêt circulatoire.
La spectroscopie infrarouge (NIRS : near-infrared spectroscopy) permet la mesure locale de la saturation de l'hémoglobine cérébrale en oxygène (ScO2) par deux capteurs placés sur l'angle fronto-temporal, de chaque côté du crâne (voir Figure 19.6). La longueur d'onde laser émise (770 – 910 nm) pénètre la boîte crânienne et se trouve dispersée par la substance cérébrale où une partie spécifique du spectre est absorbée par l'hémoglobine oxygénée (HbO2) et une autre par l'hémoglobine réduite. Les valeurs affichées sont très voisines de la saturation veineuse cérébrale (SjO2) parce que les trois quarts du sang cérébral sont dans le réseau veineux et parce que l'appareil utilise les composantes non-pulsatile du spectre; la valeur normale oscille entre 60 et 75% [57]. La CEC ne modifie pas la valeur de base, mais la ScO2 tend à baisser de 5-6 points après la sortie de pompe [76]. Une ischémie survenant dans une autre région que la zone frontale échappe cependant à la surveillance, puisque l'appareil ne mesure la SO2 que dans 4 cm3 de cerveau de chaque côté; par contre, la technique permet de différencier l'état des deux hémisphères. La ScO2 s'élève en hyperoxie et en hypothermie (baisse du métabolisme), mais aussi en état de mort cérébrale [80]. Lors d'un arrêt circulatoire hypothermique, le nadir est atteint en 15-20 minutes. Une baisse à une valeur de 30% signe une ischémie cérébrale; si elle dure plus de 10 minutes, elle est associée à des dysfonctions cognitives [89]. Le seuil d'irréversibilité n'est pas connu pour l'instant [68]. A cause de la vasoconstriction hypothermique, les valeurs de ScO2 sont plus basses en régulation alpha-stat que pH-stat [51]. Les études dont on dispose actuellement sont insuffisantes pour prouver que le maintien de la ScO2 dans sa valeur normale (environ 66%), ou sa correction si elle en dévie, ont un impact certain sur le risque d'AVC ou de troubles neuro-cognitifs [16,91]. En clinique, une chute de 20% par rapport à la valeur de base est considérée comme significative; elle survient dans 60% des CEC et commande une série de mesures thérapeutiques [76]. Dès que la ScO2 s’abaisse, il convient d’améliorer l’apport d’O2 au cerveau (voir Hémodynamique, Pression artérielle) [25,74,76,89].
- Augmentation de la PAM;
- Augmentation de la FiO2 et de l’Ht (transfusion si Ht trop bas);
- Ajustement du débit de pompe;
- Normocapnie si la PaCO2 était abaissée;
- Baisse du métabolisme cérébral: hypothermie, agents d’anesthésie, curarisation;
- Repositionnement de la tête (modification unilatérale);
- Repositionnement des canules veineuses ou du cœur dans le champ opératoire.
D'une manière générale, la ScO2 est bien corrélée à ces mesures, mais cette amélioration ne semble pas avoir d'impact significatif sur les séquelles neurologiques postopératoires chez les répondeurs [34]. Ceci démontre que la ScO2 surveille non seulement l’oxygénation cérébrale, mais encore le transport d’O2 vers tous les organes. En effet, le cerveau est le seul organe dont l’accès est aisé pour un capteur de saturation. Comme le cerveau dispose d’une autorégulation pour maintenir son apport d’O2, une baisse de sa saturation artério-veineuse indique une diminution plus importante du transport d’O2 dans le reste de l’organisme. Il n’est donc pas surprenant que la ScO2 soit corrélée à la dysfonction hémodynamique postopératoire [59].
| Surveillance neurologique |
|
L’EEG, le Doppler transcrânien et la saturométrie cérébrale (ScO2) sont les techniques de monitorage les plus fiables. Le BIS n’est pas une technique de surveillance neurologique.
La ScO2 a le meilleur rapport efficacité/complexité:
- Valeur normale: 60 – 75%
- Seuil de risque neurologique: baisse de 20% par rapport à la valeur de base, ou valeur ≤ 40%
- Une chute rapide et une durée de > 10 minutes à < 50% sont corrélées au status neurologique
- Une baisse de la ScO2 doit commander des mesures immédiates pour améliorer l’apport d’O2
au cerveau
|
© CHASSOT PG, GRONCHI F, Avril 2008, dernière mise à jour, Décembre 2019
Références
- ABU-OMAR Y, BALACUMARASWAMI L, PIGOTT DW, et al. Solid and gazeous cerebral micro-embolization during off-pump, on-pump and open cardiac surgery procedures. J Thorac Cardiovasc Surg 2004; 127:1759-65
- ANDROPOULOS DB, STAYER SA, DIAZ LK, RAMAMOORTHY C. Neurological monitoring for congenital heart surgery. Anesth Analg 2004; 99:1365-75
- AOKI M, NORMURA F, STROMSKI ME, et al. Effects of pH on brain energetics after hypothermic circulatory arrest. Ann Thorac Surg 1993; 55:1093-1103
- ARROWSMITH JE, GROCOTT HP, REVES JG, et al. Central nervous system complications of cardiac surgery. Br J Anaesth 2000; 84:378-93
- AVIDAN MS, JACOBSOHN E, GLICK D, et al. Prevention of intraoperative awareness in a high-risk surgical population. N Engl J Med 2011; 365:591-600
- BAHRAINWALA ZS, GREGA MA, HOGUE CW, et al. Intraoperative hemoglobin levels and transfusion independently predict stroke after cardiac operations. Ann Thorac Surg 2011; 91:1113-9
- BAR-YOSEF S, ANDERS M, MACKENSEN GB, et al. Aortic atheroma burden and cognitive dysfunction after coronary artery bypass graft surgery. Ann Thorac Surg 2004; 78:1556-62
- BENJO A, THOMPSON RE, FINE D, et al. Pulse pressure is an age-independent predictor of stroke development after cardiac surgery. Hypertension 2007; 50:630-5
- BHAMIDIPATI D, GOLDHAMMER JE, SPERLING MR, et al. Cognitive outcomes after coronary artery bypass grafting. J Cardiothorac Vasc Anesth 2017; 31:707-18
- BISSONNETTE B, HOLTBY HM, PUA DAJ, ET AL. Cerebral hyperthermia in children after cardiopulmonary bypass. Anesthesiology 2000; 93:611-8
- BORGER MA, RAO V. Temperature management during cardiopulmonary bypass: Effect of rewarming rate on cognitive dysfunction. Semin Cardiothorac Vasc Anesth 2002; 6:17-20
- BOWLES BJ, LEE JD, DANG CR, et al. Coronary artery bypass performed without the use of cardiopulmonary bypass is associated with reduced cerebral microemboli and improved clinical results. Chest 2001; 119: 25-30
- BRADY K, JOSHI B, ZWEIFEL C, et al. Real-time continuous monitoring of cerebral blood flow autoregulation using near-infrared spectroscopy in patients undergoing cardiopulmonary bypass. Stroke 2010; 41:1951-6
- BROWN WR, MOODY DM, CHALLA VR, et al. Longer duration of cardiopulmonary bypass is associated with greater numbers of cerebral microemboli. Stroke 2000; 31:707-13
- CALAFIORE AM, DI MAURO M, TEODORI G, et al. Impact of aortic manipulation on incidence of cerebrovascular accidents after surgical myocardial revascularization. Ann Thorac Surg 2002; 73: 1387-93
- CHAN MJ, CHUNG T, GLASSFORD NJ, et al. Near-infrared spectroscopy in adult cardiac surgery patients: a systematic review and meta-analysis. J Cardiothorac Vasc Anesth 2017; 31:1155-65
- CHENG DC, BAINBRIDGE D, MARTIN JE, NOVICK RJ. Does off-pump coronary artery bypass reduce mortality, morbidity, and resource utilization when compared with conventional coronary artery bypass? A meta-analysis of randomized trials. Anesthesiology 2005; 102:188-203
- CLEVELAND JC, SHROYER AL, CHEN AY, et al. Off-pump coronary artery bypass grafting decreases risk-adjusted mortality and morbidity. Ann Thorac Surg 2001; 72:1282-8
- COOK DJ. Neurologic effects. In: GRAVLEE GP (ed). Cardiopulmonary bypass. 2nd edition. Philadelphia, Lippincott, Williams & Wilkins, 2000, pp 403-31
- CROUGHWELL ND, NEWMAN NF, BLUMENTHAL JA, et al. Jugular bulb saturation and cognitive dysfunction after cardiopulmonary bypass. Ann Thorac Surg 1994; 58:1702-8
- DAVILA-ROMAN VG, BARZILAI B, WAREING TH, et al. Atherosclerosis of the ascending aorta. Stroke 1994; 25:2010-16
- DAVILA-ROMAN VG, BARZILAI B, WAREING TH, et al. Intraoperative ultrasonographic evaluation of the ascending aorta in 100 consecutive patients undergoing cardiac surgery. Circulation 1991; 84(Suppl III):47-53
- DE FOE GR, ROSS CS, OLMSTEAD EM, et al. Lowest hematocrit on bypass and adverse outcomes associated with coronary artery bypass grafting. Ann Thorac Surg 2001; 71:769-76
- DEMARIA RG, CARRIER M, FORTIER S, et al. Reduced mortality and strokes with off-pump artery bypass grafting surgery in octogenarians. Circulation 2002; 106(suppl I):I-5-10
- DENAULT A, DESCHAMPS A, MURKIN JM. A proposed algorithm for the intraoperative use of cerebral near-infrared spectroscopy. Semin Cardiothorac Vasc Anesth 2007; 11:274-81
- DIELMAN JM, NIERICH AP, ROSSEEL PM, et al. Intraoperative high-dose dexamethasone in cardiac surgery :a randomized controlled trial. JAMA 2012 ; 308 :1761-7
- DOBLAR DD. Cerebrovascular assessment of the high-risk patient: The role of transcranial Doppler ultrasound. J Cardiothorac Vasc Anesth 1996; 10:3-14
- DUNHAM AM, GREGA MA, BROWN CH, et al. Perioperative low arterial oxygenation is associated with increased stroke risk in cardiac surgery. Anesth Analg 2017; 125:38-43
- ENGLAND MR. The changes in bispectral index during a hypovolemic cardiac arrest. Anesthesiology 1999; 91:1947-9
- FEDOROW C, GROCOTT H. Cerebral monitoring to optimize outcomes after cardiac surgery. Curr Opin Anaesthesiol 2010; 23:89-94
- GOLD JP, CHARLESON MD, WILLIAMS-RUSSO P, et al. Improvement in outcomes after CABG. A randomized trial comparing intraoperative high versus mean arterial pressure. J Thorac Cardiovasc Surg 1995; 110:1302-14
- GRIGORE AM, GROCOTT HP, MATHEW JP, et al. The rewarming rate and increased peak temperature alter neurocognitive outcome after cardiac surgery. Anesth Analg 2002; 94:4-10
- GROCOTT HP, HOMI HM, PUSKAS F. Cognitive dysfunction after cardiac surgery: revisiting etiology. Semin Cardiothorac vasc Anesth 2005; 9:123-9
- HERINGLAKE M, GARBERS C, KÄBLER JH, et al. Preoperative cerebral oxygen saturation and clinical outcomes in cardiac surgery. Anesthesiology 2010; 114:58-69
- HO PM, ARCINIEGAS DB, GRIGSBY J, et al. Predictors of cognitive decline following coronary artery bypass graft surgery. Ann Thorac Surg 2004; 77:597-603
- HOGUE CW, PALIN CA, ARROWSMITH JE. Cardiopulmonary bypass management and neurologic outcomes: an evidence-based appraisal of current practices. Anesth Analg 2006; 103:21-37
- HONAN D, DOHERTY D, FRIZELLE H. A comparison of the effects on bispectral index of mild vs moderate hypothermia during cardiopulmonary bypass. Eur J Anaesthesiol 2006; 14:1-6
- JONAS RA. Hypothermia, circulatory arrest, and the pediatric brain. J Cardiothorac Vasc Anesth 1996; 10:66-74
- JONAS RA, WYPIJ D, ROTH SJ, et al. The influence of hemodilution on outcome after hypothermic cardiopulmonary bypass: results of a randomized trial in infants. J Thorac Cardiovasc Surg 2003; 126:1765-74
- JONES T, ROY RC. Should patients be normothermic in the immediate postoperative period ? Ann Thorac Surg 1999; 68:1454-5
- JOSHI B, ONO M, BROWN C, et al. Predicting the limits of cerebral autoregulation during cardioplumonary bypass. Anesth Analg 2012; 114:503-10
- KENNEDY ED, CHOY KC, ALSTON RP, et al. Cognitive outcomes after on- and off-pump coronary artery bypass grafting surgery: a systematic review and meta-analysis. J Cardiothorac Vasc Anesth 2013; 27:253-65
- KERN FH, UNGERLEIDER RM, REVES JG, et al. The effect of altering pump flow rate on cerebral blood flow and cerebral metabolism in neonates, infants and children. Ann Thorac Surg 1993; 58:1366-72
- KOMATSU R, YILMAZ HO, YOU J, et al. Lack of association between preoperative statin use and respiratory and neurologic complications after cardiac surgery. Anesthesiology 2017; 126:799-809
- KRISHNAN S, SHARMA A, SUBRAMANI S, et al. Analysis of neurologic complications after surgical versus transcatheter aortic valve replacement. J Cardiothorac Vasc Anesth 2019; 33:3182-95
- LIU YH, WANG DX, LI LH, et al. The effects of cardiopulmonary bypass on the number of cerebral microemboli and the incidence of cognitive dysfunction after coronary artery bypass graft surgery. Anesth Analg 2009; 109:1013-22
- LOZANO S, MOSSAD E. Cerebral function monitors during pediatric cardiac surgery: can they make a difference ? J Cardiothorac Vasc Anesth 2004; 18:645-56
- LUND C, HOL PK, LUNDBLAD R, et al. Comparison of cerebral embolization during off-pump and on-pump coronary artery bypass surgery. Ann Thorac Surg 2003; 76:765-70
- MARASCO SF, SHARWOOD LN, ABRAMSON MJ. No improvement in neurocognitive outcomes after off-pump versus on-pump coronary revascularisation: A meta-analysis. Eur J Cardiothorac Surg 2008; 33:961-70
- McCULLOUGH JN, ZHANG N, REICH DL, et al. Cerebral metabolic suppression during hypothermic circulatory arrest in humans. Ann Thorac Surg 1999; 67:1895-931
- MORIMOTO Y, NIIDA Y, HISANO K, et al. Changes in cerebral oxygenation in children undergoing surgical repair of ventricular septal defects. Anaesthesia 2003; 58:77-83
- MURKIN JM. Adverse central nervous system outcomes after cardiopulmonary bypass. A beneficial effect of aprotinin ? Semin Cardiothorac Vasc Anesth 2001; 5:282-5
- MURKIN JM. Neurocognitive outcomes: the year in review. Curr Opin Anesthesiol 2005; 18:57-62
- MURKIN JM, MARTZKE JS, BUCHAN AM, et al. A randomized study of the iunfluence of perfusion technique and pH management strategy in 316 patients undergoing coronary artery bypass surgery. II Neurologic and cognitive outcomes. J Cardiothorac Vasc Surg 1995; 110:349-55
- MURKIN JM, MENKIS AH, DOWNEY D, et al. Epiaortic scanning decreases cerebral emboli during aortic canulation and application of partial occlusion clamp. Ann Thorac Surg 1999; 68:1461-7
- MURPHY GS, HESSEL EA, GROOM RC. Optimal perfusion during cardiopulmonary bypass: an evidence-based approach. Anesth Analg 2009; 108:1394-417
- NOLLERT G, SHINOKA T, JONAS RA. Near-infrared spectrophotometry of the brain in cardiovascular surgery. J Thorac Cardiovasc Surg 1998; 46:167-75
- ONO M, JOSHI B, BRADY K, et al. Risks for impaired cerebral autoregulation during cardiopulmonary bypass and postoperative stroke. Br J Anaesth 2012; 109:391-8
- PAQUET C, DESCHAMPS A, DENAULT AY, et al. Baseline regional cerebral oxygen saturation correlates with left ventricular systolic and diastolic function. J Cardiothorac Vasc Anesth 2008; 22:840-6
- PATEL RL, TURTLE MR, CHAMBERS DJ, et al. Alpha-stat acid-base regulation during cardiopulmonary bypass improves neuropsychologic outcomes in patients udergoing coronary artery bypass grapfting. J Thorac Cardiovasc Surg 1996; 111:1267-79
- RAJA SG, DREYFUS GD. Off-pump coronary artery bypass surgery: To do or not to do? Current best available evidence. J Cardiothorac Vasc Anesth 2004; 18:486-505
- RAMPIL IJ. A primer for EEG signal processing in anesthesia. Anesthesiology 1998: 89:980-1002
- RINGELSTEIN EB, DROSTE DW, BABIKIAN VL, et al. Consensus on microembolus detection by TCD. Stroke 1998; 29:725-9
- ROACH GW, KANCHUGER M, MORA MANGANO C, et al. Adverse cerebral outcomes after coronary bypass surgery. N Engl J Med 1996; 335:1857-64
- RODRIGUEZ RA, EDMONDS HL, AUDEN SM, et al. Auditory brainstem-evoked responses and temperature monitoring during pediatric cardiopulmonary bypass. Can J Anaesth 1999; 46:832-9
- SALAZAR JD, WITYK RJ, GREGA MA, et al. Stroke after cardiac surgery: short- and long-term outcomes. Ann Thorac Surg 2001; 72:1195-201
- SCHMITZ C, WEINREICH S, WHITE J, et al. Can particulate extraction from the ascending aorta reduce neurologic injury in cardiac surgery ? J Thorac Cardiovasc Surg 2003; 126:1829-38
- SCHWARTZ G, LITSCHER G. Transcranila cerebral oxymetry, transcranial Doppler sonography, and heart rate variability: useful neuromotitoring tools in anaesthesia and intensive care ? Eur J Anaesthesiol 2002; 19:543-9
- SEBEL PS, LANG E, RAMPIL IJ, et al. A multicenter study of bispectral electroencephylogram analysis for monitoring anesthetic depth. Anesth Analg 1997; 84:891-9
- SHAABAN T, HARMER M, LATTO P. Jugular bulb oximetry during cardiac surgery. Anaesthesia 2001; 56:24-37
- SHANN KG, LIKOSKY DS, MURKIN JM, et al. An evidence-based review of the practice of cardiopulmonary bypass in adults: A focus on neurologic injury, glycemic control, hemodilution, and the inflammatory response. J Thorac Cardiovasc Surg 2006; 132:283-90
- SHARONY R, BIZEKIS CS, KANCHUGER M, et al. Off-pump coronary artery bypass grafting reduces mortality and stroke in patients with atheromatous aortas: A case control study. Circulation 2003; 108 (suppl II):15-20
- SHROYER AL, COOMBS LP, PETERSON ED, et al. The Society of Thoracic Surgeons: 30-day operative mortality and morbidity risk models. Ann Thorac Surg 2003; 75:1856-64
- SLATER JP, GUARINO T, STACK J, et al. Cerebral oxygen desaturation predicts cognitive decline and longer hospital stay after cardiac surgery. Ann Thorac Surg 2009; 87:36-44
- STUMP DA, JONES TJJ, RORIE KD. Neurophysiologic monitoring and outcomes in cardiovascular surgery. J Cardiothorac Vasc Anesth 1999; 13:600-13
- SUBRAMANIAN B, NYMAN C, FRITOCK M, et al. A multicenter pilot study assessing regional cerebral oxygen desaturation frequency during cardiopulmonary bypass and responsiveness to an intervention algorithm. Anesth Analg 2016; 122:1786-93
- SUNGURTEKIN H, BOSTON US, COOK DJ. Bypass flow, mean arterial pressure, and cerebral perfusion during cardiopulmonary bypass in dogs. J Cardiothorac Vasc Anesth 2000; 14:25-8
- SUNGURTEKIN H, PLÖCHL W, COOK DJ. Relationship between cardiopulmonary bypass flow rate and cerebral embolization in dogs. Anesthesiology 1999; 91:1387-93
- SVYATETS M, TOLANI K, ZHANG M, et al. Perioperative management of deep hypothermic circulatory arrest. J Cardiothorac Vasc Anesth 2010; 24:644-55
- TAILEFER MC, DENAULT Y. Cerebral near-infrared spectroscopy in adult heart surgery: systematic review of its clinical efficacy. Can J Anesth 2005; 52:79-87
- TIREN C, ANDERSON RE, BARR G, et al. Clinical comparison of three different anaesthetic depth monitors during cardiopulmonary bypass. Anaesthesia 2005; 60:189-93
- TUMAN KJ, McCARTHY RJ, NAJAFI RJ, IVANKOVICH AD. Differential effects of advanced age on neurologic and cardiac risks of coronary operations. J Thorac Cardiovasc Surg 1999; 104:1510-7
- VAN DIJK D, JANSEN EW, HIJMAN R, et al. Cognitive outcome after off-pump and on-pump coronary artery bypass graft surgery: a randomized trial. JAMA 2002; 287: 1405-12
- VAN DIJK D, SPOOR M, HIJMAN R, et al. Cognitive and cardiac outcomes 5 years after off-pump vs on-pump coronary artery bypass graft surgery. JAMA 2007; 297:701-8
- VAN WERMESKERKEN GK, LARDENOYE JWH, HILL SE, et al. Intraoperative physiologic variables and outcome in cardiac surgery. Part II. Neurologic outcome. Ann Thorac Surg 2000; 69:1077-83
- WARREN OJ, SMITH AJ, ALEXIOU C, et al. The inflammatory response to cardiopulmonary bypass: Part 1 – Mechanisms of pathogenesis. J Cardiothorac Vasc Anesth 2009; 23: 223-31
- WELSBY IJ, RYAN JM, BOOTH JV, et al. The bispectral index in the diagnosis of perioperative stroke: A case report and discussion. Anesth Analg 2003; 96:435-7
- WHITLOCK RP, DEVEREAUX PJ, TEOH KH, et al. Methylprednisolone in patients undergoing cardiopulmonary bypass (SIRS): a randomised, double-blind, placebo-controlled trial. Lancet 2015; 26:1243-53
- YAO FSF, TSENG CCA, HO CYA, et al. Cerebral oxygen desaturation is associated with early postoperative neuropsychological dysfunction in patients undergoing cardiac surgery. J Cardiothorac Vasc Anesth 2004; 18:553-8
- ZANGRILLO A, CRESCENZI G, LANDONI G, et al. Off-pump coronary artery bypass grafting reduces postoperative neurologic complications. J Cardiothorac Vasc Anesth 2005; 19:193-6
- ZHENG F, SHEINBERG R, YEE MS, et al. Cerebral near-infrared spectroscopy monitoring and neurologic outcomes in adult cardiac surgery patients: a systematic review. Anesth Analg 2013; 116:663-76
