La dissection est une rupture de la média avec apparition d’une zone hémorragique intrapariétale [11]. L’origine est une déchirure intimale proximale (point d'entrée) qui se prolonge entre les couches interne et externe de la média et dissèque l'aorte sur une longueur variable, créant une fausse lumière dont le flux sanguin ressort par une ou plusieurs déchirures distales (Vidéos); lorsque celles-ci sont absentes, la fausse lumière thrombose. La dissection peut être associée à un anévrysme.
Vidéo: Vue ETO long-axe 120° de l'aorte ascendante dans une dissection A; la membrane ("flap") oscille librement au cours du cycle cardiaque; on aperçoit la déchirure pendant la systole.
Vidéo: Passage de la vraie à la fausse lumière au flux couleur lors d'une dissection A dans la crosse aortique.
La force qui dissocie les tissus est liée à trois mécanismes.
Vidéo: Vue ETO long-axe 120° de l'aorte ascendante dans une dissection A; la membrane ("flap") oscille librement au cours du cycle cardiaque; on aperçoit la déchirure pendant la systole.
Vidéo: Passage de la vraie à la fausse lumière au flux couleur lors d'une dissection A dans la crosse aortique.
La force qui dissocie les tissus est liée à trois mécanismes.
- Vélocité d'éjection du flux (contractilité ventriculaire, dP/dt du VG);
- Pression artérielle aortique maximale (systolique);
- Pulsatilité artérielle (Pression pulsée = PAsyst – PAdiast).
L'intima se déchire aux endroits de stress maximum: la racine de l'aorte ascendante (68% des cas) et l’isthme (24%) [12]. L'incidence de la maladie est de 5-10 cas par 100'000 habitants et par année ou 3.2 par 100'000 autopsies [18]. La mortalité naturelle de la dissection aortique est de 50% à 48 heures et de 90% à 3 mois [12]. Plusieurs étiologies sont possibles [13].
- Hypertension artérielle; c'est le facteur de risque le plus important;
- Médianécrose aortique: environ 20% des cas; 40% des cas de syndrome de Marfan développent une dissection;
- Ectasie aortique;
- Athérosclérose (athérome ulcéré);
- Rupture de vasa vasorum;
- Complication iatrogène de la canulation aortique de CEC;
- Traumatisme thoracique (étiologie rare);
- La bicuspidie valvulaire aortique est fréquemment associée.
Il existe historiquement trois classifications des dissections de l'aorte. La plus ancienne est celle de DeBakey: les lésions sont réparties en trois types selon la localisation de la déchirure proximale et l'étendue de la lésion (Figure 18.2) [6]:
- Type I: aorte ascendante et descendante ;
- Type II: aorte ascendante seule ;
- Type III: aorte descendante, avec extension possible au niveau abdominal.
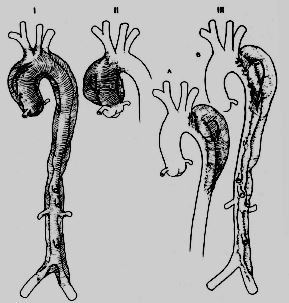
Figure 18.2 : Classification des dissections de l'aorte thoracique en trois types selon DeBakey [6].
Cette classification a été simplifiée par D. Cooley en deux types (Figure 18.3) [4].
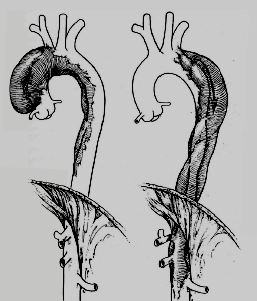
Figure 18.3 : Classification des dissections de l'aorte thoracique en deux types selon D. Cooley [4].
Comme le facteur pronostique déterminant est l'implication de l'aorte ascendante dans la dissection, indépendamment de la localisation de la déchirure proximale, des points de sortie et de l'étendue distale de la lésion, le groupe de Stanford a établi une classification en deux groupes répartis selon la sanction thérapeutique (Figure 18.4) [5]. C'est la classification la plus utilisée actuellement.
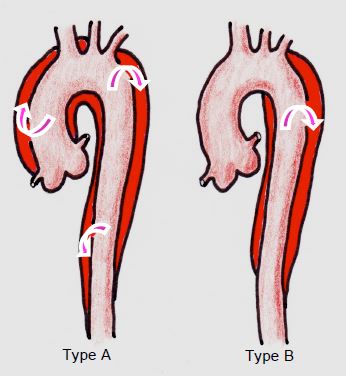
Figure 18.4 : Classification des dissections de l'aorte thoracique en deux types selon la classification de Stanford [5]. Le type A est caractérisé par une déchirure dans l’aorte ascendante, quelle que soit son extension distale. Le type B est défini par une déchirure limitée à l’aorte descendante.
- Type A: dissection de l'aorte ascendante, avec ou sans la crosse et l'aorte descendante, dont la thérapeutique est chirurgicale d'emblée (Vidéos) (Figure 18.5 et Figure 18.6) [7,13].
- Déchirure intimale proximale toujours présente.
- Incidence: 65-85% des cas; incidence des cas aigus: 80%.
- Age moyen: 50 ans.
- Insuffisance aortique: présente dans 50-75% des cas.
- Infarctus myocardique, défaillance ventriculaire gauche: 10-15% des cas.
- Mortalité aiguë (sans traitement): ≥ 90%; causes du décès: rupture, tamponnade, effondrement circulatoire, AVC, ischémie viscérale.
- Traitement: chirurgie d'urgence.
- Mortalité chirurgicale: 10% ; 20% à 1 mois (mortalité du traitement médical seul: 88%).
Vidéo: Dissection A dont la membrane est fixée à la jonction sino-tubulaire; présence de thrombus dans le cul-de-sac entre la membrane et la paroi aortique; la racine aortique est dilatée et les cuspides de la valve aortique ne coaptent pas normalement.
Vidéo: Vue long-axe de la valve aortique dans une dissection A; le flap protrude à travers la valve aortique en diastole, occasionnant une régurgitation sévère.
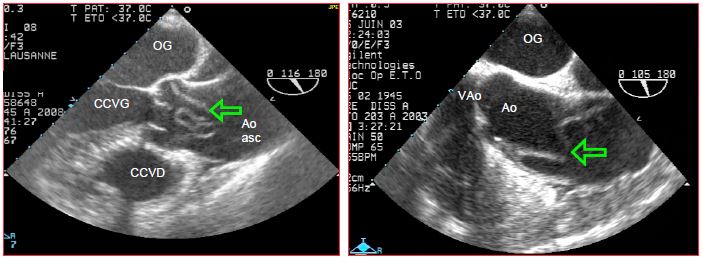
Figure 18.5 : Vues d’une dissection A de l’aorte ascendante en échocardiographie transoesophagienne (ETO). La flèche verte indique la membrane (flap) qui flotte dans la lumière aortique. Ao : aorte ascendante. VAo : valve aortique. CCVG : chambre de chasse du VG. CCVD : chambre de chasse du VD.
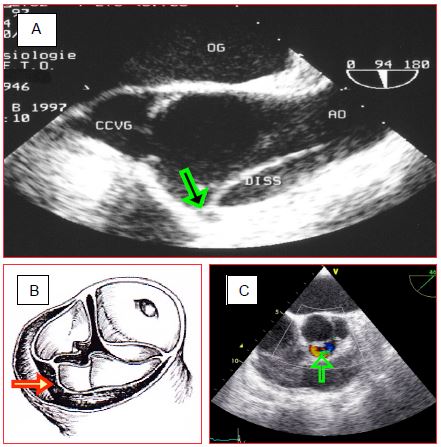
Figure 18.6 : Dissection A (images ETO). A: membrane s’insérant dans la coronaire droite et la disséquant partiellement. B: désinsertion de la cuspide coronaire gauche et de la cuspide non-coronaire. C : flux diastolique à travers la déchirure d’une dissection A située dans la cuspide coronarienne droite.
- Type B: dissection de l'aorte descendante seule, avec ou sans extension abdominale, dont le traitement primaire est médical (Vidéos et Figure 18.7) [2,8,19].
- Déchirure intimale: peut être absente (10% des cas).
- Incidence: 30-35% des cas.
- Age moyen: 65 ans.
- Association à l'hypertension et à l'artériosclérose: 80% des cas.
- Mortalité aiguë (sans traitement): 40%.
- Traitement: équilibration médicale (béta-bloqueur, anticalcique, anti-hypertenseur); opération ultérieure élective si complications.
- Mortalité chirurgicale: 17.5%; mortalité de l'endoprothèse: 6.6%; mortalité du traitement médical: 6.4% [8].
- Indication opératoire: douleur persistante, dilatation anévrysmale (> 5.5 cm ou élargissement > 4 mm/an), déficit neurologique, ischémie rénale ou digestive, HTA non-contrôlable. L’endoprothèse aortique immédiate ne modifie pas le pronostic à court terme par rapport au traitement médical optimal, mais le suivi à long terme montre qu'elle tend à diminuer la mortalité et la progression de la maladie [15]. En indication élective selon les complications, elle diminue de 3 fois (OR 3.41) le risque opératoire par rapport au remplacement chirurgical lorsqu’elle est techniquement possible [9].
Vidéo: Vue court-axe de l'aorte descendante dans une dissection B, avec la rupture de la membrane.
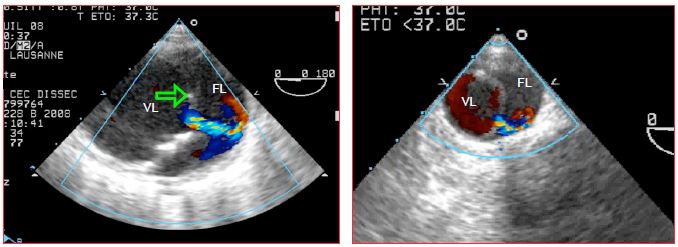
Figure 18.7 : Dissection B. Vues échocardiographiques transoesophagiennes de l’aorte descendante, qui est séparée en 2 lumières par une membrane (flèche verte). En systole, on aperçoit un passage de sang (jet de couleur) entre la vraie lumière (VL) et la fausse lumière (FL), dans laquelle le flux est lent (présence de contraste spontané indiquant la stase).
La présence ou l'absence, le nombre et la localisation des points de sortie sont sans signification pronostique. La vraie lumière s'expand en systole; le flux sanguin y est plus rapide que dans la fausse, qui contient souvent du contraste spontané ou un thrombus. Le plus souvent, la vraie lumière est la plus petite des deux (Vidéo).
Vidéo: Passage entre la vraie et la fausse lumière au flux couleur dans une dissection A s'étendant dans l'aorte descendante. La vraie lumière est en forme de croissant (située sur la droite à l'écran), elle s'expand en systole; la fausse lumière est arrondie et plus grande (située à gauche); le flux va de la vraie à la fausse lumière en systole, mais dans le sens inverse en diastole, car la pression dans la fausse lumière est supérieure à la pression diastolique dans l'aorte.
Immédiatement après correction chirurgicale, la fausse lumière reste perméable chez la majorité des patients (Vidéo) [10]; elle thrombose secondairement.
Vidéo: Vue court-axe de l'aorte descendante avec les deux lumières perméables; la vraie lumière est en forme de croissant, la fausse est circulaire.
Le pronostic est plus réservé lorsque sa perméabilité est conservée. On voit alors une aorte en "double canon", avec deux lumières contenant toutes deux un flux, séparées par une membrane épaissie et fibrosée. Le risque tient au fait que certains organes peuvent se trouver perfusés par la fausse lumière et souffrir d’ischémie chronique (Figure 18.8).
Vidéo: Passage entre la vraie et la fausse lumière au flux couleur dans une dissection A s'étendant dans l'aorte descendante. La vraie lumière est en forme de croissant (située sur la droite à l'écran), elle s'expand en systole; la fausse lumière est arrondie et plus grande (située à gauche); le flux va de la vraie à la fausse lumière en systole, mais dans le sens inverse en diastole, car la pression dans la fausse lumière est supérieure à la pression diastolique dans l'aorte.
Immédiatement après correction chirurgicale, la fausse lumière reste perméable chez la majorité des patients (Vidéo) [10]; elle thrombose secondairement.
Vidéo: Vue court-axe de l'aorte descendante avec les deux lumières perméables; la vraie lumière est en forme de croissant, la fausse est circulaire.
Le pronostic est plus réservé lorsque sa perméabilité est conservée. On voit alors une aorte en "double canon", avec deux lumières contenant toutes deux un flux, séparées par une membrane épaissie et fibrosée. Le risque tient au fait que certains organes peuvent se trouver perfusés par la fausse lumière et souffrir d’ischémie chronique (Figure 18.8).
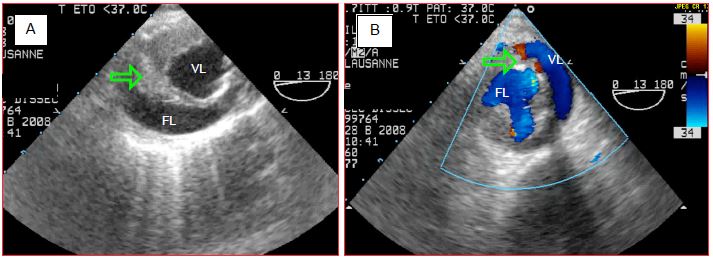
Figure 18.8 : Aorte descendante en "double canon" suite à une dissection chronifiée. La flèche verte désigne la membrane épaissie et fibrosée. Le flux aortique passe dans la vraie lumière (VL) et dans la fausse lumière (FL).
La dissection aiguë se manifeste cliniquement par des douleurs rétrosternales ou interscapulaires d'apparition brusque et par un déséquilibre hémodynamique grave: poussée hypertensive, choc hypovolémique, insuffisance gauche congestive (due à une insuffisance aortique aiguë), tamponnade (la majeure partie de l'aorte ascendante est intrapéricardique). La symptomatologie peut mimer un infarctus myocardique, mais débute souvent par des signes neurologiques fugaces. Selon l'extension de la dissection, on peut rencontrer un accident vasculaire cérébral (10 % des Type A), une paraplégie (5% des cas), des troubles neurologiques passagers ou une ischémie des membres inférieurs. L'histoire naturelle de la dissection est dramatique: mortalité à 2 jours jusqu'à 50%, survie à 3 mois de 10% [12].
Hématome intrapariétal
Bien que la dissection démarre par une déchirure intimale, il se peut qu’une hémorragie des vasa vasorum provoque un clivage au sein de la paroi aortique et donne naissance à un hématome pariétal circulaire qui correspond à une dissection localisée sans communication avec la lumière aortique ; la paroi mesure > 7 mm d’épaisseur [3]. Cette lésion se manifeste par des douleurs violentes comme une dissection. Son incidence est de 6-15% des syndromes aortiques aigus [1]. Elle est située dans l’aorte descendante dans 60% des cas et prédomine chez les personnes âgées [14]. Elle se présente au CT-scan, à l’IRM ou à l’ETO comme un épaississement hyperdense en croissant sur la paroi aortique (Figure 18.9 et Figure 18.10).
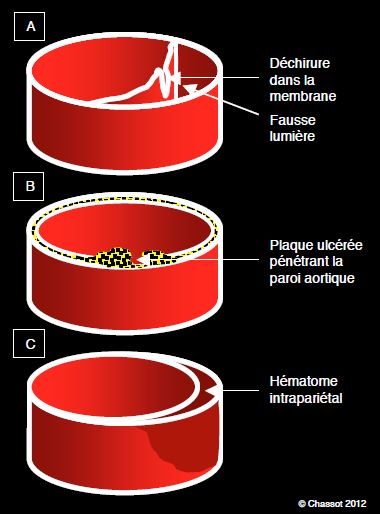
Figure 18.9 : Lésions pariétales aortiques. A : dissection ; une membrane sépare la vraie et la fausse lumières ; l’origine est une déchirure intimale. B : une plaque athéromateuse ulcérée pénètre dans la paroi aortique et érode les couches ; elle peut provoquer une dissection ou une rupture. C : hématome intrapariétal sur rupture de vasa vasorum ; il cause une dissection au sein de la paroi mais sans contact avec le flux sanguin [3].
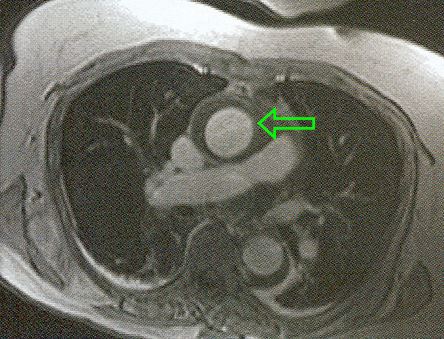
Figure 18.10 : Hématome intrapariétal circulaire de l’aorte ascendante à l’IRM (flèche verte).
L’hématome intramural évolue vers le pseudo-anévrysme ou la dissection, avec un risque de rupture de 20-45%, notamment lorsque l’épaisseur de paroi est > 16 mm ; seuls 10% régressent spontanément [15,17]. Dans l'aorte ascendante, la lésion est donc une indication au remplacement chirurgical en urgence, notamment lorsqu'elle est associée à un épanchement péricardique ou à un hématome périaortique. L'endoprothèse n'est pas un traitement validé pour les lésions de l'aorte ascendante. Dans l'aorte descendante, au contraire, le traitement est primairement endoprothétique ou médical [7]. Non opéré, l'hématome intrapariétal a une mortalité à 30 jours de 46% [17], alors que la mortalité opératoire est de 14% [14].
| Dissection aortique |
|
Rupture dans la média créant une fausse lumière où le sang pénètre par une déchirure proximale de l’intima ; présence d’une membrane (flap) flottant dans l’aorte. Mécanismes dissociant les tissus :
- Vélocité d’éjection du VG (contractilité)
- Pression artérielle systolique
- Pulsatilité (Pression pulsée = PAsyst – PAdiast)
Type A : dissection de l’aorte ascendante (± crosse et descendante), insuffisance aortique fréquente; traitement chirurgical d’emblée.
Type B : dissection de l’aorte descendante seule; traitement médical. Indications chirurgicales: ischémie, dilatation, douleurs, déficit neurologique.
Hématome intrapariétal: épaississement en croissant de la paroi aortique. Dans l'aorte ascendante: traitement chirurgical. Dans l'aorte descendante: traitement médical et observation.
|
© CHASSOT PG, TOZZI P, BETTEX D, Octobre 2010, Dernière mise à jour, Avril 2018
Références
- ALOMARI IB, HAMIRANI YS, MADERA G, et al. Aortic intramural hematoma and its complications. Circulation 2014; 129:711-716
- ANDRITSOS M, DESAI ND, GREWAL A, et al. Innovations in aortic disease management: The descending aorta. J Cardiothorac Vasc Anesth 2010; 24:523-9
- COADY MA, IKONOMIDIS JS, CHEUNG AT, et al. Surgical management of descending thoracic aortic disease: open and endovascular approaches. Circulation 2010; 121:2780-804
- COOLEY DA. Surgical treatments of aortic aneuvrisms. Philadelphia:Saunders, 1986, p 45
- DAILY PO, TRUEBLOOD HW, STINSON EB, et al. Management of acute aortic dissections. Ann Thorac Surg 1970; 10:237-43
- DEBAKEY ME, COOLEY DA, CREECH O. Surgical considerations of dissecting aneurysm of the aorta. Ann Surg 1955; 142:586-92
- ERBEL R, ABOYANS V, BOILEAU C, et al. 2014 ESC Guidelines on the diagnosis and treatment of aortic diseases. Eur Heart J 2014; 35:2873-926
- FATTORI R, CAO P, DE RANGO P, et al. Interdisciplinary expert consensus document on management of type B aortic dissection. J Am Coll Cardiol 2013; 61:1661-78
- FATTORI R, TSAI TT, MYRMEL T, et al. Complicated acute type B dissection: is surgery still the best option ? A report from the International Registry of Acute Aortic Dissection. JACC Cardiovasc Interv 2008; 1:395-402
- HEINEMANN M, LAAS J, KARCK M, et al. Thoracic aortic aneurysms after acute type A aortic dissection: necessity for follow-up. Ann Thorac Surg 1990; 49:580-4
- HIRATZKA LF, BAKRIS GL, BECKMAN JA, et al. 2010 ACCF/AHA/AATS/ACR/ASA/SCA/SCAI/ SIR/STS/SVM Guidelines for the diagnosis and management of patients with thoracic aortic disease: Executive summary. Circulation 2010:121:1544-79
- HIRST AE, JOHNS VJ, KIME W. Dissecting aneurysns of the aorta: A review of 505 cases. Medicine 1958; 37:243
- KOUCHOUKOS NT, DOUGENIS D. Surgery of the thoracic aorta. N Engl J Med 1997; 336:1876-88
- LANSMAN SL, SAUNDERS PC, MALEKAN RE, et al. Acute aortic syndome. J Thorac Cardiovasc Surg 2010; 140:S92-7
- NIENABER CA, ROUSSEAU H, EGGEBRECHT H, et al. for the INSTEAD trial. Randomized comparison of strategies for type-B aortic dissection. The Investigation of STEnt grafts in Aortic Disseaction trial. Circulation 2009; 110:2519-28
- NIENABER CA, POWELL JT. Management of acute aortic syndromes. Eur Heart J 2012; 33:26-35
- ROBBINS RC, McMANUS RP, MITCHELL RS, et al. Management of patients with intramural hematoma of the thoracic aorta. Circulation 1993; 88(Suppl II):II-1-10
- SVENSJO S, BENGTSSON H, BERGQVIST D. Thoracic and thoracoabdominal aortic aneurysm and dissection: an investigation based on autopsy. Br J Surg 1996; 83:68-71
- TERAA M, VAN HERWAARDEN JA, RIMARCHI S, MOLL FL. Morphologic characteristics for treatment guidance in uncomplicated acute type B aortic dissection. Circulation 2014; 130:1723-5
