Le volume de distribution (Vd) est un volume virtuel sans corrélation avec les volumes anatomiques de l'organisme; il représente le volume apparent nécessaire pour expliquer la concentration plasmatique d'une substance. Un produit très liposoluble aura une faible concentration plasmatique et un très grand volume de distribution, particulièrement chez les obèses; ce grand Vd est le reflet d'une importante absorption tissulaire, qui laisse peu de produit en circulation à disposition des mécanismes d'élimination et qui constitue un stockage prolongeant le temps de récupération. Un produit maintenu dans le liquide extracellulaire par une forte liaison protéique ou une ionisation importante aura un faible Vd. La baisse des protéines de fixation a pour effet apparent d'augmenter le volume de distribution.
La demi-vie d'une substance est le temps nécessaire pour que la concentration de celle-ci diminue de moitié. On estime que les concentrations plasmatiques sont négligeables après 3 demi-vies (diminution du taux plasmatique à 12.5% de sa valeur de départ) et nulles après 5 demi-vies (diminution à 3.15%).
Le modèle pharmacocinétique le plus simple est un modèle à deux compartiments, qui est utilisable pour la majeure partie des médicaments d'anesthésie (Figure 4.8A). Après une injection intraveineuse, l'équilibre de la substance entre le compartiment central (1) et le compartiment périphérique (2) commence immédiatement; sa rapidité est fonction des constantes de diffusion K 1→2 et K 2→1. La substance est éliminée depuis le compartiment central (Ke). La décroissance de la concentration plasmatique suit deux phases (Figure 4.8B) [1,3].
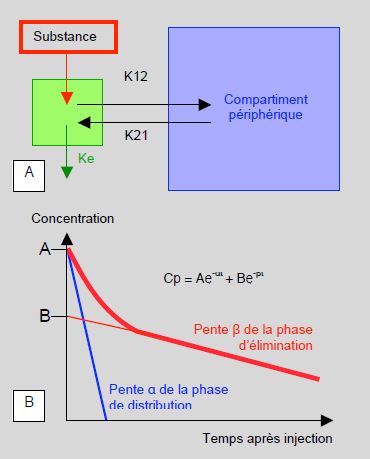
Figure 4.8: éléments de pharmacocinétique. A: modèle à deux compartiments, où K12 et K21 sont les constantes de diffusion entre le compartiment central et le compartiment périphérique, et Ke la constante d'élimination (clairance). B: concentration plasmatique (Cp) d'une substance injectée par voie intraveineuse (au temps 0); la concentration baisse de manière bi-exponentielle en suivant la phase de redistribution α et la phase d'élimination β.
- Décroissance initiale rapide (phase de distribution α), correspondant au passage du plasma (1) vers les tissus (2);
- Décroissance lente (phase d'élimination β), correspondant à l'élimination de la substance (clairance) à partir du compartiment central; la demi-vie est la tβ1/2.
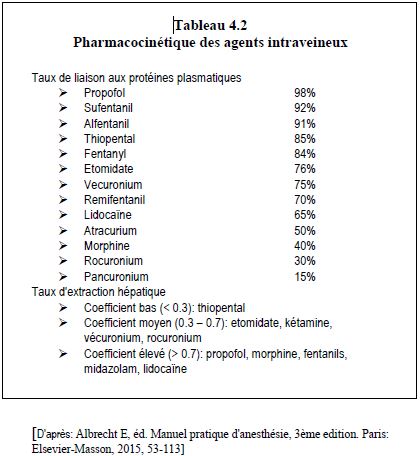
La clairance est le volume plasmatique totalement épuré de la substance par unité de temps, ou le rapport entre la quantité de médicament éliminée par unité de temps et sa concentration plasmatique. C'est la somme des éliminations rénale et hépatique, conditionnées par le degré de liaison protéique des substances (Tableau 4.2).
Les concepts de demi-vie d’élimination et de volume de distribution ne permettent pas de rendre compte efficacement de tous les effets cliniques d’une substance, notamment à cause des transferts entre les compartiments périphériques et le compartiment central. La notion de demi-vie contextuelle (context sensitive half-times : CST1/2 ) est plus adaptée, puisqu’elle décrit le temps nécessaire à la diminution de 50% de la concentration d’une substance perfusée en continu pour maintenir un taux circulant constant (Figure 4.9) [10]. Elle est significativement plus longue que la demi-vie d'élimination bi-exponentielle.
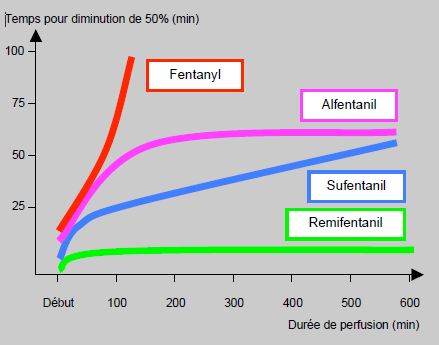
Figure 4.9: Représentation graphique de la demi-vie contextuelle (context-sentitive half-time) des principaux opiacés synthétiques utilisés en perfusion. Les courbes représentent le temps nécessaire à la diminution de moitié du taux plasmatique circulant de chaque substance après une perfusion de durée variable [10]. Alors que le fentanyl et le sufentanil s'accumulent au cours de leur perfusion, l'alfentanil et le remifentanil conservent des demi-vies contextuelles stables. Celle du remifentanil est d'environ 5 minutes.
La vitesse de distribution d'un médicament entre les différents compartiments dépend de plusieurs phénomènes.
- Perfusion tissulaire: débit cardiaque, vasodilatation, vasoconstriction; la perfusion est plus élevée dans les organes à autorégulation (cœur, cerveau, reins, foie) que dans les autres organes et que dans les tissus somatiques (muscles, glandes, peau, graisse).
- Liaison aux protéines plasmatiques: la diffusion et l'activité d'un médicament dépendent de sa fraction libre non liée aux protéines. Si la concentration protéique baisse (hypoprotéinémie, hémodilution), la fraction libre augmente, donc la diffusion et l'effet clinique sont plus importants. Les médicaments acides sont préférentiellement liés à l'albumine et les substances basiques à la glycoprotéine acide α1 (Tableau 4.2).
- Diffusion: décroissance bi-exponentielle.
L'effet anesthésique est déterminé par la concentration cérébrale de la substance. Pour un agent intraveineux, il est proportionnel à la concentration plasmatique et pour un agent par inhalation à la concentration alvéolaire. La vitesse d'induction et de réveil avec un gaz halogéné dépend de plusieurs éléments.
- La solubilité du gaz dans le sang; la vitesse augmente si la solubilité est basse dans le sang (coefficient de partition sang/gaz bas) et dans les graisses (coefficient de partition huile/eau bas).
- La différence de pression partielle du gas entre les alvéoles et les capillaires pulmonaires; la vitesse augmente si cette différence est élevée ; plus la concentration alvéolaire d'un halogéné s'élève rapidement, plus l'induction est accélérée.
- Le débit cardiaque; la vitesse d'induction augmente si le débit cardiaque diminue. En effet, le bas débit sanguin pulmonaire diminue les échanges gazeux; la pression alvéolaire du gaz se modifie donc lentement, ce qui maintient élevée la Fi alvéolaire du gaz: l'induction est donc accélérée. Ce phénomène n'est important que pour les agents à forte solubilité.
Effets de la vieillesse
Le remaniement physique lié à l'âge est caractérisé par une série de phénomènes qui sont bien évidents dès 75 ans, mais qui apparaissent progressivement dès 65 ans. Ces modifications ont des conséquences pharmacocinétiques importantes (voir Chapitre 21, Le patient âgé) [17].
- Diminution de 35% de la masse musculaire: ↓ Vd des substances lipophiles, ↑ sensibilité aux curares, retard de récupération de la curarisation.
- Diminution de 15% de l'H2O totale: ↓ Vd des substances hydrophiles et ionisées (curares, catécholamines).
- Hypoprotéinémie et hypoalbuminémie (↓ 20%): ↑ fraction libre et de l'activité des agents, particulièrement marqué pour le propofol (taux de liaison protéique 98%).
- Diminution du métabolisme hépatique de 35%: retard d'élimintaion de la morphine, des fentanils, du midazolam, du propofol.
- Diminution de l'excrétion rénale de 35%: élimination retardée.
En pharmacodynamique, on voit que la MAC des halogénés baisse de 0.6% par année d'âge; elle est diminuée de 35% à 75 ans [6] :
- Isoflurane : 0.9% au lieu de 1.2%
- Sevoflurane : 1.5% au lieu de 1.9%
- Desflurane : 5% au lieu de 6.5%
Pour maintenir l'équilibre hémodynamique, il est donc capital de réduire les doses d'environ 50% chez la personne âgée (> 75 ans), et de ralentir l'administration intraveineuse à l'induction.
Effets de l'insuffisance cardiaque
Il n'est pas rare que l'on doive endormir un malade en insuffisance cardiaque. Dans cette situation, la baisse du débit et la rétention hydro-sodée conduisent à une augmentation du volume sanguin et du volume extracellulaire, à une baisse du volume intracellulaire (perte de masse musculaire), et à une hypoalbuminémie relative. La pharmacocinétique est donc modifiée chez les patients en insuffisance ventriculaire [14].
- Prolongation de la phase de distribution intraveineuse.
- Variation globale du volume de distribution (Vd) :
- ↓ du Vd des substances à distribution intracellulaire (opiacés, diazépines) ;
- ↑ du Vd des substances à distribution exclusivement extracellulaire (curares, catécholamines).
- Modification de la distribution tissulaire: débit relatif augmenté dans le compartiment central (cerveau, coeur, poumons) et diminué dans le compartiment périphérique (vasoconstriction dans les viscères, les muscles et la peau) ; le Vd apparent est diminué.
- Baisse de la clairance des substances par plusieurs mécanismes :
- ↓ du flux plasmatique rénal (FPR), redistribution du FPR du cortex vers la médullaire et ↑ de la résorbtion tubulaire ; la clairance rénale est diminuée;
- ↓ du débit hépatique, stase hépatique, ↓ du métabolisme ; la clairance hépatique (fentanils, morphine) est diminuée.
- Hypoalbuminémie : ↑ fraction libre des substances très liées aux protéines comme le propofol ; l'effet clinique est augmenté.
Lorsqu’on administre une dose conventionnelle d’une substance, les taux plasmatiques sont plus élevés que chez un individu normal (diminution du volume de distribution effectif et de la clairance), et les effets centraux cérébraux et cardiaques sont amplifiés. De plus, la baisse du débit sanguin pulmonaire influence la pharmacocinétique des gaz: elle accélère l'induction et en augmente les effets cardiocirculatoires.
Effets de la CEC
L'hémodilution qui s'installe en début de CEC diminue brusquement la concentration des substances en solution dans le compartiment central (voir Anesthésie pendant la CEC, Pharmacocinétique). Ceci entraîne deux phénomènes:
- Diminution soudaine de la concentration libre des substances; ceci implique un risque de réveil et de décurarisation (Figure 4.10) [5,11] ; les variations de concentration sont de l'ordre de 10-55% selon les substances et selon leurs volumes de distribution [18]. L'effet est plus marqué pour celles qui ont petit Vd.
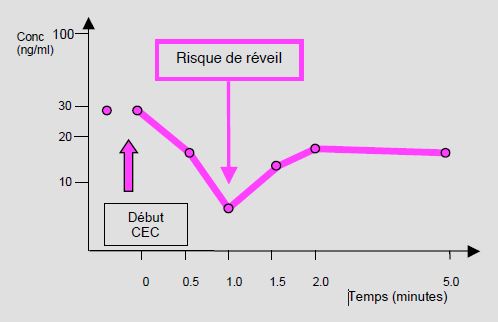
Figure 4.10: Profil de concentration plasmatique du fentanyl au début d'une CEC. La chute du taux est brêve; l'équilibre est rétabli en 2 minutes [modifié d’après Hynen M. Binding of fentanyl and alfentanil to the extracorporeal circuit. Acta Anaesthesiol Scand 1987; 31:706-10].
- Diminution de 30-40% de la concentration d'albumine et d'α-glycoprotéine acide; le taux libre des substances fortement liées (fentanyl 84%, midazolam 94%, propofol 98%, par exemple) augmente significativement, alors que celui des substances faiblement liées (vecuronium 30%, morphine 35%) se modifie peu [18].
Ces deux effets peuvent se compenser partiellement; ils n'ont pas la même cinétique et sont transitoires, car ils durent le temps nécessaire à une rééquilibration à partir du réservoir représenté par les tissus périphériques [9]. Le Vd des agents d'anesthésie, qui sont des substances lipophiles, est beaucoup plus grand que le volume de la CEC. Pour les curares, qui sont des substances hydrophiles, le Vd est moins grand, la liaison protéique plus faible, et la dilution soudaine plus importante; le risque de décurarisation est donc significatif, et d'autant plus que le volume circulant du patient est plus petit.
L'hypothermie ralentit la distribution des substances entre les différents compartiments, inhibe leur biotransformation, et réduit leur clairance par le foie et par les reins; à 27°, cette réduction est de 50%. Ainsi l'inhibition des rhodanases hépatiques retarde la métabolisation du nitroprussiate, et la concentration plasmatique des substances administrées en perfusion continue augmente. L'affinité pour les récepteurs est diminuée lorsque la température baisse. La vasoconstriction induite par le froid détourne le flux sanguin vers les organes à haut débit (cerveau, foie, rein) et réduit le volume de distribution des substances qui ont un faible Vd; c'est le cas pour les curares, dont le taux augmente en CEC hypothermique. De plus, l'hypothermie augmente graduellement l'eau intracellulaire et diminue le volume plasmatique.
La solubilité des gaz augmentant lorsque la température baisse, l'hypothermie accroît la quantité d'halogénés dilués dans le sang et baisse leur pression partielle tissulaire. Le coefficient de partition sang:gaz des halogénés s'élève. Il faut donc augmenter leur concentration pour obtenir le même effet (augmentation de la MAC apparente): en-dessous de 30°C, la concentration sanguine de l'isoflurane est la moitié de la fraction inspirée affichée sur le vaporisateur [19]. Toutefois, les besoins en agents d'anesthésie sont réduits par l'hypothermie, puisqu'il n'y a plus d'activité consciente en dessous d'une température cérébrale de 32°. La MAC réelle des halogénés diminue linéairement entre 37° et 20°, où elle devient nulle [2]. De plus, l'hémodilution réduit le coefficient de partition sang:gaz, de sorte que ces effets tendent à s'annuler mutuellement [19]. Par ailleurs, les membranes d'oxygénateur en polypropylène absorbent les halogénés mais assurent leur diffusion, alors que les membranes en polyméthylpentane leur sont imperméables [20].
Les poumons métabolisent et éliminent une série de substances: noradrénaline, isoprénaline, lidocaïne, bupivacaïne, fentanyl, stéroïdes, prostaglancines, chlorpromazine, imipramine [19]. Ils servent de réservoir aux substances liposolubles basiques comme le fentanyl, le sufentanil, le propofol ou la lidocaïne; elles y restent stockées pendant la CEC puisqu'il n'y a plus de circulation pulmonaire. Elles seront relarguées au moment du déclampage et de la reventilation, ce qui cause une augmentation du taux plasmatique et un approfondissement momentané de l'anesthésie (Figure 4.11) [15].

Figure 4.11: Modifications du taux plasmatique de fentanyl lors de la recirculation pulmonaire [modifié d’après: Bentley JB, Conahan TJ, Cork RC. Fentanyl sequestration in lungs during cardiopulmonary bypass. Clin Pharmacol Ther 1983;34:703-6].
La captation de la dopamine et de la nor-adrénaline par les poumons cesse lorsque ces derniers sont exclus; leurs taux sériques augmentent pendant la période de clampage. Le flux hépatique diminue en CEC à cause de l'hypothermie et de la dépulsation. Ceci a un effet significatif sur la métabolisation des substances qui ont un coefficient d'extraction hépatique important (fentanyl, vecuronium) ou moyen (alfentanil). La clairance du lactate est diminuée de 30% par la CEC [13].
Les composants des circuits de CEC, particulièrement les oxygénateurs, absorbent certaines substances lipophiles comme le fentanyl, l'alfentanil, le midazolam ou le propofol [11,12]. Toutefois, cet effet est d'une portée réduite à cause du grand volume de distribution de ces substances et de la rééquilibration entre les compartiments. L'hémofiltration, par contre, est efficace pour soustraire un grand nombre de substances du compartiment central de la circulation, puisqu'elle extrait toutes les molécules jusqu'à 20'000 Dalton, ce qui inclut l’eau, les électrolytes, la quasi-totalité des agents pharmacologiques et la plupart des déclencheurs inflammatoires.
L'héparine en forte concentration (300 UI/kg) induit une libération de lipoprotéine-lipase et de lipase hépatique, ce qui hydrolyse les triglycérides plasmatiques en acides gras non-estérifiés (FFA: free fatty acids) qui augmentent de 15-20% [8]. Ces acides gras libres se lient aux protéines plasmatiques et déplacent les substances qui y sont fixées, ce qui en augmente la concentration libre; ce processus a lieu en quelques minutes.
Après la CEC, il persiste une augmentation du volume de distribution due à la surcharge liquidienne et une diminution des clairances hépatiques et rénales dues à la dysfonction postopératoire de ces organes; l'effet de substances comme les fentanils ou le propofol est prolongé [4]. Pour le propofol, par exemple, on relève les valeurs suivantes [7] :
- Le Vd passe de 4 L/kg avant la CEC à 7.4 L/kg en CEC;
- La clairance plasmatique avant, pendant et après CEC est respectivement de 28, 26 et 16 mL/kg/min;
- La tβ1/2 avant, pendant et après CEC est respectivement de 5, 6 et 7.8 heures.
Toutes ces modifications ont relativement peu d'impact dans les situations habituelles, mais prennent de l'importance chez les personnes de faible poids (< 50 kg, enfants), chez les personnes âgées (masse cellulaire et taux de protéines plasmatiques diminués), et chez les malades débilités (insuffisance cardiaque chronique).
Pharmacodynamique
Du point de vue pharmacodynamique, un patient pâtira de la modification iatrogène d'une composante hémodynamique d'autant plus qu'il utilisait cette dernière comme mode de compensation pour sa cardiopathie. La baisse de précharge due au midazolam ou au propofol, bien tolérée par un coeur normal, induit une chute du débit cardiaque et une hypotension sévères lorsque le ventricule dépend de cette précharge pour maintenir sa fonction (hypertrophie concentrique, insuffisance diastolique, etc) [16]. Le fait qu'une substance ait peu d'effet inotrope négatif ne garantit nullement la stabilité circulatoire, car la performance cardiaque dépend étroitement de la précharge, de la postcharge, de la fréquence, du tonus sympathique et des réflexes vasoactifs autonomes. En clinique, la contractilité n'est guère dissociable de ces éléments, qui peuvent chacun être perturbés par les substances administrées, par la ventilation et par les conditions opératoires. Le retentissement d'un médicament ou d'une manoeuvre d'anesthésie sur la perfusion des organes dépend essentiellement de son impact sur le couplage ventriculo-vasculaire. Enfin, la curarisation et la ventilation en pression positive (IPPV) modifient significativement les conditions de charge du ventricule droit et du ventricule gauche.
| Pharmacocinétique et pharmacodynamique |
|
Le volume de distribution (Vd) représente le volume virtuel nécessaire pour expliquer la concentration plasmatique d'une substance. La demi-vie est le temps nécessaire pour que la concentration diminue de moitié ; la concentration plasmatique est négligeables après 3 demi-vies (12.5%) et quasi-nulle après 5 demi-vies (3.1%). La demi-vie contextuelle décrit le temps nécessaire à la diminution de 50% de la concentration d’une substance perfusée en continu. La clairance est le volume plasmatique totalement épuré de la substance par unité de temps.
La vieillesse induit une diminution de la masse musculaire (↓ Vd lipophile), de l’eau totale (↓ Vd hydrophile), des protéines (↑ fraction libre), et de l’élimination hépatique et rénale (↓ clairance). Cela commande de réduire les doses d'environ 50% et de ralentir la vitesse d'administration iv.
L’insuffisance cardiaque ralentit la perfusion et en modifie la distribution : ↑ perfusion musculaire, cutanée et viscérale, ↑ perfusion centrale (cœur, cerveau, poumon), ↑ Vd intracellulaire, Vd extracellulaire, hypoprotéinémie (↑ fraction libre), ↓ clairance. Ralentir la vitesse d'administration iv.
La CEC modifie significativement la pharmacocinétique :
- Hémodilution et hypoprotéinémie brusques par le volume d’amorçage (risque de réveil et de décurarisation en début de CEC)
- Hypothermie (↓ distribution périphérique, ↓ clairance, ↑ solubilité des gaz, mais diminution des besoins)
- Exclusion des poumons : stockage de fentanil et propofol, relargage à la reventilation arrêt de métabolisation de la noradrénaline
- Héparinisation (déplacement des substances fixées aux protéines)
- Absorption dans les plastiques
|
© CHASSOT PG, BETTEX D, MARCUCCI C, Septembre 2010, dernière mise à jour, Décembre 2018
Références
- ALBRECHT E, éd. Manuel pratique d'anesthésie, 3ème edition. Paris: Elsevier-Masson, 2015, 53-113
- ANTOGNINI J. Hypothermia eliminates isoflurane requirements at 20 degrees celsius. Anesthesiology 1993; 78:1152-7
- BARASH PG, CULLEN BF, STOELTING RK, GAERTNER E. Précis d’anesthésie clinique. Paris:Arnette, 2008, 1115-1204
- BARVAIS L, HEITZ D, SCHMARTZ D, et al. Pharmacokinetic model-driven infusion of sufentanil and midazolam during cardiac surgery: Assessment of the prospective predictive accuracy and the quality of anesthesia. J Cardiothorac Vasc Anesth 2000; 14:402-8
- DAWSON PJ, BJORKSTEN AR, BLAKE DW, et al. The effects of cardiopulmonary bypass on total and unbound plasma concentration of propofol and midazolam. J Cardiothorac Vasc Anesth 1997; 11:556-61
- EGER EI. Age, minimal alveolar anesthetic concentration, and minimum alveolar anesthetic concentration-awake. Anesth Analg 2001; 93:947-53
- GEDNEY JA, GHOSH S. Pharmacokinetics of analgesics, sedatives and anaesthetic agents during cardiopulmonary bypass. Br J Anaesth 1995; 75:344-51
- HAMMAREN E, YLI-HANKALA A, ROSENBERG PH, et al. Cardiopulmonary bypass-induced changes in plasma concentration of propofol and in auditory evoked potentials. Br J Anaesth 1996; 77:360-4
- HUDSON RJ, THOMPSON IR, JASSAL R, et al. Cardiopulmonary bypass has minimal effect on the pharmacokinetics of fentanyl in adults. Anesthesiology 2003; 99:847-54
- HUGHES MA, GLASS PS, JACOBS JR. Context-sensitive half-time in multicompartment pharmacokinetic models for intravenous anesthetic drugs. Anesthesiology 1992; 76:334
- HYNYNEN M, HAMMAREN E, ROSENBERG PH. Propofol sequestration within the extracorporeal circuit. Can J Anaesth 1994; 41:583-8
- ISETTA C, CADUSSEAU JL. Circuits de circulation extracorporelle: matériels réutilisables, matériels à usage unique. In: JANVIER G, LEHOT JJ (ed). Circulation extracorporelle: principes et pratique, 2ème édition. Paris: Arnette Groupe Liaison SA, 2004, pp 59-86
- MUSTAFA I, ROTH H, HANAFIAH A, et al. Effect of cardiopulmonary bypass on lactate metabolism. Intensive Care Med 2003; 29:1279-85
- NIES AS. Clinical pharmacokinetics in congestive heart failure. In: HOSENPUD J.D., GREENBERG B.H. - Congestive heart failure. Springer-Verlag, New-York, 1994, p 323-340
- OKUTANI R, PHILBIN DM. ROSOW CE, et al. Effect of hypothermic hemodilutional cardiopulmonary bypass on plasma sufentanil and catecholamine concentrations in humans. Anesth Analg 1988; 67:667
- REICH DL, HOSSAIN S, KROL M, et al. Predictors of hypotension after induction of general anesthesia. Anesth Analg 2005; 101:622-8
- RIVERA R, ANTOGNINI JF. Perioperative drug therapy in elderly patients. Anesthesiology 2009; 110:1176-81
- ROSEN D, ROSEN K. Elimination of drugs and toxins during cardiopulmonary bypass. J Cardiothorac Vasc Anesth 1997; 11:337-40
- SMITH D. Cardiovascular and pulmonary pharmacology. In: ALSTON RP, MYLES P, RANUCCI M, eds. Oxford Textbook of Cardiothoracic Anesthesia. Oxford: Oxford University Press, 2015, 69-82
- WIESENACK C, WIESNER G, KEYL C, et al. In-vivo uptake and elimination of isoflurane by different membrane oxygenators during cardiopulmonary bypass. Anesthesiology 2002; 97:133-8
