Infarctus anamnestique
Le risque opératoire après un infarctus myocardique tient moins à son âge qu'à sa taille, à sa localisation, à son degré de complications, à la quantité de muscle à risque d'ischémie subséquente, et au status fonctionnel du ventricule. Par sécurité, on admet une limite de 3-6 mois après l'évènement comme délai opératoire, mais un petit infarctus non compliqué sans angor résiduel autorise une chirurgie non-cardiaque impérative après 2-3 mois déjà. A l'opposé, un patient avec un infarctus étendu, des symptômes résiduels et une FE < 0.4 présente un risque ischémique élevé même après 6 mois. Le délai pour opérer après un infarctus est habituellement subdivisé en trois catégories de risque [9,24] :
- Moins de 6 semaines après l'évènement: période à haut risque (taux de ré-infarctus : 25-33%, mortalité : ≥ 15%) ; une intervention chirurgicale est contre-indiquée.
- Entre 6 semaines et 3 mois: période à risque intermédiaire (taux de ré-infarctus : 8-19%, mortalité : 11%), permettant une chirurgie impérative; le délai de 6 semaines représente la durée minimum pour la cicatrisation des lésions de la zone infarcie et la ré-endothélialisation des vaisseaux [30] ;
- Au-delà de 3 mois: période à risque faible (taux de ré-infarctus : 5-9%, mortalité : 9%), pour autant qu'il n'y ait ni complications ni symptômes résiduels. La persistance de symptômes nécessitant un traitement médical continu autre que la thérapeutique préventive place le malade dans la catégorie à risque intermédiaire.
La survenue d'un infarctus dans le mois qui précède une intervention est grevée d'un risque de récidive très élevé (RR 9.9-44.3) et d'une mortalité triplée (RR 1.8-3.8); un délai de 2 mois donne des valeurs de 4.5-21.9 et 1.25-2.9, respectivement [24].
Valvulopathies
Les valvulopathies sténosantes imposent une restriction hémodynamique qui ne permet aucune adaptation du débit cardiaque. Le volume systolique devient fixe, et dépend de la fréquence : la bradycardie diminue linéairement le débit cardiaque, et la tachycardie empêche un remplissage adéquat (sténose mitrale) ou une éjection satisfaisante (sténose aortique). Les critères de sévérité sont les suivants [31,37] :
- Sténose aortique serrée : surface < 0.6 cm2/m2, gradient moyen > 45 mmHg, gradient maximal ≥ 100 mmHg ;
- Sténose aortique modérée : surface 0.6 – 1.0 cm2/m2, gradient moyen 25-44 mmHg ;
- Sténose mitrale serrée : surface < 0.6 cm2/m2, gradient moyen ≥ 12 mmHg.
Environ 5% des patients de > 65 ans souffrent d’une sténose aortique significative. La présence d’une sténose aortique modérée aggrave le risque opératoire et celle d’une sténose sévère symptomatique le multiplie trois à cinq fois, quelle que soit la catégorie de risque du patient ou le nombre de facteurs de risque associés [20]. La présence de sténose aortique serrée comparée à son absence pour le même type d'opération triple le taux d'infarctus (3.0% vs 1.1%) et double la mortalité à 30 jours (2.1% versus 1.0%) [1]. Le risque opératoire est lié à 6 facteurs :
- La sévérité de la sténose ;
- La symptomatologie du patient (angor, syncope, dyspnée, insuffisance congestive) ;
- La présence de coronaropathie associée ;
- La présence d'une insuffisance mitrale sévère ;
- La fonction et la dimension du VG ;
- La gravité de l’opération chirurgicale planifiée.
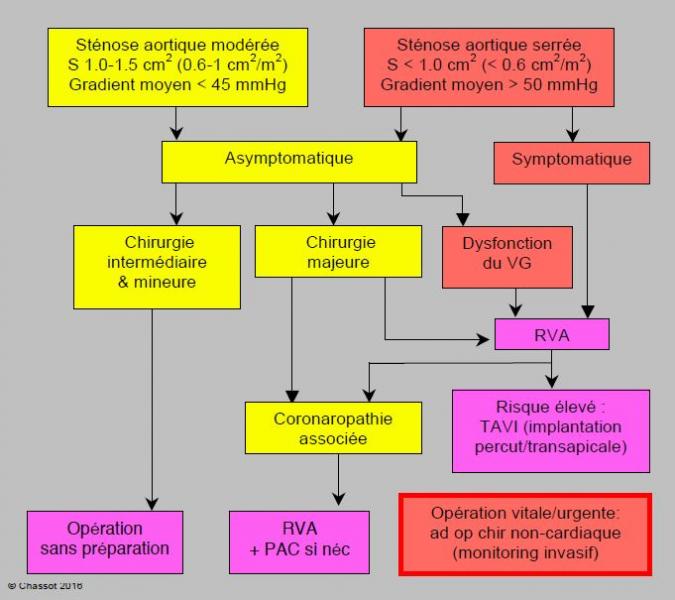
Selon les recommandations habituelles, une sténose aortique serrée découverte dans le préopératoire de chirurgie générale doit être opérée (remplacement valvulaire aortique, RVA) avant de procéder à l’intervention non-cardiaque lorsqu’elle est symptomatique (angor, syncope et/ou dyspnée) [14,22]. Lorsque le patient porteur d’une sténose aortique serrée est asymptomatique et qu’il doit subir une intervention élective majeure (chirurgie de l’aorte abdominale, chirurgie hépato-pancréatique), il est également conseillé de prévoir un RVA préopératoire. Par contre, s’il doit subir une chirurgie intermédiaire ou mineure, le RVA préopératoire ne se justifie pas (Figure 3.9A) [7,8,10].
Figure 3.9 A : Algorithme classique de prise en charge du malade porteur d’une sténose aortique [10]. Lorsqu’elle est symptomatique (angor, syncope et/ou dyspnée), une sténose aortique serrée découverte dans le préopératoire de chirurgie générale doit être opérée (remplacement valvulaire) avant de procéder à l’intervention non-cardiaque. Lorsque le patient doit subir une intervention élective majeure (chirurgie de l’aorte abdominale, chirurgie hépato-pancréatique), il est prudent de prévoir un remplacement valvulaire aortique (RVA) en cas de sténose serrée même asymptomatique ; par contre, une chirurgie intermédiaire ou mineure ne justifie pas un RVA préopératoire chez un patient asymptomatique. Dans les RVA à haut risque (mortalité prévisible > 10%), le remplacement en CEC peut être substitué par l’implantation percutanée ou transapicale d’une prothèse valvulaire montée dans un stent (TAVI). La présence d’une dysfonction du VG aggrave le pronostic et renforce l’indication à un RVA préopératoire. En cas de coronaropathie associée, on procède à des PAC simultanément au RVA. Si l’intervention est vitale ou urgente, on procède à la chirurgie générale sous cardioprotection d’aspirine et éventuellement de β-bloqueur s’il y a une indication, et sous couvert d'une prise en charge spécifique (anesthésie comme pour un RVA, monitoring avec ETO, Swan-Ganz, etc).
Toutefois, le RVA lui-même présente des risques et une mortalité qui lui sont propres (2-4%) [32]. Si la mortalité prévisible est > 5-10%, il peut être judicieux de remplacer l'opération en CEC par une implantation valvulaire par cathétérisme, ou TAVI (transcatheter aortic valve implantation), qui se conduit par voie trans-apicale ou trans-fémorale (voir Chapitre 10, Implantation valvulaire aortique) [35]. La valvuloplastie aortique par dilatation au ballon donne des résultats décevants dans les sténoses dégénératives et/ou calcifiées chez l'adulte âgé. En cas de coronaropathie associée, on procède à des PAC simultanément au RVA, ou à une angioplastie percutanée (PCI) synchronisée avec le TAVI [7]. Le type de prothèse du RVA conditionne le traitement médical ultérieur : après pose de prothèse mécanique, une anticoagulation complète est requise à vie, alors qu’après une prothèse biologique, l’anticoagulation n’est nécessaire que pendant 3 mois ; l’aspirine est maintenue à vie. Par ailleurs, traiter d'abord la valve aortique retarde considérablement l'intervention non-cardiaque, ce qui peut présenter un risque en soi en cas d'anévrysme en voie de rupture, de néoplasme envahissant ou de lésion orthopédique invalidante.
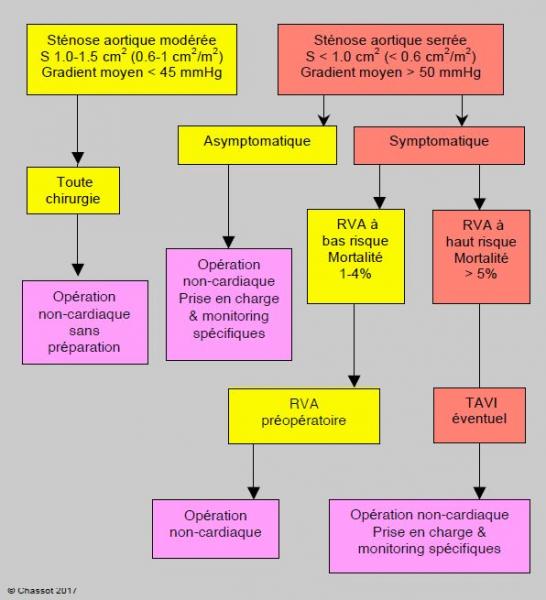
Avec les progrès de la prise en charge anesthésique basée sur un contrôle hémodynamique rigoureux, les dernières études comparatives entre porteurs de sténose aortique serrée et malades sans sténose tendent à montrer que les résultats de la chirurgie non-cardiaque sans RVA préalable sont acceptables, même si le risque est plus élevé [1,36]. Les porteurs de sténose serrée ont davantage de complications cardiaques (18.8% versus 10.5%), surtout liée à la décompensation ventriculaire, mais la mortalité à 30 jours est peu modifiée par rapport aux contrôles: patients symptomatiques 5.9% versus 3.1%, patients asymptomatiques 3.3% versus 2.7% [36]. Ces valeurs sont superposables à celles de la chirurgie à risque élevé et à risque intermédiaire dans la population générale. Du fait de ces bons résultats, il est proposé de restreindre le RVA aux malades symptomatiques. La chirurgie non-cardiaque intermédiaire et majeure peut être conduite sans danger excessif chez les porteurs de sténose aortique serrée asymptomatiques. Si la mortalité prévisible du RVA est supérieure à 5%, il peut être préférable de procéder directement à la chirurgie non-cardiaque, selon son risque, en prenant soin de conduire l'anesthésie sous monitorage invasif et contrôle strict de l'équilibre hémodynamique. Le TAVI (implantation valvulaire aortique sur cathétérisme par voie trans-apicale ou trans-fémorale) présente lui-même un risque opératoire de 5-8% (Figure 3.9B) [32,35].
Figure 3.9 B : Algorithme de prise en charge du malade porteur d’une sténose aortique selon les propositions récentes [32,35]. La chirurgie non-cardiaque intermédiaire et majeure peut être conduite sans danger excessif chez les porteurs de sténose aortique serrée asymptomatique. Le RVA préopératoire est indiqué chez les malades symptomatiques si sa mortalité prévisible est basse (1-4%). Si elle est supérieure à 5%, il peut être préférable de procéder à la chirurgie non-cardiaque, selon son risque. Le TAVI (implantation valvulaire aortique sur cathétérisme par voie trans-apicale ou trans-fémorale) présente lui-même un risque opératoire de 5-8%.
L’attitude générale est la même pour une sténose mitrale : si elle est serrée (< 0.6 cm2/m2), accompagnée d’une hypertension pulmonaire (PAP systolique > 50 mmHg) ou si le patient est symptomatique, il faut procéder en préopératoire à un remplacement valvulaire (RVM) ou à une valvuloplastie percutanée [22]; cette dernière donne de meilleurs résultats pour la mitrale que pour la valve aortique. Si la sténose est modérée (> 1 cm2/m2), la PAPsyst < 50 mmHg et le patient asymptomatique, on peut procéder à une intervention non-cardiaque sans risque majeur. Le contrôle de la fréquence cardiaque est primordial ; il faut éviter la tachycardie. En cas de FA et/ou de dilatation massive de l’OG, l’anticoagulation est requise à cause de la stagnation sanguine dans l’oreillette.
Contrairement aux sténoses, une insuffisance valvulaire est moins contraignante: elle représente une surcharge de volume et n'impose pas de restriction au débit cardiaque, car les ventricules sont de bonnes pompes-volume. La chirurgie n’est pas contre-indiquée en cas d’insuffisance valvulaire mitrale, aortique ou tricuspidienne modérées à sévères, pour autant qu’elles soient paucisymptomatiques et n’entraînent pas de décompensation ventriculaire (dilatation du VG, FE < 0.4). L’hémodynamique peut être maintenue adéquate par une postcharge basse et un effet inotrope positif ; il faut éviter la bradycardie et l’augmentation des RAS [22]. Toutefois, la mortalité en cas d’insuffisance aortique est plus élevée (9%) qu’en cas d’insuffisance mitrale (2%) [14]. La fraction régurgitée maximale supportée chroniquement par le VG sans décompenser est de 40%.
Les malades porteurs de prothèses valvulaires ne présentent pas de risque particulier si la prothèse fonctionne normalement et si le ventricule ne présente pas de défaillance. L’anticoagulation orale est remplacée par de l’héparine après l’arrêt des agents antivitamine-K dès que l’INR est < 1.5 (prothèse aortique) ou < 2.0 (prothèse mitrale) (voir Les Anticoagulants, Substitution).
Insuffisance ventriculaire
L’insuffisance ventriculaire est une condition dans laquelle le débit cardiaque ne correspond plus aux besoins de l’organisme. Elle peut revêtir trois aspects.
- Systolique : insuffisance éjectionnelle (FE < 0.4, bas débit cardiaque) caractérisée par la fatigabilité, la faiblesse et la dysfonction éventuelle des organes-cibles ; elle est le plus souvent accompagnée de tachycardie.
- Diastolique : défaut de compliance et élévation des pression de remplissage, caractérisées par la stase pulmonaire et la dyspnée ; la fonction systolique est préservée (FE ≥ 0.5) ; 25-40% des insuffisances cardiaques congestives sont de ce type [5,40].
- Droite : caractérisée par une stase systémique (hépatomégalie, oedèmes) ; elle est généralement secondaire à la défaillance gauche ou à une hypertension pulmonaire.
L'insuffisance cardiaque (IC) touche 10-15% des malades de plus de 70 ans [22]. Sa mortalité est inversement proportionnelle à la valeur de la fraction d’éjection et directement proportionnelle à celle de l’âge [5]. La découverte fortuite d’une FE abaissée < 0.5 ou des signes de dysfonction diastolique à l’échocardiographie chez des malades asymptomatiques double le risque de complications cardiovasculaires (OR = 2.3) lors de chirurgie majeure, et quadruple celui de mortalité cardiaque à long terme (OR = 4.6) [15]. L’insuffisance cardiaque symptomatique (stade III) triple le risque opératoire (mortalité à 30 jours : 9-15%). En cas de décompensation (stade IV), cette mortalité est encore doublée (15-30%) [22]. La mortalité de la défaillance diastolique est de 5-8% [29]. Le taux de complications cardiovasculaires après chirurgie non-cardiaque est de 49% en cas d’insuffisance systolique symptomatique, de 23% en cas d’insuffisance systolique asymptomatique, et de 18% en cas d’insuffisance diastolique (taux en l’absence d’insuffisance ventriculaire : 9%) [15]. En chirurgie endovasculaire, seule l’insuffisance ventriculaire symptomatique est associée à une péjoration du pronostic (OR = 1.8) [15].
L'attention s'est longtemps focalisée sur les risques opératoires liés à la coronaropathie, alors que le danger de l'insuffisance cardiaque est beaucoup plus grave. Dans une série de 38'047 patients, la mortalité à 30 jours après chirurgie non-cardiaque est de 9.2% en cas d'insuffisance cardiaque, 6.4% en cas de FA, mais seulement 2.9% en cas d'ischémie myocardique. La comparaison des mortalités entre insuffisance cardiaque et coronaropathie donne un OR de 2.9 en défaveur de la première [38]. Dans une autre étude, la mortalité est de 11.7% chez les patients en insuffisance cardiaque, mais de 6.6% chez ceux souffrant de coronaropathie, valeur voisine de celle des contrôles (6.2%) [4]. Même pour des interventions mineures, l'insuffisance ventriculaire représente un risque 2 à 3 fois plus élevé que celui de la coronaropathie [16]. De plus, elle entraîne des complications non-cardiaques qui contribuent significativement à sa mortalité, comme l'insuffisance rénale (RR 1.85) ou la pneumonie (RR 1.73) [25].
Le diagnostic est posé sur la symptomatologie clinique, l'échocardiographie et le taux des peptides natriurétiques. Les meilleures corrélations avec les complications cardiaques postopératoires ont été observées pour les éléments suivants [17,33].
- Stase pulmonaire, dyspnée, OAP anamnestique, stase périphérique ;
- Galop protodiastolique (B3) ;
- Fraction d'éjection du VG inférieure à 0.35 ;
- Dilatation du VG: diamètre télédiastolique > 6 cm (> 3.5 cm2/m2);
- Insuffisance mitrale degré ≥ II ;
- BNP > 35 ng/L (IC chronique), > 100 ng/L (IC aiguë);
- NT-proBNP > 125 ng/L (IC chronique), > 300 ng/L (IC aiguë);
- CRP > 3.4 mg/L.
Les examens paracliniques nécessaires sont les suivants.
- Laboratoire : Na+, K+, Ca2+, Mg2+, urée, créatinine, albumine, TP, tests hépatiques (foie de stase), gazométrie artérielle (échanges gazeux, équilibre acido-basique), lactate, BNP et NT-proBNP.
- ECG : élargissement du QRS.
- Rx thorax : cardiomégalie, agrandissement sélectif d'une cavité, vascularisation pulmonaire, stase, lignes de Kerley, épanchements.
- Echocardiographie transthoracique : c'est l'examen qui présente le meilleur rapport coût – bénéfice dans l'évaluation fonctionnelle cardiaque. Il permet l'évaluation de l'anatomie dynamique et de la fonction ventriculaire droite et gauche, du remodelage des cavités, de valvulopathie associée, du degré de dilatation ventriculaire ou auriculaire, de la détection de compression péricardique, de zones akinétiques ou dyskinétiques, et la quantification de la fonction ventriculaire droite et gauche.
- Fonctions pulmonaires : réduction de la capacité vitale, augmentation du volume résiduel, syndrome obstructif (diminution du FEV1, diminution de la compliance).
- Coronographie: seulement en cas d'ischémie coronarienne avérée; elle n'a de sens que si une intervention de revascularisation est envisageable.
En cas de dysfonction du VG, les inhibiteurs de l'enzyme de conversion (IEC), les antagonistes du récepteur de l’angiotensine (AA-II) ou des minéralocorticoïdes, les diurétiques, les β-bloqueurs, les statines et l’aspirine diminuent le risque de décompensation et de décès postopératoire [13]. Ils doivent être maintenus sans interruption en périopératoire, sauf les diurétiques qui sont en général arrêtés pour 24 heures [22,33]. La dose d'IEC ou d'AA-II peut être sautée à la prémédication si l'on craint une hypotension trop sévère à l'induction. En préopératoire, tout doit être entrepris pour améliorer l’état du malade [22]. Un délai de 10 jours à 3 mois est nécessaire pour rééquilibrer un patient en insuffisance congestive selon la thérapeutique nécessaire:
- Baisse de postcharge: vasodilatateurs (IEC, sartans) ;
- Diminution du volume liquidien extra et intracellulaire: diurétiques ;
- Amélioration de la fonction systolique: agents inotropes, pace-maker bi-caméral ;
- Antiarhythmiques ;
- Apport nutritionnel et protéique ;
- Repos strict.
Le β-blocage ne fait pas partie du traitement aigu de la décompensation ventriculaire. Le temps requis varie selon l'excédent liquidien à éliminer (5 à 20 litres suivant les cas) et selon le degré de cachexie métabolique et nutritionnelle à compenser (hyperalimentation, carnitine, etc). Le risque opératoire diminue directement avec le degré d’amélioration obtenu. Il est donc capital de ne programmer un malade en insuffisance cardiaque que lorsqu'il est compensé au mieux des possibilités que permet son état.
Arythmies
Les arythmies malignes qui présentent des risques opératoires majeures et qui doivent être contrôlées avant de procéder à une intervention chirurgicale sont celles qui sont associées à des maladies structurelles, à des pathologies de la conduction ou à des altérations hémodynamiques graves (voir Chapitre 20 Arythmies dangereuses) :
- Bloc atrio-ventriculaire complet, Mobitz II ;
- Arythmies supraventriculaires (FA) avec réponse ventriculaire rapide non contrôlée ;
- Arythmies ventriculaires symptomatiques, épisodes récurrents de TV ;
- Bradycardie symptomatique (maladie du sinus).
Les causes traitables doivent être investiguées : hypokaliémie, hypomagnésémie, hypoxie, etc. Il n’existe aucune évidence que les ESV isolées et les épisodes occasionnels de TV non-soutenue aggravent le pronostic opératoire [22]. Par contre, la fibrillation auriculaire avec réponse ventriculaire inadéquate est responsable d’une mortalité postopératoire augmentée de 6.4% [38]. La thérapeutique est un traitement pharmacologique (correction électrolytique, béta-bloqueur, amiodarone, bloqueur calcique), un électro-entraînement par pace-maker ou la pose d’un défibrillateur [2,3]. Les indications au pace-maker sont les mêmes que dans le cadre non-chirurgical (voir Chapitre 20 Indications au pace-maker). Les pace-makers et les défibrillateurs réclament un certain nombre de précautions dans le cadre de la chirurgie [11,14] ; elles sont décrites au Chapitre 20, Chirurgie avec pace-maker et Chirurgie avec défibrillateur.
Hypertension artérielle
L’hypertension artérielle (HTA) n’est pas un prédicteur de risque majeur. En-dehors de la poussée hypertensive maligne, la valeur de la pression artérielle n’est pas corrélée aux complications périopératoires, sauf à une certaine instabilité hémodynamique à l’induction et lors des stimulations chirurgicales. Par contre, les dommages causés aux organes-cibles, comme la néphropathie ou l’hypertrophie ventriculaire gauche, ont un impact marqué sur l’augmentation du risque opératoire (voir Chapitre 21, Hypertension artérielle Risque cardiovasculaire) [18,23]. Il n’y a donc pas lieu de renvoyer une intervention chirurgicale pour optimiser la pression du patient [22]. La meilleure prise en charge médicale de l’HTA consiste à se conformer aux recommandations les plus récentes [26].
Les patients souffrant d’hypertension pulmonaire (HTAP) doivent être soigneusement évalués en préopératoire. Leur pronostic dépend prioritairement de la fonction ventriculaire droite. Leur taux de mortalité (4-26%) et de morbidité (6-42%) est très élevé, quel que soit le type de chirurgie [14].
Maladie cérébrovasculaire
Une anamnèse d'AVC survenu moins de 6 semaines avant une intervention chirurgicale est associée à un risque d’accident cérébral de 3-4%, ce qui représente une augmentation de 10 fois par rapport au risque dans une population standard (0.2%) [12]. La mortalité liée à l’AVC périopératoire est de 18-26%. Un certain nombre de facteurs sont des prédicteurs d’AVC périopératoire [28] :
- Age > 60 ans ;
- Anamnèse d’ictus ou d’ischémie cérébrale transitoire ;
- Infarctus myocardique < 6 mois ;
- Insuffisance rénale ;
- BPCO ;
- Tabagisme.
En cas de sténose carotidienne, les indications opératoires sont basées sur la prévention à long terme de l’accident vasculaire cérébral (voir Chapitre 19, Indications opératoires). En préopératoire, elles sont identiques à celles reconnues en neurologie [22]. Après un AVC, l'autorégulation vasculaire cérébrale est affectée pendant environ 2 semaines. Il est donc recommandé d’attendre au minimum 4 semaines après un AVC symptomatique ou hémorragique pour procéder à une intervention chirurgicale, quelle qu’en soit la nature ; un délai de trois mois est préférable pour une intervention purement élective [6,14,34]. L’aspirine et le dipyridamole ne sont pas interrompus en préopératoire.
Insuffisance rénale
La dysfonction rénale est un prédicteur indépendant de complications cardiovasculaires qui a autant de poids que bien des cardiopathies. Un taux de créatinine supérieur à 200 μmol/L augmente la mortalité et les complications cardiovasculaires de 5 fois (OR 5.2) en chirurgie vasculaire [19]. Ces dernières s’élèvent (OR 3.9) dès que la clairance de la créatinine descend en dessous de 50 mL/min [27]. L’évolution postopératoire de la fonction rénale est prédictive de la survie : une péjoration transitoire entraîne une mortalité de 5%, alors qu’une péjoration non-réversible cause un taux de décès de 13% [39]. Les facteurs de risque les plus importants pour le développement d’une insuffisance rénale postopératoire sont les suivants [21] :
- Age > 60 ans ;
- Sexe masculin ;
- Insuffisance cardiaque ;
- Présence d’ascite ;
- Chirurgie d’urgence ou intrapéritonéale ;
- Créatinine préopératoire > 150 μmol/L ;
- Diabète ;
- Hypertension artérielle.
| Cardiopathies et chirurgie non-cardiaque |
| Infarctus (non compliqué) : délai minimal de 6 semaines pour opération vitale, de 3-6 mois pour opération élective (idéalement > 6 mois) ; maintien des antiplaquettaires Sténose aortique serrée : - Patient symptomatique: RVA ou TAVI préopératoire - Patient asymptomatique: opération mineure ou intermédiaire possible; opération majeure élective: RVA/TAVI préopératoire préférable; opération majeure vitale possible mais risque cardiovasculaire plus élevé Sténose mitrale serrée : - Patient symptomatique: RVM ou valvuloplastie percutanée préopératoire - Patient asymptomatique: opération mineure ou intermédiaire possible; opération majeure élective: RVM ou valvuloplastie préopératoire conseillé Sténose aortique ou mitrale modérée: chirurgie noncardiaque possible Insuffisance valvulaire: pas de contre-indication sauf en cas de décompensation ventriculaire Insuffisance ventriculaire systolique: risque opératoire doublé si l’insuffisance est compensée (mortalité 10%), risque quadruplé si elle est décompensée (mortalité 30%). Insuffisance diastolique : risque augmenté, mais inférieur de moitié au risque de l’insuffisance systolique. Le risque opératoire de l'insuffisance cardiaque est 3 fois plus élevé que celui lié à la coronaropathie. AVC préopératoire: délai de 4 semaines pour opération vitale, délai de 3 mois pour opération élective |
© CHASSOT PG, DELABAYS A, SPAHN D, Mars 2010, dernière mise à jour, Août 2019
Références
- AGARWAL S, RAJAMANICKAM A, BAJAJ NS, et al. Impact of aortic stenosis on postoperative outcomes after noncardiac surgery. Circ Cardiovasc Qual Outcomes 2013; 6:193-200
- ATLEE JL. Cardiac arrhythmias: drugs and devices. Curr Opin Anaesthesiol 2001; 14:3-9
- ATLEE JL, BERNSTEIN A. Cardiac rhythm management devices (Part II). Anesthesiology 2001; 95:1492-1506
- BEATTIE WS, WIJEYSUNDERA DN. The growing burden of perioperative heart failure. Anesth Analg 2014; 119:506-8
- BERRY C, DOUGHTY RN, GRANGER C, et al. Meta-analysis Global Group in Chronic Heart Failure (MAGGIC). The survival of patients with heart failure with preserved or reduced left ventricular ejection fraction: an individual patients meta-analysis. Eur Heart J 2012; 33:1750-7
- BLACKER DJ, FLEMMING KD, LINK MJ, et al. The preoperative cerebrovascular consultation: common cerebrovascular questions before general or cardiac surgery. Mayo Clin Proc 2004; 79:223-9
- BONOW RO, BROWN AS, GILLAM LD, et al. ACC/AATS/AHA/ASE/EACTS/HVS/SCA/SCAI/SCCT/SCMR/STS 2017 appropriate use criteria for the treatment of patients with severe aortic stenosis. J Am Coll Cardiol 2017; 70:2566-98
- CALLEJA A, DOMMARAJU S, GADDAM R, et al. Cardiac risk in patients aged > 75 years with asymptomatic, severe aortic stenosis undergoing noncardiac surgery. Am J Cardiol 2010 ; 105 :1159-63
- CHASSOT PG, DELABAYS A, SPAHN DR. Preoperative evaluation of patients with, or at risk of, coronary artery disease undergoing non-cardiac surgery. Brit J Anaesth 2002; 89:747-59
- CHRIST M, SHARKOVA Y, GELDNER G, MAISCH B. Preoperative and perioperative care for patients with suspected or established aortic stenosis facing noncardiac surgery. Chest 2005; 128:2944-53
- CROSSLEY GH, POOLE JE, ROZNER MA, et al. The Heart Rythm Society (HRS) / American Society of Anesthesiologists (ASA) Expert Consensus Statement on the perioperative management of patients with implantable defibrillators, pacemakers and arrhythmia monitors: facilities and patient management. Heart Rythm 2011; 8:1114-54
- EVANS BA, WIJDICKS EF. High-grade carotid stenosis detected before general surgery: is endarterectomy indicated ? Neurology 2001; 57:1328-30
- FERINGA HH, BAX JJ, SHOUTEN O, et al. Protecting the heart with cardiac medication in patients with left ventricular dysfunction undergoing major noncardiac vascular surgery. Semin Cardiothorac Vasc Anesth 2006; 10:25-31
- FLEISHER LA, FLEISCHMANN KE, AUERBACH AD, et al. 2014 ACC/AHA Guideline on perioperative cardiovascular evaluation and management of patients undergoing noncardiac surgery: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. Circulation 2014; 130:e278-e333
- FLU WJ, VAN KUIJK JP, HOEKS SE, et al. Prognostic implications of asymptomatic left ventricular dysfunction in patients undergoing vascular surgery. Anesthesiology 2010; 112:1316-24
- HAMMIL BG, CURTIS LH, BENNETT-GUERRERO E, et al. Impact of heart failure on patients undergoing major noncardiac surgery. Anesthesiology 2008; 108:559-67
- HEALY KO, WAKSMONSKI CA, ALTMAN RK, et al. Perioperative outcome and long-term mortality for heart failure patients undergoing intermediate and high-risk surgery: impact of left ventricular ejection fraction. Congest Heart Fail 2010; 16:45-9
- HOWELL SJ, SEAR JW, FOËX P. Hypertension, hypertensive heart disease and perioperative cardiac risk. Br J Anaesth 2004; 92:570-83
- KERTAI MD, BOERSMA E, BAX JJ, et al. Comparison between serum creatinine and creatinine clearance for the prediction of postoperative mortality in patients undergoing major vascular surgery. Clin Nephrol 2003; 39:17-23
- KERTAI MD, BOUTIOUKOS M, BOERSMA M, et. Aortic stenosis: An underestimated risk factor for perioperative complications in patients undergoing noncardiac surgery. Am J Med 2004; 116:8-13
- KHETERPAL S, TREMPER KK, HEUNG M, et al. Development and validation of an acute kidney injury risk index for patients undergoing general surgery: results from a national dataset. Anesthesiology 2009; 110:505-15
- KRISTENSEN SD, KNUUTI J, SARASTE A, et al. 2014 ESC/ESA Guidelines on non-cardiac surgery: cardiovascular assessment and management. Eur Heart J 2014; 35:2383-431153 LIVHITS M, KO CY, LEONARDI NJ, et al. Risk of surgery following recent myocardial infarction. Ann Surg 2011; 253:857-64
- LEE TH, MARCANTONIO ER, MANGIONE CM, ET AL. Derivation and prospective validation of a simple index for prediction of cardiac risk of major noncardiac surgery. Circulation 1999; 100:1043-9
- LIVHITS M, KO CY, LEONARDI NJ, et al. Risk of surgery following recent myocardial infarction. Ann Surg 2011; 253:857-64
- MAILE MD, EGOREN MC, TREMPER KK, et al. Worsening preoperative heart failure is associated with mortality and noncardiac complications, but not myocardial infarction after noncardiac surgery: a retrospective cohort study.. Anesth Analg 2014; 119:522-32
- MANCIA G, FAGARD R, NARKIEWICZ K, et al. 2013 ESH/ESC Guidelines fort he management of arterial hypertension. Eur Heart J 2013; 34:2159-219
- MASES A, SABATE S, GUILERA N, et al. Preoperative estimated glomerular filtration rate and the risk of major cardiovascular and cerebrovascular events in non-cardiac surgery. Br J Anaesth 2014; 113:644-51
- MASHOUR GA, SHANKS AM, KHETERPAL S. Perioperative stroke and associated mortality after noncardiac, nonneurologic surgery. Anesthesiology 2011; 114:1289-96
- MATYAL R, HESS PE, SUBRAMANIAM R, et al. Perioperative diastolic dysfunction during vascular surgery and its association with postoperative outcome. J Vasc Surg 2009; 50:70-6
- MIZUNO K, MIYAMOOTGO A, SATOMURA K, et al. Angioscopic coronary macromorphology in patients with acute coronary disorders. Lancet 1991; 337:809-12
- NISHIMURA RA, OTTO CM, BONOW RO, et al. 2014 AHA/ACC Guideline for the management of patients with valvular heart disease: A report of the American College of Cardiology / American Heart Association Task Force on Practice Guidelines. Circulation 2014; 129:e521-e643
- OSNABRUGGE RL, KAPPETEIN AP, SERRUYS PW. Non-cardiac surgery in patients with severe aortic stenosis: time to revise the guidelines ? Eur Heart J 2014; 35:2346-8
- PONIKOWSKI P, VOORS AA, ANKER SD, et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J 2016; 37:2129-200
- SACCO RL, ADAMS R, ALBERS G et al. Guidelines for prevention of stroke in patients with ischemic stroke or transient ischemic attack. Stroke 2006; 37:577-617
- SAMARENDRA P, MANGIONE MP. Aortic stenosis and perioperative risk with noncardiac surgery. J Am Coll Cardiol 2015; 65:295-302
- TAHIRO T, PISLARU SV, BLUSTIN JM, et al. Perioperative risk of major non-cardiac surgery in patients with severe aortic stenosis: a reappraisal in contemporary pratice. Eur Heart J 2014; 35:2372-81
- VAHANIAN A, ALFIERI O, ANDREOTTI F, et al. Guidelines on the management of valvular heart disease (version 2012). Eur Heart J 2012; 33:2451-96
- VAN DIEPEN S, BAKAL JA, McALISTER FA, et al. Mortality and readmission of patients with heart failure, atrial fibrillation or coronary artery disease undergoing noncardiac surgery. Circulation 2011; 124:289-96
- WELTEN GM, SCHOUTEN O, CHONCHOL M, et al. Temporary worsening of renal function after aortic surgery is associated with higher long-term mortality. Am J Kidney Dis 2007; 50:219-28
- ZILE MR, BRUTSAERT DL. New concept in diastolic dysfunction and diastolic heart failure: Part I. Diagnosis, prognosis, and measurement of diastolic function. Circulation 2002; 105:1387-93