Flux Doppler couleur
En réglant son échelle sur une limite de Nyquist élevée (0.8 m/s), le Doppler couleur met en évidence le passage du flux à travers la sténose: zone d’accélération concentrique (PISA) sur son versant amont, zone accélérée à travers la sténose, vena contracta à la sortie du côté aortique et zone tourbillonnaire s’élargissant dans l’aorte ascendante (Vidéos et Figure 26.108). Pour que la valeur soit correcte, l’axe d’interrogation du Doppler doit être identique à celui du flux aortique là où il est le plus rapide, c’est-à-dire juste en aval de la sténose (vena contracta). Ceci peut être difficile par voie transgastrique, parce que les positions du transducteur sont limitées par la mécanique de la sonde et parce que le faisceau Doppler doit traverser la valve pour échantillonner le flux à sa sortie dans la racine de l’aorte. Or la valve est très déformée et son axe peut être dévié. Bien qu’il n’ait pas de valeur quantitative dans cette situation, le Doppler couleur permet d’apprécier l’accélération due à la sténose et de mieux repérer la surface d’ouverture. En vues transgastriques, il est indispensable pour localiser le passage du flux à travers la sténose afin de placer l’axe du Doppler continu de manière optimale (Vidéos). Plus l’axe du Doppler est discordant de celui du flux, plus la vélocité mesurée est basse et plus le gradient est sous-estimé. L'écart est acceptable jusqu'à 20°, car l'erreur sur la vélocité ne dépasse pas 6%.
Vidéo: image long-axe 120° du Doppler couleur dans un cas de sténose aortique serrée; le flux est tourbillonnaire dans l'aorte ascendante (Vmax > 4 m/s); il existe une zone d'accélération du flux dans la chambre de chasse au niveau de l'éperon septal.
Vidéo: image long-axe 130° du Doppler couleur dans un cas de sténose aortique serrée; dans l'aorte ascendante, le flux est étroit et tourbillonnaire; présence d'une petite insuffisance en diastole.
Vidéo: vue transgastrique long-axe 120° d'une sténose aortique serrée; il existe une zone d'accélération concentrique côté ventriculaire (PISA); présence d'une minime insuffisance. La direction du flux est bien dans l'axe des ultrasons et permet d'enregistrer la Vmax avec précision.
Vidéo: vue 5-cavités transgastrique profonde 0° d'une sténose aortique serrée; le passage à travers la valve est très étroit. Dans cette vue également, la direction du flux est bien dans l'axe des ultrasons.
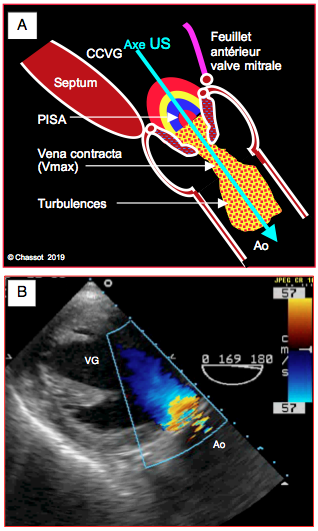
Figure 26.108 : Flux au Doppler couleur dans la sténose aortique serrée. A : pour que l'alignement soit correct, le flux couleur doit présenter un PISA en amont de la valve, un flux rétréci à travers l’orifice, une vena contracta juste en aval et une zone tourbillonnaire dans l’aorte ascendante. L’axe du Doppler, qui vient depuis le VG, doit s’aligner à l’intérieur du chenal de la sténose pour capter la Vmax à la vena contracta ; ceci n’est pas toujours réalisable. B: vue long-axe transgastrique d'un cas de sténose aortique serrée avec hypertrophie du VG et zone d'accélération concentrique en amont immédiat de la valve.
Une IM d’accompagnement est présente dans 75% des cas de sténose aortique serrée [4] ; elle peut avoir plusieurs origines.
En réglant son échelle sur une limite de Nyquist élevée (0.8 m/s), le Doppler couleur met en évidence le passage du flux à travers la sténose: zone d’accélération concentrique (PISA) sur son versant amont, zone accélérée à travers la sténose, vena contracta à la sortie du côté aortique et zone tourbillonnaire s’élargissant dans l’aorte ascendante (Vidéos et Figure 26.108). Pour que la valeur soit correcte, l’axe d’interrogation du Doppler doit être identique à celui du flux aortique là où il est le plus rapide, c’est-à-dire juste en aval de la sténose (vena contracta). Ceci peut être difficile par voie transgastrique, parce que les positions du transducteur sont limitées par la mécanique de la sonde et parce que le faisceau Doppler doit traverser la valve pour échantillonner le flux à sa sortie dans la racine de l’aorte. Or la valve est très déformée et son axe peut être dévié. Bien qu’il n’ait pas de valeur quantitative dans cette situation, le Doppler couleur permet d’apprécier l’accélération due à la sténose et de mieux repérer la surface d’ouverture. En vues transgastriques, il est indispensable pour localiser le passage du flux à travers la sténose afin de placer l’axe du Doppler continu de manière optimale (Vidéos). Plus l’axe du Doppler est discordant de celui du flux, plus la vélocité mesurée est basse et plus le gradient est sous-estimé. L'écart est acceptable jusqu'à 20°, car l'erreur sur la vélocité ne dépasse pas 6%.
Vidéo: image long-axe 120° du Doppler couleur dans un cas de sténose aortique serrée; le flux est tourbillonnaire dans l'aorte ascendante (Vmax > 4 m/s); il existe une zone d'accélération du flux dans la chambre de chasse au niveau de l'éperon septal.
Vidéo: image long-axe 130° du Doppler couleur dans un cas de sténose aortique serrée; dans l'aorte ascendante, le flux est étroit et tourbillonnaire; présence d'une petite insuffisance en diastole.
Vidéo: vue transgastrique long-axe 120° d'une sténose aortique serrée; il existe une zone d'accélération concentrique côté ventriculaire (PISA); présence d'une minime insuffisance. La direction du flux est bien dans l'axe des ultrasons et permet d'enregistrer la Vmax avec précision.
Vidéo: vue 5-cavités transgastrique profonde 0° d'une sténose aortique serrée; le passage à travers la valve est très étroit. Dans cette vue également, la direction du flux est bien dans l'axe des ultrasons.

Figure 26.108 : Flux au Doppler couleur dans la sténose aortique serrée. A : pour que l'alignement soit correct, le flux couleur doit présenter un PISA en amont de la valve, un flux rétréci à travers l’orifice, une vena contracta juste en aval et une zone tourbillonnaire dans l’aorte ascendante. L’axe du Doppler, qui vient depuis le VG, doit s’aligner à l’intérieur du chenal de la sténose pour capter la Vmax à la vena contracta ; ceci n’est pas toujours réalisable. B: vue long-axe transgastrique d'un cas de sténose aortique serrée avec hypertrophie du VG et zone d'accélération concentrique en amont immédiat de la valve.
Une IM d’accompagnement est présente dans 75% des cas de sténose aortique serrée [4] ; elle peut avoir plusieurs origines.
- IM fonctionnelle liée à l’augmentation de postcharge du VG (la pression intraventriculaire atteint facilement > 250 mmHg en systole);
- Non-contraction de l’anneau mitral due à des calcifications;
- Coulée calcique depuis la valve aortique sur la racine du feuillet antérieur;
- Maladie commune mitro-aortique : dégénérescence, maladie calcifiante, RAA, etc.
Lorsqu’elle est liée à l’augmentation de postcharge, l’IM se corrige avec le remplacement de la valve aortique. Mais elle peut aussi s’aggraver après l’opération parce que des points de fixation de la prothèse aortique peuvent rétracter la base du feuillet antérieur. Il faut prendre soin de la quantifier avant et après la CEC et d’en déterminer les mécanismes ; l’indication à une intervention simultanée sur la valve mitrale est très restrictive, surtout chez la personne âgée, parce qu’elle augmente la mortalité de la chirurgie aortique de 5-10% [5].
Flux Doppler spectral
En ETO, les deux seules possibilités de placer l’axe du Doppler dans celui du flux aortique sont les vues transgastriques à 0° (4-5 cavités) et 120° (long-axe). Ces deux vues, qui sont en général mutuellement exclusives, présentent deux inconvénients majeurs (Figure 26.109).
Flux Doppler spectral
En ETO, les deux seules possibilités de placer l’axe du Doppler dans celui du flux aortique sont les vues transgastriques à 0° (4-5 cavités) et 120° (long-axe). Ces deux vues, qui sont en général mutuellement exclusives, présentent deux inconvénients majeurs (Figure 26.109).
- Elles sont souvent difficiles à obtenir ; dans 12% des cas, il est impossible de se placer dans l’axe du flux [6]. Même s’il est satisfaisant dans le plan 2D visualisé, l’alignement ne l’est pas forcément dans le plan orthogonal ; il est important d’avoir un bon déroulement de l’aorte ascendante dans la vue choisie, parce que c’est la seule garantie que l’on soit réellement dans l’axe du vaisseau.
- Elles abordent la valve aortique par l’amont ; or la Vmax est au niveau de la vena contracta, juste en aval de la sténose. De ce fait, l’axe du Doppler continu doit traverser la sténose pour déceler la Vmax. Ceci est souvent impossible à cause de la géométrie très remaniée de la valve.
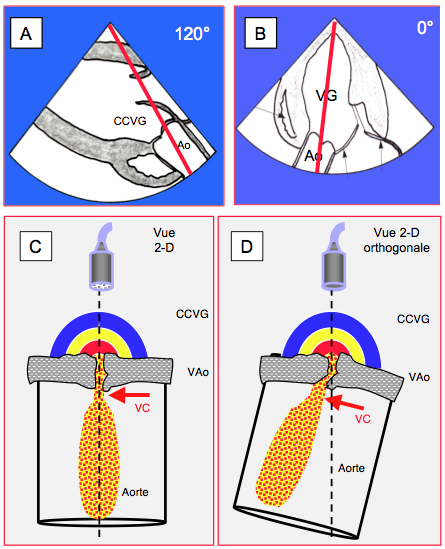
Figure 26.109 : Alignement du faisceau Doppler à travers une sténose aortique. A : positionnement de l’axe Doppler continu en vue transgastrique long axe 120°. B : positionnement en vue transgastrique profonde 0°. C: Comme le transducteur est en position transgastrique, le faisceau doit traverser la valve sténosée pour mesurer la Vmax dans la vena contracta, qui est juste distale à la sténose. Selon la tortuosité du chenal, cet accès sous-estime la Vmax réelle ou est simplement impossible. D: l'alignement dans un plan ne garantit par l'alignement dans le plan orthogonal; celui-ci n'étant pas accessible en ETO 2D. Bien qu'inconnu, cet écart excessif entre l'axe des ultrasons et l'axe du flux conduit à une sous-estimation de la Vmax.
Ce problème technique conduit fréquemment à une sous-estimation de la Vmax aortique en ETO. Il faut donc rechercher méticuleusement la vélocité maximale du flux en jouant avec l’angle du capteur, la rotation de la sonde et l’angulation de son extrémité, et en s’aidant du Doppler couleur pour localiser le passage à travers la valve. La voie épiaortique/épicardique peut obvier à ces inconvénients [3]. Lorsque plusieurs mesures donnent des résultats différents, c'est la Vmax la plus élevée qui fait foi [1].
D’autre part, la Vmax varie pour la même surface d’ouverture en fonction de plusieurs paramètres qui modifient les gradients enregistrés.
- Le volume systolique; plus il est grand (hypervolémie, insuffisance aortique, anémie), plus le gradient enregistré est élevé. Le gradient baisse en hypovolémie ou en cas de sténose mitrale sévère à cause du faible volume systolique, et lors d’IM majeure parce que celle-ci fonctionne comme une soupape d’échappement.
- La contractilité; le gradient baisse en cas de dysfonction sévère du VG ; il augmente en cas de haut débit cardiaque (stimulation béta, shunt artério-veineux, hyperthyréose).
- La postcharge; le gradient augmente si la pression dans l’aorte est très basse en protosystole, comme en cas de vasoplégie ou de contre-pulsion intra-aortique (CPIA).
- La viscosité; le gradient baisse en hémodilution.
- Le cycle respiratoire; en hypovolémie, la Vmax aortique varie de > 15% avec le cycle de la ventilation mécanique. Pour être précises, les mesures doivent se faire en apnée (voir Figure 27.10) [2].
L’image doit remplir certaines conditions pour garantir une mesure correcte du flux de sténose aortique (voir ci-dessus Figure 26.108).
- Présence d’une zone hémisphérique d'accélération concentriques (PISA) en amont de la valve;
- Passage du flux couleur à travers la sténose;
- Zone de jet étroit (vena contracta) visible à la sortie de la valve;
- Zone de turbulence se prolongeant dans l’aorte ascendante;
- Axes homogènes de la CCVG et de l’aorte ascendante;
- Déroulement de l’aorte ascendante sur plusieurs centimètres (pas d’angulation majeure dans le plan orthogonal).
L'affichage spectral offre plusieurs prestations dans le cadre de la sténose aortique (Figure 26.110) [1].
- Doppler pulsé: mesure de la vélocité du flux dans la chambre de chasse (en moyenne 1 m/s). Le volume d'échantillonnage est positionné au milieu du conduit, parce que le flux est accéléré au voisinage de l'éperon septal et ralenti du côté du feuillet mitral antérieur. Il est positionné 5-10 mm en amont de la valve aortique de manière à éviter la zone concentrique d'accélération (PISA). Pour ce faire, il est d'abord placé au voisinage direct de la valve, où le spectre des vélocités est très large et la courbe dense, puis reculé progressivement jusqu'à ce que la Vmax se stabilise et que l'enveloppe de la courbe devienne fine. La présence d'un clic de fermeture indique une trop grande proximité avec la valve (voir Figure 26.116).
- Doppler continu: mesure de la Vmax à travers la valve sténosée (> 4 m/s). Contrairement à l'image du flux aortique normal, qui est triangulaire avec un pic protosystolique (délai jusqu'au pic < 30% du temps d'éjection), la silhouette du flux de sténose aortique est symétrique et parabolique, avec un pic mésosystolique; la phase d’accélération dure > 40% de l’éjection (> 100 msec) [7]. On distingue à la base de la courbe une image superposée arrondie avec une Vmax d'environ 1 m/s, qui est le flux de la chambre de chasse. Le gain (abaissé) et la compression (élevée) sont réglés de manière à obtenir une courbe dense à la silhouette bien définie.
- Mesure de la Vmax (4-5 m/s) et du gradient de pression maximal au pic du flux (> 65 mmHg), à la limite du signal dense, sans tenir compte des signaux fins qui dépassent parfois l'arrondi de la courbe.
- Mesure du gradient de pression moyen, qui est la moyenne de tous les gradients de pression instantanés pendant la durée de l'éjection (voir Quantification de la sténose aortique).
- Mesure de l'intégrale des vélocités (ITV) par rapport au temps (durée d'éjection). Elle s'obtient comme le gradient moyen, en dessinant le pourtour externe (outer edge) de la courbe à l'écran. Elle est influencée par le volume systolique, mais elle est moins dépendante des conditions de charge que la Vmax.
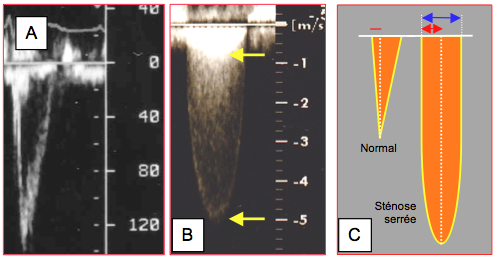
Figure 26.110 : Flux aortique au Doppler spectral. A : aspect spectral du flux Doppler pulsé dans la chambre de chasse, 5-10 mm en amont de la valve aortique. En avançant la fenêtre de lecture en direction de la valve, la Vmax augmente dès qu’on entre dans la zone d’accélération concentrique ; le spectre de vélocité y est très large; à l'écran, la courbe est pleine. Il suffit alors de reculer progressivement la fenêtre jusqu’au point où la Vmax se stabilise pour être en place. Le volume d'échantillonnage doit être au milieu du flux. B : aspect spectral du Doppler continu dans une sténose aortique ; la Vmax (5 m/s) représente la vélocité à travers la valve ; l’image superposée à environ 1 m/s est la vélocité à travers la CCVG. C : modification de la morphologie du flux lors de sténose aortique serrée ; allongement de la phase d’accélération (trait et flèche rouges) et forme arrondie du pic de vélocité.
Les mesures de vélocité et de gradient ne sont adéquates que si l'axe du Doppler est bien aligné avec celui du flux à travers la valve, ce qui est loin d'être toujours le cas. Un écart important entre les deux axes se traduit par une sous-estimation de la vélocité et du gradient. Un moyen de limiter cette sous-évaluation est de faire le rapport entre la vélocité dans la chambre de chasse et la vélocité dans la valve aortique (DI, dimensionless index). L’erreur liée à l’angle est éliminée puisque les deux structures sont dans le même axe ; de plus, le rapport est indépendant du volume systolique et de la contractilité ventriculaire. L’image spectrale du Doppler continu offre la possibilité de mesurer en même temps la Vmax ou l’ITV de la sténose et de la chambre de chasse (technique de la "double enveloppe"). On voit parfois une troisième trace qui accélère en télésystole et qui représente la vélocité intraventriculaire. L’avantage de cette mesure est d’être simultanée, alors que la mesure de la vélocité dans la CCVG au Doppler pulsé a lieu pendant un autre cycle cardiaque que celui pendant lequel a été mesurée la vélocité à travers la valve au Doppler continu. Cependant, la Vmax de la CCVG est contaminée par les vélocités enregistrées dans la zone d'accélération en amont de la sténose.
Pour gagner en précision, on utilise de préférence l’intégrale des vélocités (ITV) plutôt que la Vmax dans le calcul du rapport des vélocités:
ITVCCVG / ITVAo (normal : ≥ 0.8)
En cas de sténose serrée, la vélocité est plus de 4 fois supérieure à travers la valve: l'ITV habituelle d'une valve normale est d'enriron 20-25 cm, alors que celle d'une sténose serrée est en général ≥ 100 cm. Le rapport des vélocités descend < 0.25 dans une sténose serrée (Figure 26.111).
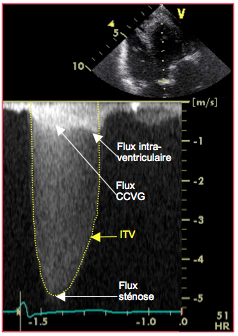
Figure 26.111 : Image du flux spectral au Doppler continu lors de sténose aortique serrée. La Vmax (5.1 m/s) permet de calculer le gradient maximal (103.6 mmHg), et l’intégrale des vélocités (ITV, 129.5 cm) le gradient moyen (63.7 mmHg). Les deux courbes superposées à la base de la trace représentent la vélocité dans la chambre de chasse (aspect en dôme) et dans la cavité ventriculaire (accélération télésystolique). Le rapport des vélocités entre la CCVG et la valve aortique est de 0.16 dans ce cas.
Flux systoliques : diagnostic différentiel
Un flux de haute vélocité s’éloignant du VG en systole peut prêter à confusion, car il peut avoir trois origines différentes (Figure 26.112).
- Sténose aortique valvulaire serrée : le flux débute après la contraction isovolumétrique (90 msec) et atteint sa Vmax (≥ 4 m/s) en mésosystole.
- Sténose sous-aortique dynamique : la silhouette du flux est en forme de "dague" ou de "dent de requin", le pic de vélocité est télésystolique; la Vmax (2.5-4 m/s) est un peu plus basse.
- Insuffisance mitrale : l’IM a la même direction que l’IA en vue transgastrique, mais sa trace est plus large car elle commence dès le début de la contraction isovolumétrique et se prolonge jusqu’à la fin de la relaxation isovolumétrique ; sa Vmax (5-6 m/s) est toujours plus élevée que celle de la sténose aortique.
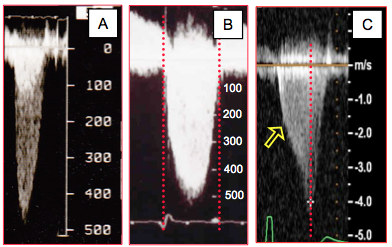
Figure 26.112 : Les trois flux systoliques qui s’éloignent du capteur en position transgastrique. A : flux de sténose aortique ; flux débutant après la contraction isovolumétrique, pic mésosystolique (Vmax 4 - 5 m/s), image superposée de la CCVG. B : flux d’IM ; flux holosystolique, s’étendant de la contraction isovolumétrique à la relaxation isovolumétrique, pic mésosystolique, Vmax la plus élevée (5-6 m/s) et durée la plus longue. C : flux de sténose dynamique de la chambre de chasse ; coudure en dague au milieu de la pente ascendante (flèche), pic télésystolique, Vmax un peu plus basse (2.5 - 4 m/s).
Un flux tourbillonnaire dans la CCVG peut également avoir trois étiologies :
- Sténose fixe d’une membrane sous-aortique (flux systolique);
- Accélération du flux systolique par une sténose dynamique de la CCVG (Vmax > 2.5 m/s);
- Turbulences diastoliques : insuffisance aortique (Vmax 3-4 m/s).
| Sténose aortique (SA) : flux Doppler |
| Doppler couleur (sténose serrée) (limite de Nyquist 0.8 m/s) - Zone d'accélération concentrique (PISA) en amont (côté CCVG) - Flux rétréci à travers et à la sortie la valve (vena contracta) - Flux tourbillonnaire en aval, avec jet central dans la racine de l’aorte - Fréquente IM d’accompagnement Doppler spectral (en vues transgastriques 0° et/ou 120°) - Axe Doppler parallèle au flux systolique, flux couleur visible à travers la valve et dans l’aorte - Mesure de la Vmax dans la vena contracta à la sortie de la valve (SA sévère : Vmax 4-5 m/s) - Vmax fréquemment sous-estimée (angle Doppler, faible pénétration à travers la valve) - Tracé arrondi, pic mésosystolique, phase d’accélération > 40% de durée d’éjection - Rapport VCCVG / VVAo ≤ 0.25 - Diagnostic différentiel des jets systoliques s'éloignant de l'apex: sténose sous-aortique (CMO), insuffisance mitrale Vmax et gradient augmentent si : - ↓ orifice systolique - ↑ contractilité VG - ↑ volume systolique (IA associée, hypervolémie) - ↓ pression aortique (vasoplégie, CPIA) - ↑ viscosité |
© CHASSOT PG, BETTEX D. Octobre 2011, Juin 2019; dernière mise à jour, Mars 2020
Références
- BAUMGARTNER H, HUNG J, BERMEJO J, et al. Recommendations on the echocardiographic assessment of aortic valve stenosis: a focused update from the European Association of Cardiovascular Imaging and the American Society of Echocardiography. Eur Heart J Cardiovasc Imaging 2017; 18:253-75
- FEISSEL M, MICHARD F, MANGIN I, et al. Respiratory changes in aortic blood velocity as an indicator of fluid responsiveness in ventilated patients with septic shock.. Chest 2001; 119:867-73
- HILBERATH JN, SHERNAN SK, SEGAL S, et al. The feasibility of epicardial echocardiography for measuring aortic valve area by the continuity equation. Anesth Analg 2009; 108:17-22
- MOAZAMI D, DIODATO MD, moon mr, et al. Does functional mitral regurgitation improve with isolated aortic valve replacement ?. J Card Surg 2004; 19:444-8
- NISHIMURA RA, CARABELLO BA, FAXON DP, et al. 2008 focused update incorporated into the ACC/AHA 2006 Guidelines for the management of patients with valvular disease. J Am Coll Cardiol 2008; 52:e1-e142
- STODDARD MF, HAMMONS RT, LONGAKER RA. Doppler transesophageal echocardiographic determination of aortic valve area in adult with aortic stenosis. Am Heart J 1996; 132:337-42
- ZOGHBI WA, ADAMS D, BONOW RO, et al. Recommendations for noninvasive evaluation of native valvular regurgitation: a report from the ASE developped in collaboration with the SCMR. J Am Soc Echocardiogr 2017; 30:303-71
