Selon la tolérance du VD au clampage de l'artère pulmonaire droite ou gauche et selon les contraintes techniques dans le champ opératoire, la transplantation pulmonaire se déroule sous assistance circulatoire ou non (CEC, ECMO). L’ETO permet d’évaluer très précisément la tolérance du VD au clampage itératif de chaque artère pulmonaire [6,7,9].
- Monitorage de la taille et de la fonction du VD (hypokinésie de la paroi libre).
- Monitorage de la position du septum interauriculaire et interventriculaire (bascule à gauche).
- Surveillance de l’IT.
- Surveillance du flux dans l’AP proximale (baisse de Vmax).
- Recherche d'une dilatation de l'OD, de la VCI et de l'AP.
- Recherhce d'un éventuel shunt D-G par un FOP (hypoxémie).
- Monitorage de la volémie; comme le poumon greffé est à haut risque d'œdème lésionnel, l'admisnistration liquidienne doit rester restrictive. L'ETO est très utile pour l'évaluation du remplissage lorsque les mesures de pression sont biaisées par la dysfonction du VD.
- En cas de dysfonction aiguë sévère malgré le traitement inotrope, il est nécessaire de déclamper l’AP et de poursuivre l’opération sous assistance circulatoire.
Au déclampage vasculaire, l'ETO permet de vérifier la qualité du débullage des veines pulmonaires dans lesquelles des poches d'air peuvent être restées bloquées. Pendant la phase de reperfusion, il existe un risque de sténose infundibulaire dynamique de la chambre de chasse droite (effet CMO à droite) dû à la baisse brutale de la PAP dans le poumon greffé par rapport au poumon malade. Ce phénomène peut s’accompagner d’une dysfonction du corps du VD, quand bien même la chambre de chasse est hypercontractile, puisque cette dernière est plus richement dotée en récepteurs béta que le reste du ventricule [4].
L’évaluation de l’anastomose artérielle pulmonaire est possible sur le tronc de l’AP ou sur l’AP droite (vue de l'aorte ascendante court-axe 0° et long-axe 120°), mais elle est impossible sur l’AP gauche à cause de l’interposition de la bronche-souche entre l’AP et l’oesophage. Le diamètre de l'anastomose doit être d'au moins 75% de celui de l'AP [9]. Le gradient maximal à travers l’anastomose doit être < 20 mmHg (Vmax 2.0 – 2.3 m/s), mais il n'existe pas de recommandation pour la valeur exacte au-delà de laquelle la révision de l'anastomose est peremptoire [1]. Outre l'accélération du flux au niveau de l'anastomose (tourbillons, aliasing), la sténose artérielle se manifeste par une dilatation et une défaillance droite aiguë.
Les veines pulmonaires étant réimplantées dans l’OG en bloc ou séparément, il est important d’évaluer le flux à travers l’anastomose des 2 veines pulmonaires (pour chaque côté en cas de greffe bipulmonaire). La Vmax du flux d’entrée dans l’OG doit être < 1.0 m/s, avec une tolérance jusqu’à 1.5 m/s (gradient de pression maximal 4-9 mmHg) ; une révision chirurgicale s’impose si la Vmax est > 1.5 m/s, car cette valeur est associée à un œdème pulmonaire aigu et à une mortalité postopératoire de 32% [5]. D'autres critères parlent en faveur d'une reprise pour élargissement: orifice d'anastomose < 0.5 cm, flux turbulent au Doppler couleur à l'entrée dans l'OG, contraste spontané dans les veines pulmonaires, OG et VG hypovolémiques [1,3]. Toutefois, la Vmax du flux veineux pulmonaire est tributaire de la volémie, du débit cardiaque, de la POG et du flux mitral; ces éléments doivent être pris en compte dans la décision de réintervenir. Comme on n’héparinise pas systématiquement les patients pour la greffe pulmonaire, il faut soigneusement rechercher la présence d'une thrombose veineuse (2-15% des cas) ou d’un thrombus dans l’OG en fin d’intervention ; souvent, le thrombus est fixé à l’anastomose d'une veine pulmonaire avec l’OG (Vidéo et Figure 27.203) [7,8].
Vidéo: découverte fortuite d'un long thrombus dans l'OG après une transplantation pulmonaire; le thrombus est attaché à l'anastomose des veines pulmonaires droites.
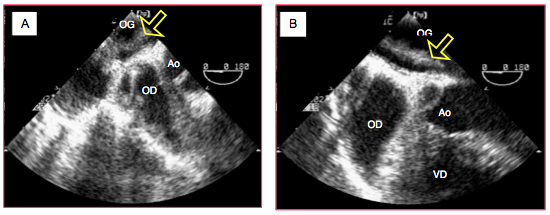
Figure 27.203 : Thrombus dans l’OG apparu en fin d’opération lors d’une transplantation bi-pulmonaire; les thrombi frais sont souvent peu échogènes. A : le thrombus est fixé à l’anastomose entre les veines pulmonaires droites et l’OG. B : il s’étend dans le corps de l’OG et mesure 5 cm de longueur. Une CEC avec arrêt circulatoire a été nécessaire pour l’extraire chirurgicalement.
Une complication inhabituelle est un pneumopéricarde aigu provoquant un effondrement hémodynamique par tamponnade. Il est aisément diagnostiqué par l'ETO [2]. L'avantage majeur de l'ETO est de permettre le diagnostic de ces différentes complications en cours d'intervention. La correction immédiate du défaut sur une anastomose évite une reprise en urgence quelques heures plus tard, alors que le poumon a gravement souffert de ce délai [1].
© CHASSOT PG, BETTEX D. Novembre 2011, Août 2019; dernière mise à jour, Mars 2020
Références
L’évaluation de l’anastomose artérielle pulmonaire est possible sur le tronc de l’AP ou sur l’AP droite (vue de l'aorte ascendante court-axe 0° et long-axe 120°), mais elle est impossible sur l’AP gauche à cause de l’interposition de la bronche-souche entre l’AP et l’oesophage. Le diamètre de l'anastomose doit être d'au moins 75% de celui de l'AP [9]. Le gradient maximal à travers l’anastomose doit être < 20 mmHg (Vmax 2.0 – 2.3 m/s), mais il n'existe pas de recommandation pour la valeur exacte au-delà de laquelle la révision de l'anastomose est peremptoire [1]. Outre l'accélération du flux au niveau de l'anastomose (tourbillons, aliasing), la sténose artérielle se manifeste par une dilatation et une défaillance droite aiguë.
Les veines pulmonaires étant réimplantées dans l’OG en bloc ou séparément, il est important d’évaluer le flux à travers l’anastomose des 2 veines pulmonaires (pour chaque côté en cas de greffe bipulmonaire). La Vmax du flux d’entrée dans l’OG doit être < 1.0 m/s, avec une tolérance jusqu’à 1.5 m/s (gradient de pression maximal 4-9 mmHg) ; une révision chirurgicale s’impose si la Vmax est > 1.5 m/s, car cette valeur est associée à un œdème pulmonaire aigu et à une mortalité postopératoire de 32% [5]. D'autres critères parlent en faveur d'une reprise pour élargissement: orifice d'anastomose < 0.5 cm, flux turbulent au Doppler couleur à l'entrée dans l'OG, contraste spontané dans les veines pulmonaires, OG et VG hypovolémiques [1,3]. Toutefois, la Vmax du flux veineux pulmonaire est tributaire de la volémie, du débit cardiaque, de la POG et du flux mitral; ces éléments doivent être pris en compte dans la décision de réintervenir. Comme on n’héparinise pas systématiquement les patients pour la greffe pulmonaire, il faut soigneusement rechercher la présence d'une thrombose veineuse (2-15% des cas) ou d’un thrombus dans l’OG en fin d’intervention ; souvent, le thrombus est fixé à l’anastomose d'une veine pulmonaire avec l’OG (Vidéo et Figure 27.203) [7,8].
Vidéo: découverte fortuite d'un long thrombus dans l'OG après une transplantation pulmonaire; le thrombus est attaché à l'anastomose des veines pulmonaires droites.

Figure 27.203 : Thrombus dans l’OG apparu en fin d’opération lors d’une transplantation bi-pulmonaire; les thrombi frais sont souvent peu échogènes. A : le thrombus est fixé à l’anastomose entre les veines pulmonaires droites et l’OG. B : il s’étend dans le corps de l’OG et mesure 5 cm de longueur. Une CEC avec arrêt circulatoire a été nécessaire pour l’extraire chirurgicalement.
Une complication inhabituelle est un pneumopéricarde aigu provoquant un effondrement hémodynamique par tamponnade. Il est aisément diagnostiqué par l'ETO [2]. L'avantage majeur de l'ETO est de permettre le diagnostic de ces différentes complications en cours d'intervention. La correction immédiate du défaut sur une anastomose évite une reprise en urgence quelques heures plus tard, alors que le poumon a gravement souffert de ce délai [1].
| Transplantation pulmonaire |
| L'ETO est le moyen le plus performant pour juger de la tolérance du VD au clampage de l'artère pulmonaire et de l'éventuelle nécessité d'une assistance circulatoire. En fin d'opération, plusieurs points sont à rechercher: - Débullage - Fonction du VD - Eventuelle sténose dynamique de la CCVD - Contrôle de l'anastomose de l'AP (Vmax < 2.0 m/s) - Contrôle de l'anastomose des veines pulmlnaires (Vmax < 1.0 m/s) - Recherche de thrombus dans l'OG |
© CHASSOT PG, BETTEX D. Novembre 2011, Août 2019; dernière mise à jour, Mars 2020
Références
- ABRAMS BA, MELNYK V, ALLEN WL, et al. TEE for lung transplantation: A case series and discussion of vascular complications. J Cardiothorac Vasc Anesth 2020; 34:733-40
- FELTEN ML, DUMANS-NIZARD V, PUYO P, et al. Intraoperative occurrence of a pneumopericardium during double-lung transplantation. Interact Thorac Cardiovasc Surg 2013; 16:929-31
- GONZALEZ-FERNANDEZ C, GONZALEZ-CASTRO A, RODRIGUEZ-BORREGAN JC, et al. Pulmonary venous obstruction after lung transplantation. Diagnostic advantages of transesophageal echocardiography. Clin Transpl 2009; 23:975-80
- HADDAD F, COUTURE P, TOUSIGNANT C, DENAULT AY. The right ventricle in cardiac surgery, a perioperative perspective: I. Anatomy, physiology and assessment. Anesth Analg 2009; 108:407-21
- KUMAR N, ESSANDOH M, BHATT A, et al. Pulmonary cuff dysfunction after lung transplantation surgery: A systematic review of the evidence and analysis of its clinical implication. J Heart Lung Transplant 2019; 38:530-44
- MURTHA W, GUENTHER C. Dynamic left ventricular outflow tract obstruction complicating bilateral lung transplantation. Anesth Analg 2002; 94:558-61
- NGUKHOON TAN C, FRASER AG. Transesophageal echocardiography and cardiovascular source of embolism. Anesthesiology 2007; 107:333-46
- SIDDIQUE A, BOSE AK, OZALP F, et al. Vascular anastomotic complications in lung transplantation: a single institution's experience. Interact Thorac Cardiovasc Surg 2013; 17:625-31
- SUBRAMANIAM KE. Role of transesophageal echocardiography in perioperative patient management of lung transplantation surgery. J Periop Pract 2013; 1:48-56
