Dans la TGV, il existe une discordance complète de la jonction ventriculo-artérielle: l'aorte sort du ventricule anatomiquement droit, qui fonctionne donc comme ventricule systémique; l'artère pulmonaire est issue du ventricule morphologiquement gauche. Dans une dextro-TGV (D-TGV) les deux vaisseaux sont parallèles, l’aorte est antérieure et l’artère pulmonaire est postérieure (Figure 15.53). La lévo-TGV (ou L-TGV) est accompagnée d'une discordance des ventricules; l'aorte et l'AP sont parallèles mais côte-à-côte sur le plan frontal (voir TGV naturellement corrigée) [11].
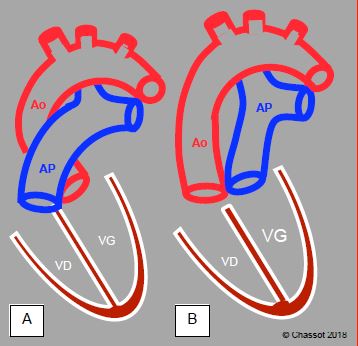
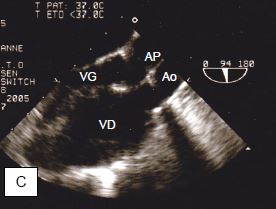
Figure 15.53 : Illustration schématique d'une transposition des gros vaisseaux (TGV). A : position normale de l'aorte et de l'artère pulmonaire. B : position des vaisseaux dans une D-TGV. C : vue long-axe de l’aorte et de l’AP qui apparaissent parallèles au lieu de se croiser à 45°. Le ventricule anatomiquement droit est hypertrophié puisqu’il fonctionne comme ventricule systémique (sous-aortique). L'aorte est antérieure par rapport à l'AP.
La circulation systémique et la circulation pulmonaire tournent en parallèle et non en continuité, ce qui est incompatible avec l’existence. C’est un mélange des sangs veineux et artérialisé par une CIA, une CIV (30-40% des cas) ou un canal artériel qui assure la survie. Les enfants porteurs d'une TGV ne survivent pas sans une intervention précoce.
- Opération de Rashkind: par cathétérisme, on déchire le septum interauriculaire pour créer ou agrandir la CIA; on procède à cette intervention dans les premières heures après la naissance.
- Opération de Mustard ou de Senning: un patch complexe positionné entre les deux oreillettes (interatrial baffle) permet de rediriger le sang veineux systémique vers le ventricule sous-pulmonaire et le sang artérialisé vers le ventricule sous-aortique (Figure 15.54). Malheureusement, le ventricule anatomiquement droit reste le ventricule systémique, ce qui ne permet pas une survie normale; il dysfonctionne vers 20-25 ans [7].
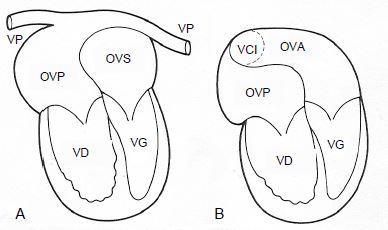
Figure 15.54 : Opération de Mustard pour TGV: un patch complexe positionné entre les deux oreillettes (interatrial baffle) permet de rediriger le sang veineux systémique vers le ventricule sous-pulmonaire (VG) et le sang artérialisé vers le ventricule sous-aortique (VD). Le ventricule systémique est le ventricule droit. A : les veines pulmonaires (VP) se drainent dans une oreillette veineuse postérieure (OVP) connectée au VD sous-aortique. B : la veine cave inférieure (VCI) se draine dans la partie basse d’une oreillette veineuse antérieure (OVA) connectée au VG sous-pulmonaire. La veine cave supérieure se draine de la même manière dans la partie haute de l’OVA [13].
- Opération de Jatene (switch artériel): avant que le remodelage des ventricules ne soit significatif (< 2-3 semaines de vie), on croise les gros vaisseaux en reconnectant l'AP sur le VD et l'aorte sur le VG; les coronaires sont réimplantées dans l'aorte (Figure 15.55). Passée la mortalité périopératoire (3%), l'espérance de vie est quasi normale (97% à 20 ans) [9,10,16].
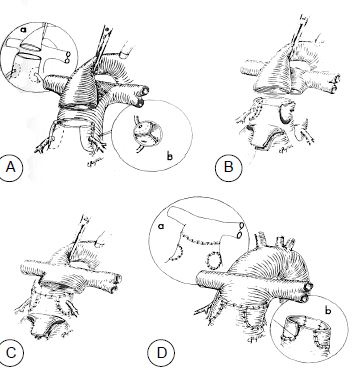
Figure 15.55 : Opération de Jatene (switch artériel): croisement des gros vaisseaux en reconnectant l'AP sur le VD et l'aorte sur le VG. A : trans-section de l’aorte et excision des coronaires. B : l’AP est excisée et les coronaires sont réimplantées dans la partie proximale de l’AP connectée au VG. C : l’AP est positionnée antérieurement à l’aorte (manœuvre de Lecompte) ; l’AP proximale est anastomosée à l’aorte distale. D : les sites de prélèvement des coronaires sont patchés et l’aorte proximale, connectée au VD, est anastomosée à l’AP distale. Cette reconstrucion présente un risque d’ischémie myocardique.
- Opération de Rastelli: le ventricule anatomiquement gauche est connecté à l’aorte par un patch sur la CIV et le ventricule anatomiquement droit à l’artère pulmonaire par un conduit valvé (Figure 15.56); elle est réservée aux cas complexes avec CIV.
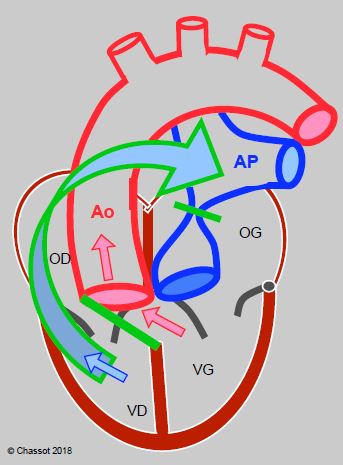
Figure 15.56 : Opération de Rastelli : lorsque la TGV est associée à une CIV et une obstruction de la CCVG, on peut fermer la CIV avec un patch (barre verte) orienté de manière à ce que le sang du VG soit dirigé vers l’aorte. L’AP proximale est ligaturée et un conduit valvé (flèche vert-bleu) est construit entre la VD et l’AP. Le sang veineux (flèche bleue) et le sang artériel (flèches rouges) sont séparés et dirigées respectivement vers le conduit-AP et l’aorte.
Les adultes les plus âgés ont en général subi un switch auriculaire de type Mustard ou Senning, alors que ceux qui sont nés dans les années quatre-vingt ont déjà bénéficié d’un switch artériel.
Anesthésie
Ce sont donc des patients déjà opérés que l'on rencontre à l'âge adulte, mais qui n'ont pas pour autant une hémodynamique normale.
- Après switch auriculaire (opérations de Mustard ou Senning), la dysfonction ventriculaire droite est la règle; le VD est dilaté, une insuffisance tricuspidienne apparaît [5]. Le VG est petit et le septum interventriculaire bombé dans la gauche rétrécit encore son volume diastolique. Une obstruction au retour veineux systémique et/ou pulmonaire par le patch interauriculaire est présente dans > 25% des cas. Ceci peut induire un syndrome de la VCS (le plus fréquent), une entéropathie hypoprotéinémique ou une stase pulmonaire [15]. Les tachy-arythmies sus-jonctionnelles, les bradycardies sinusales et les blocs AV sont fréquents (50-60% des cas) et réfractaires au traitement médicamenteux [2,8]. Une obstruction dynamique de la CCVG est possible car le VG est connecté à un circuit à basse pression. Lors d’une anesthésie, le ventricule anatomiquement droit doit bénéficier d’un soutien inotrope et d’une perfusion coronarienne optimale, car c’est lui qui assure la perfusion systémique.
- Après switch artériel, la physiologie est quasi normale. Deux complications dominent le tableau clinique: ce sont la dilatation de la racine aortique (> 50 mm) avec insuffisance de la néovalve aortique (30% des cas) et l'ischémie sur les réimplantations coronariennes (5-10% des cas) [4,6,14]. On peut aussi rencontrer des obstructions dynamiques de la CCVD ou de la CCVG, et une dysfonction du VG [3]. Ces malades sont sensibles à l'hypovolémie et à la stimulation béta, mais par ailleurs présentent une réactivité hémodynamique normale [4,16].
- Après opération de Rastelli, une CIV résiduelle peut occasionner une surcharge de volume pour le VG; une sténose secondaire du conduit doit être corrigée si le gradient de pression maximal est > 50 mmHg ou le rapport de pression VD/VG > 0.7 [1,12,15].
| Transposition des gros vaisseaux (TGV) |
|
Malades opérés dans l’enfance (pas de survie sans traitement ou palliation)
Croisement des retours veineux (opérations de Mustard et de Senning)
- Le VD reste le ventricule systémique, d’où défaillance droite vers 20-30 ans
- Obstruction dynamique de la CCVG
- Stase veineuse
- Arythmies
Décroisement artériel (opération de Jatène, switch artériel)
- IA (néo-valve aortique)
- Ischémie myocardique (réimplantation coronaraire)
- Obstruction dynamique de la CCVG et/ou de la CCVD
Caractéristiques pour l’anesthésie
- Après switch auriculaire : défaillance droite (ventricule systémique), arythmies auriculaires, stase veineuse
- Après switch artériel : physiologie normale ; risque : IA, ischémie coronarienne
|
© BETTEX D, CHASSOT PG, Janvier 2008, dernière mise à jour Janvier 2018
Références
- BAUMGARTNER H, BONHOEFFER P, DE GROOT NMS, et al. ESC Guidelines for the management of grown-up congenital heart disease (new version 2010). Eur Heart J 2010; 31:2915-57
- CHRISTENSEN RE, REYNOLDS PI, BUKOWSKI BK et al. Anaesthetic management and outcomes in patients with surgically corrected D-transposition of the great arteries undergoing non-cardiac surgery. Br J Anaesth 2010; 104:12-5
- COLAN SD, BOUTIN C, CASTANEDA AR, WERNOVSKY G. Status of the left ventricle after switch operation for transposition of the great arteries. J Thorac Cardiovasc Surg 1995; 109:311-21
- COLAN SD, TROWITZSCH E, WERNOVSKY G, et al. Myocardial performance after arterial switch operation for transposition on the great arteries with intact ventricular septum. Circulation 1988; 78:132-41
- DIMAS AP, MOODIE DS, STERBA R, GILL CC. Long-term function of the morphologic right ventricle in adult patients with corrected transposition of the great arteries. Am Heart J 1989; 118:526-30
- FORMIGARI R, TOSCANO A, Giardini A, et al. Prevalence and predictors of neoaortic regurgitation after arterial switch operation for transposition of the great arteries. J Thorac cardiovasc Surg 2003; 126:1753-9
- GRAHAM TP. Ventricular performance in congenital heart disease. Circulation 1991; 84:2259-74
- HELBING WA, HANSEN B, OTTENKAMP J, et al. Long-term results of atrial correction for transposition of great arteries: comparison of Mustard and Senning operations. J Thorac Cardiovasc Surg 1994; 108:363-72
- HOVEL-GURICH HH, SEGHAYE MC, MA Q, et al. Long-term results of cardiac and general health status in children after neonatal arterial switch operation. Ann Thorac Surg 2003; 75:935-43
- MASCIO CE, PASQUALI SK, JACOBS JP, et al. Outcomes in adult congenital heart surgery: analysis of the Society of Thoracic Surgeons database. J Thorac Cardiovasc Surg 2011; 142:1090-7
- MILLER-HANCE WC, SILVERMAN NH. Transesophageal echocardiography (TEE) in congenital heart disease with focus on the adult. Cardiol Clinics 2000; 18:861-92
- SILVERSIDES CK, SALEHIAN O, OECHSLIN E, et al. Canadian Cardiovascular Society 2009 Consensus Conference on the management of adults with congenital heart disease: Complex congenital cardiac lesions. Can J Cardiol 2010; 26:e98-e117
- STÜMPER O, SUTHERLAND GR. Transesophageal echocardiography in congenital heart disease. London: Edward Arnold, 1994, 37-38
- TANEL RE, WERNOWSKY G, LANDZBERG MJ, et al. Coronary artery abnormalities detected at cardiac catheterization following the arterial switch operation for transposition of the great arteries. Am J Cardiol 1995; 76:153-
- WARNES CA, WILLIAMS RG, BASHORE TM, et al. ACC/AHA 2008 Guidelines for the management of adults with congenital heart disease: executive summary. Circulation 2008; 118:2395-451
- WILLIAMS WG, McCRINDLE BW, ASHBURN DA, et al. Outcomes of 829 neonates with complete transposition of the great arteries 12-17 years after repair. Eur J Cardiothorac Surg 2003; 24:1-9
