Le coeur consomme 8-10 mL O2/100gm/min au repos, soit le 11% de la consommation totale de l'organisme. Le myocarde est dépendant du métabolisme aérobique, car ses réserves (O2 lié à la myoglobine et O2 dissous) ne dépassent pas une trentaine de battements à 37°C [5] ; au-delà, le métabolisme anaérobique s'installe. Le temps d'ischémie tolérable permettant d'assurer une récupération fonctionnelle totale est de 3-5 minutes à 37°C; il augmente à 15 minutes à 28°C et à 45 minutes à 18°C [4]. L'extraction d'O2 au repos étant de 70%, toute augmentation de la demande (↑ mVO2) engage une augmentation du flux coronaire (↑ Qc, d'où ↑ DO2); mVO2 et Qc sont donc étroitement couplés et suivent une relation linéaire. En conséquence, la PO2 et la saturation du sinus coronaire restent relativement constantes: respectivement 15-20 mmHg et 30% [7].
L'équilibre entre l'apport et la demande en oxygène dépend de nombreux éléments (Figure 5.134). L'apport en oxygène (DO2) est tributaire de plusieurs facteurs [6]:
- Le flux sanguin coronaire (Qc), qui dépend lui même de:
- La pression diastolique aortique, représentée par la PA moyenne (PAM);
- La pression télédiastolique du ventricule gauche (PtdVG représentée par la PAPO);
- La durée de la diastole (fréquence);
- Les résistances vasculaires coronariennes;
- Le degré de collatéralisation;
- La présence éventuelle de sténoses.
- Le transport d'oxygène défini par le contenu en oxygène du sang (CaO2):
CaO2 = ( [Hb] • Sat (%) • 1.34 ) + (0.003 • PaO2)
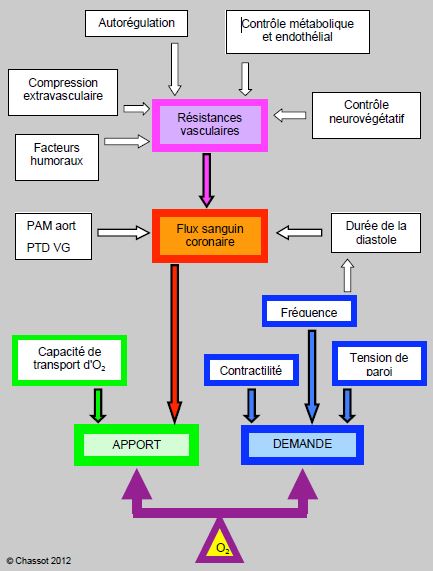
Figure 5.134 : Représentation schématique des facteurs affectant l'équilibre entre l'apport et la demande myocardique en oxygène. PAM aort: pression artérielle moyenne de l'aorte ascendante. PTD: pression télédiastolique du VG.
La demande en oxygène (mVO2) est commandée par différentes données.
- La fréquence cardiaque ; elle a trois effets qui font que la consommation d'énergie augmente disproportionnellement avec sa valeur (Figure 5.135):
- Augmentation du travail cardiaque avec le nombre de battements/minute;
- Raccourcissement géométrique de la diastole avec la tachycardie, donc diminution de la durée de perfusion coronarienne (baisse de DO2);
- Augmentation de la contractilité avec la tachycardie (accumulation de [Ca2+] libre).
- La contractilité myocardique, qui augmente la mVO2.
- La tension de paroi, réglée par la précharge et la postcharge ; selon la loi de Laplace, le stress de paroi (σ) augmente linéairement avec la pression générée (P) et avec la dimension (r) du ventricule, et diminue avec son épaisseur (h): σ = (P • r) / 2 h.
- La tension de paroi systolique correspond à la postcharge (travail interne de pression); doubler la pression double aussi la demande en O2.
- La dimension télédiastolique du ventricule est liée à la précharge et à l’éventuelle dilatation (travail externe à fournir ou volume systolique déplacé) ; doubler le volume ventriculaire n’augmente le rayon que de 25% ; l’augmentation de précharge n’occasionne qu’une modeste augmentation de la demande en O2.
- Le travail externe à fournir.
- Le métabolisme: métabolisme de base, l'énergie de contraction, la contractilité, la température.
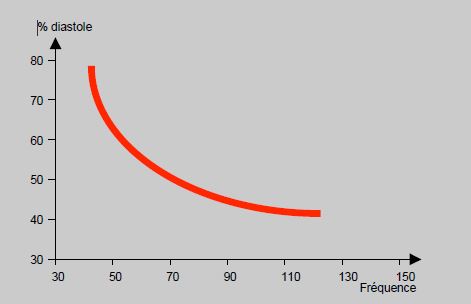
Figure 5.135 : Relation entre la fréquence et la durée de la diastole. Entre 50 et 90 battements/minute, un faible accroissement de fréquence a un effet considérable sur le raccourcissement de la diastole, donc sur la durée de la perfusion diastolique du ventricule.
La proportion de chacun de ces déterminants dans la consommation d'oxygène globale du myocarde montre que le travail fourni pour l'éjection du volume systolique ne représente que 30-40% de la mVO2 totale au repos, alors que le travail de pression en représente 40-50%; le métabolisme cellulaire (flux ioniques, mouvements de Ca++) compte pour 20% de la mVO2 (voir Figure 5.54) [3]. Les variations de charge sont plus dispendieuses que les variations de volume. Les besoins énergétiques ne sont pas simplement corrélés au travail éjectionnel fourni tel qu'on l'estime cliniquement par l'équation: PAM • Vol syst. Ils dépendent également de la tension de paroi, dont le seul maintien consomme de l'O2. Selon la loi de Laplace, cette tension augmente avec la taille du ventricule; un ventricule dilaté consomme donc davantage d'énergie pour fournir des prestations identiques, même sans considérer le coût de l'éjection [8].
La prise en charge du patient insuffisant coronaire consiste à ré-équilibrer la balance DO2/VO2 en diminuant la demande et augmentant l'apport en oxygène. En clinique, on a mis au point plusieurs index dans le but de quantifier le risque ischémique face à certaines situations hémodynamiques. On peut citer par exemple:
- Le double produit de la fréquence cardiaque et de la pression systolique: f • PAsyst; la valeur normale est < 12’000; c'est un faible critère dans la mesure où il accorde la même importance aux deux termes de l'équation, alors que l'augmentation de fréquence est beaucoup plus onéreuse que celle de la pression.
- Le triple produit de la fréquence cardiaque, de la pression systolique et de la durée de la systole; cet index est un peu meilleur.
- L'indice de Buckberg: rapport entre l'index pression-temps diastolique (IPDT) et l'index pression–temps systolique (ITTS): IPDT / ITTS = 0.7 (Figure 5.136) [1].
- Le rapport entre la pression artérielle moyenne (PAM) et la fréquence cardiaque (rapport de Buffington): le coronarien est dans une situation dangereuse lorsque sa fréquence devient supérieure à sa PAM; le rapport PAM / f doit donc rester > 1 [2].
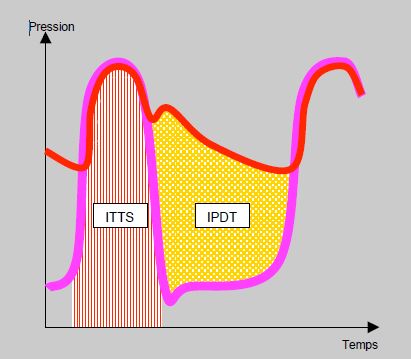
Figure 5.136 : Indice de Buckberg. C'est le rapport entre la surface couverte par la courbe de pression ventriculaire pendant la systole, et la surface comprise entre la courbe de pression aortique et la courbe de pression ventriculaire pendant la diastole. Le rapport se calcule entre l'index pression-temps diastolique (IPDT) et l'index pression–temps systolique (ITTS): IPDT / ITTS = 0.7 [1].
Jusqu'à un certain point, le couplage entre le débit coronarien et la consommation myocardique en oxygène (Qc/mVO2) n'est pas modifié par une substance qui diminue le flux coronarien et simultanément la consommation d'oxygène du myocarde, parce que l'autorégulation n'est pas altérée. Un découplage survient lorsqu'un élément modifie isolément l'un des deux paramètres. Une augmentation isolée du flux donne lieu à une perfusion luxuriante. Le risque est évidemment maximal lors de diminution du flux sans modification de la mVO2.
| Apport (DO2) et consommation d'O2 (mVO2) du myocarde |
|
Consommation d'O2 myocardique (mVO2) au repos: 8-10 mL O2/100gm/min (11% de la VO2 totale pour 0.6% de la masse corporelle). Vu l'extraction maximale d'O2 (70%), une ↑de la mVO2 commande une ↑ du flux coronarien. Réserve en métabolisme aérobique: 20-30 battements.
Le DO2 dépend de:
- Flux coronarien (PAM, PAPO, durée de la diastole, résistances, collatérales, sténoses)
- Contenu du sang en O2 (Hb, débit cardiaque, ventilation)
La mVO2 dépend de:
- Fréquence cardiaque
- Contractilité
- Tension de paroi systolique (travail interne de pression, 40-50% du travail total)
- Volume éjecté (travail externe, 30-40% du travail total)
- Dimension télédiastolique
- Métabolisme de base (échange ionique, activité électrique)
Règle pour la prise en charge du patient coronarien: ↑ DO2 et ↓mVO2. De manière simplifiée, le rapport PAM/f doit rester > 1 (rapport de Buffington). La tachycardie est doublement néfaste: elle raccourcit la diastole (↓ DO2) et augmente les besoins (↑ mVO2).
|
© CHASSOT PG Août 2010, dernière mise à jour Novembre 2018
Références
- BUCKBERG GD, FIXLER DE, ARCHIE JP, et al. Experimental subendocardial ischemia in dogs with normal coronary arteries. Cric Res 1972; 30:67
- BUFFINGTON CW, DAVIS KB, GILLEPSIE S, et al. The prevalence of steal-prone anatomy in patients with coronary artery disease. Anesthesiology 1988; 69:721
- GOULD KL. Coronary artery stenosis. New York, Elsevier 1991, p 8
- LAKE CL. Extracorporeal circulation and circulatory assist devices in the pediatric patient. In: LAKE CL. Pediatric cardiac anesthesia. Norwalk, Appleton & Lange 1993, 164-5
- MERX MW. Myoglobin facilitates oxygen diffusion. FASEB J 2001; 15:1077-9
- PRIEBE HJ. Triggers of perioperative myocardial ischemia and infarction. Brit J Anaesthesiol 2004; 93:9-20
- PRIEBE HJ. – Mechanisms of perioperative myocardial injury. In: HOWELL S, et al, eds. Heart disease and the surgical patient. New York: Informa Healthcare 2007, 39-61
- SCHMIDT C, HINDER F, VAN AKEN H. Global left ventricular systolic function. In: POELAERT J, Skarvan K. Transoesophageal echocardiography in anaesthesia and intensive care medicine. London: BMJ Books, 2004, 62
