En l'absence de mesure directe du volume circulant, l'hypovolémie est habituellement diagnostiquée par la réponse du patient au remplissage (fluid responsiveness): l'administration d'environ 500 mL de cristalloïde rétablit l'hémodynamique et le volume systolique. Les différents indices sont comparés au moyen de leurs courbes ROC (reciever operating curve) (Figure 27.16) [1,2,3,4,5,6,7,9].
- Variations ventilatoires du volume systolique, du flux aortique (Vmax) et des oscillations du septum interauriculaire en IPPV (indices dynamiques); r = 0.93. Ce sont les indices les mieux corrélés avec la réponse au remplissage en cas d'hypovolémie. Leur valeur prédictive positive est > 95%.
- Variations ventilatoires du raccourcissement de surface du VG en IPPV; r = 0.91. La valeur prédictive positive est > 90%.
- Variations respiratoires du diamètre de la veine cave inférieure en IPPV ou en respiration spontanée; r = 0.90. La valeur prédictive positive est de 90%.
- Variations ventilatoires de la pression artérielle en IPPV; PA différentielle: r = 0.78; PA systolique: r = 0.72. La valeur prédictive positive est de 70-80%.
- Surface télédiastolique du VG en vue court-axe transgastrique; r = 0.64. La valeur prédictive positive est modeste (< 70%).
- Pressions centrales (PVC et PAPO); r = 0.51. La courbe suit pratiquement la diagonale du carré, ce qui signifie qu'une valeur donnée a 50% de chance de prédire une hypovolémie et 50% de chance de prédire une normovolémie.
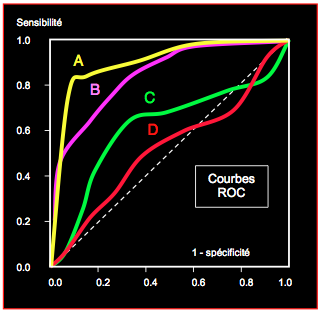
Figure 27.16 : Corrélation de différents indices hémodynamiques avec la volémie, en fonction de la réponse au remplissage vasculaire; comparaison au moyen des courbes ROC (reciever operating curve). La courbe ROC traduit le degré de spécificité et de sensibilité des diverses méthodes pour évaluer l’hypovolémie. La valeur prédictive positive est indiquée en pourcent ; le degré de corrélation (r) avec l’hypovolémie est mesuré par la surface sous la courbe ROC en proportionnalité avec la surface du quadrilatère dans lequel elle est incluse (AUC: area under the curve). A: variations du volume systolique, du flux aortique et des oscillations du septum interauriculaire en IPPV (indices dynamiques); r = 0.93. B: variations de la pression artérielle en IPPV (indice dynamique); r = 0.78. C: surface télédiastolique du VG en vue court-axe transgastrique (indice statique); r = 0.64. D: pressions de remplissage centrales (PVC et PAPO); r = 0.51.
L‘échocardiographie offre trois avantages considérables dans le diagnostic de l'hypovolémie.
- Evaluation directe des dimensions des cavités cardiaques et de leur degré de remplissage, indépendamment de leur compliance: surface, volume (3D), oscillation du septum interauriculaire.
- Indices dynamiques en ventilation mécanique (variations ventilatoires de la Vmax du flux aortique ou des dimensions des veines caves, oscillations du septum interauriculaire) et en respiration spontanée (variation respiratoires du diamètre de la VCI).
- Mise en évidence d'une dysfonction diastolique, impliquant des pressions de remplissage plus élevées pour le même volume télédiastolique.
Lorsqu’on met en relation la courbe de Frank-Starling et la courbe de compliance du VG sur un même graphique dont l’abscisse représente la précharge, on voit apparaître deux zones de configurations différentes selon que l’individu est en hypovolémie ou en hypervolémie (Figure 27.17) [8].
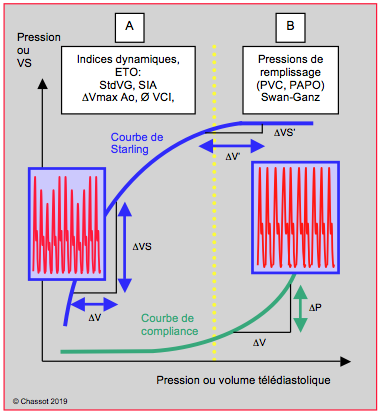
Figure 27.17 : Les deux phases de la courbe de Frank-Starling et de la courbe de compliance déterminent les meilleures techniques de monitorage. Ces deux phases sont séparées par un pointillé jaune vertical correspondant au genou de chaque courbe. A : A gauche, en hypovolémie, ce sont les indices éjectionnels dynamiques (variations ventilatoires de la pression artérielle PA et du volume systolique VS) ou les mesures indépendantes de la compliance (surfaces des cavités à l’ETO, oscillations du septum interauriculaire) qui sont les plus pertinentes. B : A droite, en hypervolémie, ce sont les pressions de remplissage fournies par la Swan-Ganz (PVC, PAPO) qui deviennent utiles. En effet, la relation précharge - volume systolique (effet Frank-Starling) est bien marquée pendant la phase de recrutement de la courbe de Starling (hypovolémie), alors que la relation pression - volume de remplissage (compliance) n’est significative que pendant la phase de redressement de la courbe de compliance (hypervolémie).
En hypovolémie, la courbe de Starling est très redressée et les variations de précharge se traduisent par de fortes variations du volume systolique (phase de recrutement). La courbe de compliance est au contraire très plate et la pression de remplissage varie peu avec le volume télédiastolique. Ce sont donc les indices éjectionnels dynamiques (variations ventilatoires de la pression artérielle, du volume systolique, de la Vmax du flux aortique, du diamètre de la veine cave inférieure) ou les mesures indépendantes de la compliance (surfaces des cavités, oscillations du septum interauriculaire) qui sont les plus pertinentes.
En hypervolémie (insuffisance cardiaque congestive, insuffisance mitrale ou aortique, surcharge liquidienne), la courbe de Starling s’est aplatie, alors que la courbe de compliance s’est redressée: le volume systolique ne varie plus avec le volume de la précharge (indices dynamiques non pertinents), alors que la pression de remplissage est bien corrélée au volume de remplissage. La surface des chambres cardiaques est maximale et le septum interauriculaire est tendu; ajouter du volume de précharge ne modifie pas ces données, mais ne fait qu'augmenter la pression dans les cavités. Ce sont donc les pressions de remplissage (PVC, PAPO) fournies par la voie centrale ou le cathéter pulmonaire de Swan-Ganz qui deviennent les plus utiles. D’autant plus qu’elles permettent de gérer l’administration liquidienne en fonction de la pression qui règne dans les poumons, là où le risque d’oedème tissulaire est le plus important. Les malades en dysfonction ventriculaire, en insuffisance rénale ou souffrant d’un syndrome de fuite capillaire se trouvent dans cette situation d’hypervolémie. Il n'y a donc pas de compétition entre l'ETO et le cathéter pulmonaire pour l'évaluation de la volémie, car ils sont complémentaires et s'adressent chacun à l'une des extrémités de l'éventail des remplissages. Chacun est pertinent dans son domaine d'application et inefficace en-dehors de sa zone de compétence.
Dans la pratique clinique, on se base sur un certain nombre d'indices pour poser le diagnostic d'hypovolémie en échocardiographie (Tableau 27.1).

Figure 27.17 : Les deux phases de la courbe de Frank-Starling et de la courbe de compliance déterminent les meilleures techniques de monitorage. Ces deux phases sont séparées par un pointillé jaune vertical correspondant au genou de chaque courbe. A : A gauche, en hypovolémie, ce sont les indices éjectionnels dynamiques (variations ventilatoires de la pression artérielle PA et du volume systolique VS) ou les mesures indépendantes de la compliance (surfaces des cavités à l’ETO, oscillations du septum interauriculaire) qui sont les plus pertinentes. B : A droite, en hypervolémie, ce sont les pressions de remplissage fournies par la Swan-Ganz (PVC, PAPO) qui deviennent utiles. En effet, la relation précharge - volume systolique (effet Frank-Starling) est bien marquée pendant la phase de recrutement de la courbe de Starling (hypovolémie), alors que la relation pression - volume de remplissage (compliance) n’est significative que pendant la phase de redressement de la courbe de compliance (hypervolémie).
En hypovolémie, la courbe de Starling est très redressée et les variations de précharge se traduisent par de fortes variations du volume systolique (phase de recrutement). La courbe de compliance est au contraire très plate et la pression de remplissage varie peu avec le volume télédiastolique. Ce sont donc les indices éjectionnels dynamiques (variations ventilatoires de la pression artérielle, du volume systolique, de la Vmax du flux aortique, du diamètre de la veine cave inférieure) ou les mesures indépendantes de la compliance (surfaces des cavités, oscillations du septum interauriculaire) qui sont les plus pertinentes.
En hypervolémie (insuffisance cardiaque congestive, insuffisance mitrale ou aortique, surcharge liquidienne), la courbe de Starling s’est aplatie, alors que la courbe de compliance s’est redressée: le volume systolique ne varie plus avec le volume de la précharge (indices dynamiques non pertinents), alors que la pression de remplissage est bien corrélée au volume de remplissage. La surface des chambres cardiaques est maximale et le septum interauriculaire est tendu; ajouter du volume de précharge ne modifie pas ces données, mais ne fait qu'augmenter la pression dans les cavités. Ce sont donc les pressions de remplissage (PVC, PAPO) fournies par la voie centrale ou le cathéter pulmonaire de Swan-Ganz qui deviennent les plus utiles. D’autant plus qu’elles permettent de gérer l’administration liquidienne en fonction de la pression qui règne dans les poumons, là où le risque d’oedème tissulaire est le plus important. Les malades en dysfonction ventriculaire, en insuffisance rénale ou souffrant d’un syndrome de fuite capillaire se trouvent dans cette situation d’hypervolémie. Il n'y a donc pas de compétition entre l'ETO et le cathéter pulmonaire pour l'évaluation de la volémie, car ils sont complémentaires et s'adressent chacun à l'une des extrémités de l'éventail des remplissages. Chacun est pertinent dans son domaine d'application et inefficace en-dehors de sa zone de compétence.
Dans la pratique clinique, on se base sur un certain nombre d'indices pour poser le diagnostic d'hypovolémie en échocardiographie (Tableau 27.1).
- Taille réduite des cavités cardiaques et mouvement excessif de leurs parois;
- Oscillations accentuées du septum interauriculaire;
- Indices dynamiques en IPPV (ETO): oscillations du septum interauriculaire aux 2 temps respiratoires, variation > 15% du flux aortique, variation > 20% du diamètre de la VCI;
- Indices dynamiques en respiration spontanée (ETT): variation > 50% du diamètre de la VCI;
- Flux de remplissage : critères peu fiables.

En l’absence de valvulopathie sévère ou d’asymétrie fonctionnelle grave entre les ventricules, les oscillations du septum interauriculaire sont un des critères les plus robustes de la volémie. Mais c'est la combinaison concordante de plusieurs de ces données qui permet de poser le diagnostic d’hypovolémie, car une seule donnée isolée n’est pas un critère suffisant pour l’affirmer. D'une manière générale, l'échocardiographie transoesophagienne (ETO) ou transthoracique (ETT) est le moyen le plus performant et le plus rapide pour poser le diagnostic d’hypovolémie, et pour la différencier du choc cardiogène ou vasoplégique en fonction de la fraction d’éjection et de la dimension des surfaces télésystolique ou télédiastolique (Tableau 27.2). Néanmoins, c’est toujours en confrontant les résultats de l’examen à la clinique que l’on est le plus pertinent.

| Evaluation de l’hypovolémie |
| Cavités cardiaques de petite surface (diminution du volume de remplissage) Dimensions réduites de la surface du VG en court-axe (< 6 cm2/m2) Parois flasques et mobiles Oscillations excessives du septum interauriculaire Dimensions réduites de la veine cave supérieure Indices dynamiques liés aux variations de précharge dues à la ventilation en pression positive (ETO): - Oscillations du septum interauriculaire présentes aux 2 temps du cycle ventilatoire - Variations de la vélocité (Vmax) du flux aortique (> 15%) - Diminution cyclique du diamètre de la VCI (> 20%) et de la VCS (> 30%) Indices dynamiques liés aux variations de précharge dues à la respiration spontanée (ETT): - Diminution cyclique du diamètre de la VCI (> 50%) Les flux de remplissage ne sont pas efficaces car indissociables de la fonction diastolique et des pressions de remplissage (problème de la compliance : pression ≠ volume) |
© CHASSOT PG, BETTEX D. Novembre 2011, Août 2019; dernière mise à jour, Mars 2020
Références
- FEISSEL M, MICHARD F, MANGIN I, et al. Respiratory changes in aortic blood velocity as an indicator of fluid responsiveness in ventilated patients with septic shock. Chest 2001; 119:867-73
- HOFER CK, MULLER SM, FURRER L, et al. Stroke volume and pulse pressure variation for prediction of fluid responsiveness in patients undergoing off-pump coronary artery bypass grafting. Chest 2005; 128:848-54
- KUSOMOTO FM, MUHIUDEEN IA, KUECHERER HF, et al. Response of the interatrial septum to transatrial pressure gradients and its potential for predicting pulmonary capillary wedge pressure: an intraoperative study using transesophageal echocardiography in patients during mechanical ventilation. J Am Coll Cardiol 1993; 21:721-8
- MARIK PE, CAVALLAZZI R. Does the central venous pressure predict fluid responsiveness ? An update meta-analysis and a plea for some common sense. Crit Care Med 2013; 41:1774-81
- MARIK PE, CAVALLAZZI R, VASU T, et al. Dynamic changes in arterial waveform derived variables and fluid responsiveness in mechanically ventilated patients: A systematic review of the literature. Crit Care Med 2009; 37:2642-7
- MICHARD F, TEBOUL JL. Predicting fluid responsiveness in ICU patients. A critical analysis of evidence. Chest 2002; 121:2000-8
- ROYSE CF, ROYSE AG, SOEDING PF, BLAKE DW. Shape and movement of the interatrial septum predicts change in pulmonary capillary wedge pressure. Ann Thorac Cardiovasc Surg 2001; 7:79-83
- SPAHN DR, CHASSOT PG. Con. Fluid restriction for cardiac patients during major noncardiac surgery should be replaced by goal-directed intravascular fluid administration. Anesth Analg 2006; 102:344-6
- TOUSIGNANT CP, WALSH F, MAZER CD. The use of transesophageal echocardiography for preload assessment in critically ill patients. Anesth Analg 2000, 90:351-5
