Il n'y a pas de recette simple applicable à tous les enfants; plusieurs techniques sont possibles, basées sur l'utilisation d'un agent principal et d'agents d'appoint. Le choix est guidé par la pathologie cardiaque, l'âge, la durée de la CEC, le degré d'hypothermie et les prévisions postopératoires [6].
En cas de cardiopathie simple chez un enfant de plus de 3 mois et de CEC courte (< 90 minutes) sans hypothermie profonde (T° > 34°C), il est souhaitable de pouvoir extuber l'enfant précocement. Dans ce cas, plusieurs combinaisons sont utilisables:
- Fentanyl (10-25 mcg/kg) ou sufentanil (0.5-2.5 mcg/kg) associés à un agent volatil à 1-1.5 MAC (sevoflurane ou isoflurane) ;
- Fentanyl (10-25 mcg/kg) ou sufentanil (0.5-2.5 mcg/kg) associés au propofol en perfusion (10-20 mg/kg/heure) ;
- Remifentanil (0.1-0.2 mcg/kg/min) et isoflurane, sevoflurane ou propofol en perfusion (2-10 mg/kg/heure)
Les données actuelles ne permettent pas de recommander les perfusions de propofol chez le petit enfant ; en dessous de 2 ans, il faut se restreindre à une combinaison d'un fentanil et d'un halogéné, de fentanyl-kétamine, ou de fentanyl-midazolam. L'analgésie postopératoire peut être assurée par une perfusion continue de morphine (20 mcg/kg/heure) ou de midazolam-sufentanil.
Dans tous les cas complexes où une intubation prolongée est prévue (nourrisson ou nouveau-né, cardiopathie cyanogène, hypertension pulmonaire, insuffisance ventriculaire, CEC > 90 min, hypothermie profonde), l'anesthésie est basée de préférence sur l'utilisation de midazolam (0.05-0.1 mg/kg iv) et de fentanyl ou de sufentanil à des doses qui inhibent la réponse au stress (respectivement environ 50-100 mcg/kg et 5-10 mcg/kg). Ces doses sont réparties entre l'induction, la sternotomie, la CEC et la fermeture du sternum. Le sommeil est entretenu par l'adjonction de sevoflurane (≤ 1 MAC), d’isoflurane (≤ 1 MAC si une baisse des RAS est désirable), de midazolam (0.1 mg/kg/h, sympathicolyse), de kétamine (1 mg/kg/h, stimulation sympathique) ou de propofol (2-10 mg/kg/h, baisse de précharge) selon les conséquences hémodynamiques souhaitées. Sevoflurane et fentanyl assurent la plus grande stabilité hémodynamique chez le tout petit. Le choix du relaxant musculaire (en général vecuronium ou rocuronium) est basé sur la nécessité de maintenir la fréquence cardiaque et la pression artérielle ainsi que sur la durée d'action souhaitée. L’effet vagolytique du pancuronium peut être utile pour limiter la bradycardie liée aux opiacés, qui est mal tolérée chez le petit enfant.
Induction
Selon l'état de l'enfant, trois méthodes d'induction sont proposées:
- L'enfant est en état hémodynamique de supporter une induction aux volatils: l'induction au masque avec sevoflurane est possible. Dès que la voie veineuse est en place, l'agent halogéné est stoppé et l'anesthésie intraveineuse débute: fentanyl, midazolam, propofol ou kétamine selon les contraintes hémodynamiques.
- L'enfant est calme et somnolent en raison de la prémédication: la pose d'une voie veineuse pour l'induction est faisable sans provoquer de réaction excessive.
- L'enfant est épuisé par sa cardiopathie ou déjà porteur d'une voie veineuse; l'induction se fait par voie intraveineuse au fentanyl avec midazolam ou etomidate selon besoin.
En cas de bradycardie, l'atropine (0,01 mg/kg i.v.; dose minimale 0,1mg) est recommandée avant la manipulation des voies aériennes chez les enfants jusqu'à l'âge de deux ans.
Intubation
Chez le petit enfant, la capacité résiduelle fonctionnelle pulmonaire (CRF) et la réserve en oxygène sont diminuées, alors que les besoins métaboliques sont élevés; la période d'apnée imposée par la manoeuvre d'intubation doit être aussi courte que possible, et précédée d'une période d'hyperventilation au masque. De plus, baisser la PaCO2 est impératif en cas d'hypertension pulmonaire. Mais la surpression endothoracique (ventilation en pression positive forcée, Valsalva) force un shunt bidirectionnel dans le sens D-G (POD > POG). Un enfant porteur d’une CIA à prédominance G-D peut soudainement désaturer ou emboliser au niveau artériel lorsqu'on le ventile avec une pression positive excessive. L'hyperventilation renouvelant plus rapidement l'air alvéolaire par rapport au débit sanguin pulmonaire, la concentration alvéolaire en gaz anesthésiant est augmentée, et, partant, sa concentration sanguine; cette accélération de l'induction est plus marquée pour les agents solubles (halothane) que pour les peu solubles (desflurane); l'isoflurane et le sevoflurane ont une position intermédiaire [31].
L'intubation par voie nasale est préférable jusqu’à 5 kg ou lors d’intubation prolongée jusqu’à 2 ans. Vu la nécessité d'instaurer parfois une hyperventilation, et en raison de la faible compliance pulmonaire, le diamètre interne du tube doit être choisi de manière à ce qu'il n'y ait pas de fuite en dessous d'une pression de 20 cm H2O. Un tube à ballonnet permet de garantir l’étanchéité ; il est recommandé dans tous les cas, à l’exception des nouveau-nés [2]. Dans le 25% des cas, les malformations cardiaques sont associées à d'autres malformations; certaines d'entre elles s'accompagnent d’un dysmorphisme facial rendant l'intubation difficile. L'anesthésiste doit le prévoir lors de l'examen préopératoire et ne pas se laisser piéger dans la situation d'un enfant cyanosé, curarisé et malaisé à ventiler, avec une glotte invisible !
L'administration massive et rapide d'un fentanyl induit fréquemment une rigidité et des mouvements choréo-atétosiques par stimulation extrapyramidale; la ventilation au masque sans curare devient difficile, voire impossible; la bradycardie diminue le débit cardiaque. Cette situation peut rapidement devenir dangereuse. La meilleure solution est une myorelaxation rapide avec 0.3 mg/kg de vécuronium ou 1.2 mg/kg de rocuronium (délai pour obtenir des conditions d'intubation: 35 secondes), ou éventuellement 1-2 mg/kg de succinylcholine (délai < 15 secondes) [28].
Ventilation
Les enfants porteurs d’un shunt G-D avec augmentation du flux pulmonaire ont une compliance pulmonaire diminuée et des résistances aériennes augmentées de manière proportionnelle à la surcharge vasculaire; la corrélation est moins nette avec la PAP [29]. La dimension excessive des vaisseaux pulmonaires peut comprimer des bronches et en restreindre le flux.
La ventilation en pression positive affecte négativement le cœur droit et positivement le cœur gauche. Les RAP sont au minimum lorsque le volume pulmonaire correspond à la capacité résiduelle fonctionnelle (voir Figure 14.19) [9]. L’hypoxie et l’hypercarbie abaissent le pH local et provoquent une vasoconstriction vasculaire pulmonaire. L’hyper- ou l’hypo-ventilation permettent ainsi de diminuer ou d’augmenter les RAP et de modifier le rapport Qp/Qs selon la direction désirée.
- Hyperventilation (PaCO2 30-35 mmHg) avec FiO2 élevée (≥ 0.8) en cas d’HTAP pour diminuer les RAP;
- Hypoventilation (PaCO2 45-50 mmHg) avec FiO2 basse (0.21-0.3) pour diminuer un flux pulmonaire excessif (Qp > Qs).
Dans toutes les situations ou la circulation droite est en souffrance (défaillance du VD, physiologie de Fontan, par exemple), le réglage du respirateur doit être minutieux de manière à maintenir la pression moyenne endothoracique la plus basse possible (PEEP minimale pour prévenir le collapsus alvéolaire, rapport I:E de 1:3-4) tout en hyperventilant l’enfant pour baisser le pH local, en général avec un volume courant bas (8-12 mL/kg) et une fréquence élevée. L’adjonction de NO, même à faible dose (10 ppm), diminue les RAP jusqu’à 30% [12].
La ventilation en mode volume-contrôlé permet d’administrer un volume courant (VC) identique même si les conditions se modifient (compliance, relaxation, bronchospasme, etc), mais avec le risque que le pic de pression soit très élevé; les alarmes et les limites de pression veillent à empêcher toute surpression excessive. La ventilation en mode pression-contrôlé offre l’avantage de limiter les risques de barotraumatisme, mais administre un volume courant variable selon les conditions mécaniques du thorax et des poumons. Elle est préférée chez les petits enfants (< 10 kg), notamment parce que le VC des ventilateurs d’anesthésie est imprécis lorsque le volume administré est faible vu le grand volume compressible de la machine; dans ce cas, le mode pression-contrôlé est plus fin.
Crise cyanogène
Certaines situations peuvent déclencher une crise cyanogène (blue spell) entre l'induction et la CEC, notamment en cas de sténose dynamique de la chambre de chasse du VD; elle peuvent être déclenchées par deux mécanismes.
- La vasodilatation systémique augmente le shunt D-G; le traitement habituel est l'administration d'agent vasopresseur (phényléphrine 1 mcg/kg) et l’augmentation du volume circulant (10 mL/kg albumine ou colloïde).
- La stimulation sympathique (douleur, dissection de la racine de l'aorte à l'ouverture du péricarde) peut induire un spasme de la chambre de chasse du VD. Le traitement est un approfondissement de l'anesthésie et l'administration d’un β-bloqueur de courte durée d'action (esmolol, 0.5 mg/kg). L'opérateur peut réduire la réactivité sympathique de la dissection en administrant de la lidocaïne dans le péricarde au moment de l'ouverture de celui-ci.
Ces mesures s'accompagnent d'une hyperventilation (alcalose respiratoire), d'une augmentation du volume circulant et d'un contrôle de la ventilation (recherche d’intubation unilatérale et de pneumothorax, aspiration des sécrétions, etc). Dans les cas de sténose/hypoplasie pulmonaire, on évite de baisser les RAP par hyperventilation, car cette manœuvre augmente le gradient à travers la sténose. Dans les shunts mixtes, la vasodilatation pulmonaire provoque une surcharge de la circulation pulmonaire et une baisse néfaste du débit systémique.
Hypertension pulmonaire
Dans les pathologies susceptibles d'HTAP, qui sont nombreuses, une crise hypertensive peut être facilement déclenchée par une série d'éléments dont il faut absolument se prévenir: hypoventilation, hypercarbie, hypoxémie (PaO2 < 60 mmHg), atélectasies, surpression endothoracique, acidose, hypothermie, stimulations sympathique et douleur. L'HTAP réduit le flux pulmonaire et accentue la désaturation artérielle; elle augmente la postcharge du VD et conduit à une défaillance droite. Les agents d'anesthésie ont des effets relativement modestes sur la circulation pulmonaire, mais ils peuvent avoir une influence dans les situations critiques [10].
- Halogénés: isoflurane et sevoflurane sont associés à une vasodilatation pulmonaire; ils diminuent les RAS (surtout l'isoflurane) et causent une dépression myocardique chez le nouveau-né. Le desflurane potentialise la stimulation sympathique alpha et augmente les RAP.
- Fentanyl: tous les fentanils atténuent la réponse vasoconstrictive au stress sympathique.
- Etomidate, midazolam: pas d'effet sur la vasoactivité pulmonaire.
- Propofol: il abaisse la précharge et les RAS, ce qui pénalise un VD hypertrophié et augmente la composante D-G d'un shunt bidirectionnel, respectivement.
- Kétamine: elle augmente les RAP déjà élevées, mais cet effet est contrecarré en présence d'agents vasodilatateurs pulmonaires.
- Péridurale thoracique: la sympathicolyse freine la réponse inotrope compensatoire à l'HTAP [25].
La prise en charge consiste en hyperventilation (PaCO2 30-35 mmHg), hyperoxie (FiO2 0.8-1.0), correction de l'acidose, inhalation de NO et/ou de prostaglandine et de milrinone (voirHypertension pulmonaire).
Perfusions peropératoires
Comme la CEC représente un apport liquidien massif souvent supérieur au volume circulant de l'enfant, on réduit l'apport intraveineux au minimum.
- Aucune perfusion avant la CEC;
- Correction de la volémie avec de l’albumine ou un colloïde (gélatine);
- Correction de l’hypoglycémie.
S'il est nécessaire d'administrer du volume pour corriger une hypotension, on choisit un colloïde ou une solution d'albumine à 5% (10-15 mL/kg) ou à 20% (5 mL/kg), à répéter au besoin. En cas d’anémie, le choix se porte sur du sang. Le HES 6% et l'albumine 5% sont équivalents en terme de fonction rénale et de morbi-mortalité, mais le HES, dont la toxicité n'est pas démontrée en pédiatrie, entraîne une balance liquidienne moins positive que l'albumine [32]. L'albumine est néanmoins l'agent le plus sûr pour le remplacement de volume circulant.
L'entretien iquidien est assuré par une solution balancée isotonique contenant du sodium et du glucose, car le petit enfant est enclin à l'hyponatrémie en cas d'administration d'eau libre et à l'hypoglycémie en cas de jeûne [33]. Il faut veiller au maintien d'une glycémie suffisante pendant toute l'opération du petit enfant, même si le stress physiologique de la chirurgie provoque une hyperglycémie qui peut entraîner une acidose métabolique, une hyperosmolarité (risque d'hémorragie cérébrale) et une diurèse osmotique. Traditionnellement, on évite l'hyperglycémie en raison de ses possibles effets néfastes sur le système nerveux central lors de bas débit ou d'arrêt circulatoire, mais cette notion n'est pas prouvée lors de la CEC chez l’enfant. En effet, cette aggravation ne paraît pas concerner le nourrisson de moins de 3 mois, car l'immaturité de sa barrière hémato-encéphalique le protège des effets de l'hyperglycémie. En revanche, les effets cérébraux délétères d'une éventuelle hypoglycémie vont s'additionner à ceux de l'hypoperfusion. Or le nouveau-né est à haut risque d'hypoglycémie vu ses pauvres réserves et sa faible néoglucogenèse.
Gestion de la volémie
Une surcharge liquidienne est communément déclenchée par l'hémodilution et la perméabilité capillaire induites par la CEC; les tissus sont oedémateux, les échanges gazeux sont altérés et le poids de l'enfant augmente de 7-15%. La mortalité s'élève parallèlement à cette prise de poids, qui dure en général 2 à 3 jours en postopératoire [4,33]. Les principaux facteurs de risque sont le jeune âge, la durée de CEC, le status clinique et la cyanose [27]. Une surcharge de > 8% est un prédicteur indépendant de prolongation de la ventilation mécanique et de néphropathie aiguë [13]. Une administration liquidienne restrictive est la meilleure prévention contre les risques de la surcharge hydrosodée [26].
Les indices de volémie sont en général classés en deux catégories: indices statiques (PVC, PAPO, StdVG, etc) et indices dynamiques (variations respiratoires en IPPV de la PAsyst, de la Ppulsée, du VS, de la Vmax du flux aortique, du diamètre de la VCI, etc) (voir Chapitre 6 Indices dynamiques et Gestion liquidienne dirigée). Chez l'adulte, la valeur prédictive des premiers pour l'hypovolémie est faible, mais celle des seconds est très élevée. Malheureusement, les deux sont peu performants chez l'enfant, car ceux-ci ont une compliance thoracique, pulmonaire et artérielle très élevée [11]. Seule la variation ventilatoire de la vélocité maximale du flux aortique lorsqu'elle est > 15% semble être un indice fiable d'hypovolémie [17].
La gestion d'une surcharge liquidienne demande un diurétique (furosémide, acide éthacrynique) et une épuration extrarénale (EER) en cas d'échec. Comme la gravité de l'excès liquidien au moment de démarrer l'EER détermine le pronostic, l'indication à celle-ci doit être précoce si les diurétiques n'amènent pas le bénéfice escompté [20].
Transfusion
La consommation d'oxygène du petit enfant est plus élevée que celle de l'adulte (3 fois chez le nourrisson); quelle que soit la saturation, le transport d'oxygène doit être adapté. Il est donc d'autant plus important de maintenir un débit cardiaque optimal et un taux d'hémoglobine adéquat que la saturation est basse. L'hématocrite optimal est situé entre 50 et 60% pour les enfants cyanosés; lorsqu'il est supérieur à 60%, il est judicieux de pratiquer une hémodilution, avec échange volume pour volume selon la formule:
- Volume échangé = [ (Htactuel - Htdésiré) / Htactuel ] • poids • 85 (ml/kg)
Les seuils pour la transfusion sanguine sont restrictifs comme chez l’adulte. La valeur de 80 g/L est un bon repère chez les enfants non-cyanosés [23]. En cas de désaturation artérielle ou d’hypertension pulmonaire sévère, le seuil est relevé à 100 g/L. L’administration de sang est réglée préférentiellement sur la SaO2 et la SvO2 et non sur un taux particulirer d’Hb. La transfusion néonatale impose d’avoir un sang compatible avec celui de la mère, parce que les anticorps maternels passés par le placenta sont détectables jusqu’au 3ème mois après la naissance. Si le groupe de la mère est inconnu, le nourrisson doit recevoir du sang O négatif Kell négatif [23].
Réveil et extubation
Après avoir été l'objet d'un long débat, la durée de la ventilation mécanique postopératoire et le délai pour l’extubation ont tendance à se raccourcir, même chez les nouveau-nés ou lors de pathologies complexes [7,19]. Pour des pathologies identiques, l’extubation sur table ou aux soins intensifs quelques heures plus tard ne présentent pas de différence significative de morbi-mortalité [24]. Elle est possible même pour des situations épineuses [1]. Cependant, les contraintes liées à la cardiopathie et à l’intervention autorisent à définir deux situations différentes.
- Situations inclinant à une extubation rapide (sur table):
- Enfant stable hémodynamiquement, sans hémorragie active ni arythmie;
- Agents d’anesthésie et dosages adaptés à une reprise rapide de la respiration spontanée (fentanyl ≤ 20 mcg/kg, sevoflurane, remifentanil-propofol en perfusion);
- Antalgie facilitée par des blocs et des infiltrations d'anesthésique local;
- Opération sans CEC (coarctation, anastomose cavo-pulmonaire) ou CEC de courte durée sans hypothermie profonde (T° > 30°C), réchauffement adéquat;
- Hémodynamique facilitée par la ventilation spontanée (Glenn, Fontan).
- Situations contre-indiquant a priori une extubation rapide:
- Nouveau-né, prématuré, retard staturo-pondéral, trisomie 21;
- Hypoxémie, atélectasies, insuffisance respiratoire préopératoire;
- CEC prolongée, long clampage aortique, hypothermie profonde;
- Instabilité hémodynamique, insuffisance congestive du VG, hémorragie active;
- Hypertension pulmonaire.
Une extubation rapide (< 2 heures postop) évite les complications liées à la ventilation mécanique (barotraumatisme, infections respiratoires, obstruction du tube endotrachéal); elle autorise une mobilisation précoce, diminue les complications respiratoires et raccourcit la durée de séjour en soins intensifs [1]. Elle est un marqueur d'une bonne maîtrise des problèmes peropératoires et offre l’avantage de faciliter le transport jusqu’à l’unité de surveillance postopératoire. Cependant, l’immobilisation de la salle d’opération le temps du réveil est une perte organisationnelle et financière par rapport à l’extubation dans l’heure qui suit l’arrivée aux soins, car l’heure de salle d’opération coûte plus cher que celle de soins intensifs. Le problème est ensuite d’assurer le confort et l’antalgie de l’enfant sans risquer une hypoventilation ou un arrêt respiratoire: morphine (bolus 0.1 mg/kg iv en fin d’intervention), dexmédétomidine (0.2-0.7 mcg/kg/h), paracétamol intraveineux [15].
Anesthésie loco-régionale rachidienne
Associée à l’anesthésie générale, l’anesthésie loco-régionale (ALR) rachidienne offre trois avantages significatifs (voir Chapitre 4, Anesthésie loco-régionale).
- Inhibition de la réaction de stress supérieure à celle des opiacés intraveineux;
- Facilitation de l’extubation et de la ventilation spontanée postopératoire;
- Amélioration du confort et de l’antalgie.
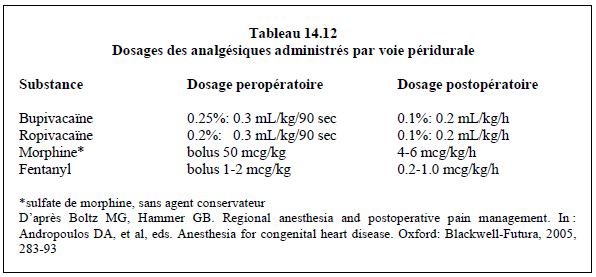
L’hypotension artérielle, un inconvénient majeur de l’ALR rachidienne chez l’adolescent et chez l’adulte, n’apparaît pas chez le petit enfant à cause de l’immaturité de son système sympathique; la fréquence cardiaque ne se modife pas significativement [8]. La dépression respiratoire se manifeste chez l’endant pour des doses de morphine > 0.05 mg/kg en péridurale et > 0.02 mg/kg en intrathécale. Le danger majeur est évidemment le risque d’hématome péridural compressif, particulièrement lorsque les enfants sont anticoagulés pour une CEC. Chez l’adulte, le calcul de ce risque donne une incidence d'hématome péridural de 1:1'2700 à 1:4'000 en chirurgie cardiaque [5,14,18], avec une valeur moyenne probablement de 1:3'550 [16]. Le risque a tout lieu d’être identique chez l’enfant, pour lequel on ne dispose d’aucune donnée précise. Parmi les précautions visant à limiter les risques, le délai d’au moins une heure entre la ponction et l’héparinisation et le retrait du cathéter lorsque la coagulation est normale sont faciles à respecter chez l’enfant. Par contre, il n’est pas possible de poser le cathéter péridural la veillle de l’opération, ni de procéder à la ponction intrathécale avant d’endormir le patient, comme il est recommandé chez l’adulte. La ponction est toujours réalisée après l’induction, sur un enfant endormi [3]. Le cathéter péridural est introduit par ponction caudale (chez le tout petit) ou thoracique D4-D8 (chez l’enfant > 4 ans). Les doses recommandées d’opiacé et d’anesthésique local sont mentionnées dans le Tableau 14.12. Les indications privilégiées à la péridurale sont les interventions par thoracotomie, car celle-ci est plus douloureuse que la sternotomie, et les interventions sans CEC après lesquelles on vise une ventilation spontanée précoce (anastomoses cavo-pulmonaires de Glenn ou de Fontan, par exemple).
Chez les petits, une anesthésie caudale avec de la morphine (70 mcg/kg in 5-10 mL NaCl 0.9% sans préservatif) après l'induction assure une excellente analgésie postopératoire.
Blocs extrarachidiens
Le guidage par ultrasons offre maintenant un accès beaucoup plus sûr aux blocs extrarachidiens profonds ou périphériques. Ceux-ci sont particulièrement utiles pour les thoracotomies; ils permettent de réduire la dose d'opiacés systémiques, autorisent l'extubation sur table et offrent une bonne analgésie postopératoire [21,22].
Chez les petits, une anesthésie caudale avec de la morphine (70 mcg/kg in 5-10 mL NaCl 0.9% sans préservatif) après l'induction assure une excellente analgésie postopératoire.
Blocs extrarachidiens
Le guidage par ultrasons offre maintenant un accès beaucoup plus sûr aux blocs extrarachidiens profonds ou périphériques. Ceux-ci sont particulièrement utiles pour les thoracotomies; ils permettent de réduire la dose d'opiacés systémiques, autorisent l'extubation sur table et offrent une bonne analgésie postopératoire [21,22].
- Bloc du nerf du muscle dentelé antérieur (thoracotomie);
- Bloc des muscles érecteurs du rachis (muscles ilio-costaux, épineux et longissimus dorsi) (thoracotomie);
- Bloc du nerf pectoral médian et latéral (implantation de boîtier de pace-maker, appoint pour thoracotomie).
Différents blocs et des infiltrations locales par l'opérateur en fin d'intervention sont d'un grand secours, car ils sont à la fois efficaces et peu dangereux après une CEC, contrairement à la péridurale.
- Bloc intercostal sous forme d'une infiltration par le chirurgien de bupivacaïne 0,5% (2,5 mg/kg) ou de ropivacaïne 0,2% (3 mg/kg, 2 mg/kg < 1 an) dans les espaces intercostaux;
- Infiltration locale de la cicatrice sternale et du sous-cutané avec de la bupivacaïne ou de la ropivacaïne;
- Bloc paravertébral thoracique unique (single shot) effectué par l'anesthésiste après l’induction ou en fin d’intervention (avant l’extubation);
- Bloc paravertébral continu (48-72 heures) avec perfusion de ropivacaïne 0.2% (0.4 mg/kg/h, 0.2 mg/kg/h < 6 mois); ponction par aiguille de Tuohy 18 G et cathéter dans l'espace paravétébral D5-D6 ou D6-D7 au moins 1 heure avant l'héparinisation de CEC [30].
| Technique d’anesthésie |
|
Situations à bas risque ou inclinant à une extubation rapide (dans les 4 premières heures)
- Opération sans CEC ou CEC de courte durée (< 90 min) sans hypothermie (T° > 34°C)
- Agents d’anesthésie et dosages adaptés à une reprise rapide de la respiration spontanée
- Fentanyl ≤ 20 mcg/kg, sufentanil < 2.5 mcg/kg, sevoflurane/isoflurane/propofol en perfusion
Situations à haut risque nécessitant une ventilation postopératoire
- Enfant en bas âge, retard stauro-pondéral, cyanose importante, HTAP
- CEC prolongée, long clampage aortique, hypothermie profonde
- Instabilité hémodynamique, insuffisance congestive du VG ou du VD
- Fentanyl 50-75 mcg/kg, midazolam
Ventilation : hyper- ou hypoventilation selon que les RAP doivent être basses ou élevées. Vemtilation mécanique de préférence en pression-contrôlée
Vemtilation mécanique de préférence en pression-contrôlée
Restriction hydrosaline (2-4 mL/kg/h selon Ht) Le nourrisson est plus à risque d’hypo- que d’hyperglycémie Les blocs de champ et les infiltrations locales d'anesthésique améliorent l'analgésie postopératoire et permettent une extubation plus rapide (fast-track) |
© BETTEX D, BOEGLI Y, CHASSOT PG, Juin 2008, dernière mise à jour Décembre 2019
Références
- ALGHAMDI AA, SINGH SK, HAMILTON BCS, et al. Early extubation after pediatric cardiac surgery: systematic review, meta-analysis, and evidence-based recommendations. J Card Surg 2010; 25:586-95
- ANDROPOULOS DA. Heart and lung transplantation : anesthetic considerations. In : BISSONNETTE B, edit. Pediatric anesthesia. Basic principles, State of the art, Future. Shelton (CO): People’s Medical Publishing House (USA), 2011, 1792-806
- BOLTZ MG, HAMMER GB. Regional anesthesia and postoperative pain management. In : ANDROPOULOS DA, et al, eds. Anesthesia for congenital heart disease. Oxford: Blackwell-Futura, 2005, 283-93
- BONTANT T, MATROT B, ABDOUL H, et al. Assessing fluid balance in critically ill pediatric patients. Eur J Ped 2015; 174:133-7
- CHAKRAVARTHY M, THIMMANGOWDA P, KRISHNAMURTY J, et al. Thoracic epidural anesthesia in cardiac surgical patients: A prospective audit of 2'113 cases. J Cardiothorac Vasc Anesth 2005; 19:44-8
- CHASSOT PG. Anesthésie en chirurgie cardiaque. In: ECOFFEY C, HAMZA J, MEISTELMAN C. Anesthésiologie pédiatrique. Paris: Flammarion, 1997, 183-202
- DINARDO JA. Con : Extubation in the operating room following pediatric cardiac surgery. J Cardiothorac Vasc Anesth 2011 ; 25 :877-9
- FINKEL JC, BOLTZ MG, CONRAM AM. Hemodynamic changes during spinal anesthesiain children undergoing open heart surgery.Anesth Analg 1998; 86:S400
- FISCHER LG, VAN HAKEN H, BÜRKLE H. Management of pulmonary hypertension: Physiological and pharmacological considerations for anesthesiologists. Anesth Analg 2003; 96:1603-16
- FRIESEN RH, WILLIAMS GD. Anesthetic management of children with pulmonary arterial hypertension. Pediatr Anesth 2008; 18:208-16
- GAN H, CANNESSON M, CHANDLER JR, et al. Predicting fluid responsiveness in children: a systematic review. Anesth Analg 2013; 117:1380-92
- GOTHBERG S, EDBERG KE. Inhaled nitric oxide to newborns and children after congenital heart surgery on cardio-pulmonary bypass. A dose-response study. Scand Cardiovasc J 2000 ; 34 :154-8
- HASSINGER AB, WALD EL, GOODMAN DM. Early postoperative fluid overload precedes acute kidney injury and is associated with higher morbidity in pediatric cardiac surgery patients. Pediatr Crit Care Med 2014; 15:131-8
- HO AM, CHUNG DC, JOYNT GM. Neuraxial blockade and haematoma in cardiac surgery: estimating the risk of a rare adverse event that does not (yet) occured. Chest 2000; 117:551-5
- IODICE FG, THOMAS M, WALKER I, et al. Analgesia in fast-track paediatric cardiac patients. Eur J Cardiothorac Surg 2011 ; 40 :610-3
- LANDONI G, ISELLA F, GRECO T, et al. Benefits and risks of epidural analgesia in cardiac surgery. Br J Anaesth 2015; 115:25-32
- LEE JH, NO HJ, KIM HS, et al. Prediction of fluid responsiveness using non-invasive cardiac output monitor in children undergoing cardiac surgery. Brit J Anaesth 2015; 115:38-44
- MEHTA Y, ARORA D. Benefits and risks of epidural analgesia in cardiac surgery. J Cardiothorac Vasc Anesth 2014; 28:1069-75
- MITTNACHT AJC. Pro : Early extubation following surgery for congenital heart disese. J Cardiothorac Vasc Anesth 2011 ; 25 :874-6
- MODEM V, THOMPSON M, GOLLHOFER D, et al. Timing of continuous renal replacement therapy and mortality in critically ill children. Crit Care Med 2014; 42:943-53
- MONOHAN A, GUAY J, HAJDUK J, et al. Regional analgesia added to general anesthesia compared with general anesthesia plus systemic analgesia for cardiac surgery in children: a systematic review and meta-analysis of randomized clinical trials. Anesth Analg 2019; 128:130-6
- NASR VG, GOTTLIEB EA, ADLER AC, et al. Selcted 2018 highlights in congenital cardiac anesthesia. J Cardiothorac Vasc Anesth 2019; 33:2833-42
- POUARD P, MAURIAT P, LABORDE N, BOURDARIAS B. Cicrulation extracorporelle en chirurgie cardiaque pédiatrique chez le nouveau-né, le nourrisson et l’enfant. In: JANVIER G, LEHOT JJ, eds. Circulation extracorporelle: principes et pratique, 2ème édition. Paris: Arnette (Groupe Liaison SA) 2004, 481-506
- PREISMAN S, LEMBERSKY H, YUSIM Y, et al. A randomized trial of outcomes of anesthetic management directed to very early extubation after cardiac surgery in children. J Cardiothorac Vasc Anesth 2009; 23:348-57
- REX S, MISSANT C, SEGERS P, et al. Thoracic epidural anethsesia impairs the hemodynamic response to acute pulmonary hypertension by deteriorating right ventricular – pulmonary arterial coupling. Crit Care Med 2007; 35:222-9
- RIZZA A, ROMAGNOLI S, RICCI Z. Fluid status assessment and management during perioperative phase in pediatric cardiac surgery patients. J Cardiothorac Vasc Anesth 2016; 30:1085-93
- SEGUIN J, ALBRIGHT B, VERTULLO L, et al. Extent, risk factors and outcome of fluid overload after pediatric heart surgery. Crit Care Med 2014; 42:2591-9
- SLOAN MH, LERMAN J, BISSONNETTE B. Pharmacodynamics of high-dose vecuronium in children during balanced anesthesia. Anesthesiology 1991; 74:656-9
- STAYER SA, HAMMER GB. Airway and ventilatory management. In ANDROPOULOS DB, et al, Eds. Anesthesia for congenital heart disease. Malden (MA): Blackwell Futura (USA), 2005, 266-82
- TAHARA S, INOUE A, SAKAMOTO H, et al. A case series of continuous paravertebral block in minimally invasive cardiac surgery. JA Clin Rep 2017; 3:45
- THORSTEINSSON A, JONMARKER C, LARSSON A, et al. Functional residual capacity in anesthetized children: normal values and values in children with cardiac anomalies. Anesthesiology 1990; 73:876-81
- VAN DER LINDE P, DUMOULIN M, VAN LERBERGHE C, et al. Efficacy and safety of 6% hydroxyethyl starch 130/0.4 (Voluven) for perioperative volume replacement in children undergoing cardiac surgery: a propensity-matched analysis. Crit Care Med 2015; 19:87-97
- WHITING D, YUKI K, DINARDO JA. Cardiopulmonary bypass in the pediatric population. Best Pract Res Clin Anaesthesiol 2015; 29:241-56
