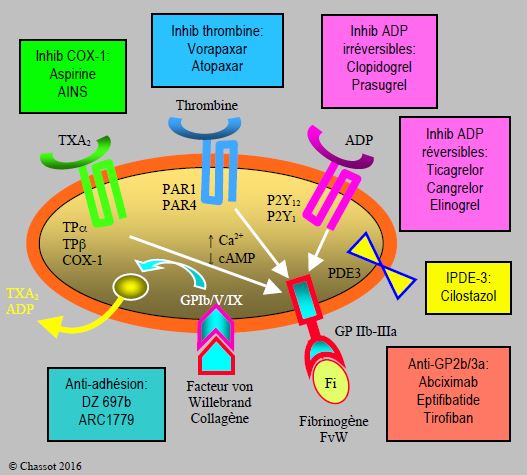
Figure 3.15 : Les différentes catégories d’agents antiplaquettaires, classés selon le récepteur bloqué. Inhib : inhibiteurs. IPDE : inhibiteur des phospho-diestérases. FvW : facteur von Willebrand. Fi : fibrinogène.
- Bloqueur irréversible de la cyclo-oxygénase-1 (COX-1) : aspirine.
- Bloqueurs réversibles de la COX-1 : anti-inflammatoires non-stéroïdiens (AINS).
- Bloqueurs du récepteur ADP (P2Y12) : irréversibles (ticlopidine, clopidogrel, prasugrel) ou réversibles (ticagrelor, cangrelor, elinogrel).
- Antagonistes des récepteurs glycoprotéine (GP) IIb/IIIa : abciximab, tirofiban, eptifibatide.
- Inhibiteur des phosphodiestérases (IPDE) ; IPDE-3 : cilostazol ; IPDE-5 : dipyridamole.
- Bloqueur réversible du récepteur de la thromboxane A2 : terutroban.
- Bloqueurs réversibles du récepteur de la thrombine : vorapaxar, atopaxar.
- Bloqueurs des molécules d’adhésion : DZ697b, ARC1779.
- Type de test utilisé pour juger de l'efficacité de la substances sur l'adhésivité plaquettaire ; avec un test spécifique à la COX-1, par exemple, la prévalence de la résistance à l’aspirine est < 5% [65].
- Génomique : les malades hétérozygotes sur certains récepteurs conservent une agrégabilité plaquettaire marquée sous des doses d'aspirine qui bloquent l'agrégation chez les homozygotes [26]. Il existe un important polymorphisme génétique dans les récepteurs GP IIb/IIIa et dans les variantes CYP2C19 du cytochrome hépatique responsable de la métabolisation du clopidogrel. Les porteurs des allèles commandant des enzymes non-fonctionnels (30% de la population en Occident) ont un risque doublé d'accident cardiovasculaire sous clopidogrel [68,90]. D’autre part, certains tests d’agrégabilité plaquettaire tendent à démontrer que les non-répondeurs à la dose de charge (600 mg), qui représentent environ 15% des coronariens, présentent un risque plus élevé de thrombose de stents et de mortalité à 6 mois par rapport aux patients qui répondent normalement [87,90]. Mais ces modifications génétiques n’expliquent que le 12-20% de la variabilité de réponse au clopidogrel [105].
- Interactions médicamenteuses : plusieurs substances interfèrent avec le métabolisme du clopidogrel et diminuent la production de métabolite actif : statines, bloqueurs calciques, midazolam, cimétidine, inhibiteurs de la pompe à proton [28]. Toutefois, cet effet ne semble être significatif que pour l’atorvastatine et l’oméprazole [72]; d'autre part, les données récentes démontrent que les tests génomiques n’ont pas d’impact sur le devenir à long terme [6].
- Comorbidités : le diabète est accompagné d’une hyperactivité des estérases sériques qui détruisent le clopidogrel.
- Non-compliance du patient : près d’un quart de la population ne prend pas régulièrement ses médicaments ou en modifie la posologie.
- Augmenter les doses de clopidogrel à 150 mg/jour.
- Remplacer le clopidogrel par le prasugrel, une thiénopyridine plus puissante qui présente moins de résistance (≤ 3%), ou par le ticagelor, un antiplaquettaire réversible plus efficace que le clopidogrel et quasi sans résistance.
- Sélectionner le meilleur traitement (stent passif, stent actif ou revascularisation chirurgicale) en fonction de l’agrégabilité plaquettaire du patient (réponse après une dose de charge); les tests d’agrégabilité permettraient de déterminer quels sont les patients résistants, qui ont davantage de risque de thrombose de stent sous clopidogrel.
- Malheureusement, ni l’augmentation des doses de clopidogrel (150 mg/j) ni le passage au prasugrel ne se sont révélés efficaces pour réduire le taux d’infarctus, de thrombose de stent ou de mortalité chez les hyporépondeurs [79].
- Sa biodisponibilité est faible et sa biotransformation variable.
- Son degré d’inhibition plaquettaire n’est que de 40-60%.
- Son effet s’installe lentement et met plus de 5 jours à disparaître.
- Son inhibition plaquettaire est irréversible ; il faut attendre le renouvellement des plaquettes (10%/jour) pour que son effet cesse.
- Son activité antiplaquettaire est sujette à une grande variabilité interindividuelle (12-35% de non-répondeurs).
- Infarctus de type STEMI (effet clinique en < 1 heure).
- SCA/infarctus non-STEMI si PCI certaine (anatomie coronarienne connue, pas de chirurgie).
- SCA, infarctus et PCI chez les diabétiques.
- Stents à haut risque ou anamnèse de thrombose de stent sous clopidogrel.
- Résistance au clopidogrel selon le génotypage ou les tests d’activité plaquettaire.
- Le prasugrel est actuellement en perte de vitesse face au ticagrelor.
- Syndrome coronarien aigu, angor instable, STEMI et NSTEMI.
- PCI en urgence (anatomie coronarienne inconnue).
- SCA présentant une probabilité de revascularisation chirurgicale.
- Prévention secondaire après infarctus.
- L'inhibition plaquettaire est quasi-totale lorsque le récepteur est occupé par le ticagrelor, c’est-à-dire pendant la durée de fixation de la substance et de son métabolite actif, ainsi que pendant la période où les molécules peuvent rediffuser sur de nouvelles plaquettes.
- Bien que réversible, la liaison au récepteur plaquettaire est forte, et dure plus longtemps (environ 3 jours) que la durée de vie plasmatique du ticagrelor et de son métabolite ; ceci repousse le délai de sécurité au-delà de 3 jours.
- Etant fixées de manière réversible sur le récepteur plaquettaire, les molécules de ticagrelor peuvent migrer sur les nouveaux thrombocytes mis en circulation et sur les plaquettes fraîchement transfusées. La transfusion plaquettaire perd ainsi de son efficacité.
- Aux tests d’agrégabilité, les plaquettes ne fonctionnent normalement que 4.5 jours après l’arrêt.
| Les antiplaquettaires |
|
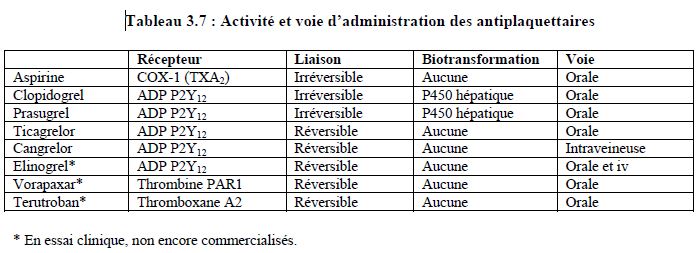
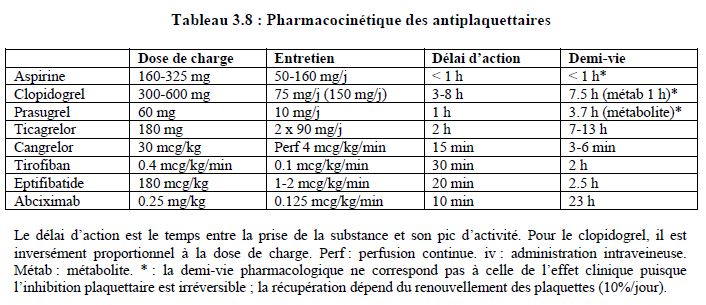
Aspirine : bloqueur irréversible de la COX-1 ; dosage : 50-160 mg/j. Traitement à vie sans interruption (prévention secondaire seulement). Taux de non-répondeurs : 6%. Sauf exceptions, pas d’interruption avant chirurgie ; si l’interruption est indispensable, stop 3-5 jours.
Clopidogrel : thiénopyridine bloquant irréversiblement le récepteur ADP (P2Y12) et réduisant l’agrégation plaquettaire de 40-60%. Métabolisme particulier :
- Faible biodisponibilité et oxydation en un métabolite actif par des cytochromes hépatiques
- Compétition pour ces cytochromes avec de nombreuses substances ; seuls l’atorvastatine et l’oméprazole semblent diminuer l’efficacité clinique
- Demi-vie du clopidogrel 6 heures, demi-vie du métabolite 1-2 heures
- Taux moyen de non-répondeurs : 15%
Administré seul, il a le même effet et le même risque hémorragique que l’aspirine ; en double thérapie (aspirine + clopidogrel), il réduit le risque cardiovasculaire de 36%, mais augmente le risque hémorragique de 2.1%/an. Dose de charge : 300-600 mg, entretien : 75 (150) mg/j. Inconvénients : biotransformation variable, inhibition plaquettaire incomplète mais irréversible, grande variabilité interindividuelle. Durée d’interruption recommandée avant chirurgie : 5 jours.
Anti GP-IIb/IIIa : bloqueurs de la liaison plaquette – fibrinogène d’utilisation très restreinte (syndrome coronarien aigu et de pose de stents à très haut risque) ;
- Abciximab : demi-vie 23 heures
- Eptifibatide : demi-vie 2.5 heures
- Tirofiban : demi-vie 2 heures
Prasugrel : thiénopyridine 10 fois plus puissante que le clopidogrel, bloquant irréversiblement le récepteur ADP (P2Y12) et réduisant l’agrégation plaquettaire de 80%. Métabolisme particulier :
- Métabolisme hépatique stable, indépendant du phénotype ; demi-vie 3.7 heures
- Taux de non-répondeurs faible : 3%
- Durée d’interruption recommandée avant chirurgie : 7 jours
Dose de charge : 60 mg (pic d’activité après 1 heure), entretien : 10 mg/j. Plus efficace que le clopidogrel, mais risque hémorragique plus élevé: hémorragies spontanées 1.5 fois, hémorragie en chirurgie cardiaque 4-5 fois.
Indications: - PCI dans STEMI et/ou diabète si anatomie coronarienne connue
- SCA / infarctus non-STEMI si PCI certaine
- Stents à haut risque, anamnèse de thrombose de stent, résistance au clopidogrel
Contre-indications : malades âgés (> 75 ans) ou de petite taille (< 60 kg), anamnèse d’AVC, risque hémorragique élevé.
Ticagrelor : inhibiteur direct (pas de biotransformation) et réversible du récepteur ADP (P2Y12) ; réduction de l’agrégation plaquettaire > 90%.
- Installation et disparition rapides de l’effet : 3 jours après l’arrêt, inhibition résiduelle 20%
- Durée d’interruption avant chirurgie : 5 jours (possibilité de 3 jours si urgence)
Dose de charge : 180 mg, entretien : 2 x 90 mg/jour. Plus efficace que le clopidogrel, risque hémorragique semblable.
Indications: - Premier choix pour SCA, PCI et stents en urgence (anatomie coronarienne inconnue)
- STEMI et NSTEMI
- Potentielle revascularisation chirurgicale
Contre-indications : bronchospasme, BPCO, bloc AV, insuffisance rénale, patient non-compliant.
Cangrelor : bloqueur direct et réversible du récepteur ADP, très puissant (> 95% d’inhibition plaquettaire) et très rapide : pic d’activité 15 min après le démarrage de la perfusion, demi-vie : 9 min ; disparition de l’effet en < 1 heure. Il est efficace et très manipulable en remplacement du prétraitement par clopidogrel ou ticagrelor en cas de SCA (perfusion intraveineuse). Il est efficace comme substitution préopératoire de substances à longue durée d’action (durée de la perfusion : 3-5 jours, arrêt 1-3 heures préopératoires).
|
- 2 semaines après angioplastie avec ballon simple.
- 24 semaines après angioplastie avec ballon à élution.
- 4 semaines après stents passifs (BMS), mais 12 mois en cas de SCA;
- 12 mois après l’implantation de stents actifs (DES) de 1ère génération.
- 6 mois après implantation de DES de 2-3ème génération si coronaropathie stable; possibilité de raccourcir à 1-3 mois en cas de risque hémorragique élevé.
- 12 mois après implantation de DES de 2-3ème génération si SCA; possibilité de raccourcir à 6 mois en cas de risque hémorragique élevé.
- 12 mois après implantation de DES biorésorbables.
- 12 mois en cas de SCA, avec ou sans implantation de stent et quel que soit le type de DES.
- > 12 mois dans les stents à haut risque ou les situations complexes, si le risque ischémique est élevé et si le risque hémorragique est faible (voir Tableau 29.6).
- Les anti-GP IIb/IIIa sont cantonnés au sauvetage pendant 48 h dans les stents à très haut risque;
- L'aspirine (50-100 mg/j) est maintenue à vie sans interruption.
- Le ticagrelor est le médicament de première intention dans le SCA, l'infarctus et la PCI.
- Si le risque hémorragique est élevé (anamnèse d'hémorragie digestive ou cérébrale, coagulopathie, anémie, anticoagulation simultanée, etc), il est souhaitable de restreindre la bithérapie à sa durée minimale et de prescrire plutôt du clopidogrel.

- Angioplastie sans stent 2-4 semaines (ballon simple)
6 mois (ballon à élution) - Stents passifs (BMS)
- Chirurgie vitale 6 semaines
- Chirurgie élective 3 mois
- Pontages aorto-coronariens
- Chirurgie vitale 6 semaines
- Chirurgie élective 3 mois
- Stents actifs (DES 1ère génération, DES biorésorbable)*
- Chirurgie vitale 6 mois (sous bi-thérapie)
- Chirurgie élective 12 mois
- Stents actifs (DES 2ème et 3ème génération)
- Chirurgie vitale 1-3 mois (sous bi-thérapie)
- Chirurgie élective 3-6 mois**

| Traitement antiplaquettaire |
|
Après un événement cardiovasculaire ischémique (SCA, infarctus, PCI et pose de stent, pontages aorto-coronariens, AVC, occlusion artérielle), l’aspirine est prescrite à vie et ne doit jamais être interrompue.
La bi-thérapie (aspirine + clopidogrel ou prasugrel ou ticagrelor) est prescrite pendant :
- 2 semaines après angioplastie au ballon simple, 24 semaines si ballon à élution
- 4-6 semaines après stents passifs (BMS) (coronaropathie stable)
- 12 mois après l’implantation de stents actifs (DES) de 1ère génération
- 3-6 mois après implantation de DES de 2-3ème génération (coronaropathie stable)
- 12 mois après syndrome coronarien instable (SCA) avec ou sans revascularisation et quel que soit le type de stent
- > 12 mois en cas de DES à haut risque ou d’anamnèse de thrombose de stent, au prix d’une augmentation du risque hémorragique à long terme
Des durées plus courtes, concevables dans des situations stables en cardiologie, ne sont pas transposables à la situation à haut risque d’une intervention chirurgicale.
Délais entre la revascularisation et une intervention chirurgicale :
- Opération vitale : 6 semaines après BMS ou PAC, 3-6 mois après DES (sous bi-thérapie et selon le type de stent)
- Opération élective : 3 mois après BMS ou PAC, 6-12 mois après DES
|
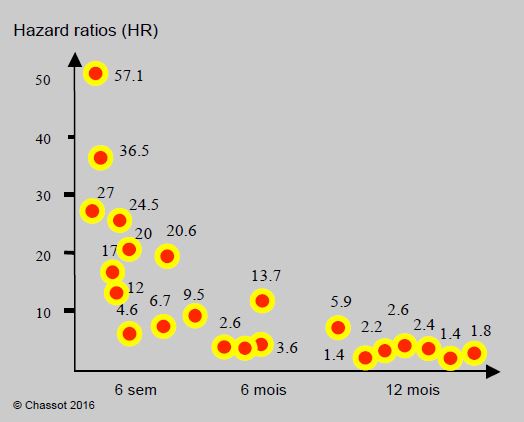
Figure 3.16 : Représentation graphique du risque (HR hazard ratio) de thrombose de stent, d’infarctus, d’AVC et de décès lié à l’interruption du clopidogrel, en fonction du délai entre la pose de stent et l’arrêt de ce dernier (données de 20 études différentes). Les données sont assez disparates selon les études. Elles montrent néanmoins que l’interruption de la bithérapie est associée à des accidents cardio-vasculaires quelle que soit la durée du traitement, mais que la corrélation devient faible au-delà de 6-12 mois (incidence 1-2%) alors qu’elle est maximale pendant les 6 premières semaines et significative pendant les 6 premiers mois.
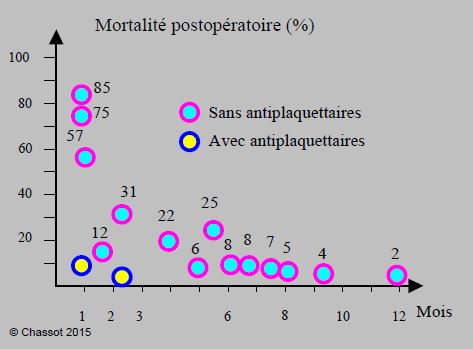
Figure 3.17 A : Mortalité des complications cardiovasculaires post-opératoires chez les patients porteurs de stents coronariens dont le traitement antiplaquettaire a été interrompu avant une opération non-cardiaque, en fonction du délai entre la revascularisation et la chirurgie. Courbe construite à partir de 14 études observationnelles (29’941 patients) [34]. Deux d’entre elles ont des données comparatives pour les malades opérés sous antiplaquettaires (points jaunes) ; leur mortalité est de 5% et de 0%. Dans une seule étude [52], l’arrêt ou la continuation des antiplaquettaires ne crée pas de différence, mais les 2/3 de ses cas relèvent d'une chirurgie mineure ambulatoire.
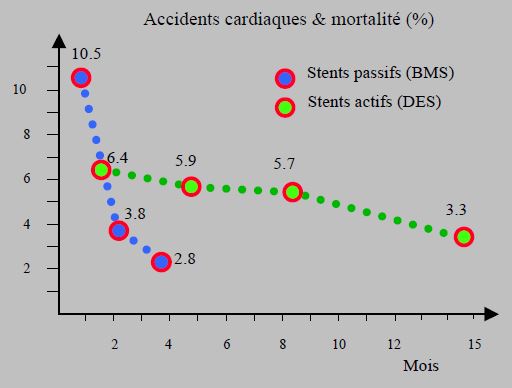
Figure 3.17 B : Incidence des accidents cardiaques (infarctus ou thrombose de stent) et de la mortalité postopératoire globale en fonction du délai entre la revascularisation (stents passifs et stents actifs de 1ère génération) et la chirurgie non-cardiaque [75,81]. La mortalité secondaire à la thrombose de stent est respectivement de 50% et de 65% pour les DES et les BMS.
L'accélération des délais avec les DES de nouvelle génération ne doit pas balayer le principe de précaution qui prévaut dans les situations à risque. En effet, avec une mortalité moyenne de 25% et un taux d’infarctus jusqu’à 60% [58], la thrombose de stent sur arrêt périopératoire des antiplaquettaires est un évènement extrêmement dangereux, même s’il est moins fréquent qu’on ne l’a cru. Dans une situation chirurgicale, le risque est aggravé par la phase d'hypercoagulabilité postopératoire, et par le taux de complication cardiaque propre à l'intervention. A cela s'ajoute l'effet rebond sur l'aggrégabilité plaquettaire lors de l'interruption de la bithérapie, même en cas de continuation de l'aspirine. Le risque de thrombose augmente de 2 à 3 fois dans les semaines qui suivent cet arrêt [58,66,69]. De ce fait, il est conseillé de respecter un décalage d'environ un mois entre la fin de l'inhibition P2Y12 et une chirurgie élective. Il apparaît donc que seules des situations exceptionnelles peuvent justifier l’interruption des antiplaquettaires (chirurgie en espace clos ou très hémorragique). Sans eux, la situation passe d’un état correspondant à une coronaropathie stable à un état de coronaropathie instable [23,34].
| Interruption des agents antiplaquettaires |
|
L’arrêt des antiplaquettaires est un facteur indépendant majeur de risque cardiovasculaire et le principal déclencheur de la thrombose de stent, tout particulièrement pendant les 6 premiers mois après implantation. La mortalité de la thrombose de stent est en moyenne 25%. Le délai moyen entre l’interruption des antiplaquettaires et l’accident thrombotique est de 7-9 jours. Le risque est d’autant plus élevé qu’on est proche de l’événement coronarien ; il est maximal pendant les 6 premières semaines. Entre 6 et 12 semaines après BMS ou PAC, et entre 6 et 12 mois après DES, le risque est intermédiaire. Il correspond à celui d’une coronaropathie stable > 3 mois après BMS ou PAC et > 12 mois après DES (probablement > 3-6 mois avec les DES de nouvelles générations).
A cause de la réaction inflammatoire systémique, de l’activation plaquettaire et de l'inhibition de la fibrinolyse liées au stress opératoire, la situation est encore plus grave en périopératoire. La mortalité de la thrombose de stent y est en moyenne de 40%. L’incidence d’accidents cardiovasculaires est maximale pendant les 6 premières semaines qui suivent le SCA et/ou la pose de stent (risque 20-40 fois plus élevé qu'après 6 mois). Pour les DES de 1ère génération, le risque reste élevé pendant 12 mois; pour les DES de nouvelle génération, cette durée est de 3-6 mois.
Suspendre les antiplaquettaires en préopératoire transforme une coronaropathie stabilisée en syndrome instable. Seules des situations exceptionnelles peuvent justifier l’interruption des antiplaquettaires. Si le clopidogrel, le prasugrel ou le ticagrelor sont arrêtés, l’aspirine doit être maintenue.
|
| Risque hémorragique peropératoire sur antiplaquettaires |
|
L’aspirine augmente de 3-20% le risque hémorragique peropératoire.
La combinaison aspirine + clopidogrel augmente de 20-50% le risque hémorragique, mais n’augmente pas la mortalité ni la morbidité opératoires, sauf en cas de :
- Chirurgie en espace clos (crâne, canal rachidien, chambre postérieure de l’œil)
- Chirurgie très hémorragique avec hémostase difficile
Le prasugrel augmente de 2-4 fois le risque hémorragique, alors que le ticagrelor ne semble pas le modifier ; toutefois, on ne dispose pas de données sur ces deux substances en chirurgie non-cardiaque.
|
- Augmentation du risque hémorragique de 20% (aspirine) à 60% (aspirine + clopidogrel) sans modification de la mortalité chirurgicale, à l'exception des situations à risque hémorragique excessif (chirurgie en espace clos, opération avec pertes sanguines massives et hémostase difficile).
- Augmentation inconstante du taux de transfusion ; mais le taux de complications liées à la transfusion n'est que de 0.4-1.3% à court terme [19,70] et 16% à long terme [95]. Par contre, la transfusion en elle-même élève le risque de mortalité (HR 5.3), d’infarctus (HR 2.7) et d’ictus (HR 2.5) lors du syndrome coronarien aigu, parce qu'elle augmente l'agrégabilité plaquettaire [40,56,89].
- L'incidence des accidents ischémiques, variable selon l'importance de l'acte opératoire, est similaire à celle des malades coronariens stabilisés : taux d'infarctus 2-6%, mortalité 1-5% [21].
- Effet rebond avec hyperadhésivité plaquettaire ; la réaction inflammatoire post-chirurgicale et le syndrome de stress augmentent la réactivité des thrombocytes et abaissent la fibrinolyse. De plus, certaines pathologies (diabète, carcinomes) sont accompagnés d’une hypercoagulabilité.
- Lorsque le patient a souffert d’un SCA, le taux d’infarctus est de 1-2% par jour pendant la durée de l’interruption des antiplaquettaires [60].
- En peropératoire, le taux de SCA et d’AVC est augmenté 3 à 9 fois [2,96].
- Pendant la phase de ré-endothélialisation des stents coronariens, l'incidence moyenne d'infarctus postopératoire est de 35% [81,86].
- La mortalité moyenne de la thrombose de stent périopératoire s’élève jusqu’à 25% ; cela correspond à une augmentation de 10 fois de la mortalité cardiaque postopératoire [41,59]. La reperméabilisation d'un axe coronarien en urgence dans le postopératoire est plus difficile et plus dangereuse que la transfusion de quelques poches de sang en peropératoire.
- Chirurgie dans une cavité fermée (chambre postérieure de l'œil, canal rachidien, crâne).
- Intervention chirurgicale majeure accompagnée d’hémorragie massive et d’hémostase difficile.

| Antiplaquettaires en périopératoire (I) |
|
D’une manière générale, le risque hémorragique sous antiplaquettaire est nettement moins important que le risque ischémique lié à leur interruption. Font exception :
- Chirurgie en espace clos (crâne, canal rachidien, chambre postérieure de l’œil)
- Chirurgie très hémorragique avec hémostase difficile
Durée de l’interruption des antiplaquettaires (si nécessaire) :
- Aspirine 3-5 jours
- Clopidogrel 5 jours
- Ticagrelor 3 jours; si risque hémorragique élevé, stop 5 jours
- Prasugrel 7 jours
|
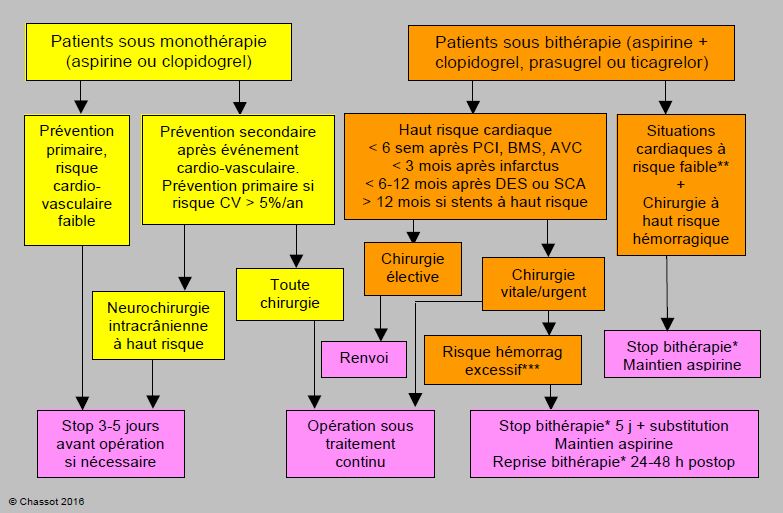
Figure 3.18: Proposition d'algorithme de prise en charge des patients sous traitement antiplaquettaire préopératoire [22,23,34]. BMS : bare metal stent (stent passif). DES : drug-eluting stent (stent actif). AVC : accident vasculaire cérébral. SCA: syndrome coronarien aigu. PCI: Percutaneous Coronary Intervention. CV : cardiovasculaire. Le clopidogrel seul est l’équivalent de l’aspirine seule. Dosage de l’aspirine : 50-325 mg/j. * : les mêmes prescriptions s’appliquent au clopidogrel, au prasugrel et au ticagrelor à l’exception des délais d’interruption : clopidogrel 5 jours, ticagrelor 5 jours, prasugrel 7 jours. ** : Exemples de situations à risque faible: absence de SCA, > 3 mois après stents passifs ou PCI sans stents, > 6 mois après DES 2ème génération, infarctus ou ictus non compliqués, > 12 mois après DES 1ère génération. *** : Risque hémorragique excessif : chirurgie en espace clos (neurochirurgie intracrânienne, chirurgie du canal médullaire, chirurgie de la chambre postérieure de l'œil), présence de coagulopathie, chirurgie invasive accompagnée d’hémorragie massive et d’hémostase difficile. Dans ces situations, le rapport risque / bénéfice doit être évalué au cas par cas. Stents à haut risque: stents proximaux, multiples, malapposés, bifurqués ou en succession, situations où le vaisseau stenté dessert un vaste territoire myocardique, patients ayant déjà thrombosé des stents précédents, stents pour SCA. Substitution du clopidogrel/prasugrel/ticagrelor : perfusion d’eptifibatide ou de tirofiban 3-5 jours préop, stop 6 heures avant l’opération, reprise dans les 6-12 heures postopératoires; maintien de l’aspirine en continu. En cas d’arrêt, les antiplaquettaires doivent être repris dans les 24-48 heures après l’intervention, éventuellement avec une dose de charge pour le clopidogrel (300 mg), mais non pour le prasugrel ni le ticagrelor.
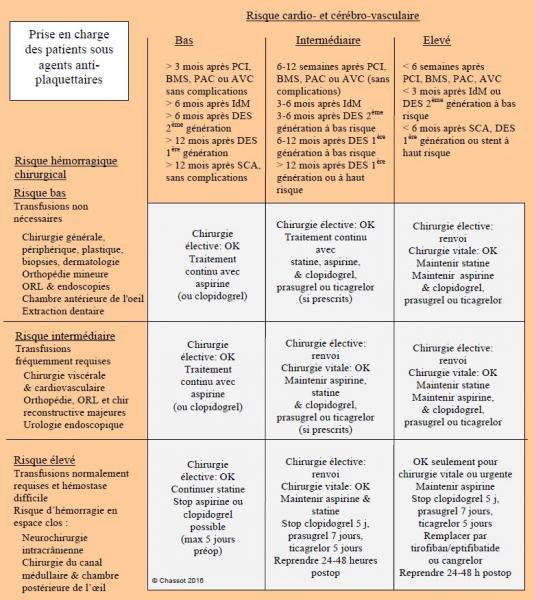
Figure 3.19: Prise en charge détaillée des patients sous antiplaquettaires en chirurgie non-cardiaque [modifié de 22]. BMS : stents passifs. DES : stents actifs. IdM : infarctus du myocarde. PCI : percutaneous coronary intervention. SCA : syndrome coronarien aigu.
- Patient sous aspirine en prévention primaire simple:
- Stop aspirine 5 j avant l’intervention, si nécessaire.
- Patient sous aspirine (ou clopidogrel seul) en prévention primaire à haut risque (diabète I, risque d’accident cardiovasculaire > 7.5%/10 ans) ou en prévention secondaire après accident vasculaire cérébral (AVC), infarctus du myocarde (IdM), stent coronarien, artériopathie des membres inférieurs, pontage aorto-coronarien (PAC), syndrome coronarien aigu (SCA); bithérapie déjà interrompue depuis > 1 mois:
- Poursuivre sans interruption le traitement d’aspirine (ou de clopidogrel).
- Patients sous aspirine/dipyridamole après AVC : poursuivre les deux médicaments.
- Exception: cas à haut risque hémorragique (neurochirurgie intracrânienne, chirurgie complexe et hémostase difficile).
- Patient sous aspirine + clopidogrel/prasugrel/ticagrelor, mais risque cardio- et cérébro-vasculaire modéré (4-12 semaines après AVC, angioplastie coronaire, stent passif ou PAC, 3-6 mois* après IdM sans complications ou stent actif (DES) 2ème génération, 6-12 mois* après SCA, DES 1ère génération ou DES biorésorbable):
- Poursuivre le traitement d’aspirine.
- Opération à faible risque hémorragique: continuer la bithérapie en périopératoire.
- Opération à haut risque hémorragique: stop ticagrelor 3-5 jours**, clopidogrel 5 jours, prasugrel 7 jours avant l’intervention.
- Reprendre la bi-thérapie dans les 24-48 heures, avec une dose de charge*** si le risque hémorragique le permet: Aspegic™ 250 mg + 150 mg/j ; clopidogrel 300 mg + 75 mg/j ; prasugrel 10 mg/j ; ticagrelor 90 mg 2x/j.
- Patient sous aspirine + clopidogrel/prasugrel/ticagrelor, avec risque cardio- et cérébro-vasculaire élevé (< 4 semaines après AVC, angioplastie simple, stent passif ou PAC, 4-12 semaines* après IdM ou stent actif 2ème génération, < 6 mois après SCA, stent actif 1ère génération, DES biorésorbable, ou davantage si stent à très haut risque).
- Chirurgie élective:
- Renvoi à 1 mois après angioplastie simple.
- Renvoi à 3 mois après AVC, angioplastie au ballon à élution, stent passif ou PAC.
- Renvoi à 6 mois après IdM ou stent actif 2ème génération.
- Renvoi à 12 mois après SCA, stent actif 1ère génération, DES biorésorbable ou IdM avec complications.
- Après ces délais : maintenir l’aspirine ; si clopidogrel/prasugrel/ticagrelor encore prescrits, discuter avec le cardiologue pour l’arrêt ou le maintien avant l’intervention en fonction du risque thrombotique et du risque hémorragique de la chirurgie.
- Chirurgie urgente ou vitale:
- Maintien de l'aspirine et du clopidogrel/prasugrel/ticagrelor.
- Renvoi à 1 mois après DES de 2ème-3ème génération.
- Renvoi à 3-6 mois* après SCA, DES de 1ère génération, DES biorésorbable.
- Après AVC/AIT, maintien de l’aspirine/dipyridamole, mais arrêt du clopidogrel (sauf < 1 mois après stents carotidiens).
- Substitution du clopidogrel/prasugrel/ticagrelor par tirofiban, eptifibatide ou cangrelor en cas d’intervention à risque hémorragique très élevé ou de coagulopathie (voir ci-après).
- L’héparine est inefficace comme substitution des antiplaquettaires.
- Patient avec stent (quel qu'en soit le type) ou SCA depuis < 4 semaines: aucune opération envisageable.
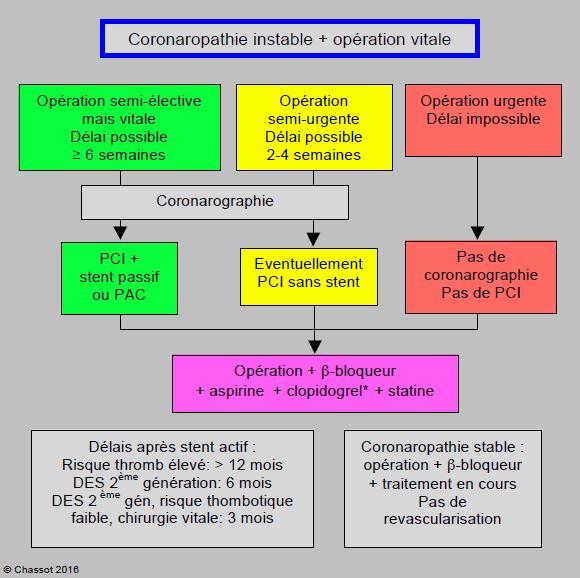
Figure 3.20 : Algorithme d'évaluation du patient souffrant de maladie coronarienne instable devant subir une intervention urgente ou vitale (exemples: anévrysme, tumeur, fracture invalidante, drainage d'abcès, obstruction ou infection digestive). Syndrome coronarien instable : angor instable (stade IV), angor de repos ou persistant, non-réactivité aux nitrés, modification récente de la symptomatologie angineuse, période précoce (6-12 semaines) après revascularisation. PCI : angioplastie coronarienne percutanée. BMS: stent passif. DES: stent actif. PAC: pontage aorto-coronarien chirurgical. PCI sans stent: angioplastie simple.
- L'opération peut attendre au moins 3 mois. Les DES de nouvelles générations sont parfaitement envisageables avec 3 mois de bithérapie. Il est prudent de respecter un délai de quelques semaines entre l'arrêt de la bithérapie et l'intervention pour éviter la phase de l'effet rebond pendant laquelle le patient est hypercoagulable. L'aspirine est maintenue sans interruption.
- L’opération peut être renvoyée de 6-8 semaines. Ceci permet de procéder à une PCI avec pose de stents passifs (BMS) et à une bithérapie antiplaquettaire de 4 semaines, ou à des pontages aorto-coronariens (prescription d’aspirine mais non de bithérapie); l’opération est planifiée à > 6 semaines après la revascularisation. Cette attitude va se modifier au vu de résultats récents tendant à démontrer que les BMS ne semblent plus forcément préférables au DES dans ce contexte, car même avec une bithérapie raccourcie à 1 mois certains DES de nouvelles générations (Biolimus A9 sans polymère) offrent un avantage en terme de mortalité et de thrombose de stent par rapport aux BMS (HR 0.71) [5,44,98]. Cette attitude, adoptée dans les situations à très haut risque hémorragique, n'a pas encore été testée dans le périopératoire où la phase d'hypercoagulabilité peut poser un grave problème; elle est toutefois une potentielle solution d'avenir dans certains cas complexes, notamment pour la chirurgie intervenant entre 1 et 3 mois après la revascularisation.
- Le délai possible pour l’intervention non-cardiaque n’est que de 2-4 semaines. En cas de flux coronaire très instable, de sténose très proximale (tronc commun) ou de vaste zone de myocarde à risque, on peut envisager une angioplastie au ballon simple sans pose de stent. En effet, les données dont on dispose montrent que l’incidence de décès et d’infarctus liés à la chirurgie non-cardiaque pratiquée 2-4 semaines après angioplastie simple est la même que 3 mois plus tard [15]. Bien que de nombreux cardiologues y soient réticents à cause de l’imprévisibilité des résultats, cette attitude est une stratégie défendable pour revasculariser des patients qui doivent être opérés dans de brefs délais. La seule alternative est l’abstention de toute manoeuvre.
- Si l’opération doit avoir lieu dans les 24-72 heures, aucune revascularisation n’est souhaitable ; une coronarographie est inutile parce que ses conclusions ne modifieront pas le choix thérapeutique. Tout au plus, une échocardiographie transthoracique pourra déterminer la fonction ventriculaire et la présence d’éventuelles valvulopathies qui influenceront le choix de la technique d’anesthésie. Dans de rares cas de chirurgie vasculaire, on peut envisager une intervention combinant simultanément des PAC et la chirurgie non-cardiaque [59].
| Antiplaquettaires en périopératoire (II) |
|
Aspirine ou clopidogrel en prévention primaire : stop 3-5 jours
Aspirine ou clopidogrel en prévention secondaire : pas d’interruption
Aspirine + clopidogrel/ticagrelor/prasugrel, risque cardiovasculaire bas : continuer aspirine, interrompre clopidogrel/ticagrelor 5 jours, prasugrel 7 jours
Aspirine + bithérapie, risque cardiovasculaire élevé, chirurgie élective :
- Renvoi à 3 mois après AVC, BMS, PAC
- Renvoi à 6-12 mois après infarctus
- Renvoi à 6 mois après DES 2ème – 3ème génération
- Renvoi à 12 mois après DES 1ère génération ou syndrome coronarien aigu (SCA)
- Continuer l’aspirine sans interruption
Aspirine + bithérapie, risque cardiovasculaire élevé, chirurgie vitale :
- Maintenir aspirine + bithérapie
- Si arrêt nécessaire clopidogrel/prasugrel, éventuelle substitution avec eptifibatide ou tirofiban
Risque clopidogrel seul = risque aspirine seule
Prasugrel : mêmes prescriptions que pour le clopidogrel, mais arrêt 7 jours préopératoires car risque hémorragique plus élevé
Ticagrelor: arrêt 3-5 jours selon risque hémorragique et risque ischémique
Les antiplaquettaires sont repris dans les 24 heures postopératoires, éventuellement avec une dose de charge de clopidogrel lorsque l’interruption est de ≥ 5 jours. Les patients à risque doivent être opérés dans une institution disposant de toutes les facilités pour pratiquer une angioplastie coronarienne en urgence.
|
| Anesthésie rachidienne et antiplaquettaires |
|
L'ALR rachidienne n'étant pas une technique indispensable, il est de rigueur d'être très prudent dans ses indications, notamment en respectant des délais prolongés après l'arrêt des substances qui modifient la coagulation (risque d'hématome spinal). D'autre part, le risque d'occlusion de stent ou de thrombose vasculaire est beaucoup plus élevé (morbi-mortalité 20-35%) que le bénéfice attendu d'une ALR rachidienne. L’interruption des antiplaquettaires prescrits en prévention secondaire est injustifiée dans le seul but de pratiquer une rachianesthésie ou une péridurale, car le taux de complications cardiovasculaires de cet arrêt est largement supérieur au bénéfice escompté de la loco-régionale.
Délais d'interruption du traitement antiplaquettaire recommandés pour procéder à une anesthésie rachidienne (rachianesthésie ou péridurale):
- Aspirine si ≤ 300 mg/j : pas d'interruption; si > 300 mg/j: arrêt 5 jours
- Clopidogrel 5-7 jours
- Aspirine + clopidogrel 7 jours
- Prasugrel 7-10 jours
- Ticagrelor 5-7 jours
- Cilostazol 3-5 jours
- Abciximab 3-5 jours
- Tirofiban, eptifibatide 8 heures
Par sécurité, il est prudent d'appliquer les mêmes délais à tous les blocs nerveux, à l'exception des blocs superficiels périphériques.
|
| Transfusion plaquettaire |
|
Théoriquement, les plaquettes fraîches ou transfusées fonctionnent normalement dès que le taux plasmatique des antiplaquettaires devient négligeable après 3 demi-vies :
- Clopidogrel 24 heures
- Prasugrel 12 heures
- Ticagrelor 38-72 heures
- Tirofiban, eptifibatide 6-8 heures
- Abciximab 72 heures
Ceci est vrai pour les bloqueurs irréversibles (clopidogrel, prasugrel, aspirine et abciximab), avec lesquels il faut attendre le renouvellement des plaquettes (10% par jour) pour obtenir une normalisation de la coagulation. Avec les antiplaquettaires à effet réversible (ticagrelor, tirofiban, eptifibatide), un délai de 3 demi-vies n’est pas suffisant, car ces substances ont la capacité de diffuser entre les plaquettes en fonction de l’équilibre de masse, de se lier aux nouveaux thrombocytes mis en circulation, et de migrer sur les plaquettes fraîchement transfusées, réduisant ainsi l’efficacité de la transfusion plaquettaire.
Moyens thérapeutiques en cas d’hémorragie excessive sous antiplaquettaires :
- Transfusion de plaquettes
- Acide tranexamique (2 gm)
- Desmopressine (0.3 mcg/kg)
- Complexe prothrombinique, fibrinogène, facteurs de coagulation selon défauts
- Mesure de sauvetage (contestée): facteur rVIIa (20 mcg/kg)
Il est capital d’éviter la normalisation de la fonction thrombocytaire, car elle augmente dangereusement le risque thrombotique chez les malades sous antiplaquettaires. Les patients à risque élevé de thrombose vasculaire doivent être maintenus dans un état d’hypocoagulabilité volontaire. La transfusion plaquettaire ne doit pas être prescrite à titre de prophylaxie, mais seulement en fonction du degré d’hémorragie. |
| Ischémie postopératoire |
| La thrombose de stent/rupture de plaque instable provoque un infarctus STEMI avec choc cardiogène nécessitant une revascularisation de toute urgence. Les patients à risque doivent donc être opérés dans une institution disposant de toutes les facilités pour pratiquer une angioplastie coronarienne en urgence. |
© CHASSOT PG, DELABAYS A, SPAHN DR, Mars 2010, dernière révision Août 2019
- ALBALADEJO P, CHARBONNEAU H, SAMAMA CM, et al. Bleeding complications in patients with coronary stents during non-cardiac surgery. Thromb Res 2014; 134:268-72
- ALBALADEJO P, MARRET E, SAMAMA CM, et al. Non-cardiac surgery in patients with coronary stents: the RECO study. Heart 2011; 97:1566-72
- ANGIOLILLO DJ, BHATT DL, GURBEL PA JENNINGS LK. Advances in antiplatelet therapy: agents in clinical development. Am J Cardiol 2009; 103(suppl):40A-51A
- ANGIOLILLO DJ, FIRSTENBERG MS, PRICE MJ, et al. Bridging antiplatelet therapy with cangrelor in patients undergoing cardiac surgery. JAMA 2012; 307:265-74
- ARIOTTI S, ADAMO M, COSTA F, et al. Is bare-metal stent implantation still justifiable in high bleeding risk patients undergoing percutaneous coronary intervention ?: a pre-sèecified analysis from the ZEUX trial. JACC Cardiovasc Interv 2016; 9:426-36
- BAUER T, BOUMAN HJ, VAN WERKUM JW, et al. Impact of CYP2C19 variant genotypes on clinical efficacy of antiplatelet treatment with clopidogrel: systematic review and meta-analysis. Br Med J 2011; 343:d4588
- BERGER JS, FRYE CB, HARSHAW Q, et al. Impact of clopidogrel in patients with acute coronary syndromes requiring coronary artery bypass surgery. J Am Coll Cardiol 2008; 52:1693-701
- BERNLOCHNER I, MORATH T,BROWN PB, et al. A prospective randomized trial comparing the recovery of platelet function after loading dose administration of prasugrel or clopidogrel. Platelets 2013; 24:15-25
- BHATT DL, STONE GW, MAHAFFEY KW, et al. Effect of platelet inhibition with cangrelor during PCI on ischemic events. N Engl J Med 2013; 368:1303-13
- BIODI-ZOCCAI GGL, LOTRIONTE M, AGOSTINI P, et al. A systematic review and meta-analysis on the hazards of discontinuing or not adhering to aspirin among 50 279 patients at risk for coronary artery disease. Eur Heart J 2006; 27:2667-74
- BITTL JA, BABER U, BRADLEY SM, et al. Duration of dual antiplatelet therapy: ACC/AHA Guideline focused update on duration of dual antiplatelet therapy in patients with coronary artery disease. J Am Coll Cardiol 2016; 68: 1116-39
- BONHOMME F, FONTANA P, RENY JL. How to manage prasugrel and ticagrelor in daily practice. Eur J Intern Med 2014; 25:213-20
- BREEN P, LEE JW, POMPOSELLI F, PARK KW. Timing of high-risk vascular surgery following coronary artery bypass surgery: A 10-year experience from an academic medical centre. Anaesthesia 2004; 59:422-7
- BRILAKIS ES, COHEN DJ, KLEIMAN NS, et al. Incidence and clinical outcome of minor surgery in the year after drug-eluting stent implantation: results from the Evalvuation of Drug-Eluting Stents and Ischemic Events Regiostry. Am Heart J 2011; 161:360-6
- BRILAKIS ES, ORFORD JL, FASSEAS P, et al. Outcome of patients undergoing balloon angioplasty in the two months prior to noncardiac surgery. Am J Cardiol 2005, 96: 512-4
- BURGER W, CHEMNITIUS JM, KNEISSL GD, RÜCKER G. Low-dose aspirin for secondary cardiovascular prevention – cardiovascular risks after its preoperative withdrawal versus bleeding risks with its continuation – review and meta-analysis. J Int Med 2005; 257:399-414
- CANNON CP, HARRINGTON RA, JAMES S, et al. Comparison of ticagrelor with clopidogrel in patients with a planned invasive strategy for acute coronary syndromes (PLATO): a randomized double-blind study. Lancet 2010; 375:283-93
- CAPODANNO D, ALFONSO F, LEVINE GN, et al. ACC/AHA versus ESC Guidelines on dual antiplatelet therapy. JACC guideline comparison. J Am Coll Cardiol 2018; 72:2915-31
- CARSON JL, TRIULZI DJ, NESS PM. Indications for and adverse effects of red-cell transfusion. N Engl J Med 2017; 377:1261-72
- CATTANEO M. New P2Y12 inhibitors. Circulation 2010; 121:171-9
- CHASSOT PG, DELABAYS A, SPAHN DR. Preoperative evaluation of patients with, or at risk of, coronary artery disease undergoing non-cardiac surgery. Brit J Anaesth 2002; 89:747-59
- CHASSOT PG, DELABAYS A, SPAHN DR. Perioperative antiplatelet therapy: the case for continuing therapy in patients at risk of myocardial infarction. Br J Anaesth 2007; 99:316-28
- CHASSOT PG, MARCUCCI C, DELABAYS A, SPAHN DR. Perioperative antiplatelet therapy. Am Fam Physician 2010; 82:1484-9
- COLLET JP, CUISSET T, RANGE G, et al. Bedside monitoring to adjust antiplatelet therapy for coronary stenting. N Engl J Med 2012; 367:2100-9
- COLOMBO A, GIANNINI F, BRIGUORI C. Should we still have bare-metal stents available in our catheterization laboratory ? J Am Coll Cardiol 2017; 70:607-19
- COOKE GE, LIU-STRATTON Y, KERKETICH AK et al. Effect of platelet antigen polymorphism on platelet inhibition by aspirin, clopidogrel, or their coombination. J Am Coll Cardiol 2006; 47:541-6
- CUELLAR JM, PETRIZZO A, VASWANI R, et al. Does aspirin administration increase perioperative morbidity in patients with cardiac stents undergoing spinal surgery ? Spine 2015; 40:629-35
- CUISSET T, FRERE C, QUILICI J, et al. Comparison of omeprazole and pantoprazole influence on a high 150 mg clopidogrel maintenance dose. J Am Coll Cardiol 2009; 54:1149-53
- D’ASCENZO F, BOLLATI M, CLEMENTI F, et al. Incidence and predictors of coronary stent thrombosis: Evidence from an international collaborative meta-analysis including 30 studies, 221’066 patients, and 4276 thromboses. Int J Cardiol 2013; 167:575-84
- DE LUCA G, DIRKSEN MT, SPAULDING C, et al. Drug-eluting stents vs bare-metal stents in primary angioplasty. A pooled patient-level meta-analysis of randomized trials. Arch Intern Med 2012; 172:611-21
- DE MARTINO RR, BECK AW, HOEL AW, et al. Preoperative antiplatalet and statin treatment was not associated with reduced myocardial infarction after High-risk vascular opérations in the Vascular Quality Initiative. J Vasc Surg 2016; 63:182-9
- DEVEREAUX PJ, MRKOBRADA M, SESSLER DI, et al. Aspirin in patients undergoing noncardiac surgery. N Engl J Med 2014 ; 370 :494-503
- DOUKETIS JD, SPYROPOULOS AC, SPENCER FA, et al. Perioperative management of antithrombotic therapy : Antithrombotic therapy and prevention of thrombosis, 9th ed. American College of Chest Physicians Evidence-Based Clinical Practice Guidelines, Chest 2012 ; 141 (2 suppl) : e326S-50S
- EBERLI D, CHASSOT PG, SULSER T et al. Urologic surgery and antiplatelet drugs after cardiac and cerebrovascular accidents. J Urol 2010; 183:2128-36
- EISENBERG MJ, RICHARD PR, LIBERSAN D, et al. Safety of short-term discontinuation of antiplatelet therapy in patients with drug-eluting stents. Circulation 2009; 119:1634-42
- EGHOLM G, KRISTENSEN SD, THIM T, et al. Risk associated with surgery within 12 months after coronary drug-eluting stent implantation. J Am Coll Cardiol 2016; 68:2622-32
- ESPRIT Study Group. Aspirin plus dipyridamole versus aspirin alone after cerebral ischemia of arterial origin (ESPRIT): randomized, controlled trial. Lancet 2006; 367:1665-73
- FERES F, COSTA RA, ABIZAID A, et al. Three vs twelve months of dual antiplatelet therapy after zotarolimus-eluting stents. The OPTIMIZE randomized trial. JAMA 2013; 310:2510-22
- FERRARI E, BENHAMOU M, CERBONI P, MARCEL B. Coronary syndromes following aspirin withdrawal: a special risk for late stent thrombosis. J Am Coll Cardiol 2005; 45:456-9
- FERRARIS VA, DAVENPORT DL, SAHA SP, et al. Surgical outcomes and transfusion of minimal amounts of blood in the operating room. Arch Surg 2012; 147:49-55
- FERRARIS VA, SAHA SP, OESTREICH JH, et al. 2012 update to the Society of Thoracic Surgeons Guidelines on use of antiplatelet drugs in patients having cardiac and noncardiac operations. Ann Thorac Surg 2012 ; 94 :1761-81
- FINTEL DJ. Oral antiplatelet therapy for atherothrombotic disease: overview of current and emerging treatment options. Vasc Health Risk Manag 2012; 8:77-89
- FLEISHER LA, FLEISCHMANN KE, AUERBACH AD, et al. 2014 ACC/AHA Guideline on perioperative cardiovascular evaluation and management of patients undergoing noncardiac surgery: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. Circulation 2014; 130:e278-e333
- GAROT P, MORICE C, TRESURKOSOL D, et al, for the LEADERS FREE Invsetigators. 2-year outcomes of high bleeding risk patients after polymer-free drug-coated stents. J Am Coll Cardiol 2017; 69:162-71
- GERSTEIN NS, GERSTEIN WH, CAREY MC, et al. The thrombotic and arrhythmogenic risks of perioperative NSAIDs. J Cardiothorac Vasc Anesth 2014; 28:369-78
- GODET G, RIOU B, BERTRAND M, et al. Does preoperative coronary angioplasty improve perioperative cardiac outcome ? Anesthesiology 2005; 102:739-46
- GURBEL PA, BLIDEN KP, BUTLER K, et al. Randomized double-blind assessment of the ONSET and OFFSET of the antiplatelet effects of ticagrelor versus clopidogrel in patients with stable coronary artery disease. Circulation 2009; 120:2577-85
- GURBEL PA, BLIDEN KP, BUTLER K, et al. Response to ticagrelor in clopidogrel nonresponders and responders and effect of switching therapies. The RESPOND study. Circulation 2010; 121:1188-99
- GWON HC, HAHN JY, PARK KW, et al. Six-month versus 12-month dual antiplatelet therapy after implantation of drug-elunting stents (EXCELLENT study). Circulation 2012 ; 125 :505-13
- HACKAM DG, GOODMAN SG, ANAND SS. Management of risk in peripheral artery disease: recent therapeutic advances. Am Heart J 2005; 150:35-40
- HANSSON EC, HAKIMI CS, ARSTRÖM-OLSSON K, et al. Effects of ex vivo platelet supplementation on platelet aggregability in blood samples from patients treated with acetylsalicylic acid, clopidogrel, or ticagrelor. Br J Anaesth 2014; 112:570-5
- HAWN MT, GRAHAM LA, RICHMAN JS; et al. Risk of major adverse cardiac events following noncardiac surgery in patients with coronary stents. JAMA 2013; 310:1462-72
- IAKOVOU I, SCHMIDT T, BONIZZONI E, et al. Incidence, predictors, and outcome of thrombosis after successful implantation of drug-eluting stents. JAMA 2005; 293 :2126-30
- JAMBOR C, VON PAPE KW, SPANNAGL M, et al. Multiple Electrode whole blood Aggregometry, PFA-100, and in vivo Bleeding Time for the point-of-care assessment of aspirin-induced platelet dysfunction in the preoperative setting. Anesth Analg 2011; 113:31-9
- JEGER RV, PFISTERER ME, SEORENSEN R, et al. Tradeoff between bleeding and stent thrombosis in different dual antiplatelet therapy regimes: importance of case fatality rates and effective treatment durations. Am Heart J 2014; 168:698-705
- KAMEL H, JOHNSTON C, KIRKHAM JC, et al. Association between major perioperative hemorrhage and stroke or Q-wave myocardial infarction. Circulation 2012; 126:207-12
- KORTE W, CATTANEO M, CHASSOT PG, et al. Perioperative management of antiplatelet therapy in patients with coronary artery disease. Thromb Haemost 2011; 105:743-9
- KOVACIC JC, LEE P, KARAJGIKAR R, et al. Safety of temporary and permanent suspension of antiplatelet therapy after drug eluting stent implantation in contemporary "real-world" practice. J Interven Cardiol 2012; 25:482-92
- KRISTENSEN SD, KNUUTI J, SARASTE A, et al. 2014 ESC/ESA Guidelines on non-cardiac surgery: cardiovascular assessment and management. Eur Heart J 2014; 35:2383-431
- KUNADIAN B, THOMLEY AR, TANOS M, DUNNING J. Should clopidogrel be stopped prior to urgent surgery ? Interact Cardiovasc Thorac Surg 2006; 5:630-6
- LEE TH, MARCANTONIO ER, MANGIONE CM, ET AL. Derivation and prospective validation of a simple index for prediction of cardiac risk of major noncardiac surgery. Circulation 1999; 100:1043-9
- LEV EI, PATEL RT, MARESH KJ, et al. Aspirin and clopidogrel drug response in patients undergoing percutaneous coronary intervention. The role of dual drug resistance. J Am Coll Cardiol 2006; 47:27-33
- LEVINE GN, BATES ER, BITTL JA, et al. 2016 ACC/AHA Guideline focused update on duration of dual antiplatelet therapy in patients with coronary artery disease. J Am Coll Cardiol 2016; 68:1082-115
- MAHLA E, SUAREZ TA, BLIDEN KP, et al. Platelet function measurement-based strategy to reduce bleeding and waiting time in clopidogrel-treated patients undergoing coronary artery bypass graft surgery. Circ Cardiovasc Interv 2012; 5:261-9
- MARIN F, GONZALES-GONEJERO R, CAPRANZANO P, et al. Pharmacogenetics in cardiovascular antithrombotic therapy. J Am Coll Cardiol 2009; 54:1041-57
- MAURI L, KEREIAKES DJ, YEH RW, et al. Twelve or 30 months of dual antiplatelet therapy after drug-eluting stents. N Engl J Med 2014; 371:2155-66
- McFALLS EO, WARD HB, MORITZ TE, et al. Coronary artery revascularization before elective major vascular surgery. N Engl J Med 2004; 351:2795-804
- MEGA JL, CLOSE SL, WIVIOTT SD, et al. Cytochrome P450 polymorphisms and response to clopidogrel. N Engl J Med 2009; 360:354-62
- MEHRAN R, BABER U, STEG PG, et al. Cessation of dual antiplatelet treatment and cardiac events after percutaneous coronary interventions. PARIS: 2 years results from a prospective observational study. Lancet 2013; 382:1714-22
- MICHLIG C, VU DH, WASSERFALLEN JB, et al. Three years of haemovigilance in a general university hospital. Transfus Med 2003; 13:63-72
- MONTALESCOT G, BOLOGNESE L, DUDEK D, et al. Pretreatment with prasugrel in non-ST segment elevation acute coronary syndromes. N Engl J Med 2013; 369:999-1010
- MOUKARBEL GV, BHATT DL. Antiplatelet therapy and proton pump inhibition: clinician update. Circulation 2012; 125:375-80
- MURPHY SA, ANTMAN EM, WIWIOTT SD, et al. Reduction in recurrent cardiovascular events with prasugrel compared with clopidogrel in patients with acute coronary syndromes from the TRITON-TIMI 38 trial. Eur Heart J 2008; 29:2473-9
- NEWSOME LT, WELLER RS, GERANCHER JC, et al. Coronary artery stents: II. Perioperative considerations and management. Anesth Analg 2008; 107:570-90
- NUTALL GA, BROWN MJ, STOMBAUGH JW, et al. Time and cardiac risk of surgery after bare-metal stent percutaneous coronary intervention. Anesthesiology 2008; 109:588-95
- O'CONNOR SA, AMOR J, MERCADIER A; et al. Efficacy of ex vivo autologous and in vivo platelet transfusion in the reversal of P2Y12 inhibition by clopidogrel, prasugrel and ticagrelor. The APTITUDE study. Circ Cardiovasc Inetrv 2015; 8:e002786
- OPREA AD, POPESCU WM. ADP-receptor inhibitors in the perioperative period: the Good, the Bad and the Ugly. J Cardiothorac Vasc Anesth 2013; 27: 779-95
- PALMERINI T, BIONDI-ZOCCAI G, DELLA RIVA D, et al. Stent thrombosis with drug-eluting and bare-metal stents: evidence from a comprehensive network analysis. Lancet 2012; 379.1393-402
- PRICE MJ, BERGER PB, TEIRSTEIN PS, et al. Standard- vs high-dose clopidogrel based on platelet function testing after percutaneous coronary intervention. The GRAVITAS randomized trial. JAMA 2011; 305:1097-105
- PRICE MJ, WALDER JS, BAKER BA, et al. Recovery of platelet function after discontinuation of prasugrel or clopidogrel maintenance dosing in aspirin-treated patients with stable coronary disease. J Am Coll Cardiol 2012; 59:2338-43
- RABBITTS JA, NUTALL GA, BROWN MJ, et al. Cardiac risk of noncardiac surgery after percutaneous coronary intervention with drug-eluting stents. Anesthesiology 2008;109: 596-604
- ROSSINI R, MUSUMECI G, CAPODANNO D, et al. Perioperative management of oral antiplatelet therapy and clinical outcomes in coronary stent patients undergoing surgery. Results of a multicentre registry. Thromb Haemost 2015; 113:272-82
- SAVONITTO S, D’URBANO M, CARACCIOLO M, et al. Urgent surgery in patients with a recently implanted coronary drug-eluting stent: a phase II study of “bridging” antiplatelet therapy with tirofiban during temporary withdrawal of clopidogrel. Br J Anaesth 2010; 104:285-91
- SCHULTZ S, SCHUSTER T, MEHILL J, et al. Stent thrombosis after drug-eluting stent implantation: incidence, timing, and relation to discontinuation of clopidogrel therapy over a 4-year period. Eur Heart J 2009; 30:2714-21
- SERRUYS PW, KUTRYK MJB, ONG ATL. Coronary artery stents. N Engl J Med 2006; 354:483-95
- SHARMA AK, AJANI AE, HAMWI SM, et al. Major noncardiac surgery following coronary stenting: When is it safe to operate ? Catheter Cardiovasc Interv 2004; 63:141-5
- SIBBING D, BRAUN S, MORATH T, et al. Platelet reactivity after clopidogrel treatment assessed with point-of-care analysis and early drug-eluting stent thrombosis. J Am Coll Cardiol 2009; 53:849-56
- SIDDIQI O, FAXON DP. Very late stent thrombosis: current concepts. Curr Opin Cardiol 2012; 27:634-41
- SILVAIN J, ABTAN J, KEMEIS M, et al. Impact of red blood cell transfusion on platelet agregation and inflammatory response in anemic coronary and noncoronary patients: the TRANSFUSION-2 study. J Am Coll Cardiol 2014; 63:1289-96
- SIMON T, VERSTUYFT C, MARY-KRAUSE M, et al. Genetic determinants of response to clopidogrel and cardiovascular events. N Engl J Med 2009; 360:411-3
- SOUSA-UVA M, STOREY R, HUBER K, et al. Expert position paper on the management of antiplatelet therapy in patients undergoing coronary artery bypass graft surgery. Eur Heart J 2014; 35:1510-4
- SPERTUS JA, KETTELKAMP R, VANCE C, et al. Prevalence, predictors, and outcomes of premature discontinuation of thienopyridine therapy after drug-eluting stent placement. Circulation 2006; 113:2803-9
- STETTLER C, WANDEL S, ALLEMAN S, et al. Outcomes associated with drug-eluting and bare-metal stents: A collaborative network meta-analysis. Lancet 2007; 370:937-48
- STONE DH, GOODNEY PP, SCHANZER A, et al. Clopidogrel is not associated with major bleeding complications during peripheral arterial surgery. J Vasc Surg 2011; 54:779-84
- SURGENOR SD, KRAMER RS, OLMSTEAD EM, et al. The association of perioperative red blood cell transfusions and decreased long-term survival after cardiac surgery. Anesth Analg 2009; 108:1741-1746
- TAYLOR K, FILGATE R, GUO DY, et al. A retrospective study to assess the morbidity associated with transurethral prostatectomy in patients on antiplatelet or anticoagulant drugs. BJU Inter 2011 ; 108(S1):45-50
- TOMSIC A, SCHOTBORGH MA, MANSHANDEN JSJ, et al. Coronary artery bypass grafting-related bleeding complications in patients treated with dual antiplatelet treatment. Eur J Cardio-Thorac Surg 2016; 50:849-56
- URBAN P, MEREDITH IT, ABIZAID A, et al for the LEADERS FREE Investigators. Polymer-free drug-coated coronary stents in patients at high bleeding risk. N Engl J Med 2015; 373:2038-47
- VALGIMIGLI M, BUENO H, BYRNE RA, et al. 2017 ESC focused update on dual antiplatelet therapy in coronary artery disease developed in collaboration with EACTS. Eur Heart J 2018; 39:213-54
- VALGIMIGLI M, CAMPO G, MONTI M, et al (PRODIGY Investigators). Short- versus long-term duration of dual antiplatelet therapy after coronary stenting: a randomized, multi-center trial. Circulation 2012; 125:2015-26
- VAN KUIJK JP, FLU WJ, SCHOUTEN O, et al. Timing of noncardiac surgery after coronary artery stenting with bare metal or drug-eluting stents. Am J Cardiol 2009; 104:1229-34
- VICENZI MN, MEISLITZER T, HEITZINGER B, et al. Coronary artery stenting and non-cardiac surgery – a prospective outcome study. Br J Anaesth 2006; 96:686-93
- WALLENTIN L. P2Y12 inhibitors: differences in properties and mechanisms of action and potential consequences for clinical use. Eur Heart J 2009; 30:1964-77
- WALLENTIN L, BECKER RC, BUDAJ A, et al. Ticagrelor versus clopidogrel in patients with acute coronary syndromes. N Engl J Med 2009; 361:1045-57
- WANG L, McLEOD HL, WEINSHILBOUM RM. Genomics and drug response. N Engl J Med 2011; 364:1144-53
- WASOWICZ M, SYED A, WIJEYSUNDERA DN et al. Effectiveness of platelet inhibition on major adverse cardiac events in noncardiac surgery after percutaneous coronarxy intervention: a prospective cohort study. Br J Anaesth 2016; 116:493-500
- WEINTRAUB WS, SPERTUS JA, KOLM P, et al. Effect of PCI on quality of life in patients with stable coronary disease. N Engl J Med 2008; 359:677-87
- WIJEYSUNDERA DN, WIJEYSUNDERA HC, YUN L, et al. Risk of elective major noncardiac surgery after coronary stent insertion. A population-based study. Circulation 2012; 126:1355-62
- WIJNS W, KOHL P, DANCHIN N, et al. Guidelines on myocardial revascularization. The Task Force on myocardial revascularization of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J 2010; 31:2501-55
- WIN HK, CALDERA AF, MARESH K, et al. Clinical outcomes and stent thrombosis following off-label use of drug-eluting stents. JAMA 2007; 297:2001-9
- WINCHESTER DE, WEN X, BREARLEY WD, et al. Efficacy and safety of glycoprotein IIb/IIIa inhibitors during elective coronary revascularization: A meta-analysis of randomized trials performed in the era of new stents and thienopyridines. J Am Coll Cardiol 2011; 57:1190-9
- WINDECKER S, KOHL P, ALFONSO F, et al. 2014 ESC/EACTS Guidelines on myocardial revascularization. Eur Heart J 2014; 35:2541-619
- WIVIOTT SD, BRAUNWALD E, MCCABE CH, et al. Prasugrel versus clopidogrel in patients with acute coronary syndromes. N Engl J Med 2007; 357:2001-15
