L'anévrisme est un élargissement localisé de plus de 50% par rapport au diamètre normal de l’aorte à cet endroit, sacculaire ou fusiforme, dont la paroi est constituée des trois couches normales, amincies et soumises à d'autant plus de tension que le diamètre est agrandi (loi de Laplace) [9,10]. Il peut se rencontrer sur toutes les portions de l'aorte (Vidéo et Figure 18.11).
Vidéo: Vue court-axe d'un anévrysme de l'aorte descendante; présence d'un thrombus mural et de contraste spontané tournoyant, à cause du ralentissement du flux.
Vidéo: Vue court-axe d'un anévrysme de l'aorte descendante; présence d'un thrombus mural et de contraste spontané tournoyant, à cause du ralentissement du flux.
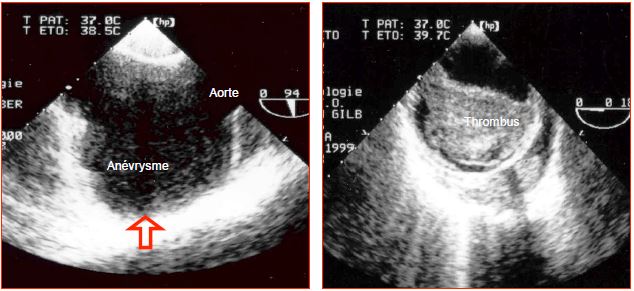
Figure 18.11 : Images ETO d'anévrysmes de l'aorte thoracique. A: anévrysme sacculaire localisé de la crosse de l'aorte. La partie proximale est à gauche de l'écran. B: thrombus intraluminal dans un anévrysme de l'aorte descendante (diamètre 6.5 cm).
Chez les adultes en bonne santé, le diamètre maximal de l'aorte ascendante ne dépasse pas 4.0 cm; il est plus grand chez l'homme que chez la femme; il augmente avec la taille corporelle, l'hypertension artérielle et l'âge (0.8 cm/10 ans) [4,7,12]. Les dimensions maximales tolérables de l’aorte (dilatation non chirurgicale) sont 4.5 cm pour la portion ascendante, 4.0 cm pour la crosse et 3.5 cm pour la descendante. L’indication opératoire est posée pour un diamètre > 5.5 cm dans l’aorte ascendante et la crosse (> 5.0 cm en cas de syndrome de Marfan) et > 6 cm dans l’aorte descendante [5,7,9] ; l’évolution vers la rupture est plus lente dans la descendante que dans l’ascendante. L'incidence est d'environ 400 cas pour 100'000 autopsies, et jusqu'à 670 pour 100'000 au-delà de 80 ans ; l’incidence des anévrysmes abdominaux est d’environ 2.5% au-delà de 65 ans [1,16]. La répartition anatomique est la suivante [2]:
- Aorte ascendante: 50 % des cas;
- Aorte descendante: 30 % des cas;
- Crosse de l'aorte: 10 % des cas;
- Aorte thoraco-abdominale: 10 % des cas.
Une dilatation de moins de 50% du diamètre normal est une ectasie. Le pseudo-anévrysme est une disruption pariétale avec extravasation de sang dans une poche dont la paroi n’est constituée que par l’externa et le tissu adventiciel périaortique [9]. Lorsqu’il s’étend vers les sinus de Valsalva et la valve aortique, l’anévrysme provoque une insuffisance aortique (IA) par dilatation de l’anneau ; cette IA peut être majeure (Vidéos et Figure 18.12).
Vidéo: Dilatation massive de la racine de l'aorte et de l'aorte ascendante dans un syndrome de Marfan, accompagnée d'une insuffisance majeure de la valve aortique.
Vidéo: Dilatation sphérique de la racine de l'aorte dans un cas de syndrome de Marfan.
Vidéo: Dilatation massive de la racine de l'aorte et de l'aorte ascendante dans un syndrome de Marfan, accompagnée d'une insuffisance majeure de la valve aortique.
Vidéo: Dilatation sphérique de la racine de l'aorte dans un cas de syndrome de Marfan.
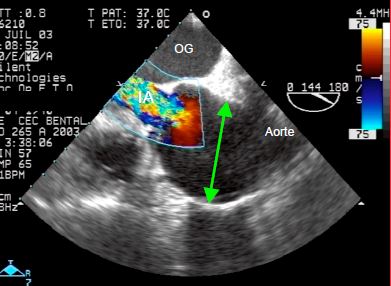
Figure 18.12 : Anévrysme de l’aorte ascendante chez un malade souffrant de syndrome de Marfan (ETO, vue long-axe). L’aorte est très dilatée (diamètre 6 cm, double flèche verte); l’anneau aortique est également dilaté et la valve fuit massivement. L’insuffisance aortique (IA) se manifeste par un large flux tourbillonnaire multicolore diastolique dans la chambre de chasse (IA sévère).
Il existe plusieurs étiologies à un anévrysme aortique [14].
- Artériosclérose: 60% des cas (dans les cas d'anévrismes abdominaux, la proportion est de 95%); en général fusiformes, ils sont situés le plus souvent sur l'aorte descendante et thoraco-abdominale.
- Dissection aortique (15% des cas): en cas de non-rupture, la paroi amincie de la fausse lumière se dilate progressivement.
- Médianécrose d’origine génétique (Marfan, Ehlers-Danlos): défaut de synthèse de la glycoprotéine appelée fibrilline, qui est un des éléments du tissu élastique de la média [6]; une bicuspidie et/ou une insuffisance valvulaire aortique sont fréquemment associées. La chirurgie est préférable à l'endoprothèse dans ces cas, car la maladie continue à dilater l'aorte autour de l'endogreffe [5].
- Aortite (syphilis, maladies granulomateuses, PCE, maladies de Takayashu, de Kawasaki, de Behcet, de Reiter): 10% des cas; en général sacculaires, situés le plus souvent sur l'aorte ascendante ou sur la crosse.
- Rupture traumatique (10% des cas): en cas de survie, l'hématome pariétal est circonscrit par l'adventice et le tissu médiastinal péri-aortique (faux-anévrisme); il se dilate progressivement. La localisation est en général à l'isthme, juste après le départ de l'artère sous-clavière gauche.
- Anévrisme mycotique: endocardite chronique, immunosuppression, abus de drogues intraveineuses.
Les facteurs le plus souvent associés sont la fumée (risk ratio : 5.0), l'âge et l'hypertension. Spontanément, les anévrysmes augmentent de dimensions à raison de 0.1 – 0.4 cm par an [8,9]. Ceux de la crosse ont la croissance la plus rapide; les abdominaux sont les plus lents (0.28 cm/an). Globalement, le taux de rupture est de 23% [11]. Lorsqu'ils ont plus de 6 cm de diamètre, leur risque de rupture est cinq fois plus élevé [15]. La probabilité de rupture est de 43% à 1 an et de 100% à 5 ans lorsque l'anévrysme mesure plus de 6 cm et que le patient est hypertendu ou porteur d’une bicuspidie [3].
La symptomatologie est celle de douleurs thoraciques ou abdominales, dues à la dilatation ou à l'érosion osseuse d'une vertèbre sous-jacente. Les symptômes d'appel les plus fréquents sont liés à la compression de structures du voisinage; on peut rencontrer une raucité de la voix (lésion du nerf récurrent gauche), un syndrome de Horner (compression du ganglion stellaire), une atélectasie ou une pneumonie lobaire (compression bronchique), une dysphagie (compression de l'oesophage), un oedème en pèlerine (compression de la veine cave supérieure), une hémoptysie ou une hématémèse (rupture en viscère creux). Il arrive qu'on ausculte un thrill ou qu'on palpe une masse pulsatile, ou que les pouls périphériques soient asymétriques, mais beaucoup de cas sont des découvertes fortuites chez des malades asymptomatiques. L'évolution naturelle est la rupture, d'autant plus rapide que l'anévrisme est grand; après diagnostic, la survie est de 40% à deux ans pour les anévrysmes thoraciques et de 65% pour les anévrysmes abdominaux [13].
Comme l'incidence d'artériosclérose et d'HTA est très élevée dans ce type de lésion aortique, l'aortographie et la coronarographie sont nécessaires avant une sanction chirurgicale. L'indication opératoire est posée sur la persistance de la douleur, sur l’importance de l’insuffisance aortique, sur l'accroissement progressif du diamètre (≥ 0.4 cm/an), ou à partir d'un diamètre de 5.5 cm (aorte ascendante) à 6.0 cm (aorte descendante). Une fuite hémorragique est évidemment une indication à intervenir d'urgence [5].
| Anévrysme de l’aorte thoracique |
|
Définition : dilatation localisée de > 50% du diamètre normal à cet endroit. Dimensions normales de l’aorte :
- Racine de l’aorte 3.5 – 4.0 cm (+ IA majeure)
- Aorte ascendante (partie tubulaire) 2.9 – 3.6 cm (IA fréquente)
- Crosse 2.5 – 2.8 cm
- Aorte descendante 2.4 – 2.9 cm
- Aorte abdominale 2.0 – 2.7 cm
Indications opératoires en cas d’anévrysme : - Aorte ascendante > 5.5 cm (> 5.0 cm en cas de syndrome de Marfan)
- Aorte descendante > 6.0 cm
- Elargissement > 0.4 cm/an
- Douleurs, compression, facteurs de risque (Marfan)
- Insuffisance aortique majeure
|
© CHASSOT PG, TOZZI P, BETTEX D, Octobre 2010, Dernière mise à jour, Décembre 2019
Références
- BANOUB M, KAGAN-KOEPKE T, SHENAQ S. Anesthesia for thoracic aortic surgery. In: ESTEFANOUS FG, ed. Cardiac anesthesia: Principles and clinical practice. Philadelphia: J.B.Lippincott Co, 1994, pp 545-95
- BICKERSTAFF LK, PAIROLERO PC, HOLLIER LH et al. Thoracic aortic aneurysms: A population-based study. Surgery 1982; 92:1103-10
- CRONENWETT JL, MURPHY TF, ZELENOCK GB, et al. Actuarial analysis of variables associated with rupture of small abdominal aortic aneurysms. Surgery 1985; 98:472-83
- DEVEREUX RB, DE SIMONE G, ARNETT DK, Normal limits in relation to age, body size and gender of two-dimensional echocardiographic aortic root dimensions in persons ≥15 years of age. Am J Cardiol 2012; 110:1189-94
- ERBEL R, ABOYANS V, BOILEAU C, et al. 2014 ESC Guidelines on the diagnosis and treatment of aortic diseases. Eur Heart J 2014; 35:2873-926
- FRANCKE U, FURTHMAYR H. Genes and gene products involved in Marfan syndrome. Semin Thorac Cardiovasc Surg 1993; 5:3-10
- GOLDSTEIN SA, EVANGELISTA A, ABBARA S, et al. Multimodality imaging of diseases of the thoracic aorta in adults: from the American Society of Echocardiography and the European Association of CardioVascular Imaging. J Am Soc Echocardiogr 2015; 28:119-82
- GRIEPP RB, ERGIN MA, LANSMAN SL, GALLA JD. The natural history of thoracic aortic aneurysms. Semin Thorac Cardiovasc Surg 1991; 3:258-65
- HIRATZKA LF, BAKRIS GL, BECKMAN JA, et al. 2010 ACCF/AHA/AATS/ACR/ASA/SCA/SCAI/ SIR/STS/SVM Guidelines for the diagnosis and management of patients with thoracic aortic disease: Executive summary. Circulation 2010:121:1544-79
- JOHNSTON KW, RUTHERFORD RB, TILSON MD, et al. Suggested standards for reporting an arterial aneurysm. J Vasc Surg 1991; 13:452-8
- JUVONEN T, ERGIN MA, GALLA JD, et al. Prospective study of the natural history of thoracic aortic aneuvrysms. Ann Thorac Surg 1997; 63:1533-45
- KALSCH H, LEHMANN N, MOHLENKAMP S, et al. Body-surface adjusted aortic reference diameters for improved identification of patients with thoracic aortic aneurysms: results from the population-based Heinz Nixdorf Recall study. Int J Cardiol 2013; 163:72-78
- KIRKLIN JW, BARRAT-BOYES BG. Cardiac Surgery, 2nd edition, New-York: Churchill-Livingstone 1993, p 74
- OCHSONOR J, ANCALMO N. Descending thoracic aortic aneuvrysms. Chest Surg Clin N Am 1992; 2:291
- PATEL HJ, DEEB GM. Ascending and arch aorta. Pathology, natural history and treatment. Circulation 2008; 118:188-95
- SVENSJO S, BENGTSSON H, BERGQVIST D. Thoracic and thoracoabdominal aortic aneurysm and dissection: an investigation based on autopsy. Br J Surg 1996; 83:68-71
