Une valvuloplastie, qui est faisable dans au moins 60% des insuffisances valvulaires, présente plusieurs avantages par rapport à une prothèse [10,28,31].
- Absence d’anticoagulation.
- Préservation de la fonction ventriculaire (la géométrie du ventricule et l’intégrité de l’appareil sous-valvulaire sont préservées après plastie mitrale ou tricuspidienne); régression du remodelage ventriculaire dû à l'insuffisance mitrale.
- Risques thrombo-emboliques et infectieux (endocardite) très faibles.
- Risque de détérioration structurelle quasi inexistant.
- Possibilité de croissance de la valve chez l’enfant et l’adolescent.
- Morbi-mortalité 2-4 fois plus basse que celle du remplacement valvulaire.
La faible mortalité (1%) et le succès à long terme (taux de reprise à 10 ans < 5%) pousse à intervenir plus tôt dans l'évolution de la maladie [8]. Les résultats à long-terme sont meilleurs pour la dégénérescence fibro-élastique que pour la maladie de Barlow [13].
Examen ETO avant plastie mitrale
L'anesthésiste-échocardiographeur doit fournir au chirurgien des données suffisantes pour évaluer les chances de réussite d'une plastie. L’examen ETO pratiqué avant la CEC est un examen complet et détaillé de la mitrale (voir Tableau 26.3). Il offre une vision dynamique de la valve et permet de juger si une plastie est faisable dans des conditions satisfaisantes. On recherche en particulier quelques données-clefs pour l'opérateur [19,27,28].
Examen ETO avant plastie mitrale
L'anesthésiste-échocardiographeur doit fournir au chirurgien des données suffisantes pour évaluer les chances de réussite d'une plastie. L’examen ETO pratiqué avant la CEC est un examen complet et détaillé de la mitrale (voir Tableau 26.3). Il offre une vision dynamique de la valve et permet de juger si une plastie est faisable dans des conditions satisfaisantes. On recherche en particulier quelques données-clefs pour l'opérateur [19,27,28].
- Quantification de l'IM (tendance à la sous-estimation en AG): PISA, vena contracta, surface de l'orifice de régurgitation;
- Mécanisme de l’IM : restriction, prolapsus, rupture de cordage, dilatation;
- Localisation exacte de l’origine du/des jet(s) d’IM;
- Mobilité, longueur et épaisseur des feuillets; localisation des anomalies;
- Etat des 2 commissures;
- Etat de l’anneau (calcifications) et de l’appareil sous-valvulaire, dimensions de l'anneau;
- Flux mitral et veineux pulmonaire;
- Fonction et taille du VG, remodelage ventriculaire, taille de l’OG;
- Mesures spécifiques (voir ci-dessous): diamètres de l’anneau (vues mi-oesophagiennes 60° et 120°), distance intercommissurale, longueur du feuillet antérieur;
- Dans les IM secondaires restrictives: distance et surface de tente, angle des feuillets en systole.
Certains critères échocardiographiques permettent de prédire une bonne faisabilité et un bon résultat de la plastie [4,25,28,35,42].
- Diamètre de l’anneau < 5.0 cm (mesures en vues mi-oesophagiennes bicommissurale 40-60° et long axe 120-140°);
- Rapport longueur feuillet antérieur / diamètre de l’anneau > 0.65 (mesures en diastole et en vue long axe 120-140°);
- Rapport longueur feuillet antérieur / longueur feuillet postérieur ≥ 1.5;
- Lésion de 1 ou 2 festons postérieurs, commissures stables;
- Degré d’IM modérée-à-sévère mais non massive;
- Jet unique;
- Appareil sous-valvulaire satisfaisant;
- Absence de calcification de l’anneau.
Pour les IM secondaires de type restrictif (IIIb), les critères sont un peu différents (voir Figure 26.43) [14,20].
- Distance plan de l’anneau – point de coaptation (tenting height) < 1.0 cm;
- Surface entre le plan de l’anneau et les feuillets (tenting area) < 1.5 cm2;
- Angle de fermeture du feuillet antérieur < 25°;
- Angle de fermeture du feuillet postérieur < 45°;
- Index de sphéricité du VG ≥ 1.5 (pas de dilatation majeure);
- Fraction d'éjection < 50%.
Dans les IM secondaires, la restriction asymétrique et le remodelage localisé du VG sont associés à un taux de persistence élevé de la régurgitation en postopératoire. La restriction symétrique typique de la dilatation du VG, avec un déplacement apical des piliers, est plutôt associée à des récidives ultérieures de l'IM, car l'annuloplastie ne résout pas le problème de base [14].
L’imagerie tridimensionnelle permet de se rendre compte avec une plus grande précision de l’anatomie et des mouvements de la valve mitrale. Elle permet notamment de déterminer la taille de l’anneau mitral à implanter d’après les mesures de la distance intercommissurale, de la hauteur du feuillet antérieur et des diamètres de l’anneau (Vidéos et Figure 11.54) [9,18,21,24,38].
Vidéo: vue 3D depuis l'OG d'un prolapsus de la commissure postérieure et de P3.
Vidéo: vue 3D depuis l'OG d'un prolapsus de P1 avec rupture de cordage.
Vidéo: vue 3D depuis l'OG d'un prolapsus de P2.
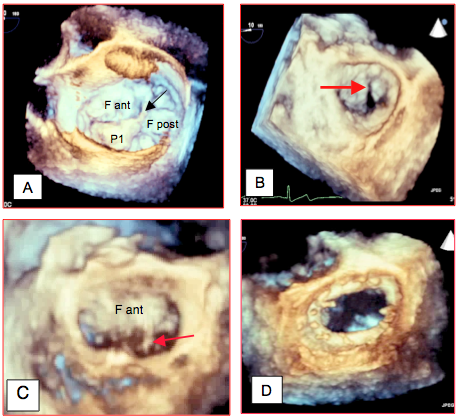
Figure 11.54 : Exemples d’imagerie tridimensionnelle de la valve mitrale. A : valve mitrale souffrant d’un prolapsus du feston antérieur du feuillet postérieur (P1) ; la flèche indique une rupture de cordage. B : fente (cleft) dans le feuillet antérieur; cette pathologie peut être très difficile à mettre en évidence en 2D alors qu'elle est bien visible en 3D. C : valve mitrale souffrant d’un prolapsus de la partie postérieure du feuillet antérieur (A3) ; la flèche indique une rupture de cordage. D: image d'un anneau de plastie mitrale vu depuis l'OG.
Certains éléments de l'imagerie 2D sont des prédicteurs du risque d'obstruction dynamique de la CCVG après plastie (Figure 26.48) (voir plus loin "Effet CMO après plastie") [30,41].
L’imagerie tridimensionnelle permet de se rendre compte avec une plus grande précision de l’anatomie et des mouvements de la valve mitrale. Elle permet notamment de déterminer la taille de l’anneau mitral à implanter d’après les mesures de la distance intercommissurale, de la hauteur du feuillet antérieur et des diamètres de l’anneau (Vidéos et Figure 11.54) [9,18,21,24,38].
Vidéo: vue 3D depuis l'OG d'un prolapsus de la commissure postérieure et de P3.
Vidéo: vue 3D depuis l'OG d'un prolapsus de P1 avec rupture de cordage.
Vidéo: vue 3D depuis l'OG d'un prolapsus de P2.

Figure 11.54 : Exemples d’imagerie tridimensionnelle de la valve mitrale. A : valve mitrale souffrant d’un prolapsus du feston antérieur du feuillet postérieur (P1) ; la flèche indique une rupture de cordage. B : fente (cleft) dans le feuillet antérieur; cette pathologie peut être très difficile à mettre en évidence en 2D alors qu'elle est bien visible en 3D. C : valve mitrale souffrant d’un prolapsus de la partie postérieure du feuillet antérieur (A3) ; la flèche indique une rupture de cordage. D: image d'un anneau de plastie mitrale vu depuis l'OG.
Certains éléments de l'imagerie 2D sont des prédicteurs du risque d'obstruction dynamique de la CCVG après plastie (Figure 26.48) (voir plus loin "Effet CMO après plastie") [30,41].
- Distance entre le point de coaptation et le septum (C-sept) < 2.6 cm;
- Distance entre le point de coaptation et le plan de l'anneau > 0.6 cm;
- Longueur du feuillet postérieur > 1.5 cm (mesurée en diastole dans le plan de sa plus grande dimension);
- Rapport longueur feuillet antérieur/feuillet postérieur < 1.3;
- Angle mitro-aortique < 130°;
- Hypertrophie septale (épaisseur > 1.5 cm);
- Diamètre télédiastolique du VG < 4.5 cm.
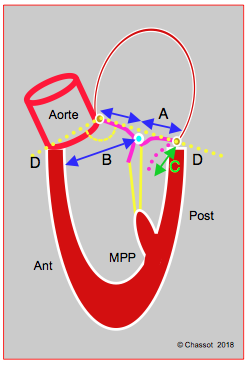
Figure 26.48 : Eléments prédicteurs de bascule du feuillet antérieur dans la chambre de chasse en postopératoire (SAM systolic anterior motion). A : rapport hauteur du feuillet antérieur / hauteur du feuillet postérieur < 1.3. B : distance entre le point de coaptation et le septum < 2.6 cm. C : hauteur du feuillet postérieur déployé en diastole > 1.5 cm. D : angle mitro-aortique refermé (< 140°) [30].
La taille de l'anneau prothétique est choisie en fonction de la distance intertrigonale, qui n'est pas modifiée par la dilatation de l'anneau mitral; à l'ETO 2D, elle se calcule en multipliant par 0.8 la longueur de la base du feuillet antérieur en vue bicommissurale 60° avec rotation horaire de la sonde. En 3D (vue "en-face"), elle se calcule de la même manière à partir de la distance intercommissurale mesurée directement à l'image (voir Figure 26.10A).
Certaines données rendent le succès d'une plastie peu probable et la récidive fréquente (> 50% des cas) [7,20,23,28,29,35].
- Implication de ≥ 3 festons;
- Implication des 2 feuillets;
- Feuillets raccornis et peu développés, fusion commissurale (RAA, endocardite);
- Longueur du feuillet antérieur < 2.8 cm et du feuillet postérieur < 1.7 cm;
- Angle du feuillet postérieur > 45°;
- Orifice de régurgitation très large (> 0.4 cm2);
- Dilatation annulaire massive (diamètre > 5.0 cm pour les IM structurelles et > 4.0 cm pour les IM fonctionnelles) ou anneau très restrictif (diamètre < 3.5 cm);
- Calcifications étendues.
Dans les IM ischémiques secondaires, un diamètre annulaire > 37 mm, une hauteur de tente > 11 mm, une surface de tente > 1.6 cm2 en ETO (ou > 2.0 cm2 en ETT), un angle du feuillet antérieur > 25°, un angle du feuillet postérieur > 45° et une IM sévère au jet couleur sont des indicateurs d'un risque de récidive de 50% [20]. Une forte dilatation du VG (diamètre télédiastolique > 6.0 cm, diamètre télésystolique > 5.0 cm, écartement des muscles papillaires en télésystole > 2.5 cm, index de sphéricité > 0.7) est aussi un handicap [23,27,34].
Les indications opératoires des IM primaires et secondaires sont décrites dans le Chapitre 11, Insuffisance mitrale, Indications et résultats opératoires.
Techniques de plastie
La technique chirurgicale de la plastie est adaptée en fonction du type de lésion, mais trois principes guident la reconstruction: 1) préserver ou rétablir le mouvement des feuillets; 2) créer une surface de coaptation satisfaisante; et 3) stabiliser l'anneau. Les interventions les plus fréquentes sont les suivantes (voir Figures 11.50 et 11.51) [28,29,37].
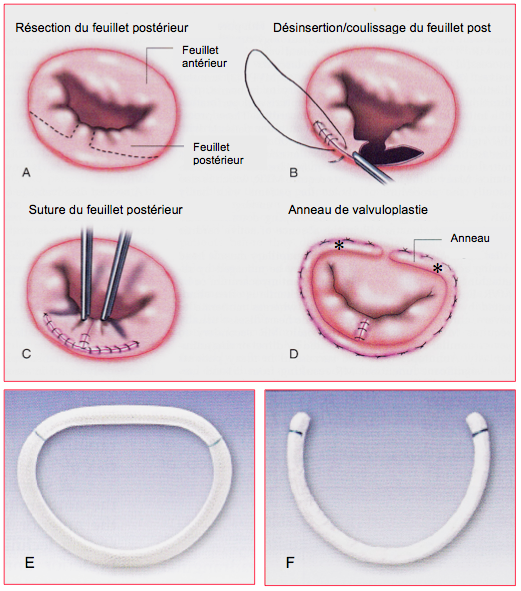
Figure 11.50 : Plastie mitrale pour prolapsus de P2 et anneaux prothétiques. A : résection quadrangulaire de P2. B : désinsertion, coulissage et suture du feuillet postérieur au niveau de P1 et P3. C : suture du feuillet postérieur. D : pose d’un anneau de valvuloplastie de type Carpentier-Edwards Classic. Les 2 astérisques (*) marquent la distance intertrigonale à laquelle correspond l’anneau (Doty DB. Cardiac surgery : operative technique. St Louis :Mosby-Year Book, 1997). E : anneau de Carpentier-Edwards Physio ring. F : anneau de Cosgrove-Edwards [5].
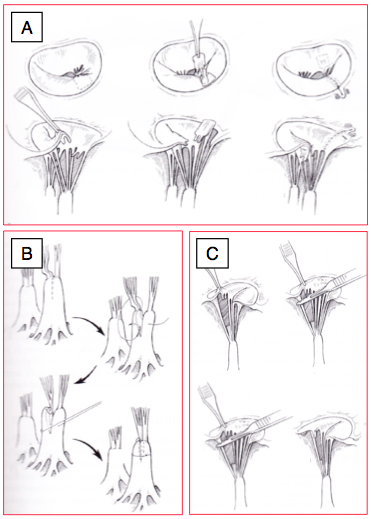
Figure 11.51 : Plastie mitrale. A : transposition de cordages pour prolapsus du feuillet antérieur. B : technique de raccourcissement de cordages. C : réparation de cordage rompu avec translation d’un cordage secondaire sur le bord libre [Edmunds LH. Cardiac surgery in the adult. New-York :McGraw-Hill, 1997].
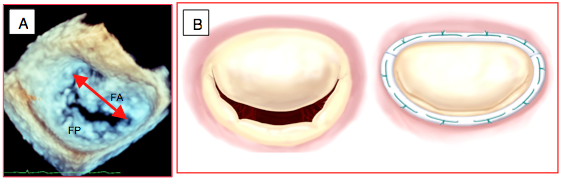
Figure 11.52 : Annuloplastie mitrale. A: reconstruction ETO 3D de la valve mitrale "en face" comme vue depuis l'OG. Mesure de la distance intercommissurale. FA: feuillet antérieur. FP: feuillet postérieur. B: effet de restriction de l'anneau prothétique amenant les feuillets à la coaptation.
La faible mortalité (moyenne 1%) et le succès à long terme (taux de reprise à 15 ans: 7%) des plasties pousse à intervenir plus tôt dans l'évolution de la maladie lorsque la pathologie porte sur les feuillets mitraux (IM primaire) [16].
La situation est moins claire dans les IM secondaires (voir Chapitre 11, IM secondaire sur ischémie et IM secondaire sur dilatation du VG). L'intervention consiste généralement en une annuloplastie simple. Dans l'IM ischémique, une opération simultanée sur la mitrale augmente la mortalité des pontages aorto-coronariens à 3.5-5%. Les indications le plus souvent retenues sont une IM sévère si la plastie paraît aisée, une IM sur rupture de cordage ou de pilier, et une IM structurelle; l'IM modérée n'est pas une indication à intervenir [2,17,22,33]. Dans l'IM secondaire à une dilatation du VG, la plastie n'est envisageable que si la maladie est symptomatique au repos et reste sévère malgré un traitement optimal, et que si la mortalité opératoire prévisible ne dépasse pas 5% [2,40]. Que l'IM soit secondaire à une ischémie ou à une dilatation, sa correction chirurgicale ne semble pas présenter de bénéfice en terme de survie à long terme, d'autant plus que le taux de récidive est important après annuloplastie pour IM fonctionnelle [2,32,39].
Examen ETO après plastie mitrale
L'image ETO de la valve après plastie peut paraître bizarre parce que la restauration d'une fonction normale n'est pas synonyme d'une anatomie normale. En général, le feuillet postérieur sert de butée au feuillet antérieur qui assure à lui seul l'ouverture et la fermeture (valve unicuspide). Après la CEC, les critères échocardiographiques de réussite d’une plastie mitrale sont définis pour une postcharge (pression artérielle), une précharge (volémie) et une fonction ventriculaire normales. L’examen doit être accompagné d’un test de charge (PAM > 80 mmHg, PAsyst > 120 mmHg) et d’une stimulation de la contractilité, pour être certain que les résultats obtenus correspondent aux situations de la vie réelle. La plastie est considérée comme réussie lorsque les conditions suivantes sont réunies (Figures 26.49 et 26.50) (Vidéo) [1,12,27,29,43].
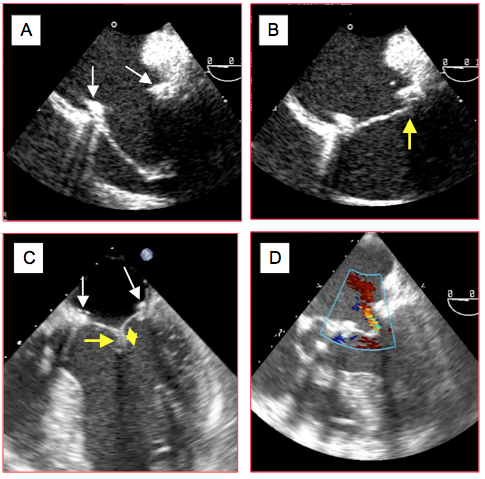
Figure 26.49 : Images ETO après plastie mitrale. A : après résection large de P2 et plastie du feuillet postérieur, toute l’occlusion est assurée par le feuillet antérieur ; sa longueur doit dépasser le diamètre de l’anneau (flèches blanches) et permettre un affrontement sous le feuillet postérieur pour que la valve soit occlusive. B : occlusion satisfaisante du feuillet antérieur en butée sous le feuillet postérieur et l’anneau en systole. C : la coaptation des feuillets doit se faire sur une hauteur d’au moins 5 mm (flèche jaune) pour assurer l’étanchéité, ce qui est le cas ici après une plastie et résection du feuillet antérieur. D : fuite résiduelle après plastie mitrale ; si elle est pansystolique, cette fuite est excessive car le jet présente une largeur significative au passage de la valve.
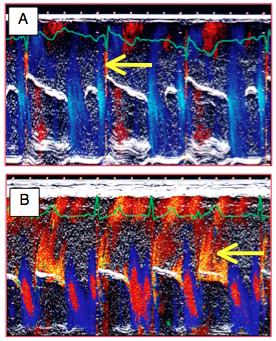
Figure 26.50 : Images en mode TM de fuite résiduelle après plastie mitrale. A: fuite minime exclusivement protosystolique, due à l'inertie de fermeture de la valve réparée; elle est sans signification. B: fuite modérée pansystolique; elle demande une correction immédiate.
Les indications échocardiographiques à retourner en pompe (environ 10% des cas) pour compléter la plastie ou, à défaut, remplacer la valve sont variables selon les institutions et les chirurgiens, mais peuvent se résumer comme suit [11,29].
La mesure du gradient, de la surface utile en diastole et de la surface de l'orifice de régurgitation en systole est complexe, car la surface d'ouverture n'est pas circulaire et l'axe du flux oblique par rapport au faisceau Doppler. Le calcul par le temps de demi-pression (pressure half-time), réservé aux valves dont la surface est < 1.5 cm2, est inadapté à la géométrie irrégulière de l'orifice et à l'écart entre l'axe du flux diastolique et l'axe du Doppler. Dans ces conditions, la planimétrie après découpe (cropping) soigneuse de la reconstruction 3D est plus précise. Un gradient excessif peut apparaître en cas de surcharge liquidienne (transfert trop rapide du volume de la CEC) ou de haut débit cardiaque (excès de catécholamines). Ces facteurs doivent être contrôlés avant de décider d'un retour en pompe. A l'inverse, un bas débit cardiaque, une dysfonction diastolique sévère ou une insuffisance aortique associée peuvent masquer la réalité en diminuant artificiellement le gradient diastolique [11].
Il est essentiel de diagnostiquer le mécanisme de l'insuffisance résiduelle pour que le chirurgien puisse réaliser une correction adéquate [12].
Une subobstruction dynamique de la chambre de chasse par le feuillet mitral antérieur (effet de cardiomyopathie obstructive, ou effet CMO) survient dans 4-12% des plasties mitrales pour dégénérescence myxoïde (IM type II) (Vidéo et Figure 26.51) [15,26,30]. Elle est secondaire au déplacement antérieur de la zone de coaptation mitrale par un anneau restrictif chez un malade qui souffre d'une abondance de tissu valvulaire; ce déplacement rapproche excessivement le point de coaptation de la CCVG. En effet, la jonction mitro-aortique est le point fixe de l’anneau mitral (trigone fibreux), alors que la partie postérieure est fine et n’est soutenue que par la musculature ventriculaire ; c’est donc elle qui va se déplacer vers l’avant. Ce déplacement a lieu pour plusieurs raisons différentes.
Vidéo: vue 5-cavités d'une subobstruction de la chambre de chasse du VG par le feuillet mitral antérieur (SAM, systolic anterior motion) après plastie mitrale.
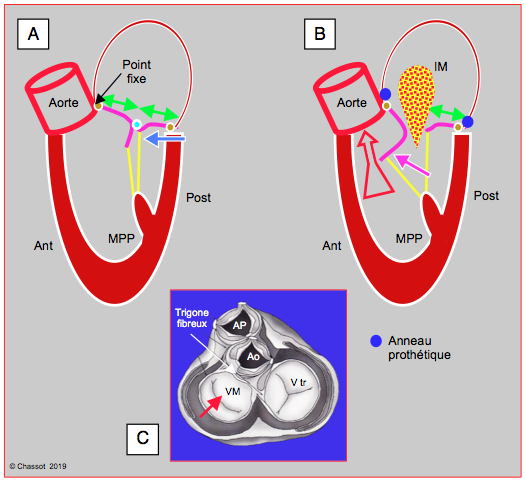
Figure 26.51 : Obstruction dynamique de la CCVG après plastie mitrale. A : un anneau restrictif et/ou une trop grande hauteur du feuillet postérieur (FP) (rapport feuillet antérieur / feuillet postérieur < 1.3, flèches vertes) avance la paroi postérieure et projette le point de coaptation vers la CCVG (flèche bleue). En protosystole, la coaptation a lieu sur le corps du feuillet antérieur (FA) dont la partie distale se retrouve dans le VG et non en application contre le FP. B : en mésosystole, la pression intraventriculaire pousse le FA en direction de la CCVG (flèche violette) ; en cours d’éjection, celui-ci est aspiré par effet Venturi et vient bloquer la CCVG (SAM: systolic anterior motion). Le débit aortique baisse soudainement, et la réouverture de la valve mitrale provoque une insuffisance méso-télésystolique (IM). C : Lorsque le VG se rétrécit, seule la paroi postérieure peut se déplacer antérieurement (flèche rouge) parce que la base du feuillet antérieur est accolée au trigone fibreux qui est un point fixe puisqu’il est le squelette et le centre mécanique du cœur.
Les trois premiers points sont liés à l’intervention chirurgicale ; ils surviennent dans 5% des plasties mitrales [15]. Les deux autres points sont liés à l’hémodynamique et se corrigent par remplissage, vascoconstriction systémique et β-blocage ; ils sont beaucoup plus fréquents mais ne réclament pas une reprise chirurgicale. La plupart du temps, le rééquilibrage médicamenteux suffit à interrompre le processus. Une réfection de la plastie du feuillet postérieur n’est nécessaire que dans 1-8% des cas selon les séries [6,26]; elle a pour but de reculer le point de coaptation afin de l’éloigner de la CCVG. Dans les cas réfractaires malgré une reprise chirurgicale, il est possible de recourir à une plastie selon Alfieri en CEC ou par MitraClip™ pour conserver la valve native et éviter de devoir implanter une prothèse. Sinon, la seule solution est un RVM.
Lorsque le point de coaptation de la valve mitrale avance en direction de la CCVG, l’occlusion n’a plus lieu sur le bord distal du feuillet antérieur mais sur son corps, et la pression intaventriculaire le repousse antérieurement en direction de la chambre de chasse en protosystole. Par effet Venturi, il est ensuite aspiré dans la CCVG et l’occlut plus ou moins complètement. C’est le SAM (systolic anterior motion), qui survient en méso-télésystole (Vidéo et Figure 26.52). Le flux baisse dans l’aorte, et la réouverture de la valve mitrale en cours de systole induit une IM méso-télésystolique (Vidéos). Ce phénomène est bien visible en 4-cavités, 5-cavités ou en long axe du VG mi-œsophage [30,41].
Vidéo: subobstruction de la chambre de chasse du VG par le feuillet mitral antérieur (SAM) après plastie restrictive du feuillet postérieur.
Vidéo: insuffisance mitrale due à la réouverture mésosystolique de la valve à cause du SAM; bien qu'importante, l'IM est brêve car elle ne dure que la moitié de la systole.
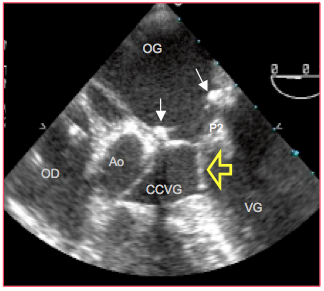
Figure 26.52 : SAM (systolic anterior motion) du feuillet antérieur en postopératoire de plastie mitrale; image ETO de SAM en vue 5-cavités. Les deux flèches blanches indiquent l’emplacement de l’anneau prothétique ; la flèche jaune pointe le déplacement de la partie distale du feuillet antérieur dans la chambre de chasse du VG (CCVG). P2: feston réséqué et resuturé du feuillet postérieur, d'où son aspect épaissi et remanié.
Après plastie mitrale, deux signes échocardiographiques donnent l'alerte sur la présence d'une possible obstruction dynamique de la CCVG :
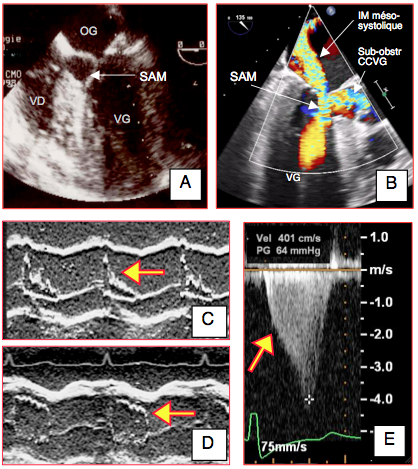
Figure 26.53 : Signes échocardiographiques de l'effet “CMO”. A : image de systolic anterior motion (SAM) en vue ETO 4-cavités mi-oesophage. B : au Doppler couleur, présence d'une IM méso-télésystolique et de flux tourbillonnaire dans la CCVG (Vmax > 2.5 m/s). C : la chute du débit systolique en cours de systole ne permet plus à la valve aortique de rester ouverte ; en mode TM en court axe basal de la valve aortique (40°), on voit collaber les feuillets en cours de systole. D : après traitement (vasoconstricteur et béta-bloqueur), la valve aortique reste ouverte pendant toute la systole, le SAM a disparu. E : aspect en dague du flux aortique; la flèche indique la vélocité à laquelle survient le SAM et la restriction/accélération du flux éjectionnel; la Vmax est de 4 m/s.
Le collapsus méso-systolique des cuspides aortiques en mode TM est le signe le plus pathognomonique du SAM et de l'effet CMO. Tant qu'il est présent, la situation n'est pas contrôlée, même si l'hémodynamique paraît normale.
Dans > 95% des cas, l'effet CMO est du à une inadéquation hémodynamique momentanée et n'a pas de sanction chirurgicale [6,26]. La correction de l'hypovolémie, l'élévation de la postcharge (vasoconstricteur) et le frein inotrope (arrêt des catécholamines béta, béta-bloqueur) suffisent à rétablir la situation dans la majorité des cas (Vidéos). A long terme, le devenir des patients n’est pas influencé par un épisode de CMO [3].
Vidéo: insuffisance mitrale due à la réouverture mésosystolique de la valve à cause du SAM; l'IM est importante mais ne dure que la moitié de la systole.
Vidéo: disparition de l'IM précédente après correction de l'hémodynamique, sans intervention chirurgicale.
© CHASSOT PG, BETTEX D. Octobre 2011, Juin 2019; dernière mise à jour, Mars 2020
Références
Les indications opératoires des IM primaires et secondaires sont décrites dans le Chapitre 11, Insuffisance mitrale, Indications et résultats opératoires.
| Messages pour le chirurgien avant chirurgie mitrale |
Description : étendue de la lésion, prolapsus, zones de remaniement, de dégénérescence et de calcification, état des commissures (tenue, bascule, fuite), localisation de la (des) fuite(s), direction du (des) jet(s), état de l’anneau mitral et de l’appareil sous-valvulaire. Dimensions : diamètres et surface de l’OG, diamètre anneau mitral (60° et 120-140°), longueur feuillet antérieur + rapport feuillet antérieur/diamètre anneau (en diastole à 120-140°), base du feuillet antérieur + distance intertrigonale (60°), distance point de coaptation – septum en systole, hauteur de coaptation (le cas échéant). Degré de remodelage du VG : dilatation (Dts > 2.5 cm/m2), sphéricité (index > 0.7), abaissement du point de coaptation > 1 cm sous le plan de l’anneau, angle feuillet antérieur/plan anneau > 25° en systole, fonction du VG. Mécanisme de l’IM et quantification (selon conditions hémodynamiques). Etat de la valve aortique (indication à un remplacement ou à une plastie). Fonction et dimension du VD, état de la valve tricuspidienne (indication à une plastie si diamètre de l'anneau > 4 cm). |
| Critères de faisabilité pour une plastie mitrale |
| Dilatation modérée du VG et de l’OG Peu de restriction sur les feuillets (distance plan de l’anneau – point de coaptation < 1 cm) Anneau souple et non calcifié Diamètre de l’anneau mitral < 5 cm, distance intercommissurale < 3.7 cm IM non massive, commissures stables, jet unique Lésions de < 3 festons Rapport longueur feuillet antérieur / diamètre de l’anneau > 0.65 Rapport entre la hauteur du feuillet antérieur et du feuillet postérieur ≥ 1.5 Appareil sous-valvulaire satisfaisant |
Techniques de plastie
La technique chirurgicale de la plastie est adaptée en fonction du type de lésion, mais trois principes guident la reconstruction: 1) préserver ou rétablir le mouvement des feuillets; 2) créer une surface de coaptation satisfaisante; et 3) stabiliser l'anneau. Les interventions les plus fréquentes sont les suivantes (voir Figures 11.50 et 11.51) [28,29,37].
- Annulopastie avec un anneau souple ou rigide (PVM anneau 3D). La taille de l’anneau varie de 28 à 36 mm dans les IM structurelles et de 26 à 32 mm dans les IM fonctionnelles. Cette taille est fonction de la distance intertrigonale que l’on veut obtenir après plastie (distance intertrigonale = 0.8 • longueur de la base du feuillet antérieur en vue bicommissurale 60° avec rotation horaire de la sonde, ou en vue 3D "en face") (voir Figure 11.52). L'anneau est indispensable pour empêcher une dilatation secondaire et pour assurer un succès à long terme. Il a quatre fonctions : restaurer la géométrie de l’anneau mitral, prévenir la dilatation, diminuer la tension sur les sutures, et augmenter la surface de coaptation.
- Résection quadrangulaire du/des feston(s) du feuillet postérieur (P2 dans 57% des cas) et résection des cordages rompus ; suture du feuillet postérieur.
- Résection quadrangulaire de P2, désinsertion et coulissage (sliding valvuloplasty) de P1 et P3 pour réduire la hauteur du feuillet à < 1.5 cm et diminuer le risque de SAM en cas de résection étendue et de très grand feuillet postérieur. Le taux de succès est de 90-95% (Vidéo).
- Résection triangulaire du feuillet antérieur, résection des cordages rompus, suture bord à bord ; transfert de cordages secondaires sur le bord libre (Vidéo). En cas de résection importante : transfert d’un feston du feuillet postérieur et de ses cordages. Les résultats de la plastie du feuillet antérieur, qui est plus difficile, ne sont pas aussi bons que ceux de la plastie du feuillet postérieur.
- Transfert, raccourcissement, réinsertion ou remplacement de cordages; les cordages sont fixés au feuillet sur des patchs et enfouis au sein du muscle papillaire. La longueur exacte des néocordages est souvent difficile à évaluer.
- Fermeture d'une perforation endocarditique ou d'une fente (cleft) par un patch de péricarde autologue.
- Allongement du feuillet antérieur ou remplacement partiel des feuillets par du péricarde autologue ou par une homogreffe (en cas d'IM restrictive type IIIa).
- Remplacement partiel des feuillets ou allongement du feuillet antérieur par du péricarde autologue ou par une homogreffe.
- Décalcification de l’anneau mitral ; le calcium se dépose dans la fibrose réactionnelle de la partie postérieure de l’anneau lors de prolapsus de longue durée ou de maladie calcifiante. Le feuillet postérieur est désinséré, l’anneau décalcifié en bloc, et la jonction atrio-ventriculaire reconstruite en ramenant la paroi auriculaire sur la musculature ventriculaire et en complétant au besoin avec un patch de péricarde. Le risque est une rupture secondaire au niveau de la jonction auriculo-ventriculaire postérieure, souvent fatale.
- Résection des cordages du 2ème ordre du feuillet antérieur lors d'IM secondaire ischémique avec déplacement externe du pilier postérieur et traction excessive sur la partie centrale du feuillet antérieur.
- Plastie selon Alfieri : suture bord à bord de la partie médiane des feuillets (A2 et P2), réservée aux cas à très haut risque avec IM fonctionnelle et fuite centrale, ainsi qu'au SAM réfractaire après PVM; en diastole, la valve présente 2 hémi-orifices de dimensions rétrécies (PVM Alfieri). C'est la technique réalisée par voie transcutanée (MitraClip™) (Vidéo).
Vidéo: résultat satisfaisant après une plastie-résection de P2; le grand feuillet antérieur vient en butée sous le feuillet postérieur soutenu par l'anneau mitral prothétique.
Vidéo: vue 4-cavités après plastie mitrale satisfaisante; bien que remanié, la feuillet antérieur s'affronte en systole avec le fin feuillet postérieur sur une hauteur d'environ 6 mm.
Vidéo: status après pose de MitraClip; A2 et P2 sont fixés ensemble; la valve occlut complètement en systole.

Figure 11.50 : Plastie mitrale pour prolapsus de P2 et anneaux prothétiques. A : résection quadrangulaire de P2. B : désinsertion, coulissage et suture du feuillet postérieur au niveau de P1 et P3. C : suture du feuillet postérieur. D : pose d’un anneau de valvuloplastie de type Carpentier-Edwards Classic. Les 2 astérisques (*) marquent la distance intertrigonale à laquelle correspond l’anneau (Doty DB. Cardiac surgery : operative technique. St Louis :Mosby-Year Book, 1997). E : anneau de Carpentier-Edwards Physio ring. F : anneau de Cosgrove-Edwards [5].

Figure 11.51 : Plastie mitrale. A : transposition de cordages pour prolapsus du feuillet antérieur. B : technique de raccourcissement de cordages. C : réparation de cordage rompu avec translation d’un cordage secondaire sur le bord libre [Edmunds LH. Cardiac surgery in the adult. New-York :McGraw-Hill, 1997].

Figure 11.52 : Annuloplastie mitrale. A: reconstruction ETO 3D de la valve mitrale "en face" comme vue depuis l'OG. Mesure de la distance intercommissurale. FA: feuillet antérieur. FP: feuillet postérieur. B: effet de restriction de l'anneau prothétique amenant les feuillets à la coaptation.
La faible mortalité (moyenne 1%) et le succès à long terme (taux de reprise à 15 ans: 7%) des plasties pousse à intervenir plus tôt dans l'évolution de la maladie lorsque la pathologie porte sur les feuillets mitraux (IM primaire) [16].
La situation est moins claire dans les IM secondaires (voir Chapitre 11, IM secondaire sur ischémie et IM secondaire sur dilatation du VG). L'intervention consiste généralement en une annuloplastie simple. Dans l'IM ischémique, une opération simultanée sur la mitrale augmente la mortalité des pontages aorto-coronariens à 3.5-5%. Les indications le plus souvent retenues sont une IM sévère si la plastie paraît aisée, une IM sur rupture de cordage ou de pilier, et une IM structurelle; l'IM modérée n'est pas une indication à intervenir [2,17,22,33]. Dans l'IM secondaire à une dilatation du VG, la plastie n'est envisageable que si la maladie est symptomatique au repos et reste sévère malgré un traitement optimal, et que si la mortalité opératoire prévisible ne dépasse pas 5% [2,40]. Que l'IM soit secondaire à une ischémie ou à une dilatation, sa correction chirurgicale ne semble pas présenter de bénéfice en terme de survie à long terme, d'autant plus que le taux de récidive est important après annuloplastie pour IM fonctionnelle [2,32,39].
| Plastie valvulaire mitrale (PVM) |
| Une valvuloplastie, faisable dans 60-80% des insuffisances mitrales, est toujours préférable à un remplacement parce qu'elle rétablit l'anatomie normale. Avantages par rapport à une prothèse: - Absence d’anticoagulation - Préservation de la géométrie et de la fonction ventriculaire - Très faibles risques mécaniques et infectieux - Mortalité opératoire trois fois plus basse (moy 1%) ; reprise à 10 ans : < 5% La PVM consiste en résection du feston prolabant (en général P2), résection de cordages rompus, raccourcissement ou transfert de cordages, et implantation d’un anneau (nécessaire à empêcher une dilatation secondaire). Critères de faisabilité d’une plastie mitrale : - Dilatation modérée du VG et de l’OG (diamètre de l’anneau mitral < 5 cm) - Peu de restriction sur les feuillets (distance plan de l’anneau – point de coaptation < 1 cm) - Anneau souple et non calcifié - IM non massive, commissures stables, jet unique - Rapport longueur feuillet antérieur / diamètre de l’anneau > 0.65 - Appareil sous-valvulaire satisfaisant |
Examen ETO après plastie mitrale
L'image ETO de la valve après plastie peut paraître bizarre parce que la restauration d'une fonction normale n'est pas synonyme d'une anatomie normale. En général, le feuillet postérieur sert de butée au feuillet antérieur qui assure à lui seul l'ouverture et la fermeture (valve unicuspide). Après la CEC, les critères échocardiographiques de réussite d’une plastie mitrale sont définis pour une postcharge (pression artérielle), une précharge (volémie) et une fonction ventriculaire normales. L’examen doit être accompagné d’un test de charge (PAM > 80 mmHg, PAsyst > 120 mmHg) et d’une stimulation de la contractilité, pour être certain que les résultats obtenus correspondent aux situations de la vie réelle. La plastie est considérée comme réussie lorsque les conditions suivantes sont réunies (Figures 26.49 et 26.50) (Vidéo) [1,12,27,29,43].
- IM résiduelle de degré ≤ mineur; IM protosystolique et brève (Vidéos).
- Si une reprise n'est pas envisageable, une IM mineure peut être acceptable, à la condition que la vena contracta soit < 3 mm et l'orifice de régurgitation < 0.2 cm2, sans traduction sur le flux veineux pulmonaire.
- Si résection du feuillet postérieur : abutement du feuillet antérieur sous le feuillet postérieur et la partie postérieure de l’anneau (Vidéo).
- Si affrontement des 2 feuillets : auteur de coaptation ≥ 5-8 mm; cette hauteur se calcule en soustrayant la distance entre l'anneau mitral et le point de coaptation en systole de la longueur totale du feuillet antérieur mesurée en diastole (vue long-axe 120°) (voir Figure 26.16) (Vidéos).
- Rapport hauteur de coaptation / longueur feuillet antérieur > 0.2.
- Rapport longueur feuillet postérieur / feuillet antérieur < 0.4.
- Gradient antérograde : ΔPmax ≤ 4 mmHg, ΔPmoy ≤ 2 mmHg ; le temps de demi-pression (pressure half-time) n'est pas adapté au calcul de la surface d'ouverture qui n'est pas circulaire. Comme le gradient de pression tend à diminuer de 20-30% pendant la première année, on peut accepter un ΔPmax ≤ 5 mmHg si une reprise n'est pas envisageable.
- Vmax ≤ 1.5 m/s dans la CCVG, pas de SAM (voir ci-dessous).
- Forme en croissant de la ligne de coaptation (vue 3D "en-face").
Vidéo: absence de fuite résiduelle au Doppler couleur après plastie-résection de P2.
Vidéo: vue long-axe après plastie mitrale en mode X-Plane. L'abutement des feuillets est correct en vue bidimensionnelle; il n'y a pas de fuite résiduelle au Doppler couleur.
Vidéo: minuscule fuite protosystolique en vue 4-cavités après plastie du feuillet postérieur. Cette fuite est négligeable.
Vidéo: abutement adéquat du feuillet antérieur sous la plastie-résection de P2.
Vidéo: affrontement adéquat des deux feuillets sur une hauteur d'environ 6 mm.
Vidéo: affrontement adéquat des deux feuillets, très remaniés, sur environ 10 mm. Présence d'un anneau et d'un fil de suture sur sa partie gauche.

Figure 26.49 : Images ETO après plastie mitrale. A : après résection large de P2 et plastie du feuillet postérieur, toute l’occlusion est assurée par le feuillet antérieur ; sa longueur doit dépasser le diamètre de l’anneau (flèches blanches) et permettre un affrontement sous le feuillet postérieur pour que la valve soit occlusive. B : occlusion satisfaisante du feuillet antérieur en butée sous le feuillet postérieur et l’anneau en systole. C : la coaptation des feuillets doit se faire sur une hauteur d’au moins 5 mm (flèche jaune) pour assurer l’étanchéité, ce qui est le cas ici après une plastie et résection du feuillet antérieur. D : fuite résiduelle après plastie mitrale ; si elle est pansystolique, cette fuite est excessive car le jet présente une largeur significative au passage de la valve.

Figure 26.50 : Images en mode TM de fuite résiduelle après plastie mitrale. A: fuite minime exclusivement protosystolique, due à l'inertie de fermeture de la valve réparée; elle est sans signification. B: fuite modérée pansystolique; elle demande une correction immédiate.
Les indications échocardiographiques à retourner en pompe (environ 10% des cas) pour compléter la plastie ou, à défaut, remplacer la valve sont variables selon les institutions et les chirurgiens, mais peuvent se résumer comme suit [11,29].
- Défaut structurel qui ne peut pas s’améliorer : perforation, déhiscence, bascule de feuillet, fuite para-annulaire ≥ mineure (Vidéos).
- IM de degré ≥ mineure:
- Non-coaptation des feuillets en image 2D ou 3D.
- Jet d’IM important et pansystolique (PVM IM III) .
- Présence d'un PISA côté ventriculaire.
- Vena contracta > 0.3 cm.
- Orifice de régurgitation > 0.25 cm2.
- Volume de régurgitation > 25 mL.
- Sténose restrictive : S < 2.0 cm2, ΔPmax ≥ 10 mmHg, ΔPmoy ≥ 5 mmHg.
- SAM réfractaire au traitement médical (voir ci-dessous).
- La décision est prise en fonction du contexte clinique et non de la seule image ETO.
Vidéo: fuite para-annulaire en vue 4-cavités après plastie mitrale et pose d'un anneau prothétique; la fuite est située le long du septum.
Vidéo: vue 3D depuis l'OG de la même fuite para-annulaire après plastie mitrale; l'orifice est situé à 2 heures, en regard de la valve tricuspide.
La mesure du gradient, de la surface utile en diastole et de la surface de l'orifice de régurgitation en systole est complexe, car la surface d'ouverture n'est pas circulaire et l'axe du flux oblique par rapport au faisceau Doppler. Le calcul par le temps de demi-pression (pressure half-time), réservé aux valves dont la surface est < 1.5 cm2, est inadapté à la géométrie irrégulière de l'orifice et à l'écart entre l'axe du flux diastolique et l'axe du Doppler. Dans ces conditions, la planimétrie après découpe (cropping) soigneuse de la reconstruction 3D est plus précise. Un gradient excessif peut apparaître en cas de surcharge liquidienne (transfert trop rapide du volume de la CEC) ou de haut débit cardiaque (excès de catécholamines). Ces facteurs doivent être contrôlés avant de décider d'un retour en pompe. A l'inverse, un bas débit cardiaque, une dysfonction diastolique sévère ou une insuffisance aortique associée peuvent masquer la réalité en diminuant artificiellement le gradient diastolique [11].
Il est essentiel de diagnostiquer le mécanisme de l'insuffisance résiduelle pour que le chirurgien puisse réaliser une correction adéquate [12].
- IM de type I (jet central dans l'OG): anneau trop grand, perforation iatrogène, fente résiduelle (cleft);
- IM de type II (jet excentrique dirigé à l'opposé du feuillet prolabant): prolapsus résiduel, dont la localisation est à définir précisément;
- IM de type III (jet excentrique dans la direction du feuillet restrictif): résection excessive, malposition de l'anneau, raccourcissement trop important de cordages, dilatation ventriculaire;
- IM due au SAM: jet méso-télé-systolique, feuillet postérieur trop long, excès de tissu valvulaire, anneau trop petit.
- Contractilité de la paroi latérale ; l’artère circonflexe (CX) peut être lésée par les points de fixation latéraux.
- Etanchéité de la valve aortique ; les points au niveau de la base du feuillet antérieur peuvent exercer une traction sur la cuspide gauche ou la cuspide non coronaire de la valve aortique et provoquer une IA. Ils peuvent également perforer un feuillet aortique.
- Intégrité de la paroi-basale du VG ; la décalcification de l’anneau peut entraîner des lésions au niveau du sillon auriculo-ventriculaire ; la présence continue d’air dans le VG et l’akinésie basale sont des signes avant-coureurs de la rupture ventriculaire.
Une subobstruction dynamique de la chambre de chasse par le feuillet mitral antérieur (effet de cardiomyopathie obstructive, ou effet CMO) survient dans 4-12% des plasties mitrales pour dégénérescence myxoïde (IM type II) (Vidéo et Figure 26.51) [15,26,30]. Elle est secondaire au déplacement antérieur de la zone de coaptation mitrale par un anneau restrictif chez un malade qui souffre d'une abondance de tissu valvulaire; ce déplacement rapproche excessivement le point de coaptation de la CCVG. En effet, la jonction mitro-aortique est le point fixe de l’anneau mitral (trigone fibreux), alors que la partie postérieure est fine et n’est soutenue que par la musculature ventriculaire ; c’est donc elle qui va se déplacer vers l’avant. Ce déplacement a lieu pour plusieurs raisons différentes.
Vidéo: vue 5-cavités d'une subobstruction de la chambre de chasse du VG par le feuillet mitral antérieur (SAM, systolic anterior motion) après plastie mitrale.
- L’anneau de valvuloplastie est trop restrictif;
- La longueur du feuillet antérieur est excessive (redondance de tissu typique de la maladie de Barlow);
- La longueur du feuillet postérieur dépasse 1.5 cm; sa longueur résiduelle après plastie est exagérée;
- La cavité ventriculaire est trop petite : HVG concentrique, hypovolémie;
- La course radiaire de la paroi postérieure en systole est trop grande : hyperdynamisme, sur-stimulation béta, vasoplégie.

Figure 26.51 : Obstruction dynamique de la CCVG après plastie mitrale. A : un anneau restrictif et/ou une trop grande hauteur du feuillet postérieur (FP) (rapport feuillet antérieur / feuillet postérieur < 1.3, flèches vertes) avance la paroi postérieure et projette le point de coaptation vers la CCVG (flèche bleue). En protosystole, la coaptation a lieu sur le corps du feuillet antérieur (FA) dont la partie distale se retrouve dans le VG et non en application contre le FP. B : en mésosystole, la pression intraventriculaire pousse le FA en direction de la CCVG (flèche violette) ; en cours d’éjection, celui-ci est aspiré par effet Venturi et vient bloquer la CCVG (SAM: systolic anterior motion). Le débit aortique baisse soudainement, et la réouverture de la valve mitrale provoque une insuffisance méso-télésystolique (IM). C : Lorsque le VG se rétrécit, seule la paroi postérieure peut se déplacer antérieurement (flèche rouge) parce que la base du feuillet antérieur est accolée au trigone fibreux qui est un point fixe puisqu’il est le squelette et le centre mécanique du cœur.
Les trois premiers points sont liés à l’intervention chirurgicale ; ils surviennent dans 5% des plasties mitrales [15]. Les deux autres points sont liés à l’hémodynamique et se corrigent par remplissage, vascoconstriction systémique et β-blocage ; ils sont beaucoup plus fréquents mais ne réclament pas une reprise chirurgicale. La plupart du temps, le rééquilibrage médicamenteux suffit à interrompre le processus. Une réfection de la plastie du feuillet postérieur n’est nécessaire que dans 1-8% des cas selon les séries [6,26]; elle a pour but de reculer le point de coaptation afin de l’éloigner de la CCVG. Dans les cas réfractaires malgré une reprise chirurgicale, il est possible de recourir à une plastie selon Alfieri en CEC ou par MitraClip™ pour conserver la valve native et éviter de devoir implanter une prothèse. Sinon, la seule solution est un RVM.
Lorsque le point de coaptation de la valve mitrale avance en direction de la CCVG, l’occlusion n’a plus lieu sur le bord distal du feuillet antérieur mais sur son corps, et la pression intaventriculaire le repousse antérieurement en direction de la chambre de chasse en protosystole. Par effet Venturi, il est ensuite aspiré dans la CCVG et l’occlut plus ou moins complètement. C’est le SAM (systolic anterior motion), qui survient en méso-télésystole (Vidéo et Figure 26.52). Le flux baisse dans l’aorte, et la réouverture de la valve mitrale en cours de systole induit une IM méso-télésystolique (Vidéos). Ce phénomène est bien visible en 4-cavités, 5-cavités ou en long axe du VG mi-œsophage [30,41].
Vidéo: subobstruction de la chambre de chasse du VG par le feuillet mitral antérieur (SAM) après plastie restrictive du feuillet postérieur.
Vidéo: insuffisance mitrale due à la réouverture mésosystolique de la valve à cause du SAM; bien qu'importante, l'IM est brêve car elle ne dure que la moitié de la systole.

Figure 26.52 : SAM (systolic anterior motion) du feuillet antérieur en postopératoire de plastie mitrale; image ETO de SAM en vue 5-cavités. Les deux flèches blanches indiquent l’emplacement de l’anneau prothétique ; la flèche jaune pointe le déplacement de la partie distale du feuillet antérieur dans la chambre de chasse du VG (CCVG). P2: feston réséqué et resuturé du feuillet postérieur, d'où son aspect épaissi et remanié.
Après plastie mitrale, deux signes échocardiographiques donnent l'alerte sur la présence d'une possible obstruction dynamique de la CCVG :
- IM importante mais non holo-systolique;
- Inflexion du feuillet antérieur dans la chambre de chasse en cours de systole (SAM).
- Vmax dans la CCVG > 2.5 m/s (en vue transgastrique profonde 0° ou long-axe du VG 120°);
- Aspect "en dague" (dagger-shape) du flux aortique au Doppler continu;
- Vibrations et collapsus mésosystolique des cuspides aortiques en mode TM de la valve aortique (court-axe 40° ou long-axe 120°);
- IM méso-télé-systolique.

Figure 26.53 : Signes échocardiographiques de l'effet “CMO”. A : image de systolic anterior motion (SAM) en vue ETO 4-cavités mi-oesophage. B : au Doppler couleur, présence d'une IM méso-télésystolique et de flux tourbillonnaire dans la CCVG (Vmax > 2.5 m/s). C : la chute du débit systolique en cours de systole ne permet plus à la valve aortique de rester ouverte ; en mode TM en court axe basal de la valve aortique (40°), on voit collaber les feuillets en cours de systole. D : après traitement (vasoconstricteur et béta-bloqueur), la valve aortique reste ouverte pendant toute la systole, le SAM a disparu. E : aspect en dague du flux aortique; la flèche indique la vélocité à laquelle survient le SAM et la restriction/accélération du flux éjectionnel; la Vmax est de 4 m/s.
Le collapsus méso-systolique des cuspides aortiques en mode TM est le signe le plus pathognomonique du SAM et de l'effet CMO. Tant qu'il est présent, la situation n'est pas contrôlée, même si l'hémodynamique paraît normale.
Dans > 95% des cas, l'effet CMO est du à une inadéquation hémodynamique momentanée et n'a pas de sanction chirurgicale [6,26]. La correction de l'hypovolémie, l'élévation de la postcharge (vasoconstricteur) et le frein inotrope (arrêt des catécholamines béta, béta-bloqueur) suffisent à rétablir la situation dans la majorité des cas (Vidéos). A long terme, le devenir des patients n’est pas influencé par un épisode de CMO [3].
Vidéo: insuffisance mitrale due à la réouverture mésosystolique de la valve à cause du SAM; l'IM est importante mais ne dure que la moitié de la systole.
Vidéo: disparition de l'IM précédente après correction de l'hémodynamique, sans intervention chirurgicale.
| ETO après plastie mitrale |
| Critères de réussite d’une plastie mitrale (examen post-CEC, taux d’échec moyen 6%) : - IM résiduelle nulle ou mineure (PAM > 80 mmHg, fonction VG satisfaisante) - Affrontement adéquat des feuillets (hauteur de coaptation > 5 mm), pas de prolapsus - Gradient antérograde moyen ≤ 2-3 mmHg - Absence de SAM, VmaxCCVG < 1.5 m/s Sténose sous-aortique dynamique ("effet CMO") post-plastie (4-12% des cas) : - Subocclusion mésosystolique de la CCVG par le feuillet antérieur, VmaxCCVG > 2.5 m/s - Collapsus mésosystolique des cuspides aortiques en mode TM - IM méso-télésystolique - Cause : anneau restrictif, excès de tissu valvulaire, hypovolémie, vasoplégie, stimulation β - Traitement : vasopresseur, volume, stop amines β, β-bloqueurs, correction chirurgicale chez le 5% des cas réfractaire au traitement conservateur |
© CHASSOT PG, BETTEX D. Octobre 2011, Juin 2019; dernière mise à jour, Mars 2020
Références
- ADAMS DH, ANYANWU AC, SUGENG L, LANG RM. Degenerative mitral valve regurugitation: surgical echocardiography. Curr Cardiol Rep 2008; 10:226-32
- BAUMGARTNER H, FALK V, BAX JJ, et al. 2017 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J 2017; 38:2739-86
- BROWN ML, ABEL MD, CLOCK RL, et al. Systolic anterior motion after mitral valve repair: Is surgical intervention necessary ? J Thorac Cardiovasc Surg 2007; 133:136-43
- CALAFIORE AM, GALLINA S, DI MAURO M, et al. Mitral valve procedure in dilated cardiomyopathy: repair or replacement ? Ann Thorac Surg 2001; 71:1146-52
- CARPENTIER AF, LESSANA A, RELLAND JYM, et al. The “Physio-Ring”: an advanced concept of mitral valve annuloplasty. Ann Thorac Surg 1995; 60:1177-85
- CRESCENZI C, LANDONI G, ZANGRILLO A, et al. Management and decision-making strategy for systolic anterior motion after mitral valve repair. J Thorac Cardiovasc Surg 2009; 137:320-5
- DE BONIS M, AL-ATTAR N, ANTUNES M, et al. Surgical and interventional management of mitral valve regurgitation: a position statement from the European Society of Cardiology working groups on Cardiovascular Surgery and Valvular Heart Disease. Eur Heart J 2016; 37:133-9
- DELOCHE A, JEBARA VA, RELLAND JY, et al. Valve repair with Carpentier techniques. The second decade. J Thorac Cardiovasc Surg 1990; 99:990-7
- ENDER J, EIBEL S, MUKHERJEE C, et al. Prediction of the annuloplasty ring size in patients undergoing mitral valve repair using real-time three-dimensional transoesophageal echocardiography. Eur J Echocardiogr 2011; 12:445-53
- ENRIQUEZ-SARANO M, AKINS CW, VAHANIAN A. Mitral regurgitation. Lancet 2009; 373:1382-94
- ESSANDOH M. Intraoperative echocardiographic assessment of mitral valve area after degenerative mitral valve repair: a call for guidelines or recommendations. J Cardiothorac Vasc Anesth 2016; 30:1364-8
- FISCHER GW, ANYANWU AC, ADAMS DH. Intraoperative classification of mitral valve dysfunction: The role of the anesthesiologist in mitral valve reconstruction. J Cardiothorac Vasc Anesth 2009; 23:531-43
- FLAMENG W, MEURIS B, HERIJGERS P, et al. Durability of mitral valve repair in Barlow disease versus fibroelastic deficiency. J Thorac Cardiovasc Surg 2008; 135:274-82
- GELSOMINO S, VAN GARSSE I, LUCA F, et al. Left ventricular strain in chronic ischemic mitral regurgitation in relation to mitral tethering pattern. J Am Soc Echocardiogr 2013; 26:370-80
- GILINOV AM, COSGROVE DM. Reoperation for failure of mitral valve repair. J Thorac Cardiovasc Surg 1997; 113:467-73
- GILINOV AM, COSGROVE DM, BLACKSTONE EH, et al. Durability of mitral valve repair for degenerative disease. J Thorac Cardiovasc Surg 1998; 116:734-43
- GRAYBURN PA, CARABELLO B, HUNG J, et al. Defining "severe" secondary mitral regurgitation. Emphasizing an integrated approach. J Am Coll Cardiol 2014; 64:2792-801
- GREWAL J, MANKAD S, FREEMAN WK. Real-time three-dimensional transesophageal echocardiography in the intraoperative assessment of mitral valve disease. J Am Soc Echocardiogr 2009; 22:34-41
- JAIN P, FABBRO M. ACC Expert Consensus Decision Pathway on the management of mitral regurgitation: A review of the 2017 document fot cardiac anesthesiologist. J Cardiothorac Vasc Anesth 2019; 33:274-89
- KONGSAEREPONG V, SHIOTA M; GILLINOV AM, et al. Echocardiographic predictors of successful versus unsuccessful mitral valve repair in ischemic mitral regurgitation. Am J Cardiol 2006; 98:504-8
- KWAK J, ANDRAWES M, GARVIN S, et al. 3D transesophageal echocardiography: a review of recent literature 2007-2009. Curr Opin Anesthesiol 2010; 23:80-8
- LANCELLOTTI P, FATTOUCH K, LA CANNA G. Therapeutic decision-making for patients with fluctuating mitral regurgitation. Nat Rev Cardiol 2015; 12:212-9
- LANCELLOTTI P, TRIBOUILLOY C, HAGENDORFF A, et al. Recommendations for the echocardiographic assessment of native valvular regurugitation: an executive summary from the EACI. Eur Heart J Cardiovasc Imaging 2013; 14:611-44
- LANG RM, BADANO LP, TSANG W, et al. EAE/ASE recommendations for image acquisition and display using three-dimensional echocardiography. Eur Heart J Cardiovasc Imaging 2012; 13:1-46
- LEE APW, ACKER M, KUBO SH, et al. Mechanisms of recurrent functional mitral regurgitation after mitral valve repair in nonischemic dilated cardiomyopathy. Circulation 2009; 119:2606-14
- LOULMET DF, YAFFEE DW, URSOMANNO PA, et al. Systolic anterior motion of the mitral valve: a 30-year perspective. J Thorac Cardiovasc Surg 2014; 148:2787-94
- MAHMOOD F, MATYAL R. A quantitative approach to the intraoperative echocardiographic assessment of the mitral valve for repair. Anesth Analg 2015; 121:34-58
- MASLOW A. Mitral valve repair: an echocardiographic review: Part I. J Cardiothorac Vasc Anesth 2015; 29:156-77
- MASLOW A. Mitral valve repair: an echocardiographic review: Part II. J Cardiothorac Vasc Anesth 2015; 29:439-71
- MASLOW AD, HAERING JM, LEVINE RA, et al. Echocardiographic predictors of left ventricular outflow tract obstruction and systolic anterior motion of the mitral valve after mitral valve reconstruction for myxomatous valve disease. J Am Coll Cardiol 1999; 34:2096-104
- MOHTI D, ORSZULAK TA, SCHAFF HV. Very long-term survival and durability of mitral valve repair for mitral valve prolapse. Circulation 2001; 104:II-7
- NISHIMURA RA, OTTO CM, BONOW RO, et al. 2014 AHA/ACC Guideline for the management of patients with valvular heart disease. Circulation 2014; 129:e521-e643
- NISHIMURA RA, OTTO CM, BONOW RO, et al. 2017 AHA/ACC focused update of the 2014 AHA/ACC Guideline for the management of patients with valvular heart disease. J Am Coll Cardiol 2017; 70:252-89
- NISHINO S, WATANABE N, KIMURA T, et al. Acute versus chronic ischemic mitral regurgitation. An echocardiographic study of anatomy and physiology. Circ Cardiovasc Imaging 2018; 11:e007028
- OMRAN AS, WOO A, DAVID TE, et al. Intraoperative transesophageal echocardiography accurately predicts mitral valve anatomy and suitability for repair. J Am Soc Echocardiogr 2002; 15:950-7
- RIZZA A, SULCAJ L, GLAUBER M, et al. Predictive value of less than moderate residual mitral regurgitation as assessed by transesophageal echocardiography for the short-term outcomes of patients with mitral regurgitation treated by mitral valve repair. Cardiovasc Ultrasound 2007; 5:25
- SLEILATY G, EL RASSI I, JEBARA V. Mitral valve repair. In: MATHEW JP, AYOUB CM, SWAMINATHAN M. Clinical manual and review of transesophageal echocardiography. 2nd ed. New-York: McGraw Hill Medical, 2010, 175-194
- SUGENG L, CHANDRA S, LANG RM. Three-dimensional echocardiography for assessment of mitral valve regurgitation. Curr Opin Cardiol 2009; 24:420-5
- TAHTA SA, OURY JH, MAXWELL JM, et al. Outcome after mitral valve repair for functional ischemic mitral regurgitation. J Heart Valve Dis 2002; 11:11-8
- UDELSON JE, STEVENSON LW. The future of heart failure diagnosis, therapy and management. Circulation 2016; 133:2671-86
- VARGHESE R, ITAGAKI S, ANYANWU AC, et al. Predicting systolic anterior motion after mitral valve reconstruction: using intraoperative transesophageal echocardiography to identify those at greatest risk. Eur J CardioThorac Surg 2014; 45:132-37
- YAMAUCHI T, TANIGUCHI K, KUKI S, et al. Evaluation of the mitral valve leaflet morphology after mitral valve reconstruction with a concept of “coaptation length index”. J Card Surg 2005; 20:432-5
- ZOGHBI WA, ADAMS D, BONOW RO, et al. Recommendations for noninvasive evaluation of native valvular regurgitation: a report from the ASE developped in collaboration with the SCMR. J Am Soc Echocardiogr 2017; 30:303-71
