La TGV est la cardiopathie cyanogène la plus fréquente à la naissance; elle représente 5-7% des cardiopathies congénitales et prédomine chez les garçons. Dans la TGV, il existe une discordance complète de la jonction ventriculo-artérielle: l'aorte sort du ventricule anatomiquement droit, qui fonctionne donc comme ventricule systémique; l'artère pulmonaire est issue du ventricule morphologiquement gauche. Dans la dextro-TGV (D-TGV, ou TGV classique), les deux vaisseaux sont parallèles, l’aorte est antérieure et l’artère pulmonaire est postérieure; la valve aortique est en avant et à droite de la valve pulmonaire (Figure 14.64).
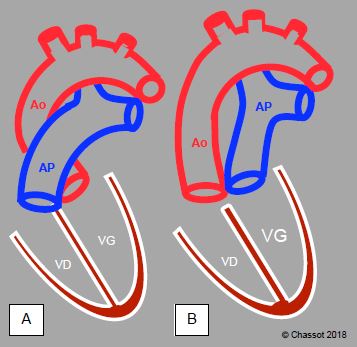
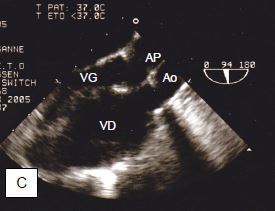
Figure 14.64 : Illustration schématique d'une transposition des gros vaisseaux (TGV). A : position normale de l'aorte et de l'artère pulmonaire. B : position des vaisseaux dans une TGV. C : vue long-axe de l’aorte et de l’AP qui apparaissent parallèles au lieu de se croiser à 45°. Le ventricule anatomiquement droit est hypertrophié puisqu’il fonctionne comme ventricule systémique (sous-aortique).
Dans la lévo-TGV (ou L-TGV) l'aorte et l'AP sont aussi parallèles, mais côte-à-côte sur le plan frontal; la L-TGV est accompagnée d'une discordance des ventricules: c'est la TGV congénitalement corrigée (voir ci-dessous Figure 14.69).
Dans la D-TGV, la circulation systémique et la circulation pulmonaire tournent en parallèle et non en continuité. La survie n’est possible que si un canal artériel, une CIA ou une CIV (présente dans 30-40% des cas) assure un mélange des sangs veineux et artérialisés. Les enfants qui ont un septum intact sont profondément cyanosés. L’obstruction de la CCVG (30% des cas) et les anomalies coronariennes ne sont pas rares (voir Figure 14.73) et compliquent la reconstruction chirurgicale. Comme les RAP baissent pendant les 2 premières semaines de vie, le VG perd rapidement de sa masse et s’hypotrophie; le VD, au contraire, s’hypertrophie puisqu’il est connecté aux RAS. Le débit et la direction des shunts dépenent de leur position et des RAP. Le shunt est habituellement D-G par la CIV et le canal artériel, mais G-D par la CIA [15].
Dans la D-TGV, la circulation systémique et la circulation pulmonaire tournent en parallèle et non en continuité. La survie n’est possible que si un canal artériel, une CIA ou une CIV (présente dans 30-40% des cas) assure un mélange des sangs veineux et artérialisés. Les enfants qui ont un septum intact sont profondément cyanosés. L’obstruction de la CCVG (30% des cas) et les anomalies coronariennes ne sont pas rares (voir Figure 14.73) et compliquent la reconstruction chirurgicale. Comme les RAP baissent pendant les 2 premières semaines de vie, le VG perd rapidement de sa masse et s’hypotrophie; le VD, au contraire, s’hypertrophie puisqu’il est connecté aux RAS. Le débit et la direction des shunts dépenent de leur position et des RAP. Le shunt est habituellement D-G par la CIV et le canal artériel, mais G-D par la CIA [15].
Les nouveaux-nés porteurs d'une TGV sans shunt suffisant sont cyanosés dès la naissance (SaO2 < 60%) et ne survivent pas sans une intervention précoce, dont le pronostic a été grandement amélioré par le diagnostic prénatal [5,12].
- Maintien du flux par le canal artériel au moyen d’une perfusion de prostaglandine E1 (0.01-0.05 mcg/kg/min) dès la naissance.
- Opération de Rashkind: par cathétérisme, on déchire le septum interauriculaire pour créer ou agrandir la CIA (dilatation au ballon); on procède à cette intervention dans les premières heures après la naissance.
Plusieurs interventions chirurgicales permettent d'assurer la survie ultérieure des nourrissons. Elles sont en général réalisées pendant les premières semaines ou les premiers mois de vie.
- Opération de Mustard ou de Senning: un patch complexe positionné entre les deux oreillettes (interatrial baffle) permet de rediriger le sang veineux systémique vers le ventricule sous-pulmonaire et le sang artérialisé vers le ventricule sous-aortique (Figure 14.65). Malheureusement, le ventricule anatomiquement droit reste le ventricule systémique, ce qui ne permet pas une survie normale; il souffre de la surcharge de pression et de l'ischémie liée à un déséquilibre entre l'apport et la demande en O2 [7]. Il dysfonctionne vers 20-25 ans [10]. Ce type de reconstruction n’est plus guère pratiqué à cause de ses nombreuses complications : arythmies sus-jonctionnelles, obstruction du retour veineux systémique ou pulmonaire, défaillance ventriculaire droite terminale, shunts résiduels.
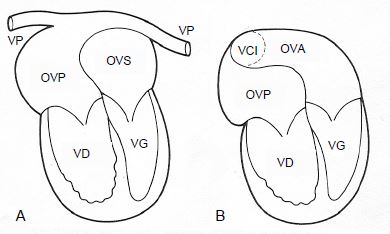
Figure 14.65 : Opération de Mustard pour TGV: un patch complexe positionné entre les deux oreillettes (interatrial baffle) permet de rediriger le sang veineux systémique vers le ventricule sous-pulmonaire (VG) et le sang artérialisé vers le ventricule sous-aortique (VD). Le ventricule systémique est le ventricule droit. A : les veines pulmonaires (VP) se drainent dans une oreillette veineuse postérieure (OVP) connectée au VD sous-aortique. B : la veine cave inférieure (VCI) se draine dans la partie basse d’une oreillette veineuse antérieure (OVA) connectée au VG sous-pulmonaire. La veine cave supérieure se draine de la même manière dans la partie haute de l’OVA [16].
- Opération de Jatene (switch artériel) pratiquée dès 3 jours et jusqu'à 3 semaines de vie [2]: on croise les gros vaisseaux en reconnectant l'AP sur le VD et l'aorte sur le VG avant que le remodelage des ventricules ne soit significatif et que le VG perde de sa masse avec la baisse post-natale des RAP. L’AP est positionnée antérieurement à l’aorte (manœuvre de Lecompte); les coronaires sont réimplantées dans le conduit aortique (Figure 14.66). Le cas échéant, la CIA ou la CIV est fermée. Cette reconstrucion présente un risque d’ischémie myocardique (défaut d'anastomose, torsion d'un vaisseau, compression) mais offre une reconstruction anatomique et une survie de > 90% à 20 ans une fois passée la mortalité périopératoire immédiate (3%) [13,18]. La néo-valve aortique (ex-valve pulmonaire) est facilement insuffisante.
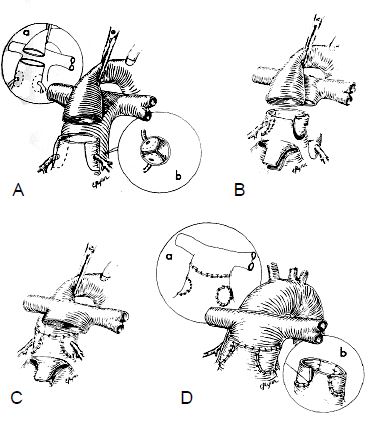
Figure 14.66 : Opération de Jatene (switch artériel): croisement des gros vaisseaux en reconnectant l'AP sur le VD et l'aorte sur le VG. A : trans-section de l’aorte et excision des coronaires. B : l’AP est excisée et les coronaires sont réimplantées dans la partie proximale de l’AP connectée au VG. C : l’AP est positionnée antérieurement à l’aorte (manœuvre de Lecompte) ; l’AP proximale est anastomosée à l’aorte distale ; l’aorte est déclampée. D : les sites de prélèvement des coronaires sont occlus avec du péricarde ou un tissu synthétique et l’aorte proximale, connectée au VD, est anastomosée à l’AP distale [5]. Cette reconstrucion présente un risque d’ischémie myocardique.
- Si la CIV est importante, le VG est soumis à la pression systémique et conserve sa masse, mais si le septum est intact ou que le switch artériel ne peut pas être réalisé assez tôt, sa connexion à l'AP lui fait perdre sa puissance. Dans ce cas, il faut le reconditionner à éjecter contre des résistances élevées par un cerclage pulmonaire préalable qui augmente sa postcharge. La perte de débit pulmonaire est compensée si nécessaire par un shunt de type Balock [15]
- Opération de Rastelli : lorsque la TGV est associée à une CIV et à une obstruction de la CCVG, on peut fermer la CIV avec un patch orienté de manière à ce que le sang du VG soit dirigé vers l’aorte; un conduit valvé est construit entre la VD et l’AP (Figure 14.67).
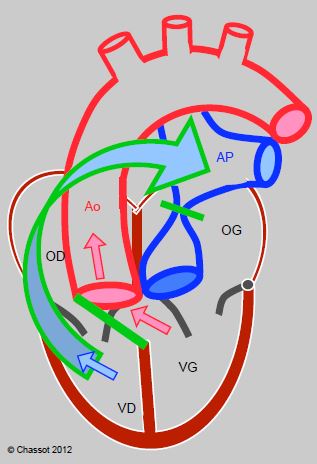
Figure 14.67 : Opération de Rastelli : lorsque la TGV est associée à une CIV et une obstruction de la CCVG, on peut fermer la CIV avec un patch (barre verte) orienté de manière à ce que le sang du VG soit dirigé vers l’aorte. L’AP proximale est ligaturée et un conduit valvé (flèche vert-bleu) est construit entre la VD et l’AP. Le sang veineux (flèche bleue) et le sang artériel (flèches rouges) sont séparés et dirigées respectivement vers le conduit-AP et l’aorte.
- Opération de Damus-Kaye-Stansel : l’AP proximale est anastomosée termino-latéralement à l’aorte ascendante lorsque celle-ci est hypoplasique, et sa partie distale est suturée ; un conduit valvé est placé entre le VD et l’AP distale. La pression qui règne dans l’aorte maintient la valve aortique fermée (elle doit être compétente) (Figure 14.68).
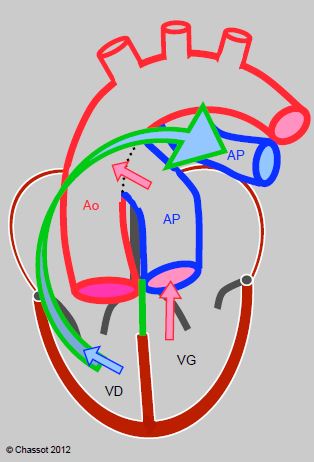
Figure 14.68 : Opération de Damus-Kaye-Stansel : l’AP proximale est anastomosée termino-latéralement à l’aorte ascendante, et la partie distale est suturée ; un conduit valvé est placé entre le VD et l’AP distale. Le sang veineux (flèche bleue) est séparé du sang artériel (flèches rouges). La pression qui règne dans l’aorte maintient la valve aortique fermée (elle doit être compétente) [4].
Le switch artériel est actuellement l’intervention de premier choix. La reconstruction étant anatomique, le cœur a une fonction normale, pour autant que l’opération ait eu lieu assez tôt pour empêcher une involution irréversible du VG connecté au système à basse pression de l’AP. Hormis une mortalité périopératoire de 3%, l'espérance de vie est quasi normale (97% à 10 ans) [13,19]. Les séquelles possibles sont une dilatation de la racine aortique avec une fuite pulmonaire ou aortique (30% des cas), une ischémie myocardique (10% des cas) et une obstruction de la CCVD ou de la CCVG [9,18,19].
Anesthésie pour switch artériel
A 1-3 semaines de vie, le nouveau-né souffrant d’une TGV présente des particularités qui augmentent le risque opératoire.
- Persistance de l’hypertension pulmonaire et retour à une circulation transitionnelle lors de stress (voir Figure 14.4);
- Canal artériel souvent encore perméable (perfusion de PGE1), d’où une réduction de la PA systémique;
- Désaturation artérielle importante (SaO2 ≤ 75%).
Basée principalement sur de hautes doses de fentanyl/sufentanil et suffisamment profonde pour diminuer la VO2, l’anesthésie ne peut guère influencer la répartition des flux pulmonaire et systémique, car le rapport Qp/Qs est fixé par l’anatomie. La baisse de précharge et de contractilité induite par l’anesthésie et l’augmentation de pression intrathoracique par la ventilation en pression positive peuvent réduire considérablement le mélange des sangs veineux et artérialisé au niveau auriculaire, particulièrement chez les enfant qui n’ont pas de CIV. Il s’ensuit une profonde désaturation artérielle, qui demande une ventilation hyperoxique (FiO2 1.0) et une normocarbie.
Le monitorage comprend la SaO2, la ScO2, un cathéter artériel (ombilical, radial ou fémoral), une voie centrale percutanée, éventuellement un cathéter transthoracique dans l’OG (introduit en fin de CEC) et l’échocardiographie transoesophagienne. A cet âge, la sonde d’ETO pédiatrique peut facilement gêner la ventilation et augmenter le pic de pression des voies aériennes; il est préférable d’utiliser la mini-sonde actuellement sur le marché. Le but de l’ETO est de pouvoir surveiller en continu le degré de remplissage, la fonction biventriculaire, la contractilité segmentaire, les défauts résiduels éventuels, les gradients transanastomotiques de l’AP et de l’aorte et une insuffisance de la néo-valve aortique.
En l’absence de CIV, le VG peut être insuffisamment développé pour assumer la postcharge systémique, et peut réclamer une forte stimulation inotrope (dobutamine, adrénaline-milrinone) ou une assistance en sortant de CEC (ECMO). La présence d’une CIV maintient une charge importante sur le VG, ce qui l’empêche d’involuer et facilite la mise en charge. L’hémodynamique recherchée est un débit cardiaque satisfaisant (SaO2 et SvO2 normales, absence d’acidose métabolique), une PA systémique de 50-75 mmHg et une POG de 4-6 mmHg. On évite toute manœuvre qui pourrait augmenter les RAP ou abaisser les RAS [15]. Une dysfonction diastolique sévère du VG est particulièrement fréquente. Une dysfonction ventriculaire ou un échec de sortie de pompe doivent être considérées comme d'origine ischémique jusqu'à preuve du contraire, car la réimplantation coronarienne est la manœuvre la plus sujette à complication [18]. Une extubation précoce (< 6 heures) est envisageable si la situation est calme [1]. Les complications peropératoires comme l'hypoxémie, l'acidose, le bas débit ou la prolongation de la CEC sont directement associées au retard de développement neurocognitif [3]. L’intervention ayant lieu avant que les RAP se soient normalisées, une crise vasospastique pulmonaire est toujours possible. Dans ce cas, le VD peut également défaillir et nécessiter une aide inotrope (dobutamine, milrinone) et un traitement de l’hypertension pulmonaire (PGE1, NO•) (voir Tableau 14.7).
Les manipulations imposées aux coronaires augmentent le risque ischémique: la surveillance du segment ST et de la contractilité segmentaire à l’ETO est essentielle pour évaluer le besoin d’un traitement spécifique: augmentation de la pression artérielle (nor-adrénaline), nitroglycérine (1-2 mcg/kg/min), ou reprise chirurgicale de la réimplantation de la coronaire concernée. Un cercle vicieux peut très vite s'installer entre l'ischémie et la dilatation ventriculaire, chacune renforçant l'autre.
| Transposition des gros vaisseaux (TGV) |
|
Malades opérés dans l’enfance (pas de survie sans traitement ou palliation). Actuellement : switch artériel à 5-20 jours de vie (poids moyen 3 kg)
Croisement des retours veineux (opérations de Mustard et de Senning). Problèmes :
- Le VD reste le ventricule systémique, d’où défaillance droite vers 20-30 ans
- Obstruction dynamique de la CCVG
- Stase veineuse
- Arythmies
Décroisement artériel (opération de Jatène, switch artériel). Problèmes :
- IA (néo-valve aortique)
- Ischémie myocardique (réimplantation coronaire)
- Obstruction dynamique de la CCVG et/ou de la CCVD
Caractéristiques pour l’anesthésie
- Après switch auriculaire : défaillance droite (ventricule systémique), arythmies auriculaires, stase veineuse
- Après switch artériel : physiologie normale, mais potentielle insuffisance du VG; risque : IA, ischémie coronarienne, insuffisance aortique
|
TGV naturellement corrigée
Si une discordance auriculo-ventriculaire se rajoute à la discordance ventriculo-artérielle, la survie devient possible, car les circulations systémique et pulmonaire sont de nouveau en continuité. C'est le cas de la transposition naturellement corrigée des gros vaisseaux. Dans cette anomalie, l'AP et l'aorte sont transposées comme dans la TGV, mais les ventricules sont également inversés (Vidéo). L’aorte se trouve à la gauche de l’AP (L-TGV); les deux vaisseaux sont côte-à-côte dans le plan frontal. De ce fait, le sang suit une séquence physiologique à travers des cavités croisées: OD → VG → AP → poumons → OG→ VD → Ao. Le système coronarien est inversé, la CD se trouvant à gauche et le tronc commun à droite (Figure 14.69).
Vidéo: Transposition naturellement corrigée des gros vaisseaux. La TGV (non visible dans cette vue) est accompagnée d'une transposition des ventricules: le VG est à droite et le VD à gauche, comme le prouvent la présence dans le VD d'un pilier septal et d'une insertion de la valve tricsupide plus apicale que celle de la mitrale.
Vidéo: Transposition naturellement corrigée des gros vaisseaux. La TGV (non visible dans cette vue) est accompagnée d'une transposition des ventricules: le VG est à droite et le VD à gauche, comme le prouvent la présence dans le VD d'un pilier septal et d'une insertion de la valve tricsupide plus apicale que celle de la mitrale.
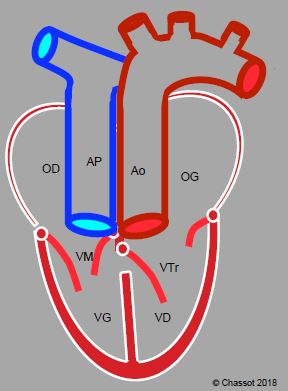
Figure 14.69 : Transposition des gros vaisseaux (TGV) naturellement corrigée ou L-TGV. A la discordance ventriculo-artérielle (TGV) s’ajoute une discordance auriculo-ventriculaire. L’OD est connectée à une valve mitrale (VM) et à un ventricule anatomiquement gauche (VG), puis à l’AP. Le sang oxygéné revient à l’OG par les veines pulmonaires ; l’OG se draine à travers une valve tricuspide dans un ventricule anatomiquement droit, connecté à l’aorte. Le malade n’est pas cyanosé, mais son ventricule systémique est un ventricule droit, qui défaille après 20 ans.
Ces malades ne sont pas cyanosés, mais le ventricule anatomiquement droit se retrouve en position sous-aortique, donc fonctionnant comme ventricule systémique. Il se dilate, développe une insuffisance tricuspidienne (IT) sévère, et devient insuffisant vers 20-25 ans [6]. C'est souvent à ce moment-là que le diagnostic est posé (voir Chapitre 15 TGV naturellement corrigée). La TGV corrigée n’est symptomatique chez l’enfant que si le VD défaille prématurément ou s’il se développe une cyanose due à une CIV avec sténose de la CCVG (présentes dans 40-50% des cas) qui entraînent un shunt D-G. Le bloc AV complet est fréquent parce que l'anatomie de la jonction auriculo-ventriculaire est anormale [15].
Selon le type de lésion associée (CIV, obstruction de la CCVG, insuffisance tricuspidienne) et l’évolution de la symptomatologie, il existe deux options chirurgicales.
- Correction "classique" : plastie tricuspidienne, avec fermeture de la CIV et/ou élargissement de la CCVG si indiqué. Le VD reste le ventricule systémique; il développe une dysfonction postopératoire dans 50% des cas. Un bloc AV complet survient dans 25% des cas (mortalité opératoire : 10%) [17].
- Correction "anatomique" : double switch auriculaire (Senning) et artériel (Jatene); ceci n’est possible que si la valve mitrale est compétente et que s'il n'existe pas d'obstruction de la CCVG (mortalité opératoire 8%) [14]. Elle demande une préparation du VG à assumer la pression systémique par un cerclage préalable de l'AP pour augmenter sa postcharge et rétablir la position du septum interventriculaire; une retransposition de l'aorte et de l'AP (éventuellement avec un conduit) est réalisée ensuite [8]. L'intervention a lieu entre 3 et 24 mois selon la fonction ventriculaire, la taille de la CIV et l'importance de l'insuffisance tricuspidienne. La survie à long terme est de 75-85% [11].
La prise en charge anesthésique est dominée par la dysfonction du VD, l’importance de l’IT et les blocs de conduction. La baisse des RAS (vasodilatateur systémique, isoflurane) facilite l’éjection du VD et réduit l'insuffisance tricuspidienne, mais les RAS doivent être suffisamment maintenues pour assurer la perfusion coronarienne. Le PiCCO™ est très utile pour la surveillance hémodynamique. L'ETO est essentielle pour l'évaluation de la fonction ventriculaire et de la volémie.
| TGV naturellement corrigée |
|
Discordance auriculo-ventriculaire + discordance ventriculo-artérielle. Trajet du sang: OD → VG → AP → poumons → OG → VD → Ao. Pas de cyanose, souvent asymptomatique dans l’enfance; insuffisance tricuspidienne souvent massive. Le problème: le ventricule systémique est le VD (défaillance à long terme).
|
© BETTEX D, BOEGLI Y, CHASSOT PG, Juin 2008, dernière mise à jour Mai 2018
Références
- ALGHAMDI AA, SINGH SK, HAMILTON BCS, et al. Early extubation after pediatric cardiac surgery: systematic review, meta-analysis, and evidence-based recommendations. J Card Surg 2010; 25:586-95
- ANDERSON BR, CIARLEGLIO AJ, HAYES DA; et al. Earlier arterial switch operation improves outcomes and reduces costs for neonates with transposition of the great arteries. J Am Coll Cardiol 2014; 63:481-7
- ANDROPOULOS DB, EASLEY RB, BRADY K, et al. Five-year neurocognitive and health outcomes after the neonatal arterial switch operation. Ann Thorac Surg 2012; 94:1250-5
- CASTANEDA AR, JONAS RA, MAYER JE, HANLEY FL. Cardiac Surgery of the Neonate and Infant. Philadelphia:WB Saunders, 1994, 23
- CASTANEDA AR, NORWOOD WI, JONES RA, et al. Transposition of the great arteries and intact ventricular system : Anatomical repair in the neonate. Ann Thorac Surg 1984 ; 38 :440
- CONNELLY MS, ROBERTSON P, LIU P, et al. Congenitally corrected transposition of the great arteries in adults: Natural history. Circulation 1994; 90:I-51
- DAVLOUROS PA, NIWA K, WEBB G, GATZOULIS MA. The right ventricle in congenital heart disease. Heart 2006; 92(Suppl 1): i27-i38
- FILIPPOV AA, DEL NIDO PJ, VASILYEV NV. Management of systemic right ventricular failure in patients with congenitally corrected transposition of the great arteries. Circulation 2016; 134:1293-302
- FORMIGARI R, TOSCANO A, GIARDINI A, et al. Prevalence and predictors of neoaortic regurgitation after arterial switch operation for transposition of the great arteries. J Thorac cardiovasc Surg 2003; 126:1753-9
- GRAHAM TP. Ventricular performance in congenital heart disease. Circulation 1991; 84:2259-74
- HIRAMATSU T, MATSUMURA G, KONUMA T, et al. Long-term prognosis of double-switch operation for congenitally corrected transposition of the great arteries. Eur J Cardiothorac Surg 2012; 42:1004-8
- HONJO O, Van ARSDELL GS. Cardiovascular procedures : surgical considerations. In : BISSONNETTE B, edit. Pediatric anesthesia. Basic principles, State of the art, Future. Shelton (CO): People’s Medical Publishing House (USA), 2011, 1589-608
- HOVEL-GURICH HH, SEGHAYE MC, MA Q, et al. Long-term results of cardiac and general health status in children after neonatal arterial switch operation. Ann Thorac Surg 2003; 75:935-43
- KARL TR, WEINTRAUB RG, BRIZARD CP, et al. Senning plus arterial switch operation for discordant (congenitally corrected) transposition. Ann Thorac Surg 1997; 64:495-502
- NASR VG, DINARDO JA. The pediatric cardiac anesthesia handbook. Oxford: Wiley-Blackwell, 2017; 147-60
- STÜMPER O, SUTHERLAND GR. Evaluation of Mustard and Senning procedures. In: STÜMPER O, SUTHERLAND GR. Transesophageal echocardiography in congenital heart disease. London, Edward Arnold, 1994, 247-60
- TERMIGNON JL, LECA F, VOUHE PR, et al. "Classic" repair of congenitally corrected transposition and ventricular septal defect. Ann Thorac Surg 1996 ; 62 :199-206
- VILLAFAÑE J, LANTIN-HERMOSO MR, BHATT AB, et al. D-transposition of the great arteries. The current era of the arterial switch operation. J Am Coll Cardiol 2014; 64:498-511
- WILLIAMS WG, McCRINDLE BW, ASHBURN DA, et al. Outcomes of 829 neonates with complete transposition of the great arteries 12-17 years after repair. Eur J Cardiothorac Surg 2003; 24:1-9
