Données générales
La chirurgie instaure un état d'insuffisance fonctionnelle en insuline endogène. Les besoins en sont augmentés par les hormones de stress, par l'infection et par l'excès métabolique que représente une intervention majeure, alors que sa concentration baisse dès l'induction de l'anesthésie [4]. La concentration en glucose s'élève dès le début de la chirurgie parallèlement à l'augmentation du cortisol et des catécholamines endogènes; simultanément, l'utilisation périphérique de l'insuline diminue ("résistance" à l'insuline).
En préopératoire, les données essentielles dont il faut disposer pour évaluer un diabétique sont la glycémie, l'hémoglobine glycosylée (HbA1c), la clairance de la créatinine, le BMI et la pression artérielle. Avant l'induction, il est de routine de contrôler la glycémie (capillaire, intraveineuse ou par la gazométrie artérielle) afin d'avoir une valeur de base sur laquelle établir le dosage des injections ou la vitesse de la perfusion d'insuline. Cette dernière doit être administrée par une voie veineuse indépendante (cathéter central multi-lumière) pour éviter les à-coups occasionnés par la variation des autres fluides. Elle est souvent accompagnée d'une perfusion simultanée et indépendante de glucose. L'administration d'insuline est scrupuleusement consignée sur la feuille d'anesthésie. La glycémie est contrôlée au minimum chaque heure. Si l'opération impose de ne sauter qu'un seul repas (same day surgery), la régulation de la glycémie peut se faire par des agents oraux ou par la couverture de l'insuline lente prise par le patient, mais ce dernier doit pouvoir s'alimenter dans les heures qui suivent l'opération. Il faut donc prévoir une reprise rapide du transit (prescription d'antiémétiques, pas d'opiacés postopératoires). L'anesthésie loco-régionale diminue le risque de nausée et de douleur, mais les complications neurologiques sont plus fréquentes chez les diabétiques à cause de leur neuropathie [24]. Dès que le jeûne imposé par l'opération s'étend au-delà de 24 heures, une perfusion d'insuline et de glucose doit être prévue [6].
Le but poursuivi pendant l'anesthésie du patient diabétique s'est longtemps contenté de limiter les risques d'hypoglycémie. Le jeûne, l'augmentation des besoins peropératoires en insuline et l'inconscience d'une anesthésie générale contribuent en effet à accroître les risques d'une hypoglycémie sévère, qui passe inaperçue si l'on ne dose pas le glucose circulant. Mais il est apparu que même dans les situations aiguës (salle d'opération, soins intensifs), le contrôle strict de la glycémie améliorait le pronostic des patients et diminuait leur taux de complications à long terme [2,11,35]. La normoglycémie est bénéfique sur le court-terme également, car elle diminue le risque de catabolisme protéique, de décompensation hyperosmolaire, d'acidocétose, de retard de cicatrisation et d'infection de plaie [12,17,21,22,36]. La glycémie visée en peropératoire est située entre 6 et 10 mmol/L; une ascension jusqu'à 11 mmol/l peut être momentanément acceptable chez les non-diabétiques, mais au-delà de cette valeur, l'hyperglycémie de stress est associée à une péjoration plus importante de la mortalité chez les non-diabétiques que chez les diabétiques [34]. Elle doit donc être contrôlée avec la même rigueur dans les deux cas. Une valeur inférieure à 5 mmol/L n'est pas tolérable chez un malade endormi. Par contre, chez un patient éveillé sous un antidiabétique oral qui ne provoque pas d'hypoglycémie comme la metformine, l'acarbose ou les thiazolidinédiones, on peut accepter que la glycémie descende jusqu'à 3.5 mmol/L si le malade est asymptomatique [6,7].
Il est certain que la variation constante dans l'intensité des stimulations sympathiques et du stress rend la stabilité plus aléatoire en salle d'opération qu'en soins intensifs, mais la fourchette dans laquelle la glycémie est tolérée reste de 6 à 10 mmol/L; le maximum tolérable est 11 mmol/L, car le pronostic se modifie au-delà de cette valeur [22]. Lorsqu'il existe un risque d'ischémie cérébrale, comme lors d'arrêt circulatoire en chirurgie cardiaque ou de clampage artériel en chirurgie de l'aorte, on a démontré qu'une augmentation de la glycémie au-delà de 12 mmol/L péjore les conséquences de l'ischémie cérébrale [13,33]. En effet, l'hyperglycémie, lors d'une diminution de l'apport d'oxygène, amène la cellule à fabriquer du lactate, et crée une acidose cellulaire grave accompagnée d'hyperosmolarité et d'œdème particulièrement délétères pour les neurones [3,29]. Toutefois, les résultats cliniques à long terme du contrôle strict de la glycémie sont obérés par la dangerosité extrême de l'hypoglycémie sur les neurones en souffrance et par l'absence de gain en terme de récupération neurologique. Comme pour la situation peropératoire, l'idéal semble se situer à une valeur de glycémie entre 6 et 10 mmol/L [16,33].
Anesthésie
Il n'y a pas de technique d'anesthésie particulière pour le diabétique. Toutefois, il est certain que la diminution des réactions au stress obtenue avec de hautes doses d'opiacés et avec l'anesthésie péridurale thoracique ou combinée facilite le contrôle de la glycémie. En chirurgie abdominale, il n'existe cependant aucune évidence que l'anesthésie loco-régionale soit supérieure à l'anesthésie générale chez le diabétique en terme de mortalité et de complications postopératoires [20]. En cas de neuropathie, il est préférable d'éviter les blocs périphériques ou centraux. La neuropathie et la microangiopathie rendent les points d'appui très sensibles à l'ischémie et à la nécrose, particulièrement les talons. Il est donc important d'être très soigneux avec l'installation de ces malades sur la table d'opération, notamment en protégeant les zones d'appui et de compression avec beaucoup d'ouate et de rembourrage [6].
L’inhibition de la 11-β-hydroxylase par l’etomidate freine la synthèse de cortisol et décroît la réponse hyperglycémiante d’environ 1 mmol/L chez le non-diabétique [10]. Les benzodiazépines à doses élevées freinent la sécrétion d’ACTH et la synthèse de cortisol, ce qui diminue aussi la réponse hyperglycémiante [5]. Les hautes doses de fentanyl bloquent toute la réponse sympathique par une action hypothalamique (bloc de l’axe hypothalamo-hypophysaire) [14].
La glycolysation articulaire propre au diabète de longue durée diminue l’amplitude des mouvements (stiff-joint syndrome) et peut bloquer l’articulation temporo-maxillaire, rendant l’intubation difficile [28]. Le meilleur test préopératoire est la difficulté à opposer les doigts et les paumes des mains (signe de la prière). A cela s’ajoute le retard de vidange gastrique et le risque de régurgitation. Plus d’un tiers des diabétiques souffre de dysautonomie, comme le prouve la perte de la variabilité de la fréquence cardiaque, qui est un marqueur de risque élevé pour des arythmies malignes et des morts subites [32].
La dysautonomie altère l’autorégulation cérébrale, ce qui rend la perfusion cérébrale dépendante de la pression systémique [9]. Ce phénomène est particulièrement important en CEC, pendant laquelle il est capital de maintenir une PAM suffisante (70-75 mmHg) chez les diabétiques pour garantir une oxygénation cérébrale satisfaisante. L’utilisation de la saturométrie cérébrale (ScO2) permet d’ajuster plus finement le débit et la pression de la CEC.
| Diabète et anesthésie |
|
Le stress chirurgical représente un état de besoin accru et de résistance à l'insuline. La glycémie visée en peropératoire est située entre 6 et 10 mmol/L chez les diabétiques comme chez les non-diabétiques; une ascension jusqu'à 11 mmol/l peut être momentanément acceptable. Une valeur inférieure à 5 mmol/L n'est pas tolérable chez un malade endormi à cause du risque d'hypoglycémie grave. La technique d'anesthésie n'a pas d'influence significative, mais la neuropathie diabétique peut être une contre-indication à la loco-régionale. La dysautonomie diabétique cause une labilité tensionnelle et altère l'autorégulation cérébrale (maintenir PAM ≥ 75 mmHg).
|
Contrôle de la glycémie en chirurgie générale (mineure ou intermédiaire)
La veille de l'opération, les malades sous antidiabétiques oraux interrompent leur traitement ou prennent leur dose normale selon la durée de vie des substances (voir ci-dessous Tableau 21.8). Ceux qui sont insulino-dépendants s'injectent le 80% de la dose d'insuline habituelle du soir s'ils sont sous deux doses par jour, ou le 80% de la dose d'insuline habituelle du matin, s'ils sont sous une seule dose quotidienne [6].
La dose d'hypoglycémiant oral est supprimée le matin de l'intervention si le patient doit rester à jeun et sauter un repas. Le médicament est repris dès que l'alimentation est possible: le soir de l'intervention en cas de 2 prises quotidiennes, ou le lendemain en cas d'une seul prise le matin. En cas d'intervention simple qui ne supprime qu'un repas, le régime d'insuline recommandé pour le jour opératoire dépend du type de substance que le patient s'injecte.
- Insuline lente ou ultralente: pas d'injection ou 25% de la dose habituelle selon la glycémie;
- Insuline semilente ou mixte: 25-50% de la dose matinale sous forme d'insuline lente;
- Ajouts d'insuline rapide: stop.
- Reprise des injections dès que l'alimentation du soir est possible.
Dans tous les cas, la glycémie est mesurée à l'arrivée en salle d'opération. Deux tableaux indiquent la gestion des antidiabétiques oraux (Tableau 21.8) et des insulines (Tableau 21.9) dans les cas standards de chirurgie non-cardiaque, telles la chirurgie vasculaire périphérique ou la pose de défibrillateur [6,7].
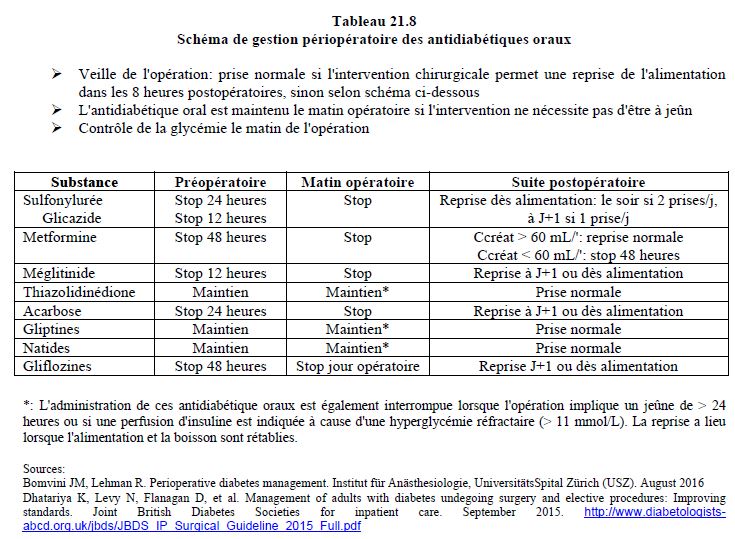
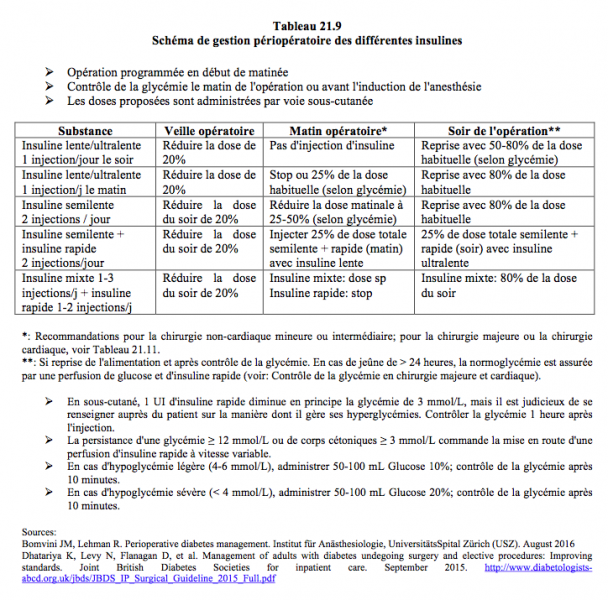
Dans la chirurgie peu invasive, le diabétique bénéficie d'interventions en ambulatoire et d'une reprise rapide de l'alimentation qui lui laissent la possibilité de régler lui-même son régime hypoglycémiant [7,19]. En attendant la possibilité de s'alimenter, le patient peut recevoir de l'insuline rapide par voie sous-cutanée pour régulariser la glycémie lorsque celle-ci dépasse 10 mmol/L (Tableau 21.10).
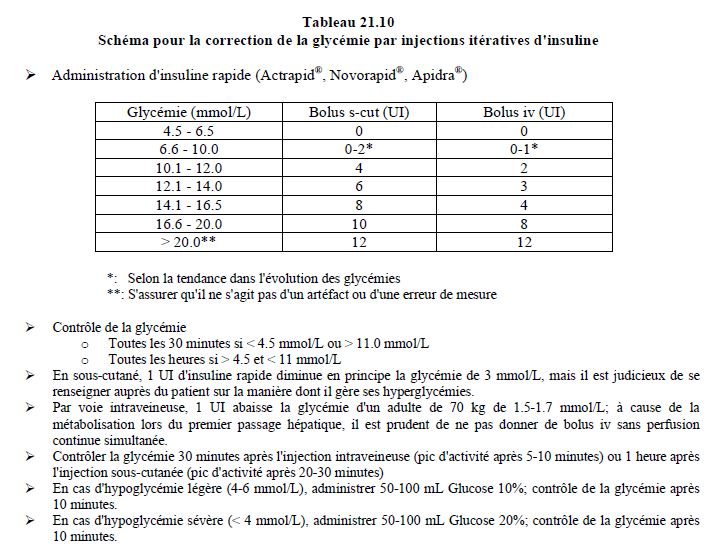
La perfusion d'insuline est réservée aux opérations qui entraînent un jeûne prolongé; elle peut être administrée en complément d'une insuline ultralente maintenue à 80% de sa dose habituelle [6]. Le système de pompe administrant l'insuline sous-cutanée de manière programmée et continue peut convenir à de la chirurgie mineure qui nécessite de ne sauter qu'un seul repas, et qui ne s'accompagne pas de variations hémodynamiques modifiant considérablement la perfusion hypodermique. Un diabétologue doit être consulté afin de reprogrammer la pompe si nécessaire pour le jour de l'intervention. Comme il n'est pas adapté à une intervention chirurgicale importante, ce système doit être interrompu et remplacé par une perfusion intraveineuse d'insuline lors de chirurgie majeure ou cardiaque [25].
Contrôle de la glycémie en chirurgie majeure et en chirurgie cardiaque
Les recommandations pour la veille de l'opération sont les mêmes que précédemment. Par contre, quatre éléments modifient la prise en charge lors de chirurgie lourde.
- Le jeûne du jour opératoire se prolonge bien au-delà de 24 heures;
- Le stress métabolique considérable de l'intervention bouleverse complètement les besoins en insuline et les rend très variables;
- Certaines situations augmentent la résistance à l'insuline et réclament une augmentation des doses: sepsis, état inflammatoire (CRP > 100 mg/L), BMI > 30, stéroïdes concommittants;
- L’instabilité hémodynamique peropératoire et les variations de la perfusion tissulaire rendent aléatoire la résorption des médicaments administrés par voie intra-musculaire ou sous-cutanée.
La perfusion intraveineuse continue d'une insuline rapide (Actrapid®, Novorapid®, Apidra®) à vitesse variable (VRIII: variable rate intravenous insulin infusion) est donc la technique de choix pour contrôler la glycémie dans la situation instable d'une intervention chirurgicale associée à un jeûne prolongé. Une perfusion d'insuline chez un malade endormi présente toutefois certaines contraintes [7,19].
- Le contrôle de la glycémie doit avoir lieu au minimum toutes les heures (maintien à 6-10 mmol/L); les larges oscillations dans les valeurs doivent être évitées à tout prix.
- Le malade étant inconscient, toute hypoglycémie passe inaperçue.
- L'administration d'insuline et de glucose entraîne un apport important d'eau libre et peut conduire à une hyponatrémie.
- La combinaison d'insuline et de glucose force le transport intracellulaire du K+ et peut aboutir à une hypokaliémie.
- La perfusion d'insuline fait partie des manœuvres médicales les plus souvent associées à des accidents iatrogènes.
- L'arrêt d'une perfusion d'insuline rapide supprime toute substance circulante en 5 minutes et provoque une flambée d'hyperglycémie; elle ne doit jamais être interrompue sans que le relai ne soit pris par une forme lente.
- Certains centres recommandent un apport de glucose sous la forme d'une perfusion continue parallèle et indépendante de glucose (10%, 20% ou 50% selon le degré de restriction hydrique nécessaire) pour éviter le risque d'hypoglycémie; le schéma de Portland, qui est le plus largement utilisé, ne contient pas d'apport glucidique (Tableau 21.11).
Chez le patient insulino-dépendant (type I), le réglage de départ de la perfusion correspond au besoin horaire basé sur la dose quotidienne d'insuline divisée par 24 (total journalier en UI/24 heures); les besoins sont multipliés par 1.2-1.5 en cas de sepsis, de consommation de stéroïdes ou de CEC [26]. Toutefois, il faut se souvenir que les besoins peropératoires en insuline sont largement imprévisibles. Une alimentation parentérale totale induit un besoin insulinique de 4 U/heure.
Deux régimes possibles sont proposés ici pour la chirurgie majeure et la chirurgie cardiaque. Le premier est une modification du schéma de Portland, qui ne comporte pas d'apport glucidique; il est exposé dans le Tableau 21.11.
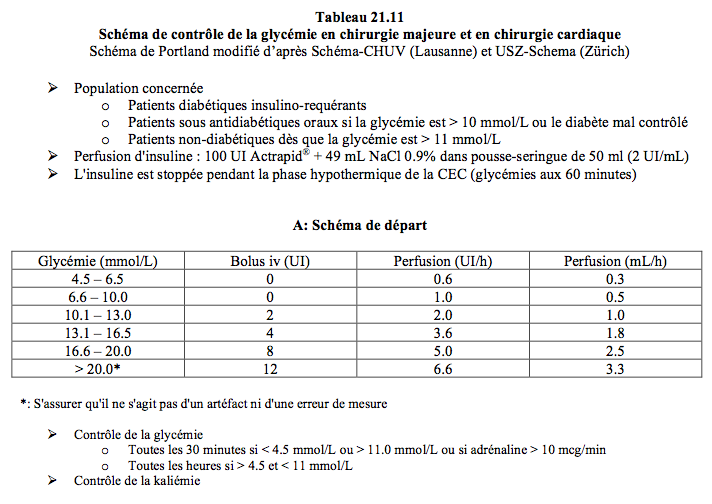
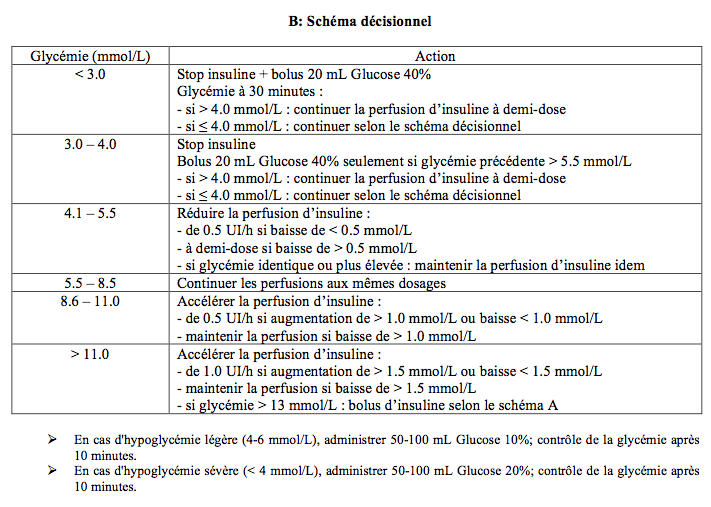
Le deuxième comprend une perfusion d'insuline rapide comme le premier, avec en plus une perfusion simultanée et permanente de glucose pour parer au risque d'hypoglycémie. Il se déroule comme suit.
- Pas d'injection d'insuline le matin opératoire (opération programmée en début de matinée).
- Glycémie et gazométrie artérielle à l'arrivée en salle d'opération.
- Perfusion continue d'insuline (Actrapid®); deux préparations possibles dans pousse-seringue de 50 mL: 1 UI/mL (50 UI dans 49.5 mL glucose 5%), ou 2 UI/mL (100 UI dans 49 mL glucose 5%).
- Débit horaire: dose quotidienne totale / 24 et multipliée par 1.2-1.5;
- Dans le doute : 0.05-0.1 UI/kg/h, puis selon glycémies itératives au minimum aux 60 minutes (prélèvements par la CEC ou par voie centrale/artérielle, mais non par voie capillaire);
- 1 U iv abaisse la glycémie d'un adulte de 70 kg de 1.4-1.7 mmol/L.
- Perfusion indépendante de glucose 10%, 20% ou 50% (pompe-seringue) ; la solution de glucose est concentrée pour diminuer l’apport hydrique à cause de la CEC.
- Points de repère :
- 2 g glucose / UI insuline pour abaisser la glycémie,
- 3 g glucose /UI pour maintenir la glycémie stable ;
- En cas de simple hyperkaliémie : 5 g glucose / 1 UI insuline.
- Lorsque les variations de la glycémie sont faibles, il est plus simple de maintenir stable la perfusion d’insuline et de modifier le débit de celle de glucose, qui est plus rapide.
- Glycémie toutes 30-60 minutes; contrôle fréquent de l'équilibre acido-basique.
- Arrêt des perfusions d’insuline et de glucose pendant le temps hypothermique de la CEC (sécurité à cause de la baisse du métabolisme < 32°C).
- Reprise des perfusions dès le réchauffement (après glycémie de contrôle).
- Administration de potassium selon la kaliémie; se souvenir que la cardioplégie est déjà responsable d'une hyperkaliémie pendant et après la CEC.
- Le régime de perfusion insuline-glucose est continué pendant au moins trois jours dans le postopératoire.
Une solution de Hartmann ou de Ringer-lactate complète l'arsenal pour assurer les besoins hydro-électrolytiques périopératoires; la faible quantité de lactate administrée de cette manière ne provoque pas de glucogenèse significative [31]. Afin d'éviter une hyponatrémie et une hypokaliémie, la perfusion d'insuline rapide doit s'accompagner d'un apport continu de Na+ et de K+. Une alternative plus sophistiquée à la méthode décrite ci-dessus consiste à diluer l'insuline dans du NaCl (50 UI Actrapid dans 49.5 mL NaCl 0.9%) et à administrer en parallèle une solution de 0.45% NaCl + 5% glucose + 20 mmol/L de K+. En cas d'hyponatrémie, le NaCl est augmenté à 0.9% (normal saline) [6,7]. Plus physiologique et plus équilibrée, cette solution n'est cependant pas disponible dans tous les pays. En remplacement, le Plasmalyte 148/dextrose contient 5% de glucose, 140 mmol/L de Na+ et 5 mmol/L de K+, mais il est hypertonique par rapport au plasma car il contient encore du Mg2+, du Cl-, de l'acétate et du gluconate. Le Polionique B66 est une solution de Ringer avec seulement 1% de glucose [19].
Une variante mieux adaptée à la chirurgie majeure non-cardiaque consiste à maintenir l'administration d'insuline à longue durée d'action selon le schéma habituel du patient mais réduit de 20%, et d'assurer en parallèle la stabilisation des variations périopératoires par une perfusion d'insuline rapide à bas débit. Cette technique évite un rebond dans l'hyperglycémie lorsque l'insuline est interrompue et facilite la transition avec le régime pratiqué en-dehors de la salle d'opération et des soins intensifs [7,15,27]. L'addition d'une perfusion d'insuline n'est pas requise si le patient ne doit sauter qu'un seul repas.
L'ancienne technique proposée par Alberti & Thomas sous forme d'une perfusion unique Insuline-Glucose-K+ (GIK) contenant une combinaison de 250 UI Actrapid ad 50 ml Glucose 50% + 50 mmoles KCl dans 50 ml et administrée à raison de 10-20 ml/h [1,18] n'est actuellement plus recommandée, car elle ne permet pas de dissocier les quantités perfusées de chaque élément [6,7]. Alors qu'elle n'est plus de mise dans le traitement du diabète, la solution GIK reste utilisée dans certains cas d'insuffisance ventriculaire aiguë, sans pour autant que son efficacité soit vraiment prouvée [8,18].
Pour les patients non-insulino-dépendants (diabète type II), la perfusion d'insuline ne s'impose pas nécessairement. Toutefois, on a démontré une baisse de la mortalité de 28% après infarctus du myocarde lorsque ces patients sont mis au bénéfice d'une perfusion de glucose-insuline-potassium [8]. De même, une perfusion d'insuline à faible dose (1 U/h) peut améliorer la fonction myocardique après des pontages aorto-coronariens [18]. La normoglycémie diminue également le taux d'infections sternales [2]. Il paraît donc justifié de recommander l'administration d'insuline en continu pour les diabétiques de type II lorsqu'ils subissent des interventions en CEC dès que la glycémie s'élève au dessus de 11 mmol/L en peropératoire [21]. Le coma hyperosmolaire non-cétosique associé à une hyperglycémie est un mode de décompensation possible de ce type de diabète en cas de résistance à l'insuline pendant la CEC; la mortalité de cette complication peropératoire est de 42% [30]; le traitement est une réhydratation et une perfusion d'insuline. La phentolamine (Régitine©) inhibe la suppression de la sécrétion d’insuline due au stress et peut contribuer à une hypoglycémie [23]. Dans le postopératoire, la stimulation du stress diminue progressivement en fonction de l'évolution clinique; la glycémie fait de même. Il faut prendre soin d'adapter la perfusion d'insuline aux besoins nouveaux.
En résumé, il convient de traiter agressivement la glycémie des patients non-diabétiques et des patients diabétiques, qu’ils soient de type I ou de type II. La cible est 6-10 mmol/L en peropératoire et 5-8 mmol/L en postopératoire, en évitant toute hypoglycémie. Les perfusions d’insuline et de glucose doivent être réglées séparément et ne sont en aucun cas interrompues avant que le patient puisse reprendre une alimentation orale et avant que le régime antidiabétique sous-cutané/oral soit rééquilibré. Les schémas décrits ici sont essentiellement pragmatiques. Ils sont le fruit de consensus d'experts et de routines institutionnelles, car on ne dispose pas de suffisamment de données issues d'études contrôlées pour les fonder sur un haut degré d'évidence. Néanmoins, ils sont importants car ils évitent de dangereuses improvisations en salle d'opération. Il est capital que chaque institution dispose d'un algorithme écrit qui soit à la portée de tous les soignants.
| Contrôle peropératoire de la glycémie (chirurgie majeure et chirurgie cardiaque) |
|
Pas d'insuline préopératoire le matin, glycémie à l'arrivée en salle d'opération (début de matinée)
Perfusion continue d’insuline (100 UI dans 50 mL glucose 5% en pousse-seringue) : débit horaire de base = dose quotidienne totale / 24 multipliée par 1.2-1.5
Perfusion indépendante de glucose 10%, 20% ou 50% (selon restriction hydrique) à vitesse variable
Arrêt pendant la phase hypothermique de la CEC (< 32°C)
Glycémies de contrôle toutes les 30-60 minutes; cible: 6-10 mmol/L
1 UI insuline iv abaisse la glycémie de 1.5-2.0 mmol/L
Rapport glucose / insuline :
- 1-2 g glucose / UI insuline pour abaisser la glycémie
- 3 g glucose / UI insuline pour maintenir la glycémie stable
- 5 g glucose / UI insuline chez les non-diabétiques (hyperkaliémie)
Alternative: schéma de Portland modifié (Tableau 21.11), sans apport de glucose
En chirurgie cardiaque, ce régime insuline-glucose iv est prescrit chez tous les diabétiques insulino-requérants et chez tous les patients dont la glycémie persiste à plus de 11 mmol/l.
Maintenir la PAM à 80 mmHg en peropératoire et à 70 mmHg en CEC à cause de la perte de l’autorégulation cérébrale (dysautonomie).
|
© CHASSOT PG, Septembre 2007, dernière mise à jour, Décembre 2018
Références
- ALBERTI KG, THOMAS DJ. The management of diabetes during surgery. Br J Anaesth 1979; 51(7):693-710.
- ASCIONE R, ROGERS CA, RAJAKARUNA C, ANGELINI GD. Inadequate blood glucose control is associated with in-hospital mortality and morbidity in diabetic and nondiabetic patients undergoing cardiac surgery. Circulation 2008; 118:113-23
- BEVERS MB, VAISHNAV NH, PHAM L, et al. Hyperglycemia is associated with more severe cytotoxic injury after stroke. J Cereb Blood Flow Metab 2016; in press
- DESBOROUGH JP. The stress response to trauma and surgery. Br J Anaesth 2000; 85(1):109-117
- DESBOROUGH JP, HALL GM, HART GR, BURRIN JM. Midazolam modifies pancreatic and anterior pituitary secretion during upper abdominal surgery. Br J Anaesth 1991; 67:390-6
- DHATARIYA K, LEVY N, FLANAGAN D, et al. Management of adults with diabetes undegoing surgery and elective procedures: Improving standards. Joint British Diabetes Societies for inpatient care. September 2015. http://www.diabetologists-abcd.org.uk/jbds/JBDS_IP_Surgical_Guideline_2015_Full.pdf
- DHATARIYA K, LEVY N, KILVERT A, et al. Diabetes UK position statement and care recommendations. NHS diabetic guideline for the perioperative management of the adult patient with diabetes. Diabet Med 2012; 29:420-33 219
- FATH-ORDOUBADI F, BEAT KJ. Glucose-insulin-potassium therapy for treatment of acute myocardial infarction. An overview of randomized placebo-controlled trials. Circulation 1997; 96:1152-6
- FLYNN MD, O'BRIEN IA, CORRALL RJ. The prevalence of autonomic and peripheral neuropathy in insulin-treated diabetic subjects. Diabet Med 1995; 12:310-3
- FRAGEN RJ, SHANKS CA, MOLTENI A, AVRAM MJ. Effects of etomidate on hormonal responses to surgical stress. Anesthesiology 1984; 61:652-6
- FURNARY AP, GAO G, GRUNKEMEIER GL, et al. Continuous insulin infusion reduces mortality in patients with diabetes undergoing coronary artery bypass grafting. J Thorac Cardiovasc Surg 2003; 125-1007-21
- GANDHI GY, NUTTALL GA, ABEL MD, et al. Intraoperative hyperglycemia and perioperative outcomes in cardiac surgery patients. Mayo Clin Proc 2005; 80:862-6
- GARRIOCH MA, FITCH W. Anesthesia for carotid artery surgery. Brit J Anaesth 1993; 71:569-79
- HALL GM, LACOUMENTA S, HART GR, BURRIN JM. Site of action of fentanyl in inhibiting the pituitary-adrenal response to surgery in man. Br J Anaesth 1990; 65:251-3
- HSIA E, SEGGELKE S, GIBBS J et al. Subcutaneous administration of glargine to diabetic patients receiving insulin infusion prevents rebound hyperglycemia. J Clin Endocrinol Metab 2012; 97(9):3132-3137.
- KRAMER AH, ROBERTS DJ, ZYGUN DA. Optimal glycemic control in neurocritical care patients: a systematic review and meta-analysis. Crit Care 2012; 16: R203
- KWON S, THOMPSON R, DELLINGER P, et al. Importance of perioperative glycemic control in general surgery. Ann Surg 2013; 257:8-14
- LAZAR HL, CHIPKIN S, PHILIPPIDES G, et al. Glucose-insulin-potassium solutions improve outcomes in diabetics who have coronary artery operations. Ann Thorac Surg 2000; 70:145-50
- LEVY N, PENFOLD N, MYTHEN M. Perioperative management of diabetes and the emerging role of anaesthetists as perioperative physicians. Br J Anaesth 2016; 116:443-7
- McANULTY GR, ROBERTSHAW HJ, HALL GM. Anesthetic management of patients with diabetes mellitus. Br J Anaesth 2000; 85:80-90
- McNULTY PH, ETTINGER SM, GILCHRIST IC, et al. Cardiovascular implications of insulin resistance and non-insulin-dependent diabetes mellitus. J Cardiothorac Vasc Anesth 2001; 15:768-77
- MURKIN JM. Pro: tight intraoperative glucose control improves outcome in cardiovascular surgery. j Cardiothor Vasc Anesth 2000; 14:475-8
- NAKAO K, MIYATA M. The influence of phentolamine, an adrenergic blocking agent, on insulin secretion during surgery. Eur J Clin Invest 1977; 7:41-5
- NICHOLSON G, HALL GM. Diabetes and adult surgical inpatients. Continuing Education in Anaesthesia, Critical Care & Pain 2011; 11(6):234-238.
- PARTRIDGE H, PERKINS B, MATHIEU S, et al. Clinical recommendations in the management of the patient with type 1 diabetes on insulin pump therapy in the perioperative period: a primer for the anaesthetist. Br J Anaesth 2016; 116:18-26
- ROBERTSHAW HJ, McANULTY GR, HALL GM. Strategies for managing the diabetic patient. Best Pract Res Clin Anaesthesiol 2004; 18:631-43
- ROSEBLATT SI, DUKATZ T, JAHN R et al. Insulin glargine dosing before next-day surgery: comparing three strategies. J Clin Anesth 2012; 24(8):610-617.
- SALZARULO HH, TAYLOR LA. Diabetic stiff joint syndrome as a cause of difficult endotracheal intubation. Anesthesiology 1986; 64:366-8
- SCOTT JF, ROBINSON GM, FRENCH JM, et al. Glucose potassium insulin infusion in the treatment of acute stroke patients with mild to moderate hyperglycemia: the Glucose Insulin in Stroke Trial (GIST). Stroke 1999; 30:793-9
- SEKI S. Clinical features of hyperosmolar hyperglycemic non-ketotic coma associated with cardiac operations. J Thorac Cardiovasc Surg 1991; 91:867-73
- SIMPSON AK, LEVY N, HALL GM. Perioperative iv fluids in diabetic patients – don't forget the salt. Anaesthesia 2008; 63:1043-5
- STYS A, STYS T. Current clinical applications of heart rate variability. Clinical Cardiol 1998; 21:719-24
- TAO J, YOUTAN L. Impact of anesthesia on systemic and cerebral glucose metabolism in diabetes patients undergoing neurosurgery. J Diabetes Metab 2013; 4:297
- UMPIERREZ GE, ISAACS SD, BAZARGAN N, et al. Hyperglycemia: an independent marker for in-hospital mortality in patients with undiagnosed diabetes. J Clin Endocrinol Diab 2002; 87:978-82
- VAN DEN BERGHE G, WOUTERS P, WEEKERS F, et al. Intensive insulin therapy in critically ill patients. N Engl J Med 2001; 345:1359-67
- VRIESENDORP TM, MORELIS QJ, DEVRIES JH, et al. Early post-operative glucose levels are an independent risk factor for infection after peripheral vascular surgery. A retrospective study. Eur J Vasc Endovasc Surg 2004; 28:520-25
