Dans l'insuffisance mitrale ischémique, les feuillets de la valve sont normaux ; la régurgitation est la traduction d'un problème sous-jacent dans le ventricule. Cette IM relève de plusieurs mécanismes (Figure 11.65) [25].
- Restriction asymétrique de la course systolique des feuillets (IM restritive type IIIb) sur akinésie ou dyskinésie segmentaire de la paroi ventriculaire, entraînant un déplacement latéral et/ou apical d'un muscle papillaire (Vidéos).
Vidéo: insuffisance mitrale secondaire sur dilatation du VG due à une cardiomyopathie ischémique avec akinésie antéro-latérale étendue entraînant une IM légèrement asymétrique.
La traction excessive sur les cordages secondaires lors de déplacement latéral peut déformer le feuillet antérieur qui prend une allure en "aile de mouette" à l'échocardiographie (Figure 11.65B). Une restriction du feuillet postérieur est plutôt liée à un infarctus inférieur. - Restriction symétrique sur cardiomyopathie dilatative d'origine ischémique (IM restritive type IIIb) avec dilatation importante du VG (Vidéo).
Vidéo: Insuffisance mitrale restrictive sur dilatation et dysfonction sévère du VG (IM type IIIb sur défaillance gauche ischémique).
- Bascule d'un ou des feuillets sur rupture ou ischémie papillaire; la rupture partielle ou totale d’un pilier entraîne un basculement de la commissure correspondante dans l'OG en systole (IM type II) et une régurgitation massive (voir Figure 26.15). La non-contraction d'un muscle papillaire en systole donne trop de longueur aux cordages; le point de coaptation des feuillets est alors éversé dans l'OG (Vidéos).
Vidéo: Rupture totale du muscle papillaire antérieur, dont un fragment oscille au bout de cordages du feuillet antérieur; la valve mitrale reste béante en systole.
Vidéo: Prolapsus de la commissure antérieure sur ischémie-rupture du muscle papillaire antérieur (vue bicommissurale 70°); le VG et l'OG sont dilatés.
Vidéo: Prolapsus de la commissure antérieure sur ischémie-rupture du muscle papillaire antérieur (vue 4-cavités 0°); l'IM excentrique est sévère (IM type II).
- Dilatation et aplatissement de l'anneau mitral sur akinésie de la paroi inféro- et postéro-basale (IM type I); la dilatation annulaire est asymétrique; elle porte essentiellement sur la partie postérieure de l'anneau car la partie antérieure est fixée au trigone fibreux.
Vidéo: insuffisance mitrale centrale modérée (type I); le jet est symétrique et atteint la paroi postérieure de l'OG.
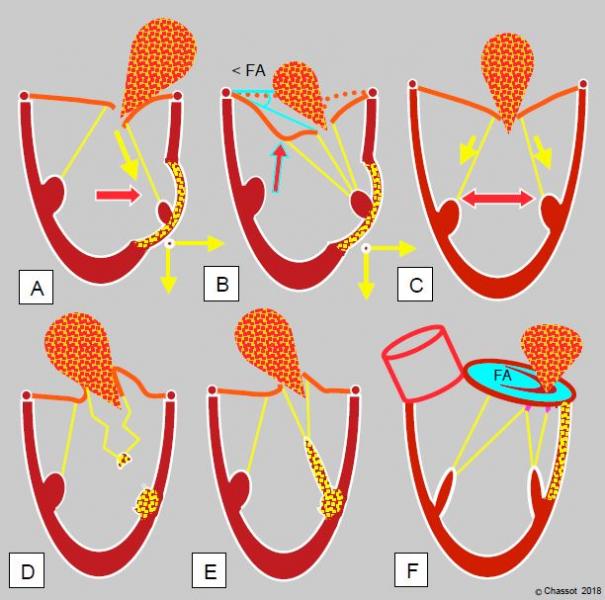
Figure 11.65 : Insuffisance mitrale ischémique. L’IM peut être de type IIIb restrictif (A, B et C), de type II prolapsus (D et E) ou de type I fonctionnel (F). A : akinésie ou dyskinésie segmentaire entraînant le pilier vers l’extérieur et vers l’apex en systole ; le feuillet correspondant est restrictif ; l’IM est excentrique. B : akinésie ou dyskinésie segmentaire entraînant le pilier vers l’extérieur avec une traction excessive sur les codages de 2ème ordre ; ceci se traduit par une image en aile de mouette du feuillet antérieur. < FA : angle du feuillet antérieur à son extrémité avec le plan de l’anneau en systole. La section chirurgicale des cordages de 2ème ordre peut être curative dans ce cas de figure. C : cardiomyopathie ischémique avec dilatation homogène du VG ; l’IM restrictive est centrale. D : la rupture partielle ou complète d’un pilier provoque un basculemrnt total de la commissure dans l’OG en systole ; on voit un morceau du pilier rompu oscillant au bout des cordages. E : ischémie d’un pilier occasionnant un prolapsus de la commissure correspondante parce que le pilier s’allonge au lieu de se contracter en systole. F : ischémie basale causant une dilatation postérieure de l’anneau mitral.
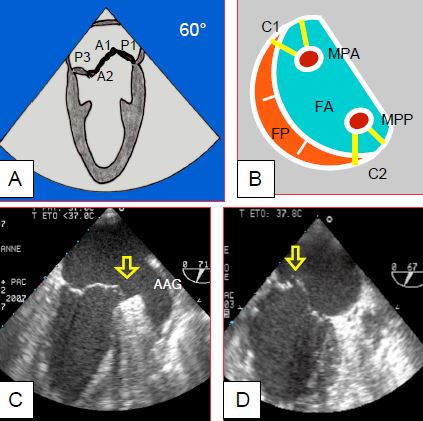
Figure 26.15 : Ischémie ou rupture partielle du pilier antérieur. A : en vue bicommissurale, toute la commissure antérieure est basculée (prolapsus de A1 et P1). B : ceci s’explique par le fait que les piliers sont anatomiquement axés sur les commissures et envoient des cordages aux 2 feuillets. MPA : muscle papillaire antérieur. MPP : muscle papillaire postérieur. FA : feuillet antérieur. FP : feuillet postérieur. C : prolapsus de la commissure antérieure sur ischémie de la paroi antérieure du VG. D : prolapsus de la commissure postérieure sur rupture partielle du pilier postérieur.
L'IM ischémique n'est pas rare: elle est présente chez 10-40% des coronariens opérés [3]. Dans 76% des cas, elle est de type restrictif (IIIb). Comme elle est la signature d'une lésion grave du VG, elle péjore significativement le pronostic: la mortalité de la revascularisation coronarienne combinée à une réparation mitrale est approximativement le double de celle de la revascularisation simple (moyenne < 2%) [10,12,27,29]. Certes l'IM résiduelle est plus importante après pontages seuls, mais le devenir et la survie à long terme ne bénéficient pas de la correction supplémentaire d'une IM modérée à sévère [27,29]. En effet, la réparation mitrale est une réponse valvulaire à un problème ventriculaire !
Indications opératoires
La découverte par l’anesthésiste échocardiographeur d'une IM modérée-à-sévère ou sévère en cours de pontages aorto-coronariens pose un difficile problème d'indication opératoire, parce que l'intervention valvulaire augmente de 3-5 fois la mortalité des PAC, qui peut alors s'élever jusqu'à 15% dans les mauvais cas. Son analyse des images ETO est cruciale pour la décision opératoire [14]. Les recommandations actuelles pour la chirurgie mitrale d'accompagnement lors de revascularisation coronarienne sont plutôt restrictives [2,14,19,20,22,24].
- IM secondaire ischémique modérée ou modérée-à-sévère: bénéfice incertain, en général pas d'indication opératoire.
- IM secondaire ischémique sévère et symptomatique (stade D): indication selon la situation.
- Indication de classe IIa si la plastie est aisée, la FE > 30%, le VG peu dilaté, le risque opératoire faible et la survie à long terme du malade hautement probable.
- Indication de classe IIa si l'IM se péjore au test d'effort; une réduction de l'IM sous dobutamine signe au contraire une réserve contractile du VG qui incite à une revascularisation seule, sans intervention mitrale d'accompagnement.
- IM sévère sur rupture d'un muscle papillaire: indication à une réparation en urgence (le plus souvent remplacement valvulaire par une prothèse).
La détermination du degré d'IM ischémique en peropératoire doit tenir compte de trois facteurs importants.
- L'IM ischémique est un phénomène très dynamique qui se modifie en fonction de la postcharge, de la taille et de la contractilité du VG.
- L'anesthésie et la ventilation en pression positive altèrent les conditions de charge et diminuent l'importance de l'IM; il faut rétablir une hémodynamique normale (PAM ≥ 80 mmHg), au besoin avec des vasopresseurs, avant de porter un jugement quantitatif.
- L'échelle de quantification de l'IM ischémique est plus restrictive que celle de l'IM organique (voir Tableau 11.10); l'IM ischémique est considérée comme sévère si le diamètre de la vena contracta est ≥ 40 mm (au lieu de 70 mm pour l'IM organique), si la surface de l'orifice de régurgitation est ≥ 20 mm2 (au lieu de 40 mm2) et si le volume régurgité est ≥ 30 mL (au lieu de 60 mL) [31].
La situation est différente si l'IM concomitante à des pontages aorto-coronariens (PAC) est de nature structurelle (IM primaire) et non secondaire à l'ischémie. Lors d'IM sévère sur pathologie des feuillets (dégénérescence, RAA, etc), la plastie ou le remplacement mitral est indiqué selon les critères habituels de la maladie mitrale. Dans ces conditions, la combinaison PAC + PVM ou RVM a une mortalité opératoire voisine de la somme de celle de chacune des deux opérations électives.
Chirurgie
La revascularisation coronarienne seule peut diminuer l'IM si celle-ci est liée à une ischémie active elle-même guérie par les PAC. Si la viabilité du myocarde adjacent aux piliers (déterminée par échocardiographie de stress, PET-scan ou IRM) et la synchronisation entre les muscles papillaires (évaluée au Doppler tissulaire) sont satisfaisantes, les pontages seuls, sans plastie associée, ont des chances de réduire l'IM [26]. Toutefois, dans 60% des cas les PAC ne modifient pas la régurgitation mitrale. Si le segment myocardique correspondant aux piliers n'est pas viable et si la contraction des muscles papillaires est désynchronisée, la revascularisation seule est insuffisante, et une plastie mitrale est nécessaire lorsque l'IM est sévère. Pour avoir tout son sens, la valvuloplastie ne devrait pas occasionner une mortalité opératoire globale > 4% [4].
La correction d’une IM ischémique se fait par annuloplastie (PVM avec anneau rigide standard Carpentier-Edwards™ ou anneaux ETlogics™ et GeoForm™ spécifiques pour l'IM ischémique), complétée de plusieurs possibilités selon la situation: réinsertion de cordages, plastie de pilier, résection de cordages du 2ème ordre, affrontement bord-à-bord. L'annuloplastie n'est efficace que si la dilatation du VG est modeste, parce qu'elle ne résout que la dilatation annulaire mais non la traction excessive exercée par les cordages ni le remodelage ventriculaire, qui nécessitent une reconstruction de l'appareil sous-valvulaire [19]. Certaines données échocardiographiques prédisent la persistence d'une fuite mitrale ou l'échec de l'annuloplastie (Figure 11.83 et Figure 11.84) [9,11,17,20,23,28].
- IM massive ou jets multiples;
- Dilatation de l'anneau mitral (diamètre > 3.7 cm);
- Distance entre le point de coaptation et le plan de l'anneau (tenting distance) > 1.1 cm;
- Surface de tente entre le plan de l’anneau et les feuillets mitraux (tenting area) > 2.5 cm2 (souvent asymétrique);
- Volume de tente entre le plan de l’anneau et les feuillets mitraux (tenting volume) > 3.4 cm3;
- Angle du feuillet postérieur avec le plan de l’anneau mitral > 45°;
- Angle entre l'extrémité distale du feuillet antérieur et le plan de l’anneau mitral > 25°;
- Index de sphéricité du VG (diamètre court axe / diamètre long axe) > 0.7;
- Ecartement des muscles papillaires en télésystole > 2.7 cm;
- Diamètre télésystolique du VG > 5.0 cm, diamètre télédiastolique > 6.5 cm;
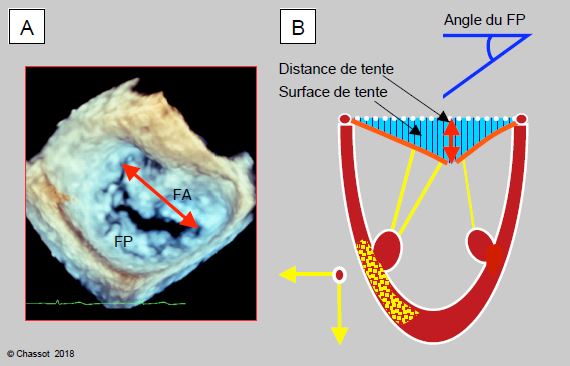
Figure 11.83 : Mesures ETO de faisabilité d’une plastie mitrale. A : en vue 3D, mesure de la distance intercommissurale. B : éléments échocardiographiques déterminant la gravité d’une IM ischémique et ses probabilités de plastie. La zone ischémique déplace le pilier vers l’extérieur et vers l’apex, ce qui maintient les feuillets dans la cavité ventriculaire en systole. Le degré de remodelage induit est fonction de l’ischémie et de l’éventuelle dysfonction ventriculaire associée ; plus ce remodelage est important, moins bons sont les résultats. Mesures de remodelage : dilatation de l'anneau mitral > 3.7 cm, distance de tente entre le point de coaptation et le plan de l'anneau mitral (tenting distance) > 1.1 cm, surface de tente (tenting area) > 2.5 cm2, angle du feuillet postérieur avec le plan de l’anneau mitral > 45°.
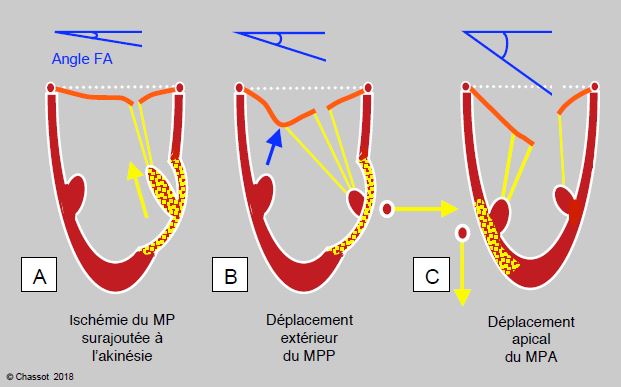
Figure 11.84 : Angle de fermeture du feuillet antérieur (FA) de la valve mitrale mesuré entre l’extrémité du FA et le plan de l’anneau mitral en systole. A : l’ischémie du pilier surajoutée à celle de la paroi donne davantage de course aux cordages et permet aux feuillets de se rapprocher de leur point de coaptation ; l’angle systolique se referme et l’IM diminue. B : akinésie pariétale postérieure et déplacement externe du pilier postérieur ; la traction prédomine sur les cordages de 2ème ordre parce qu’elle est désaxée vers l’extérieur ; le feuillet antérieur est angulé en son centre et déformé en aile de mouette (flèche bleue). La section chirurgicale des cordages de 2ème ordre rétablit la situation. C : akinésie pariétale antérieure et déplacement apical du pilier antérieur ; la traction prédomine dans le sens longitudinal et tire de manière homogène sur les cordages ; l’angle de fermeture systolique est maximal. Le pronostic est d’autant plus mauvais que l’angle est plus grand.
Ces données concernent l'IM ischémique chronique qui pâtit d'un remodelage ventriculaire majeur. Dans l'IM aiguë qui survient au cours d'un infarctus, les dimensions de l'anneau, de la tente et du VG sont bien moins importantes, quoique déjà supérieures aux valeurs normales [23]. D'autre part, la taille des feuillets mitraux est normale, alors qu'elle tend à s'agrandir avec la chronicité. Ce phénomène est une adaptation compensatoire dans l'IM chronique; induit par la tension excessive, il vise à limiter la fuite en augmentant la dimension des feuillets [6,8].
La persistance d'une IM modérée-à-sévère après l'opération, que ce soit par non-correction ou par échec de la plastie (15-19% des plasties), péjore sérieusement le pronostic fonctionnel parce qu'elle aggrave le remodelage ventriculaire proportionnellement à son importance; jusqu'à 33% des plasties sont des échecs à 1-2 ans [11,15].
Lorsque les conditions pour une plastie ne sont pas favorables, il est préférable de procéder à un remplacement par une prothèse en épargnant l'appareil sous-valvulaire de manière à maintenir un maximum du squelette interne du VG et à prévenir le remodelage sphérique ultérieur (voir Figure 11.41) [30]. La comparaison entre la plastie et le remplacement valvulaire dans l'IM ischémique sévère ne montre pas de différence significative dans la survie des patients, même si la situation fonctionnelle postopératoire et le remodelage ventriculaire sont diminués [16,18,27]. La mortalité reste de 15-20% à 5 ans, mais le risque de récidive de l'IM est bien plus élevé après plastie puisqu'il est en moyenne de 25-30% [1,13]. Cependant, le remplacement valvulaire mitral impose une anticoagulation à vie avec un agent antivitamine K (INR 3.0-3.5); ceci présente un risque hémorragique dangereux chez les malades souvent placés sous bithérapie antiplaquettaires à long terme pour des stents coronariens à haut risque.
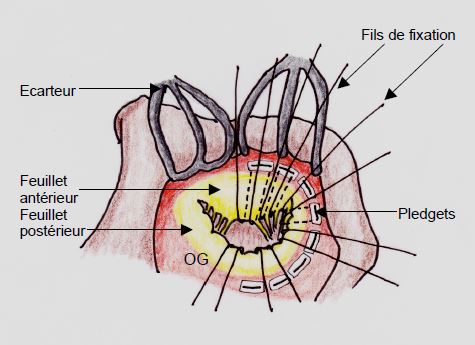
Figure 11.41 : Préservation des feuillets et de l’appareil sous-valvulaire en cours de remplacement valvulaire mitral (RVM). Les fils de fixation de la prothèse sont passés sous les feuillets et les cordages (ou ce qu’il en subsiste après résection) et implantés dans l’anneau mitral sur des pledgets, petits rectangles de téflon assurant la tenue du fil sur le versant auriculaire de l’anneau. A l'écho, ce montage peut parfois donner une certaine mobilité apparente à la prothèse.
Lorsque l'IM n'est que modérée, l'abstention thérapeutique (revascularisation coronarienne seule) ne change pas la survie des patients ni le remodelage du VG à 2 ans par rapport à l'opération combinée pontages + plastie mitrale. Cette dernière diminue certes l'IM, mais elle ne modifie pas le devenir; de plus, elle est associée à davantage de séquelles neurologiques et d'arythmies [21]. Lorsqu'elle est pratiquée dans de bonnes conditions, elle peut améliorer la capacité fonctionnelle des patients mais au prix d'un légère augmentation de mortalité à 1 an (9% au lieu de 5%) [5,7]. En conclusion, il n'y a pas lieu d'être agressif avec l'indication opératoire de l'IM ischémique, sauf lorsqu'elle est sévère et symptomatique (stade D).
Principes pour l’anesthésie
Il s’agit de combiner les contraintes d’une ischémie coronarienne avec celles d’une IM majeure. Tant que la fonction du VG est préservée, ce sont les premières qui dominent le tableau ; en cas de cardiomyopathie ischémique (FE < 0.4), l’insuffisance ventriculaire est l’élément déterminant.
- Précharge: elle doit rester normale-basse ; l’hypovolémie est mal tolérée à cause de l’IM, mais l’hypervolémie augmente le Vts (augmentation de l’IM) et le Vtd (élévation de la tension de paroi diastolique et baisse de la pression de perfusion coronarienne).
- Postcharge: elle conditionne la taille de l’IM ; on recherche des RAS basses pour diminuer le Vts du VG tout en maintenant une PAM > 75 mmHg pour assurer une pression de perfusion coronarienne (PPC) adéquate. Lorsqu’on dispose d’un cathéter pulmonaire, cette dernière peut se calculer par la formule : PPC = PAM – PAPO (mmHg). L’adéquation de la perfusion coronarienne peut être évaluée par les éléments suivants :
- PPC ≥ 60 mmHg;
- Absence de modifications à l’ECG;
- Pas de nouvelles altérations de la cinétique segmentaire à l’ETO;
- IM stable.
- Contractilité: elle doit être maintenue à l’équilibre entre la baisse de la mVO2 favorable à l’ischémie et l’inotropisme nécessaire à diminuer la taille du VG en télésystole. La contrepulsion intra-aortique est la meilleure solution en cas de défaillance du ventricule, car elle baisse la postcharge du VG, diminue l’IM, et augmente la perfusion coronaire.
- Fréquence: un léger ralentissement (55-60 batt/min) diminue la mVO2 et allonge la diastole sans augmenter l’IM, qui a lieu en systole ; la limite est l’augmentation de taille du VG par excès de volume télédiastolique (contrôle ETO).
- Ventilation en pression positive : elle est bénéfique pour l’IM, mais son retentissement hémodynamique varie de cas en cas selon la fonction systolique et diastolique.
Technique d’anesthésie
- Induction : étomidate ou midazolam.
- Pour le maintien de l’anesthésie, profiter du préconditionnement anti-ischémique offert par les halogénés :
- L’isoflurane est le plus logique (préconditionnement et baisse des RAS);
- Sevoflurane adéquat (préconditionnement et RAS stables);
- Perfusion de propofol : perte de l’avantage du préconditionnement.
- Maintenir les RAS basses mais éviter toute hypotension artérielle (PAM > 75 mmHg) ; équilibrer la PAM avec nor-adrénaline, nitroglycérine, isoflurane.
- Maintenir la volémie normale-basse.
- Monitorage particulier :
- ETO (variations de l’IM, taille du VG, cinétique segmentaire);
- Cathéter artériel pulmonaire (PAPO, PPC, volume systolique antérograde, SvO2);
- ScO2 (adéquation de la perfusion périphérique);
- Taux de lactate dans le sinus coronaire (si canulé).
| IM ischémique |
|
L’IM ischémique relève de plusieurs étiologies.
- Akinésie ou dyskinésie de segments jouxtant un muscle papillaire (type restrictif IIIb asymétrique)
- Cardiomyopathie ischémique dilatative (type restrictif IIIb symétrique)
- Ischémie ou rupture partielle/totale d’un pilier (type II)
- Akinésie basale (type fonctionnel I)
L’IM ischémique est très dépendante des conditions hémodynamiques. Les critères de sévèrité de l'IM ischémique sont plus restrictifs que ceux de l’IM organique.
- Diamètre de la vena contracta ≥ 40 mm (au lieu de 70 mm)
- Surface de l'orifice de régurgitation est ≥ 20 mm2 (au lieu de 40 mm2)
- Volume régurgité ≥ 30 mL (au lieu de 60 mL)
Indications à une réparation mitrale simultanément à une revascularisation coronarienne (mortalité de PAC + PVM/RVM : 5-12%) :
- IM sévère symptomatique (stade D) si la plastie est aisée et le risque opératoire faible
- IM sévère sur rupture de pilier (partielle ou totale)
- IM sévère organique (non-ischémique)
- IM modérée: pas d'indication opératoire
Bien qu'elle améliore le status fonctionnel, la correction mitrale dans le cadre d'une revascularisation coronarienne en CEC ne modifie pas le pronostic vital. D'autre part, le risque de récidive est élevé.
Hémodynamique recherchée en cas d'IM ischémique:
Compromis entre les contraintes d’une ischémie coronarienne et celles d’une IM majeure
Volémie normale-basse
RAS basses mais maintien de PAM > 75 mmHg
Contractilité diminuée pour autant que le Vts du VG n’augmente pas (surveillance ETO)
Fréquence 60 batt/min
|
© CHASSOT PG, BETTEX D, Août 2011, dernière mise à jour Novembre 2019
Références
- ACKER MA, PARIDES MK, PERRAULT LP, et al. Mitral valve repair versus replacement for severe ischemic mitral regurgitation. N Engl J Med 2014; 370:23-32
- BAUMGARTNER H, FALK V, BAX JJ, et al. 2017 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J 2017; 38:2739-86
- BONOW RO, BRAUNWALD E. Valvular heart disease. In: ZIPES DP, et al, eds. Braunwald’s heart disease. A textbook of cardiovascular medicine. 7th edition. Philadelphie: Elsevier Saunders, 2005, 1553-632
- BORGER MA, ALAM A, NURPHY PM, et al. Chronic ischemic mitral regurgitation: repair, replace or rethink ? Ann Thorac Surg 2006; 81:1153-61
- CHAN KMJ, PUNJABI PP, FLATHERE M, et al. Coronary artery bypass surgery with or without mitral valve annuloplasty in moderate functional ischemic mitral regurgitation. Circulation 2012; 126:2502-10
- CHAPUT M, HANDSCHUMACHER MD, TOURNOUX F, et al. Mitral leaflet adaptation to ventricular remodeling: occurrence and adequacy in patients with functional mitral regurgitation. Circulation 2008; 118:845-52
- CHERRY SV, JAIN P, RODRIGUEZ-BLANCO YF, FABBRO M. Noninvasive evaluation of native valvular regurgitation: a review of the 2017 American Society of Echocardiography Guidelines for the perioperative echocardiographer. J Cardiothorac Vasc Anesth 2018; 32:811-22
- DAL-BIANCO JP, AIKAWA E, BISCHOFF J, et al. Myocardial infarction alters adaptation of the tethered mitral valve. J Am Coll Cardiol 2016; 67:275-87
- DE BONIS M, AL-ATTAR N, ANTUNES M, et al. Surgical and interventional management of mitral valve regurgitation: a position statement from the European Society of Cardiology working groups on Cardiovascular Surgery and Valvular Heart Disease. Eur Heart J 2016; 37:133-9
- FERGUSON T, DZIUBAN F, EDWARDS F, et al. STS National Database: current changes and challenges for the new millenium. Ann Thorac Surg 2000; 69:680-91
- GILLINOV AM. Is ischemic mitral regurgitation an indication for surgical repair or replacement ? Heart Fail Rev 2006; 11:231-9
- GILLINOV AM, WIERUP PN, BLACKSTONE EH, et al. Is repair preferable to replacement for ischaemic mitral regurgitation ? J Thorac Cardiovasc Surg 2001; 122:1125-41
- GOLDSTEIN D, MOSKOWITZ AJ, GELIJNS AC, et al. Two-year outcomes of surgical treatment of severe ischemic mitral regurgitation. N Engl J Med 2016; 374:344-53
- GRAYBURN PA, CARABELLO B, HUNG J, et al. Defining "severe" secondary mitral regurgitation. Emphasizing an integrated approach. J Am Coll Cardiol 2014; 64:2792-801
- GRIGIONI F, ENRIQUEZ-SARANO M, ZEHR KJ, et al. Ischemic mitral regurgitation: long-term outcome and prognostic implications with quantitative Doppler assessment. Circulation 2001; 103:1759-64
- KANG DH, KIM MJ, KANG SJ, et al. Mitral valve repair versus revascularization alone in the treatment of ischemic mitral regurgitation. Circulation 2006; 114:1499-503
- KONGSAEREPONG V, SHIOTA M; GILLINOV AM, et al. Echocardiographic predictors of successful versus unsuccessful mitral valve repair in ischemic mitral regurgitation. Am J Cardiol 2006; 98:504-8
- LAM BK, GILLINOV AM, BLACKSTONE EH, et al. Importance of moderate ischemic mitral regurgitation. Ann Thorac Surg 2005; 79:462-70
- LANCELLOTTI P, FATTOUCH K, LA CANNA G. Therapeutic decision-making for patients with fluctuating mitral regurgitation. Nat Rev Cardiol 2015; 12:212-9
- MAGNE J, SENECHAL M, DUMESNIL J, PIBAROT P. Ischemic mitral regurgitation: A complex multifactorial disease. Cardiology 2009; 112:244-59
- MICHLER RE, SMITH PK, PARIDES MK, et al. Two-year outcomes of surgical treatment of moderate ischemic mitral regurgitation. N Engl J Med 2016; 374:1932-41
- NISHIMURA RA, OTTO CM, BONOW RO, et al. 2014 AHA/ACC Guideline for the management of patients with valvular heart disease. Circulation 2014; 129:e521-e643
- NISHINO S, WATANABE N, KIMURA T, et al. Acute versus chronic ischemic mitral regurgitation. An echocardiographic study of anatomy and physiology. Circ Cardiovasc Imaging 2018; 11:e007028
- NISHIMURA RA, OTTO CM, BONOW RO, et al. 2017 AHA/ACC focused update of the 2014 AHA/ACC Guideline for the management of patients with valvular heart disease. J Am Coll Cardiol 2017; 70:252-89
- OURY JH, CLEVELAND JC, DURAN CG; ANGELL WW. Ischemic mitral valve disease: classification and systemic approach to management. J Card Surg 1994; 9(suppl2):262-73
- PENICKA M, LINKOVA H, LANG O, et al. Predictors of improvement of unrepaired moderate ischemic mitral regurgitation in patients undergoing elective isolated coronary artery bypass graft surgery. Circulation 2009; 120:1474-81
- RENEW JR, MARTIN AK, MURRAY AW, et al. Functional mitral regurgitation: interventions and outcomes. J Cardiothorac Vasc Anesth 2019; 33:2053-64
- SHAKIL O, JAINANDUNSING JS, ILIC R, et al. Ischemic mitral regurgitation: an intraoperative echocardiographic perspective. J Cardiothorac Vasc Anesth 2013; 27:573-85
- VIRK SA, TIAM DH, SRIRAVINDRARAJAH A, et al. Mitral valve surgery and coronary artery bypass grafting for moderate-to-severe ischemic mitral regurgitation. Meta-analysis of clinical and echocardiographic outcomes. J Thorac Cardiovasc Surg 2017; 154:127-36
- YUN KL, SINTEK CF, MILLER DC, et al. Randomized trial comparing partial versus complete chordal-sparing mitral valve replacement: effects on left ventricular volume and function. J Thorac Cardiovasc Surg 2002; 123:707-14
- ZOGHBI WA, ADAMS D, BONOW RO, et al. Recommendations for noninvasive evaluation of native valvular regurgitation: a report from the ASE developed in collaboration with the SCMR. J Am Soc Echocardiogr 2017; 30:303-71
