Nosologie
L'endocardite infectieuse est une affection peu fréquente (prévalence 3-10/100'000/an), mais dont la mortalité reste dramatique: 20% en intra-hospitalier et 40% à un an en moyenne [3]. Malgré les progrès de l'antibiothérapie et de la chirurgie, ces données restent stables parce que les patients sont de plus en plus âgés, les germes de plus en plus virulents et le contexte médical de plus en plus complexe (hémodialyse, diabète, immunosuppression, matériel prothétique intravasculaire, pace-maker, drogues intraveineuses). L'atteinte porte dans 72% des cas sur une valve native souffrant d'une pathologie dégénérative et dans 20% des cas sur une valve artificielle [10]. Le risque d'endocardite pour ces dernières est de 0.4-0.6%/an [4]. Les germes en cause ont évolué ces vingt dernières années et présentent actuellement le profil suivant [9,10].
- Staphylocoques 42%
- Streptocoques 29%
- Entérocoques 10%
- Groupe HACEK* 2%
- Champignons, levures 2%
- Hémocultures négatives 10-20%
*: Haemophilus, Actinobacillus, Cardiobacterium, Eikenella et Kingella.
La clinique est caractérisée par la fièvre persistante, les pétéchies (40% des cas), l'insuffisance cardiaque, l'apparition d'un souffle à l'auscultation et les embolies (50% des cas) [10]. La majorité des embolies cérébrales est silencieuse. Le diagnostic est posé sur les hémocultures (2 prélèvements séparés) et l'échocardiographie. Si l'examen transthoracique est insuffisant, on procède à une échocardiographie transoesophagienne (sensibilité et spécificité > 90%) (Figure 11.32) et éventuellement à un CT-scan qui est moins sujet aux artéfacts induits par le matériel prothétique. Dans les cas douteux, le PET-Scan met en évidence les zones à haute activité métabolique autour des prothèses [2]. Les hémocultures sont négatives dans 10-20% des cas, le plus souvent à cause d'une antibiothérapie préalable; pour certains germes, une sérologie spécifique permet de contourner ce problème. Les critères de Duke sont utiles pour évaluer la probabilité d'une endocardite (Tableau 11.4) [5].
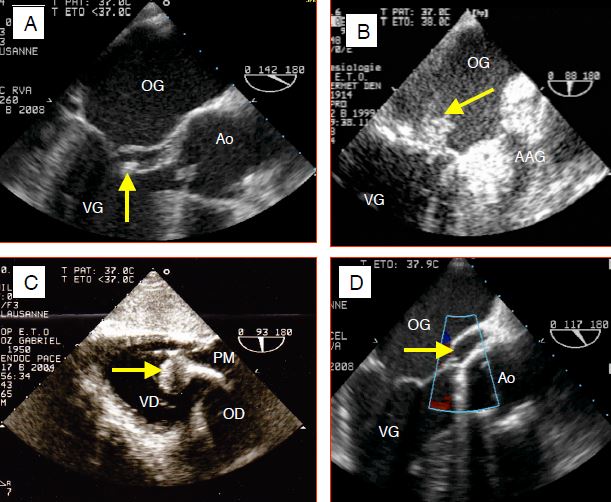
Figure 11.32 : Images ETO d'endocardite. A: végétation de la valve aortique flottant dans la chamber de chasse en diastole. B: végétation sur la face auriculaire du feuillet antérieur de la valve mitrale. C: endocardite tricuspidienne avec une végétation sur une sonde de pacemaker (PM) (vue transgastriques 90° du VD). D: abcès péri-aortique apparaissant comme une cavité entre l'aorte et l'OG (vue long-axe 120°).

Traitement antibiotique
Le traitement antibiotique est débuté dès que le germe incriminé est identifié. Si la clinique et l'échocardiographie sont positives mais les hémocultures sont négatives, on est contraint à un traitement empirique (Tableau 11.5) [1,3,4,11].
- Staphylocoques: la flucloxacilline ou la pénicilline sont efficaces lorsque les germes y sont sensibles; la gentamicine réduit la durée de la bactérémie. La vancomycine est recommandée en cas de MRSA; la daptomycine est efficace en cas d'hyperrésistance.
- Streptocoques: la monothérapie par bétalactame est le traitement préférentiel; en cas de résistance intermédiaire, on associe un aminoglycoside (surveillance de la fonction rénale).
- Entérocoques: ces germes peuvent être résistants aux bétalactames, aux aminoglycosides et isolément à la vancomycine; dans ce cas, la combinaison ampicilline + ceftriaxone peut être efficace. La daptomycine peut être une solution.

Traitement chirurgical
Dans 48% des cas d'endocardite, le traitement conduit à une sanction chirurgicale dont le but est de réséquer la structure infectée, de résoudre l'insuffisance valvulaire ou la fistule, de contrôler l'infection et de prévenir les embolies. Le degré de défaillance est tel que l'intervention a souvent lieu en urgence dans les 48 heures, après ré-équilibration hémodynamique et couverture antibiotique; une fois l'indication posée, la temporisation est délétère, sauf en cas d'AVC (risque d'hémorragie intracrânienne) [2]. Les indications à la chirurgie sont groupées en trois catégories [1,4].
- Décompensation hémodynamique.
- Insuffisance mitrale ou aortique sévère (souvent aiguë).
- Obstruction valvulaire sévère (ailette bloquée).
- Fistule entrainant un choc cardiogène.
- Infection non contrôlée.
- Abcès, pseudo-anévrysme (augmentant de volume), bloc AV complet.
- Végétations.
- Infection de matériel prothétique (valve mécanique, bioprothèse, tube en Dacron).
- Persistance de l'infection malgré l'antibiothérapie (fièvre, hémocultures positives).
- Prévention des embolies
- Végétation mobile de > 10 mm aortique ou mitrale avec événement embolique, abcès ou décompensation cardiaque.
- Végétation mobile de > 15 mm aortique ou mitrale.
- Végétation de > 20 mm sur la tricuspide.
Une plastie valvulaire est toujours préférable à la mise en place d'une prothèse dans ce contexte, mais elle n'est pas toujours possible vu le degré de destruction de la valve et l'étendue de la lésion. Si une reconstruction aortique est requise, on utilise de préférence une homogreffe. Lorsqu'il est infecté, l'ablation du matériel implanté (pacemaker, cathéter, etc) est recommandée [7]. La mortalité hospitalière est de 17%; la survie à 10 ans est de 40-60%, très inférieure à celle de la chirurgie valvulaire élective sur une valve propre [6].
Traitement prophylactique
Les jets de haute vélocité et la présence de matériel prosthétique sont une cause de lésions endothéliales occasionnant le dépôt de plaquettes et de fibrine; lors d'une bactérémie, des organismes peuvent facilement coloniser ces lésions et développer un foyer d'endocardite [7]. Ce phénomène concerne les situations à haut risque réclamant une prophylaxie antibiotique en cas d'intervention pouvant entraîner une bactériémie [2,7,8].
- Présence de matériel prothétique; le risque d’endocardite est le plus élevé avec les prothèses mécaniques et les constituants étrangers (anneaux, tubes, patch, matériel implanté); il est moindre avec les bioprothèses; il est le plus faible avec les homogreffes. Les endoprothèses comme le TAVI courent le même danger que les autres prothèses. La présence d'un flux sanguin à haute vélocité est un facteur de risque supplémentaire.
- Cardiopathies congénitales cyanogènes.
- Cardiopathies congénitales avec matériel prothétique pendant les 6 premiers mois après implantation, ou à vie en présence de shunt/régurgitation à haute vélocité.
- Transplanté cardiaque avec insuffisance valvulaire sur lésion structurelle.
- Anamnèse d'endocardite.
Les cardiopathies non-cyanogènes à basse vélocité (CIA, FOP, coarctation), les valvulopathie à faible stress mécanique (maladie de Barlow, IM ischémique ou fonctionnelle, obstruction sous-aortique dynamique) et les insuffisances fonctionnelles sont des lésions à bas risque ne nécessitant pas de prophylaxie, hormis celle que justifie l'acte chirurgical [1,4].
Bien qu'une prophylaxie antibiotique soit nécessaire dans les cas à haut risque, les recommandations récentes penchent pour une attitude plus équilibrée entre les risques liés aux antibiotiques, qui sont importants, et les bénéfices de la prophylaxie, qui sont peu significatifs [1,4]. Cette dernière n'est donc plus systématiquement recommandée pour toute opération, à moins qu'elle ne fasse partie de la procédure chirurgicale elle-même. Quelques remarques s'imposent [7].
- Lors de procédures dentaires, la prophylaxie antibiotique n'est justifiée que dans les situations où il y a effraction de la gencive, perforation de la muqueuse, chirurgie péri-apicale, ou abcès dentaire.
- Les interventions endoscopiques génito-urinaires ou digestives (cystoscopie, gastroscopie, ETO, colonoscopie, etc) ne nécessitent pas de prophylaxie en l'absence d'infection active.
- A l'exception de la résection amygdalienne, la prophylaxie n'est plus recommandée pour les interventions sur l'arbre respiratoire en l'absence d'infection active.
- La prophylaxie n'est plus recommandée en cas sténose aortique, de sténose mitrale, de bicuspidie aortique sans conséquence hémodynamique, de coarctation de l'aorte, de prolapsus mitral, d'insuffisance fonctionnelle ou de cardiomyopathie obstructive, sauf si un traitement de routine est justifié par l'intervention chirurgicale elle-même.
L'antibiothérapie est dirigée contre l'organisme causal, qui est dans 70% des cas un streptocoque ou un staphylocoque; un entérocoque est en général associé aux néoplasies et aux manipulations du tube digestif ou de l'appareil génito-urinaire. L'Haemophilus et les Candida sont des causes importantes chez les patients porteurs de prothèses immunodéprimés ou contaminés par voie intraveineuse [2].
| Prophylaxie de l'endocardite |
|
Indications:
- Présence de matériel prosthétique
- Valvulopathies à haut stress mécanique ou accompagnée de dégénérescence tissulaire
- Cardiopathies congénitales cyanogènes ou à haute vélocité
- Anamnèse d'endocardite
La prophylaxie n'est plus recommandée en cas de sténose aortique ou mitrale simple, de bicuspidie aortique sans conséquence hémodynamique, de prolapsus mitral, d'insuffisance fonctionnelle ou de cardiomyopathie obstructive, sauf si elle est justifiée par l'intervention chirurgicale elle-même.
Indications à la chirurgie valvulaire (en plus du traitement médical en cours)
- Défaillance ventriculaire sur IM ou IA
- Bloc AV, abcès aortique, fistule, perforation
- Non-régression des lésions
- Embolisation de végétations > 10 mm
Indications chirurgicales particulières en cas d'endocardite sur prothèse: déhiscence, fuite paravalvulaire, blocage d'ailette, bactériémie persistante.
|
© CHASSOT PG, BETTEX D, Août 2011, dernière mise à jour Août 2018
Références
- BADDOUR LM, WILSON WR, BAYER AS, et al. Infective endocarditis in adults: diagnosis, antimicrobial therapy, and management of complications. A Scientific Statement for healthcare professionals from the AHA. Circulation 2015; 132:1435-86
- CAHILL TJ, BADDOUR LM, HABIB G, et al. Challenges in infective endocarditis. J Am Coll Cardiol 2017; 69:325-44
- CAHILL TJ, PRENDERGAST BD. Infective endocarditis. Lancet 2016; 387:882-93
- HABIB G, LANCELLOTTI P, ANTUNES MJ, et al. 2015 ESC Guidelines for the management of infective endocarditis. Eur Heart J 2015; 36:3075-123
- LI JS, SEXTON DJ, MICK N, et al. Proposed modifications to the Duke criteria for the diagnosis of infective endocarditis. Clin Infect Dis 2000;30:633-8
- MANNE MB, SHRESTHA NK, LYTLE BW, et al. Outcomes after surgical treatment of native and prosthetic valve infective endocarditis. Ann Thorac Surg 2012; 93:489-93
- NISHIMURA RA, OTTO CM, BONOW RO, et al. 2014 AHA/ACC Guideline for the management of patients with valvular heart disease. Circulation 2014; 129:e521-e643
- NISHIMURA RA, OTTO CM, BONOW RO, et al. 2017 AHA/ACC focused update of the 2014 AHA/ACC Guideline for the management of patients with valvular heart disease. J Am Coll Cardiol 2017; 70:252-89
- ROSSEL A, CARBALLO D, CARBALLO S. Diagnostic et prise en charge précoce des endocardites infectieuses. Rev Méd Suisse 2012; 8:1966-71
- SONDEREGGER B, FÜHRER U, PORTMANN S, ZIMMERLI S. Endocardite infectieuse – Update 1ère partie. Forum Med Suisse 2012; 12:608-12
- SONDEREGGER B, FÜHRER U, PORTMANN S, ZIMMERLI S. Endocardite infectieuse – Update 2ème partie. Forum Med Suisse 2012; 12:624-7
