Le développement du sphygmomanomètre (Karl Vierordt, 1855) a remplacé par les chiffres de la pression systolique, diastolique et moyenne l'évaluation qualitative sophistiquée de la forme de l'onde pulsatile palpée au poignet, décrite à l'époque en termes de pulsus altus, parvus, celer ou tardus. Il a fallu plus d'un siècle pour redécouvrir que le cathéter artériel permet d'analyser en continu la forme de la courbe artérielle, qui contient une série de renseignements de première importance: force d'éjection ventriculaire (dP/dt ascentionnel), volume systolique (surface sous la courbe systolique), résistances artérielles (pente descendante et position du dicrotisme), compliance artérielle (proportionnelle à l'amplitude) (Figure 6.5A) [3].
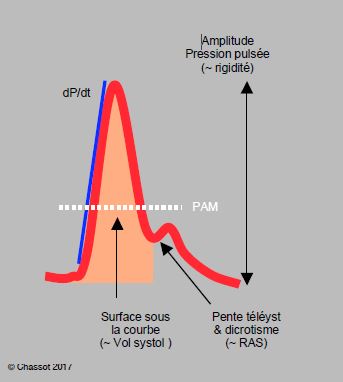
Figure 6.5A: Analyse du tracé analogique de la courbe artérielle et de ses principales composantes: pente ascentionnelle (proportionnelle au dP/dt ventriculaire, trait bleu), surface sous la courbe systolique (proportionnelle au volume d'éjection), amplitude (fonction de la compliance artérielle, des RAS et de la volémie), pente descendante et niveau du dicrotisme (proportionnelles aux RAS). La pression artérielle moyenne (PAM) est calculée selon la formule : PAM = (PAsyst + 2 PAdiast) / 3. Tous ces éléments sont mieux visibles sur une courbe fémorale que sur une courbe radiale.
Image analogique
La forme de la courbe artérielle est très instructive pour autant que certaines conditions soient remplies.
- Amplification adéquate de la courbe sur l’écran du moniteur (échelle, étalement des canaux); celui-ci ne doit pas fonctionner en mode d'ajustement automatique de la courbe, mais en mode manuel.
- Coefficient d’atténuation du système de mesure adapté à la valeur de la pression.
- Absence d’artéfact dû au mauvais rinçage de l’artère, à une coudure du cathéter ou à une étanchéité défectueuse du système; tout amortissement ou image anormale de la courbe doivent commander immédiatement un rinçage manuel à la seringue.
- Absence d’obstacle entre le ventricule gauche et le point de mesure (sténose valvulaire aortique, rétrécissement athéromateux de l’aorte thoraco-abdominale).
Plusieurs phénomènes sont impliqués dans la genèse de la courbe artérielle lue à l'écran.
- La transmission de l'influx électrique dans le myocarde et la contraction isovolumétrique imposent un décalage entre l'ECG et la courbe artérielle. Le pic systolique apparaît 120-200 msec après le début de la systole électrique; de plus, il existe un délai de 60 msec entre le pic de PAs dans l'aorte et celui d'une artère périphérique [3].
- Etant normalement très élastiques, l’aorte est ses principales branches se dilatent en systole et restituent pendant diastole le volume emmagasiné pendant la systole [7]. Cela a pour effet de diminuer la pression systolique (PAs) et d’augmenter la pression diastolique (PAd). Ce phénomène de tamponnement disparaît lorsque les vaisseaux se sclérosent et se calcifient : la pression systolique de la personne âgée s’élève parce que ses vaisseaux sont rigides, mais sa diastolique baisse parce qu’il n’y a plus de restitution de pression en diastole.
- La mise sous tension du volume sanguin pendant la contraction ventriculaire provoque une onde de pression qui va cheminer dans l’arbre vasculaire et y progresser plus rapidement que le volume éjecté (voir Figure 5.58). Cette onde de pression avance à 4 m/s chez le jeune, mais jusqu’à 10 m/s chez le vieillard dont l’arbre vasculaire calcifié transmet mieux les pressions [6]. Le volume sanguin est éjecté par le VG avec une vélocité de 1-1.5 m/s seulement. L’onde de pression se réfléchit en périphérie lorsque les artères se divisent en artérioles et que les résistances augmentent soudainement. Cette réflection va renvoyer l’onde de pression en direction du cœur, où elle parvient normalement en protodiastole [9]. Ce retour peut être plus rapide en cas de vasoconstriction et de rigidité de l’arbre vasculaire : l’onde de pression réfléchie vient alors se superposer à la pression systolique engendrée par le volume sanguin éjecté du ventricule ; la PAs mesurée est artificiellement augmentée. Sur le moniteur, la PAs apparaît bifide (voir Figure 6.7A).
- La courbe de pression artérielle est différente selon l’endroit de l’arbre vasculaire où elle est analysée. Cela tient à la complexité des embranchements vasculaires, au rétrécissement progressif des vaisseaux, au remplacement du tissu élastique par des fibres musculaires circulaires (baisse d'élasticité), et à la superposition de l'onde de pression, ou onde réfléchie, avec celle du flux sanguin. Au fur et à mesure que l’on s’éloigne de la racine de l’aorte, la pulsation due au flux est retardée, mais l’onde de réflection est rapprochée; leur modalité de superposition modifie le pic de pression enregistré par un capteur positionné à différents endroits de l’arbre vasculaire (voir Figure 5.60) [8]. La PAs est donc plus basse dans la racine aortique que dans l’artère fémorale, et plus basse dans cette dernière (artère élastique) que dans la radiale (artère musculaire). C’est l’inverse pour la pression diastolique : PAd aorte > fémorale > radiale (Figure 6.5B). Ce phénomène est accentué lorsque les RAS augmentent.
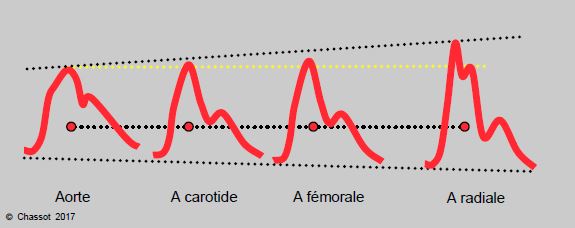
Figure 6.5B: Evolution de la pression artérielle au long de l'arbre vasculaire, avec amplification de la courbe de pression centrale depuis l'aorte ascendante jusqu'à la périphérie (artère radiale). La pression systolique (PAs) augmente significativement, alors que la pression diastolique (PAd) tend à baisser légèrement. La pression différentielle (PAs – PAd) augmente en périphérie, alors que la pression moyenne (PAM, points rouges) est pratiquement identique dans toutes les artères. La PAs aortique correspond au deuxième pic systolique en position radiale (traitillé jaune), le premier étant dû à la superposition de l'onde de pression réfléchie. Comme on le voit, l'artère fémorale est le vaisseau ponctionnable en périphérie dont la pression est la plus voisine de la pression centrale qui perfuse le cerveau, le cœur, le foie et les reins.
L'analyse de la courbe artérielle permet d'obtenir une série d'informations hémodynamiques précieuses [3,9,15].
- L'état des résistances artérielles (RAS) modifie la forme de la courbe. En cas de vasodilatation, le pic de pression systolique est émoussé, la pente diastolique est raide (-dP/dt important) et le crochetage est bas situé. En cas de vasoconstriction, le pic systolique est plus pointu, la pente est très oblique et le crochetage surélevé (Figure 6.6A) [3]. Les moniteurs qui évaluent le volume systolique par le contour de la courbe artérielle (arterial waveform analysis) tiennent compte de ces particularités pour estimer les RAS. A noter que le dicrotisme n’est réellement synchrone de la fermeture de la valve aortique que lorsque la pression est mesurée dans l’aorte.
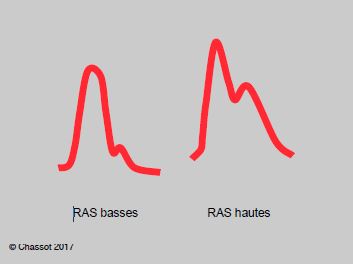
Figure 6.6A: Comparaison de la courbe artérielle en cas de vasodilatation (RAS basses) et de vasoconstriction (RAS hautes); dans le premier cas, la pente diastolique est raide (-dP/dt important) et le crochetage est bas situé, dans le second la pente est très oblique et le crochetage surélevé.
- La compliance artérielle centrale est fonction de la pression et du volume systolique; elle est inversement propotionnelle à l'impédance aortique. Elle se traduit par l'amplitude de la courbe artérielle, qui est variable selon les circonstances.
- La dérivée première de la courbe pression-temps (dP/dt), ou pente d'ascension de la pression systolique, donne une appréciation de la fonction systolique du VG. Cette pente est d’autant plus faible que la fonction ventriculaire est déficiente. L’évolution du dP/dt de l’artère fémorale chez un même patient présente une excellente corrélation avec celle du dP/dt éjectionnel de son VG (r = 0.93) si les RAS restent stables dans des limites normales [2]. Une valeur < 850 mmHg/s signe un abaissement de la fraction d'éjection, et une valeur < 440 mmHg/s est liée à une augmentation de la mortalité (valeur normale: environ 1'000 mmHg/s) [14]. De plus, le pic systolique est arrondi et la pression différentielle diminuée (Figure 6.6B).
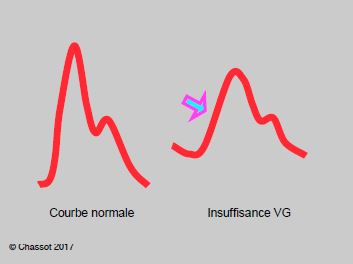
Figure 6.6B: Image d'une courbe artérielle de défaillance ventriculaire gauche; la pente ascentionnelle (+dP/dt, flèche) est diminuée, le pic systolique est arrondi, la surface sous la courbe est diminuée (VS bas) et la différentielle est faible.
- La surface située sous la courbe d'éjection systolique est proportionnelle au volume d'éjection ventriculaire gauche, en l’absence de variation importante dans les résistances périphériques. En hypovolémie, l’onde est rétrécie et pointue, sa surface est diminuée (Figure 6.6C). Toutefois, l'aorte élastique stocke momentanément une partie du volume systolique en se dilatant en systole et le restitue lorsqu'elle reprend sa forme en diastole. De ce fait, le volume qui transite en systole dans une artère périphérique est inférieur au volume éjecté par le VG. Cette différence s'atténue lorsque les vaisseaux se rigidifient avec l'âge ou l'artériosclérose.
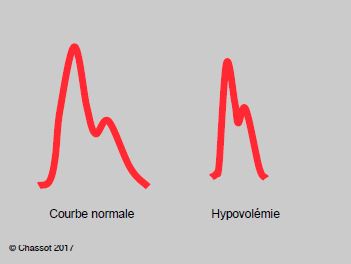
Figure 6.6C : Comparaison de la courbe artérielle normale (1) avec celle d'un malade en hypovolémie (2). La surface est rétrécie et la forme plus pointue; l'amplitude est diminuée.
- En cas de choc hypovolémique, la pression artérielle est basse parce que le volume circulant est faible, mais l’onde de pression est fortement réfléchie à cause de la vasoconstriction périphérique. Cependant, elle progresse plus lentement à cause de l’hypotension, parce que les parois vasculaires ne sont pas tendues et parce que l'arbre vasculaire est vide. Elle est donc très marquée mais décalée dans le temps, d’où l’aspect bifide de la courbe artérielle telle qu'elle apparaît dans un cathéter fémoral chez les patients en choc hémorragique (Figure 6.6D) [10].
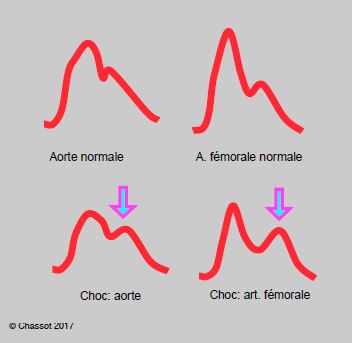
Figure 6.6D : Comparaison de la courbe de pression dans l’aorte et dans l’artère fémorale en cas de choc hypovolémique. L’onde réfléchie (flèche) est importante à cause de la vasoconstriction périphérique, mais elle progresse plus lentement à cause de l’hypotension (parois vasculaires molles) ; elle est donc très marquée mais décalée dans le temps, d’où l’aspect bifide de la courbe.
- En ventilation mécanique (volume courant 8-10 mL/kg), les variations du remplissage gauche liées aux modifications cycliques de la pression intrathoracique font osciller la PAs proportionnellement au degré d’hypovolémie (voir ci-dessous Monitorage de la volémie). Les variations de la pression systolique avec le cycle ventilatoire du respirateur sont d’autant plus importantes que la volémie du patient est basse.
Un arbre artériel rigide se caractérise par un double pic systolique, typique du patient âgé dont les vaisseaux sont calcifiés ; dans ce cas, le moniteur affiche comme valeur systolique la pression maximale, mais cette dernière correspond à l’onde de pression, non au flux sanguin. Elle ne traduit donc pas une pression de perfusion réelle pour les organes (Figure 6.7A).
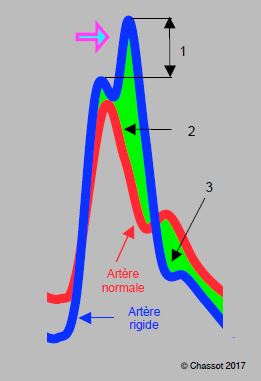
Figure 6.7A : Comparaison d’une courbe artérielle normale (en rouge) et de la courbe d’un patient souffrant d’athéromatose (en bleu), dont l’aorte est devenue rigide. 1 : augmentation de la pression systolique due à la superposition de l’onde réfléchie. 2 : augmentation de la postcharge du VG. 3 : diminution de la pression de perfusion coronarienne en diastole. Comparaison d’une artère normale et d’une artère rigidifiée par une athéromatose diffuse (artère fémorale). L’effet du retour de l’onde de pression (onde réfléchie, marquée par la flèche violette) survient plus tôt dans le deuxième cas et donne un crochetage sur le pic systolique. Bien qu’enregistré comme la pression systolique par le moniteur, cet effet ne correspond pas à un volume de perfusion réel mais à un simple pic de pression.
Chez les personnes dont les vaisseaux sont calcifiés et rigides, le pic de pression est représenté par la pression de l’onde réfléchie superposée à celle du flux systolique. La vasodilatation due à l’anesthésie diminue considérablement l’intensité de l’onde réfléchie alors que la pression artérielle différentielle liée au flux sanguin (pic systolique inférieur) ne se modifie que très peu. Dans ce cas, la chute de la PAsyst à l’induction ne représente pas une baisse de pression de perfusion, car la pression due à l’éjection du volume systolique dans les artères ne se modifie presque pas (Figure 6.7B).
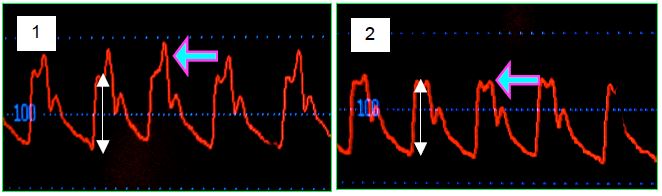
Figure 6.7B : Courbes de pression artérielle fémorale avant (1) et après (2) l’induction chez un patient de 80 ans dont les vaisseaux artériels sont athéromateux et rigides. L’induction de l’anesthésie a provoqué une baisse des résistances artérielles périphériques ; cette vasodilatation a diminué considérablement l’intensité de l’onde réfléchie (flèche violette), mais non sa synchronisation parce que la pression artérielle différentielle (flèches blanches) liée au flux sanguin (premier pic systolique) n’a pas changé. Le moniteur de pression affiche la valeur maximale de la pression comme valeur systolique ; on note donc une chute importante de la PAsyst, alors que la pression due à l’éjection du volume systolique dans les artères ne s’est presque pas modifiée.
Alors que la PAs et la PAd se modifient le long de l’arbre vasculaire et que la pression pulsée (PAs – PAd) augmente en allant vers la périphérie, la pression artérielle moyenne PAM = (PAs + 2PAd) / 3 reste pratiquement identique de la racine de l’aorte jusqu’aux artérioles périphériques (augmentation moyenne de 1 mmHg) [9]. Elle est la meilleure approximation de la pression de perfusion coronarienne. La pression artérielle systolique centrale, qui est celle de l'aorte thoracique, a une meilleure corrélation avec le risque cardiovasculaire et avec l'effet des anti-hypertenseurs que la PAs mesurée en périphérie avec un sphygmomanomètre [7,9]. Ces modifications analogiques de la courbe sont extrêmement instructives et sont parfaitement visibles sur un moniteur habituel.
Après une CEC, on oberve souvent une discordance importante entre la pression radiale et la pression centrale, mais dans le sens inverse de la relation physiologique: la PAs radiale est plus basse que la PAs aortique de 20 à 50%; la PAM radiale est inférieure de 15 à 35% à la PAM aortique (Figure 6.8).
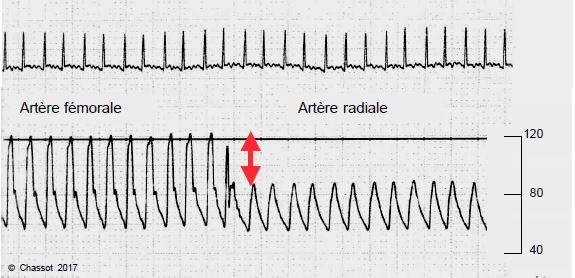
Figure 6.8: Enregistrement de la pression artérielle après une CEC prolongée en hypothermie; la PA systolique lue en radiale est pratiquement la moitié de celle lue en fémorale, cette dernière représentant la pression aortique centrale. La pression diastolique, qui repréente la pression de perfusion coronarienne, est par contre presque identique dans les deux cas.
Le coefficient de corrélation entre la PAs radiale et la PAs aortique est de 0.8 avant la CEC, mais plus que de 0.5 après celle-ci [1]. Près de 60% des patients présentent cette altération, qui dure de 10 minutes à quelques heures; elle correspond à un abaissement distal de la vélocité de l'onde de pression, donc à une perte d'élasticité artérielle qui est progressive tout au long de l'arbre artériel [5]. Ceci conduit à une sous-estimation considérable (20-40 mmHg) de la PAs réelle par la mesure radiale. Les facteurs prédictifs de cette discordance sont essentiellement l'état clinique du malade (score de risque élevé) et la durée du clampage aortique, mais l'hémodilution, la vasoconstriction et la petite taille du patient ont aussi un rôle [4]. La mesure de la pression par un cathéter fémoral reste donc normalement corrélée à la pression aortique et évite d'être leurré par la discordance aorto-radiale en sortant de pompe.
| Courbe artérielle |
|
L’élasticité des grandes artères tamponne les variations de pression dues à l’éjection ventriculaire. Lorsque les artères deviennent rigides, ce tamponnement disparaît : la PAsyst augmente et la PAdiast diminue (augmentation de la PA différentielle). Normalement, l’onde réfléchie revient à la racine de l’aorte en protodiastole ; dans les artères rigides, sa progression est plus rapide et elle se superpose au pic de PAsyst (aspect bifide de la courbe). Plus on s’éloigne de l’aorte, plus la PAsyst mesurée augmente (aorte < fémorale < radiale) et plus la PAdiast diminue (aorte > fémorale > radiale), alors que la pression moyenne (PAM) reste stable. La pression dans les artères périphériques (artères musculaires) est influencée par la proximité de la zone de réflection de l'onde de pression et par le jeu de la vasoconstriction-vasodilatation.
La forme analogique de la courbe artérielle apporte autant de renseignements cliniques que les valeurs numériques de la pression. Pour l’interpréter correctement, la courbe de pression doit être de taille suffisante sur l’écran du moniteur (régler l’échelle et l’amplification, ajustement manuel).
- Pente ascentionnelle : proportionnelle au dP/dt du VG (si RAS et valve aortique normales)
- Pente de décroissance faible et position haute du dicrotisme : RAS élevées ; en cas de
vasoplégie : pente abrupte et dicrotisme bas positionné
- Surface sous la courbe systolique : proportionnelle au volume systolique
- Double pic systolique : onde réfléchie
- Variations respiratoires : inversément proportionnelles au remplissage
En ventilation mécanique, les variations du remplissage gauche liées aux modifications cycliques de la pression intrathoracique font osciller la PAsyst proportionnellement au degré d’hypovolémie.
|
Mesures non-invasives en continu (Finapres™, CNAP™, T-Line Tensymeter ™)
Plusieurs appareils de photo-pléthysmographie actuellement sur le marché permettent une mesure continue de la pression artérielle de manière non-invasive, tels le Finapres™ ou le CNAP™. Une mini-manchette pléthysmographique adaptée au doigt, munie d’un émetteur infrarouge pour mesurer en continu le diamètre de l’artère digitale, varie sa pression pour maintenir la dimension de l’artère constante à sa valeur télédiastolique (volume minimal) (voir Figure 6.34). La pression enregistrée est alors équivalente à la pression artérielle systémique. Une manchette à pression brachiale permet d’étalonner les valeurs lues au doigt. Le système n’est pas fonctionnel chez 5-15% des patients [12]. Le Infinity CNAP™ SmartPod est similaire au Finapres™, mais il possède de nombreuses boucles de rétrocontrôle. Ces systèmes fournissent en temps réel une valeur de PAM corrélée à celle mesurée par un cathéter artériel avec une marge d’erreur de 30-40% [11]. Ces systèmes perdent toute précision lorsque la circulation périphérique est compromise (bas débit cardiaque), lors d’œdème, lors d’hypothermie ou lors de vasoconstriction artérielle.
En comprimant l’artère radiale contre l’os sous-jacent (applanométrie tonométrique), il est facile de mesurer en continu la pression qui règne dans ce vaisseau. Le système T-Line Tensymeter™ consiste en un bracelet avec des senseurs pour enregistrer les dimensions de l’artère et positionner optimalement le capteur à l’endroit de pulsatilité maximale ; une calibration externe n’est pas nécessaire. L’appareil mesure la PAM de manière fiable (marge d’erreur 23%) et dérive les pressions systolique et diastolique à partir d’algorithmes incluant les données physiques du patient [12].
Plus simplement, un algorithme d'analyse de la courbe de pouls appliqué aux données photo-pléthysmographiques du pulsemètre (SpO2 standard) est capable de mesurer en continu la pression artérielle en s'étalonnant en permanence sur la manchette à pression qui prend une mesure toutes les 5 à 10 minutes. Ce système est une application sophistiquée de la théorie de la propagation de l'onde de flux et de l'onde de pression dans l'arbre artériel, dont la vélocité se modifie avec les variations de pression artérielle. Dans les premiers essais cliniques, l'erreur standard est de seulement 4-8 mmHg [13].
Même s’ils sont peu performants lorsque les conditions hémodynamiques sont sévèrement perturbées, ces systèmes permettent de suivre en continu les variations de la PAsyst et de la PAdiff (pression pulsée), notamment leurs oscillations respiratoires sous IPPV lors d’hypovolémie. Ils sont particulièrement bienvenus pour la gestion dirigée de l’administration liquidienne lors d'interventions de gravité intermédiaire (voir Monitorage de la volémie).
| Courbe artérielle non-invasive |
Différentes astuces technologiques permettent de mesurer et d'afficher la pression artérielle en continu à partir de l'enregistrement fait sur un doigt, à la manière du pulsoxymètre. Ces systèmes ont une marge d'erreur encore très significative et ne sont pas utilisables lorsque les perturbations hémodynamiques sont importantes. |
© CHASSOT PG Août 2010, dernière mise à jour Août 2017
Références
- BAZARAL MG, WELCH M, GOLDING LAR, et al. Comparison of brachial and radial arterial pressure monitoring in patients undergoing coronary artery bypass surgery. Anesthesiology 1990; 73:38-45
- DE HERT SG, ROBERT D, CROMHEECKE S, et al. Evaluation of left ventricular function in anesthetized patients using femoral artery dP/dtmax. J Cardiothorac Vasc Anesth 2006; 20:325-30
- ESPER SA, PINSKY MR. Arterial waveform analysis. Best Pract Res Clin Anaesthesiol 2014; 28:363-80
- FUDA G, DENAULT A, DESCHAMPS A, et al. Risk factors involved in central-to-radial arterial pressure gradient during cardiac surgery. Anesth Analg 2016; 122:624-32
- KANAZAWA M, FUKUYAMA H, KINEFUCHI Y, et al. Relationship between aortic-to-radial arterial pressure gradient after cardiopulmonary bypass and changes in arterial elasticity. Anesthesiology 2003; 99:48-53
- LEVICK JR. An introduction to cardiovascular physiology. Oxford: Butterworth-Heinemann, 1995, 116-7
- McENIERY CM, COCKCROFT JR, ROMAN MJ, et al. Central blood pressure: current evidence and clinical importance. Eur Heart J 2014; 35:1719-25
- MURGO JP, WESTERHOF N. Arterial reflections and pressure waveforms in humans. In: YIN FCP, ed. Ventricular/vascular coupling. Clinical, physiological and engineering aspects. New York: Springer Verlag, 1987, 140-58
- O'ROURKE MF, SEWARD JB. Central arterial pressure and arterial pressure pulse: new views entering the second century after Korotkov. Mayo Clin Proc 2006; 81:1057-48
- O’ROURKE MF, YAGINUMA T. Wave reflections and the arterial pulse. Arch Int Med 1984; 144:366-71
- SAUGEL B, CECCONI M, REUTER DA. Noninvasive continuous cardiac output monitoring in perioperative and intensive care medicine. Br J Anaesth 2015; 114:562-75
- SAUGEL B, DUECK R, WAGNER JY. Measurement of blood pressure. Best Practice Res Clin Anaesthesiol 2014; 28:309-22
- SOLÀ J, PROENÇA M, BRAUN F, PIERREL N, et al. Continuous non-invasive monitoring of blood èpressure in the operating room: a cuffless optical technology at the fingertip. ResearchGate 2016; DOI:10.1515/cdbme-2016-0060
- TARTIERE JM, TABET JY, LOGEART D, et al. Noninvasively determined radial dP/dt is a predictor of mortality in patients with heart failure. Am Heart J 2008; 155:758-63
- THIELE RH, DURIEUX ME. Arterial waveform analysis for the anesthesiologist: past, present, and future concepts. Anesth Analg 2011; 113:766-76
