Dans la relation pression/volume, la fraction d’éjection (FE) est définie par le rapport entre le volume éjecté (volume télédiastolique – volume télésystolique) et le volume télédiastolique (Vtd – V0) :
- FE = (Vtd – Vts) / (Vtd – V0)
- Comme le V0 est faible et n’est pas connu en clinique, on obtient: FE = (Vtd – Vts) / Vtd
Sa valeur normale est de 0.55 - 0.75 (moyenne 0.67) [7]. On a pu démontrer mathématiquement que l'efficience mécanique du ventricule, qui est le rapport entre le travail externe fourni et la consommation d'oxygène, est au maximum lorsque la vidange systolique correspond aux 2/3 du volume diastolique (Véj = Vtd • FE) [1]. Augmenter la FE au-delà de 75% diminue l’efficacité du système pour trois raisons.
- Augmentation de l’énergie mécanique, donc de la mVO2, pour comprimer le myocarde et sa structure collagéno-fibreuse jusqu'à un volume télésystolique quasi-nul;
- Gain minime en volume éjecté, car la cavité ventriculaire est devenue petite en télésystole;
- Allongement nécessaire de la diastole pour arriver à un remplissage ventriculaire adéquat.
La fraction d'éjection (FE = [Vtd - Vts] / Vtd) représente le degré de vidange du ventricule, qui est fonction de l'équilibre dynamique entre cinq éléments [7].
- La contractilité: elle est représentée par la pente Emax (ou Ets) sur le diagramme pression-volume; le calcul de la FE y est d'autant plus sensible que l’Emax est faible, ce qui signifie que la FE est un meilleur critère de fonction ventriculaire lorsqu'elle est basse (< 0.5) que lorsqu'elle est normale (> 0.6). Elle peut aussi être exprimée par le dP/dt sur une courbe de pression systolique.
- La postcharge: mesurée par la pression télésystolique maximale (Pts), elle agit en équilibre avec la contractilité pour déterminer la FE. L'impédance à l'éjection du ventricule est une variable modifiée physiologiquement pour maintenir la FE en dépit des variations de précharge et de contractilité de chaque ventricule. La sensibilité de la FE et du Véj à l'augmentation de la Pts est d'autant plus marquée que la FE est basse (Emax de pente faible).
- Le volume télésystolique (Vts): plus il diminue (hypovolémie, par exemple), plus la FE augmente, sans que la contractilité change.
- Le volume initial (V0): plus il augmente (dilatation ventriculaire, anévrysme, zone akinétique, sidération, surentraînement), plus la FE baisse, mais la pente Emax n'est pas modifiée pour autant et le Véj peut rester inchangé [3].
- La précharge (Vtd): elle détermine l'effet Starling (augmentation de la force de contraction par augmentation du Vtd). Elle modifie peu la FE au sein des valeurs normales, et agit en équilibre avec la postcharge. La FE reste constante si le Vtd et la Pts augmentent parallèlement, alors qu'elle baisse si la Pts s'élève lorsque le Vtd est bas (exemple: hypovolémie chez un hypertendu). La FE devient indépendante de la précharge lorsque le V0 tend vers 0. Même inchangée, la FE correspond à un volume systolique abaissé si le Vtd est faible; même si la FE est normale, la perfusion périphérique est alors insuffisante. Seule la tachycardie permet de rétablir le débit cardiaque.
La fraction d'éjection (normale 0.65) reste étonnamment constante pour un individu sur une large plage de valeurs de précharge et de postcharge différentes. C'est le reflet de la régulation intégrée du volume systolique dans des conditions de contractilité, de précharge et de postcharge données: la FE quantifie la capacité du système ventricule - vaisseaux à maintenir un débit cardiaque adéquat en cas de variations des conditions de charge et/ou de contractilité [7]. Lorsqu'elle est basse, on peut prévoir que tout stress imposé au système cardiovasculaire peut devenir catastrophique, bien que les conditions hémodynamiques au repos paraissent satisfaisantes. La FE n'est donc pas un indice de contractilité proprement dite. Elle doit toujours être interprétée dans le contexte clinique, en particulier en fonction de la taille du VG et de la valeur de la pression artérielle. Plusieurs éléments altèrent sa signification et démontrent sa dépendance des conditions hémodynamiques et sa non-concordance avec la contratilité intrinsèque du ventricule [4].
- Selon la loi de Laplace, un VG de grande taille pâtit d'une tension de paroi élevée par rapport à un ventricule de petite taille pour fournir la même prestation hémodynamique. Une FE de 0.5, par exemple, correspond à un stress de paroi 3 fois plus important dans un VG dilaté (diamètre télédiastolique 8 cm, épaisseur 0.75 cm) que dans un ventricule normal (diamètre 4 cm, épaisseur 1.0 cm) [8].
- Une postcharge basse (insuffisance mitrale, vasoplégie) facilite l'éjection du VG; la FE surestime alors largement la performance contractile du ventricule. A l'inverse, une postcharge élevée (hypertension artérielle, sténose aortique) impacte lourdement l'éjection du ventricule. Une FE de 0.5 ne représente absolument pas la même performance contractile si la pression artérielle systolique est 90 mmHg (travail faible) ou 180 mmHg (travail élevé). Mesurer la pression artérielle au moment du calcul de la FE est une manière de prendre en compte la dépendance de la postcharge.
- Dans les valvulopathies, la géométrie ventriculaire et les conditions de charge sont très altérées. La fonction ventriculaire est mieux évaluée par le volume systolique, ou par le Vts dans les insuffisances et le Vtd dans les sténoses.
- Les modifications de la cinétique segmentaire dues à l'ischémie (akinésie en cas d'infarctus, dyskinésie en cas d'anévrysme) ou à la désynchronisation (bloc de branche, dilatation ventriculaire) brouillent la signification de la FE, qui est une mesure globale et qui ne différencie pas les zones contractiles des zones non-contractiles.
- Les altérations structurelles des cardiopathies congénitales s'accompagnent d'un remodelage considérable des ventricules, d'une augmentation de précharge ou de postcharge, voir d'une augmentation du volume systolique liée aux shunts ou à la contrainte de perfuser la circulation systémique et la circulation pulmonaire avec le même ventricule. Dans ces conditions, la FE ne correspond plus à un indice fiable de fonction ventriculaire.
Certaines inconsistances de la FE proviennent de la manière dont elle est calculée.
- Comme il figure au dénominateur de la fraction d'éjection, le Vtd modifie arithmétiquement la FE: s'il est petit, la FE augmente; s'il est grand, elle baisse.
- Si le volume télésystolique (Vts) diminue et tend vers 0 (hypovolémie, vasoplégie), la FE tend vers 1 (ou 100%), car (Vtd – 0) / Vtd = 1.
- A l'échocardiographie bidimensionnelle, le calcul de la FE dépend d'approximations géométriques qui permettent d'obtenir des valeurs de volume à partir d'images 2D. La formule de Teichholz, par exemple, assimile le VG à un ellipsoïde régulier et calcule la valeur de la FE à partir de la mesure du diamètre court-axe de la cavité ventriculaire en systole et en diastole. Cet artifice présuppose que le VG est de forme normale et que sa contraction est homogène. Il n'est pas valide lorsque la cavité est déformée (dilatation, sphéricisation) ou la contraction inhomogène (anomalies de la contractilité segmentaire). De plus, il doit respecter un plan de coupe strictement médio-ventriculaire et perpendiculaire au long-axe, puis identifier l'endocarde avec précision à la jonction entre la musculature compacte et les trabéculations (voir Chapitre 25, Indices éjectionnels). Le développement des nouvelles technologies 3D en écho, en IRM et au CT-scan autorisent une mesure effective des volumes et devraient désormais remplacer les extrapolations à partir de l'imagerie 2D, dont la marge d'erreur est de 5-9 points et le coefficient de variation de 0.15 [2]. La plus petite variation de FE susceptible d'être mesurée dans une limite de confiance de 95% est 0.11; cette forte marge d'erreur fait qu'un patient peut aisément être classé dans deux catégories fonctionnelles différentes d'un examen à l'autre [4]
La FE n'est pas la mesure d'un élément physiologique; c'est une reconstruction artificielle qui est l'équivalent d'une mesure de travail (force x distance, pression x volume); elle ne tient pas compte de la vélocité de raccourcissement des fibres myocardiques. Introduire le temps dans la mesure donne accès à l'évaluation de la puissance (travail / temps); celle du ventricule est d'autant plus faible que la durée d'éjection est ralentie, et d'autant meilleure que le volume systolique est propulsé plus rapidement (durée d'éjection normale: 220-300 msec).
Avec sa forme en croissant enroulé autour du VG, le VD ne répond à aucune formulation géométrique simple. Seules des mesures volumétriques tridimensionnelles permettent d'en calculer la fraction d'éjection. De ce point de vue, l'IRM offre les meilleures prestations pour la définition des volumes, mais le développement de l'écho 3D permet déjà une évaluation assez fiable. D'autre part, l'écho permet la mesure de la contraction longitudinale par celle du déplacement systolique de l'anneau tricuspidien ou de la déformation longitudinale de la paroi libre (global longitudinal strain) (voir Figure 5.35) [10].
La valeur préopératoire de la FE est un facteur pronostique des complications cardiaques per- et postopératoires pour la chirurgie cardiaque ou non-cardiaque, pour autant qu'elle soit < 0.5 et en l'absence de pathologie valvulaire [4,7,9]. Elle est certainement un élément pertinent et présente l'avantage d'être comprise intuitivement par chacun. Ceci n'est pas dû à sa valeur comme marqueur de la contractilité, mais à sa qualité d'indice de performance cardiaque dans des conditions de travail variables. Elle chiffre la réserve fonctionnelle et l'adaptabilité aux conditions hémodynamiques si celles-ci se modifient (précharge, postcharge, stimulation, arythmies) et quantifie l'atteinte pathologique du système couplé ventricule - vaisseaux - volume circulant.
Une des mesures les plus adéquates pour compléter la FE est la déformation tissulaire longitudinale (global longitudinal strain). A l'échocardiographie, l'évaluation de la déformation du myocarde pendant la systole (strain en %, valeur normale > 20%) et de sa vélocité de raccourcissement (strain rate, en %/s) se détermine avec les technologies de Doppler tissulaire ou de speckle-tracking; elle consiste à mesurer la distance qui sépare deux points déterminés dans la paroi ventriculaire en systole et en diastole et à calculer le raccourcissement longitudinal de cet échantillon (Figure 25.29). Elle est d'autant plus intéressante que la contraction longitudinale est essentiellement le résultat de celle des fibres sous-endocardiques, qui sont soumises au stress maximal et qui sont le plus à risque d'ischémie [6]. Elle est plus proche d'un indice de contractilité que la FE. Une diminution < 15% de raccourcissement présente une excellente corrélation avec le développement de l'insuffisance ventriculaire [5].
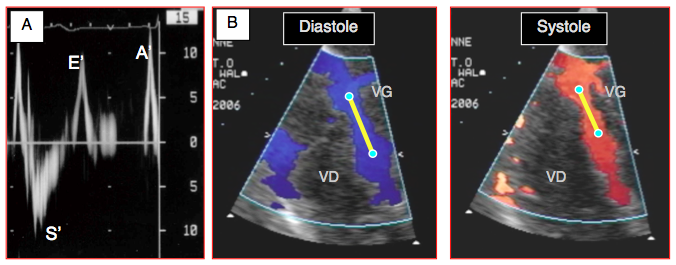

Figure 25.29 : Doppler tissulaire (DT). A : affichage Doppler spectral de la vélocité du mouvement de l’anneau mitral (échelle de vélocité 15 cm/s). B: affichage couleur des mouvements du septum interventriculaire en vue 4-cavités 0°. La descente de l'anneau mitral en systole se traduit par une vélocité de déplacement longitudinal illustrée par une coloration bleue (éloignement du capteur); le mouvement inverse a lieu en diastole (couleur rouge). Le DT mesure la vélocité des deux points situés à l'extrémité du segment sélectionné (V1 et V2). CI : contraction isovolumétrique. S : éjection systolique (descente de l’anneau mitral dû à la contraction longitudinale), Vmax 10-15 cm/s. CI: contraction isovolumétrique. E’ : mouvement de l’anneau mitral en relation avec la relaxation protodiastolique. A’ : mouvement de l’anneau mitral en relation avec la contraction auriculaire.
| Fraction d'éjection (FE) |
|
FE = (Vtd – Vts) / Vtd (normal: 0.55 – 0.75). La FE résulte de l'équilibre de 5 éléments:
- La contractilité
- La postcharge
- Le volume télésystolique
- Le volume télédiastolique
- Le volume intial
La FE n'est pas une mesure de contratilité, mais une mesure de la réserve fonctionnelle de l'ensemble ventricule – volémie – artères. Elle n'évalue pas correctement la fonction ventriculaire en cas de valvulopathie ni de remodelage important du ventricule (akinésie, dilatation sphérique, malformation).
|
© CHASSOT PG Août 2010, dernière mise à jour Novembre 2019
Références
- BURKHOFF D, SAGAWA K. Ventricular efficiency predicted by an analytical model. Am J Physiol 1986; 250: R1021- R1027
- DOROSZ JL, LEZOTTE DC, WEITZENKAMP DA, et al. Performance of 3-dimensional echocardiography in measuring left ventricular volumes and ejection fraction: a systematic review and meta-analysis. J Am Coll Cardiol 2012; 59:1799-808
- KASS DA, MARINO P, MAUGHAN WL, et al. Determinants of end-systolic pressure-volume relations during acute regional ischemia in situ. Circulation 1989; 80:1783-94
- MARWICK TH. Ejection fraction pros and cons. JACC state-of-the-art review. J Am Coll Cardiol 2018; 72:2360-79
- PARK JJ, PARK JB, PARK JH, et al. Global longitudinal strain to predict mortality in patients with acute heart failure. J Am Coll Cardiol 2018; 71:1947-57
- POTTER E, MARWICK TH. Assessment of left ventricular function by echocardiography: the case of routinely adding global longitudinal strain to ejection fraction. J Am Coll Cardiol Cardiovasc Imag 2018; 11:260-74
- ROBOTHAM JL, TAKATA M, BERMAN M, et al. Ejection fraction revisited. Anesthesiology 1991; 74:172-83
- SCHMIDT C, HINDER F, VAN AKEN H. Global left ventricular systolic function. In: POELAERT J, Skarvan K. Transoesophageal echocardiography in anaesthesia and intensive care medicine. London: BMJ Books, 2004, 62
- VROOM MB. Epidemiology and pharmacotherapy of acute heart failure. Semin Cardiothorac Vasc Anesth 2003; 7:3-12
- WU VCC, TAKEUCHI M. Echocardiographic assessment of right ventricular systolic function. Cardiovasc Diagn Ther 2018; 8:70-9
