Atrésie pulmonaire avec CIV
L’atrésie pulmonaire à septum ouvert (APSO) est une forme extrême de Fallot dans laquelle il n’y a pas de communication entre le VD et l’AP. A la naissance, le canal artériel est la seule source de flux pulmonaire. Un tiers des enfants maintient un débit dans l’AP grâce à des collatérales aorto-pulmonaires (MAPCA : major aorto-pulmonary collateral arteries) au nombre de 2 à 6 [5]. Les enfants sont plus ou moins cyanosés selon le degré de shunt D-G par la CIV et celui de shunt G-D par le canal artériel ou les collatérales. Cette situation n’offre que rarement une survie à long terme car l’AP est hypoplasique et les collatérales n’assurent pas un débit suffisant, mais la connexion entre l’aorte et les artères pulmonaires induit des altérations structurelles de celles-ci et conduit à une HTAP irréversible.
En l’absence de collatérales, la lésion est une urgence néonatale, car la fermeture du canal signe le décès. Si la situation le permet, on procède à une correction totale d’emblée: patch sur la CIV et conduit VD-AP (homogreffe ou conduit valvé en jugulaire de bœuf). Si la situation ne le permet pas, on peut placer un stent dans le canal artériel par voie percutanée pour empêcher sa fermeture, ou construire un shunt périphérique calibré de type Blalock [5]. En présence de MAPCA, la stratégie chirurgicale est une unifocalisation qui consiste à transformer le réseau de collatérales en un seul vaisseau médiastinal qui vascularise le tronc de l’AP et en le calibrant pour obtenir une PAP d’environ 30 mmHg. Un cathétérisme pré-opératoire est nécessaire afin de cartographier au mieux ces vaisseaux et de différencier les MAPCA compétitives (ligatures simples) des MAPCA non-compétitives ou compétitives distales (unifocalisation obligatoire) dont dépend la vascularisation d’un lobe ou d'un segment pulmonaire (Figure 14.61A). La survie à 10 ans est de 70-85% [1].
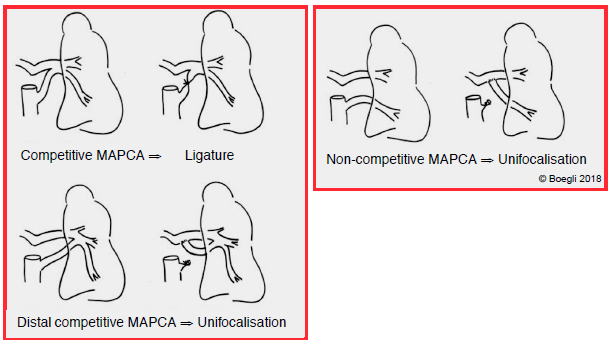
Figure 14.61A: Illustration schématique de différents types de corrections chirurgicales en cas de MAPCA.
L’anesthésie est dominée par trois problèmes [6]:
- Dysfonction du VD : support inotrope (dobutamine, adrénaline-milrinone), baisse de postcharge (NO);
- Hémorragie intrapulmonaire;
- Lésion de reperfusion pulmonaire (œdème, bronchospasme, difficultés ventilatoires); l’extubation est tardive et l’IPPV avec PEEP prolongée dans le postopératoire.
Atrésie pulmonaire avec septum intact
L’atrésie pulmonaire à septum intact (APSI) est un obstacle fibro-musculaire complet, associé à divers degrés d’hypoplasie du VD et de la valve tricuspide. Chez 10-20% ds cas, des fistules entre le VD et les coronaires épicardiques rendent la perfusion myocardique dépendante de la fonction du VD, dont la pression est très élevée à cause de l'obstacle à son éjection [2]. La survie est assurée par une CIA (shunt D-G) et un canal artériel, maintenu ouvert par une perfusion de prostaglandine. Dès que le canal artériel se ferme, la cyanose s'aggrave. Plusieurs options thérapeutiques sont possibles selon le degré d’hypoplasie du VD [5,6].
- VD bien développé, valve tricuspide normale, pas de fistule coronaire : patch d’élargissement de la CCVD dans la 1ère semaine de vie, valvotomie percutanée ou chirurgicale si l’atrésie est due à une membrane.
- VD mal développé, valve tricuspide hypoplasique, présence de fistule coronaire : anastomose systémico-pulmonaire. Dans un 1er temps, shunt de Blalock pour assurer le flux pulmonaire. Par la suite, anastomose de Glenn (VCS – PAD) ou de Fontan lorsque la PAP est assez basse; pas indiquée avant 3 mois parce que les RAP sont encore trop élevées. Dans cette situation particulière, le VD ne peut pas être décomprimé à cause du risque pour la perfusion coronarienne.
- Formes intermédiaires : shunt de Blalock puis anastomose VD-AP, sauf si la circulation coronaire dépend du VD.
Le VD est petit, hypertrophique et en surcharge de pression; s'il n'existe pas de fistule coronaire, il doit être décomprimé pour que sa croissance puisse avoir lieu. L’anesthésie est guidée par les mêmes contraintes qu'en cas de ventricule unique (voir Hypoplasie ventriculaire).
Cas particulier : sténose pulmonaire isolée
Une sténose pulmonaire est présente dans environ 10% des cardiopathies congénitales, mais peut aussi exister de manière isolée et se manifester tardivement par une hypertrophie ventriculaire droite, puis une défaillance du VD chez l’adolescent. Le VD est souvent ischémique, car la demande en O2 est augmentée mais l’apport en O2 compromis par l’hypertension intraventriculaire en systole. Une augmentation de postcharge qui débute dès la naissance n’induit pas de dilatation du VD mais une hypertrophie de type concentrique. La fonction droite reste adéquate tant que la pression intraventriculaire est < 50% de la pression gauche et qu’il n’y a pas de surcharge de volume associée. Les patients deviennent symptomatiques lorsque la pression du VD dépasse la moitié de la pression systémique [7]. La valve a une forme en dôme avec une ouverture centrale rétrécie (Figure 14.61B).
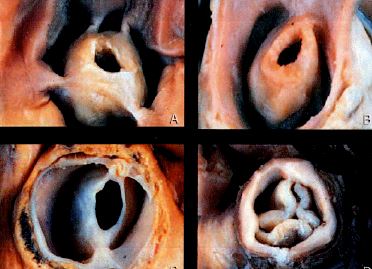
Figure 14.61B : Exemples de sténose pulmonaire congénitale; la valve est rétrécie, hypoplasique, plus ou moins en forme de cône [3].
L’indication opératoire est posée lorsque le gradient maximal est ≥ 60 mmHg et la pression du VD > 0.7 fois la pression du VG [5]. La valvuloplastie percutanée par dilatation d’un ballon est le traitement de choix, mais elle s’accompagne d’une insuffisance pulmonaire importante dans 25% des cas. La valvulotomie chirurgicale, plus invasive, donne d’excellents résultats et une survie de 95% à 25 ans.
La prise en charge anesthésique lors de sténose pulmonaire isolée est dominée par quatre contraintes.
- Risque ischémique du VD; maintenir la pression systémique avec des vasoconstricteurs artériels pour assurer la perfusion coronarienne droite.
- Risque de l’hypovolémie; le débit du VD hypertrophié est très dépendant de sa précharge. Ajoutée à l’effet de la sténose, une hypovolémie entraîne ainsi une baisse significative du débit pulmonaire et une désaturation artérielle.
- Prise en charge de la dysfonction systolique droite. Dans le postopératoire, le VD hypertrophié peut également souffrir d’une dysfonction diastolique de type restrictif, ce qui implique une élévation importante de la PVC pour maintenir le débit du ventricule [4].
- Prise en charge des arythmies.
Au moment du déclampage de l’AP, la brusque augmentation du flux pulmonaire peut provoquer un exsudat alvéolaire massif; cette lésion de reperfusion pulmonaire survient dans un quart des cas. Une PEEP élevée est bénéfique [8].
| Atrésie pulmonaire |
|
Selon le type de lésion, différentes contraintes affectent la prise en charge peropératoire
- VD petit et hypertrophique, avec volume systolique limité et dysfonction diastolique
- Dysfonction systolique du VD (dobutamine, milrinone, NO)
- Possible composante dynamique dans la sténose de la CCVD
- Maintien de la pression de perfusion coronarienne
- En postopératoire, risque d’œdème pulmonaire de reperfusion
|
© BETTEX D, BOEGLI Y, CHASSOT PG, Juin 2008, dernière mise à jour Mai 2018
Références
- AMARK KM, KARAMLOU T, O’CAROLL A, et al. Independent factors associated with mortality, reintervention, and achievement of complete repair in children with pulmonary atresia with ventricular septal defect. J Am Coll Cardiol 2006 ; 47 :1448-56
- ASHBUM DA, BLACKSTONE EH, WELLS WJ, et al. Determinants of mortality and type of repair in neonates with pulmonary atresia and intact ventricular septum. J Thorac Cardiovasc Surg 2004 ; 127 :1000-7
- BOHN D. Anomalies of the pulmonary valve and pulmonary circulation. In: LAKE CL. Pediatric Cardiac Anesthesia, 2nd edition, Appleton & Lange, Norwalk, 1993, 295-323
- CHATURVEDI RR, SHORE DF, LINCOLN C, et al. Acute right ventricular restrictive physiology after repair of tetralogy of Fallot : association with myocardial injury and oxidative stress. Ciculation 1999; 100:1540-7
- HONJO O, Van ARSDELL GS. Cardiovascular procedures : surgical considerations. In : BISSONNETTE B, edit. Pediatric anesthesia. Basic principles, State of the art, Future. Shelton (CO): People’s Medical Publishing House (USA), 2011, 1589-608
- SCHMITZ ML, ULLAH S. Anesthesia for right-sided obstructive lesions. In : ANDROPOULOS DA, et al, eds. Anesthesia for congenital heart disease. Oxford: Blackwell-Futura, 2005, 328-45
- WARNES CA. Adult congenital heart disease. Importance of the right ventricle. J Am Coll Cardiol 2009; 54:1903-10
- YACOUBY S, MEADOR M, MOSSAD E. Lung reperfusion injury in patients after balloon angioplasty for pulmonary artery stenosis. J Cardiothorac Vasc Anesth 2014; 28:502-5
