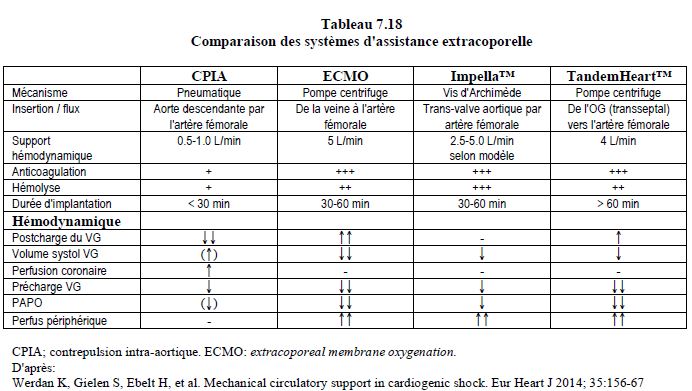
Les différents aspects de l'assistance ventriculaire sont décrits en détail dans le Chapitre 12 (voir Assistance ventriculaire). Nous n'aborderons ici que les situations d'assistance peropératoire qui utilisent, prolongent ou remplacent une CEC. L'assistance extracorporelle est indiquée lorsque le cœur ne peut plus assurer une hémodynamique correspondant aux besoins de l'organisme et que la situation doit être stabilisée par un dispositif mécanique pour éviter le drame d'une insuffisance multiorganique. On peut lui adjoindre un oxygénateur lorsque les poumons n'assurent plus les échanges gazeux. Le pronostic doit correspondre à l'une de quatre possibilités: 1) soutien momentané en cours d'intervention, 2) récupération myocardique probable en quelques jours ou semaines, 3) attente d'une transplantation, ou 4) prévision d'une assistance à long terme [15]. Plusieurs techniques sont à disposition (Tableau 7.18).
- Sans oxygénateur:
- Contrepulsion intra-aortique (CPIA) (voir Chapitre 12, CPIA);
- Assistance ventriculaire par canulation percutanée (Impella™, TandemHeart™) ou centrale (CentriMag™, Abiomed™) (voir Chapitre 12, Dispositifs à court-terme);
- Avec oxygénateur:
- ECMO (extracorporeal membrane oxygénation) ou ECLS (extracorporeal life support) (voir Chapitre 12, ECMO).
Les indications à une assistance sont nombreuses [1,14].
- Echec de mise en charge au sortir de CEC (taux de survie 25-35%) [7];
- Stabilisation avant chirurgie cardiaque (défaillance ventriculaire, insufffisance mitrale massive, ischémie active, CIV);
- Choc cardiogène (infarctus massif, contusion cardiaque);
- Myocardite fulminante;
- PCI complexe (tronc commun) en cas de dysfonction gauche sévère;
- Sepsis et collapsus circulatoire;
- Intoxication médicamenteuse (anti-arythmiques comme la flécaïnide ou la digitale); une hémofiltration accélère la clairance du produit;
- Embolie pulmonaire;
- Post-arrêt cardiaque intrahospitalier (amélioration de la survie de 2-4 fois) [12];
- Attente d'un dispositif à long-terme.
La mise en place a lieu sous contrôle fluoroscopique et échocardiographique. Ces systèmes demandent une anticoagulation complète avec de l’héparine (ACT > 300 secondes). Leur performance dépend de plusieurs conditions [8].
- VD fonctionnel; un support inotrope est souvent nécessaire en continu pour soutenir le VD;
- Echanges gazeux satisfaisants;
- Absence d’insuffisance aortique (IA degré > I) (risque de dilatation aiguë du VG);
- Vaisseaux fémoraux de bonne taille (risque d’ischémie du membre canulé).
Les contre-indications sont importantes: âge > 75 ans, espérance de vie < 1 an, hépatopathie sévère, anticoagulation impossible, lésions neurologiques irréversibles, néoplasie incurable [15].
Environ 10% des patients présentent des problèmes liés à la canulation. Il s'agit essentiellement d'ischémie du membre dans l'artère duquel est implantée la canule artérielle. Pour éviter cette complication, on dispose d'une petite canule montée en dérivation qui permet de vasculariser le membre dont l'artère est occluse par la canule principale [3].
ECMO
L'ECMO est certainement la première option en cas de défaillance cardiorespiratoire [15]. Le sang veineux est drainé/aspiré vers une pompe centrifuge et propulsé à travers un oxygénateur à membrane puis retourné au patient par une canule artérielle (fémorale, axillaire, sous-clavière). C'est le mode veino-artériel, utilisé en cas de défaillance primairement circulatoire. Si le malade souffre exclusivement d'insuffisance respiratoire, on adopte un circuit veino-veineux qui assure les échanges gazeux mais aucune aide hémodynamique (Figure 7.56).
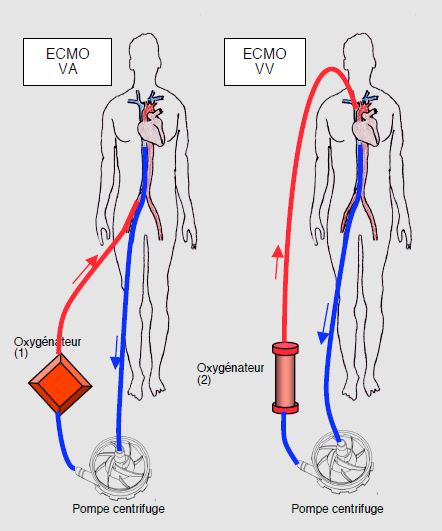
Figure 7.56: Circuits d’ECLS (Extra-corporeal life support) et d’ECMO (Extra-corporeal membrane oxygenation). 1: circuit veino-artériel (VA). Le sang est prélevé dans la veine cave inférieure au voisinage de l’OD par une canule fémorale; il est renvoyé sous pression artérielle dans l’artère fémorale après oxygénation; l’assistance est cardio-respiratoire. En chirurgie cardiaque, les canules peuvent être introduites par voie centrale (OD et aorte). Le coeur droit et le coeur gauche ne contiennent que du sang veineux. 2: circuit veino-veineux (VV). Le sang est prélevé de la même manière, mais il est renvoyé sous basse pression dans une grande veine centrale, en l’occurrence la jugulaire interne. L’assistance n’est que respiratoire [13]. Le coeur droit et le coeur gauche contiennent du sang veineux mêlé (saturé et désaturé). L'oxygénateur est le plus souvent de type tubullaire micropore en polyméthylpentane. Les pompes à galets, identiques à celles utilisées en CEC, sont abandonnées à cause de leur hémolyse excessive lors d’utilisation au-delà de quelques heures.
L'oxygénateur est de type micropore en polyméthylpentane, qui fait malheureusement obstacle au passage des halogénés mais qui fonctionne plusieurs jours sans modification de ses caractéristiques. L'ECMO réclame une anticoagulation avec de l'héparine non-fractionnée pour obtenir une activité anti-Xa de 0.3-0.5 UI/mL [10]. Par son débit artériel rétrograde, l'ECMO augmente la postcharge du VG. Il est donc important de surveiller ce dernier à l'échocardiographie. Si la valve aortique ne s'ouvre jamais, si le ventricule se dilate et si la courbe artérielle n'affiche aucune pulsatilité, il faut diminuer le débit de l'ECMO, insérer un drainage du VG et/ou prévoir une assistance ventriculaire mécanique [10]. Le taux de sevrage avec survie à long terme est en moyenne un peu supérieur à 60% [6]. La liste des complications est longue: ischémie du membre canulé, thromboembolie, AVC, hémorragie, hémolyse, infection, insuffisance aortique [15].
Assistance ventriculaire
Cette assistance est monoventriculaire et permet de maintenir la perfusion des organes pendant un épisode de choc cardiogène, ou de procéder à des interventions percutanées à haut risque sous couvert d’une prothèse circulatoire [4]. Ces systèmes sont conçus pour fonctionner pendant une courte durée, au maximum 2-4 semaines selon les modèles [8]. Ils sont implantables par canulation fémorale (systèmes percutanés) ou par accès central (OG, VG, aorte ascendante). Le débit pulmonaire et les échanges gazeux sont en général assurés par le VD et les poumons du patient. Ces dispositifs sont indiqués dans des circonstances où le cœur gauche ne peut plus assurer la survie. Ils fournissent seulement une pression aortique moyenne car ils ne sont pas pulsatiles mais propulsent un flux continu; dans ce cas, l’absence de PAs peut compromettre la perfusion coronarienne systolique du VD, notamment en présence de dysfonction droite et/ou d’hypertension pulmonaire. Certains peuvent être implantés comme assistance droite en cas de défaillance du VD. La Figure 7.57 donne deux exemples de ces appareils.
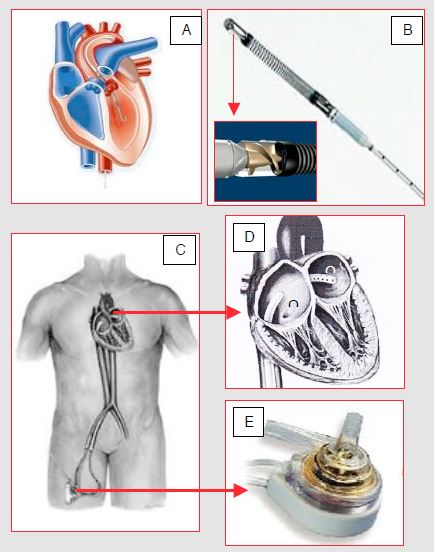
Figure 7.57: Systèmes d’assistance ventriculaire gauche percutanée. A: Impella™; la canule introduite par l’artère fémorale ou l’aorte ascendante (en cas de sternotomie) est à cheval sur la valve aortique. La vis d’Archimède qui tourne à l’intérieur (B) aspire le sang dans le VG et le renvoie dans l’aorte ascendante. C: TandemHeart™; la canule veineuse introduite par voie fémorale prélève le sang dans l’OG en traversant le septum interauriculaire (D); le sang est renvoyé par une pompe centrifuge (E) dans l’artère fémorale.
- L’Impella™ consiste en une vis d’Archimède montée dans un cathéter placé à travers la valve aortique; il aspire le sang dans le VG et le renvoie dans l’aorte ascendante. Le système est aussi utilisable en assistance monoventriculaire droite entre le VD et l’artère pulmonaire. Le placement de la canule à cheval sur la valve aortique est très précis, sinon la valve peut devenir insuffisante ou le débit de la pompe peut dilater le VG; l’échocardiographie transoesophagienne est très utile pour en contrôler l’adéquation. Contre-indications particulières: insuffisance ou sténose aortique, prothèse valvulaire aortique, thrombus du VG.
- Le TandemHeart™ draine le sang veineux de l’OG par une canule trans-septale (21F) introduite par voie fémorale et le renvoie dans l’artère fémorale (canule 15-17F) au moyen d’une pompe centrifuge qui débite jusqu’à 4 L/min à 7'500 tours/min.
En comparaison avec l'ECMO, les systèmes d'assistance ventriculaire assurent un meilleur débit cardiaque, une pression systémique plus haute et une PAPO plus basse, mais avec des répercussions peu significatives sur la survie à long terme [2,5]. La possibilité de prendre en charge un arrêt circulatoire réfractaire par une assistance ventriculaire aisée à installer pose un problème majeur: comment évaluer les chances de récupération à long terme de la fonction cardiaque et de la fonction neurologique ? Deux critères sont à prendre en compte : 1) la durée de débit cardiaque nul (no-flow), et 2) la durée de bas débit cardiaque (low-flow). On peut considérer les éléments suivants comme une indication possible à l’assistance circulatoire [9]:
- Durée de débit cardiaque nul < 5 minutes;
- Durée de bas débit cardiaque (en réanimation) < 100 minutes et PeCO2 > 10 mmHg.
Il est évident que ces critères simples sont à mettre en balance avec les circonstances de l’arrêt cardiaque (âge, traumatisme, hypothermie, etc). Ils ne sont applicables que pour les arrêt survenus au sein de l'hôpital.
Les systèmes à canulation interne (CentriMag™, Abiomed™, Thoratek™ PVAD) impliquent une sternotomie pour introduire la canule de drainage dans l'apex du VG ou dans l'OG et fixer la canule d'éjection sur l'aorte ascendante; cette anastomose entre la prothèse tubulaire et la face antérieur de l'aorte implique en outre un clampage tangentielle de cette dernière.
Implications pour l’anesthésie
Bien que certains systèmes percutanés puissent être théoriquement implantés sous sédation, une anesthésie générale est requise pour la mise en place d’une assistance (voir Chapitre 12 Anesthésie et assistance ventriculaire). Un cathéter artériel est obligatoire, puisque les pompes rotatives ou axiales fournissent une pression dépulsée, équivalente à la PAM; en outre, la pulsoxymétrie est inopérante. Le site de canulation artérielle est choisi en fonction des canulations de l’assistance; il est de préférence radial droit lors de canulation fémorale, afin de mesurer la pression à l'extrémité du circuit et la SaO2 du sang oxygéné par les poumons en cas de syndrome d'Arlequin (voir Chapitre 12 ECMO). Une voie veineuse centrale est également nécessaire pour la surveillance de l’éventuelle dysfonction droite (PVC > 12 mmHg) et pour l’administration d’agents inotropes; un cathéter de Swan-Ganz est très utile, mais il n’est pas toujours possible de le mettre en place dans les conditions difficiles de l’urgence et du choc cardiogène profond. Dans les situations où les minutes comptent, on est souvent contraint à un monitorage minimal. L’échocardiographie transoesophagienne (ETO), par contre, est aisée à installer; elle fournit des renseignements indispensables sur la valve aortique (absence d’IA), sur la position des canules, sur la décharge du VG et sur la fonction du VD [11]. L'oxygénation est surveillée par la SaO2 et la SvO2 mesurées sur les canules artérielle et veineuse, respectivement.
La mise en route d’une assistance monoventriculaire gauche peut toujours conduire à une défaillance droite aiguë parce que la dysfonction du VD était masquée par celle du VG et parce que la pompe augmente soudainement le retour veineux systémique à droite. D’autre part, la décompression du VG modifie la géométrie du septum interventriculaire et annule sa participation à l’éjection droite. Cette menace de défaillance droite implique de prendre les mesures nécessaires au soutien du VD avant que ne se manifeste un choc cardiogène.
- Hyperventilation avec maintien d’une Pit moyenne aussi basse que possible;
- Perfusion d’agent inotrope (milrinone + adrénaline, levosimendan);
- Perfusion de noradrénaline ou de vasopressine pour maintenir la position du septum interventriculaire et la pression de perfusion coronarienne;
- Vasodilatateur pulmonaire : NO, prostacyclines, nitroglycérine.
Si ces mesures s'avèrent insuffisantes, une assistance droite doit être installée.
| Systèmes d’assistance ventriculaire |
|
Systèmes d’assistance gauche percutanés (voie fémorale):
- ECMO: veine fémorale → pompe centrifuge → oxygénateur → artère (fémorale, sous-clavière, axillaire)
- Impella®: vis d’Archimède à cheval sur la valve aortique (2.5 – 5.0 L/min), pompe le sang dans le VG et le propulse dans l’aorte ascendante
- TandemHeart®: pompe le sang dans l’OG par une canule trans-septale et le propulse dans l’artère fémorale
Systèmes d’assistance gauche par canulation centrale (sternotomie): CentriMag™, Abiomed™, Thoratek™ PVAD.
La mise en route d’une asistance gauche peut précipiter une défaillance droite.
Ces dispositifs ne sont pas pulsatiles et donnent une PAM linéaire à laquelle se superpose l'éjection systolique du VG.
|
© CHASSOT PG, GRONCHI F, Avril 2008, dernière mise à jour, Avril 2018
Références
- BIRNBAUM DE. Extracorporeal circulation in non-cardiac surgery. Eur J Cardiothorac Surg 2004; 26:S82-5
- CHENG JM, DEN UIL CA, HOEKS SE, et al. Percutaneous left ventricular assist devices vs. intra-aortic balloon pump counterpulsation for treatment of cardiogenic shock: A meta-analysis. Eur Heart J 2009; 30:2102-8
- MOHITE PN, FATULLAYEV J, MAUNZ O, et al. Distal limb perfusion: Achilles' heel in peripheral venoarterial extracorporeal membrane oxygenation. Artif Organs 2014; 38:940-4
- NAIDU SS. Novel percutaneous cardiac assist devices. The science of and indications for hemodynamic support. Circulation 2011; 123:533-43
- OUWENEEL DM, ERIKSEN E, SJAUW KD, et al. Percutaneous mechanical circulatory support versus intra-aortic balloon pump in cardiogenic shock after acute myocardial infarction. J Am Coll Cardiol 2017; 69:278-87
- PADEN ML, CONRAD SA, RYCUS PT, et al. Registry. Extracorporeal Life Support Organization Registry report 2012. ASAIO J 2013; 59:202-10
- POKERSNIK JA, BUDA T, BASHOUR CA, et al. Have changes in ECMO technology impacted outcomes in adult patients developing postcardiotomy cardiogenic shock ? J Card Surg 2012; 27:246-52
- PULIDO JN, PARK SJ, RIHAL CS. Percutaneous left ventricular assist devices: Clinical uses, future applications, and anesthetic considerations. J Cardiothorac Vasc Anesth 2010; 24:478-86
- RIOU B, ADNET F, BAUD F, et al. Recommandations sur les indications de l’assistance circulatoire dans le traitement des arrêts cardiaques réfractaires. Ann Fr Anesth Réanim 2009; 28:182-6
- SCHAHEEN BW, THIELE RH, ISBELL JM. Extracorporeal life support for adult cardiopulmonary failure. Best Pract Res Clin Anaesthesiol 2015; 29:229-39
- SCHWARZ B, MAIR P, MARGREITER J, et al. Experience sith percutaneous venoarterial cardiopulmonary bypass for emergency circulatory support. Crit Care Med 2003; 31:758-64
- SHIN TG, JO IJ, SIM MS, et al. Two-year survival and neurological outcome of in-hospital cardiac arrest patients rescued by extracorporeal cardiopulmonary resuscitation. Int J Cardiol 2013; 168:3424-30
- SIDEBOTHAM D, ALLEN SJ, McGEORGE A, et al. Venovenous extracorporeal membrane oxygenation in adults: Practical aspects of circuits, cannulae, and procedures. J Cardiothorac Vasc Anesth 2012; 26:893-909
- SUBRAMANIAN B. Mechanical circulatory support. Best Pract Res Clin Anaesthesiol 2015; 29:203-27
- VAN DIEPEN S, KATZ JN, ALBERT NM, et al. Contemporary management of cardiogenic shock. A scientific statement from the American Heart Association. Circulation 2017; 136:e232-e268
