Le flux sanguin cérébral (FSC) est de 50 mL/100g/min, réparti entre 70 mL/100g/min pour la substance grise et 20 mL/100g/min pour la substance blanche [7]. La perte de conscience survient en dessous de 30 mL/100gm/min. En normothermie, l'EEG devient isoélectrique vers 15-20 mL/100gm/min (seuil de silence synaptique ou de lésion fonctionnelle électrique), et les dégâts cellulaires irréversibles en dessous de 10-15 mL/100gm/min (seuil de lésion de la membrane cellulaire, ou seuil de viabilité). D'une manière générale, on parle d'ischémie cérébrale lorsque le FSC est inférieur à 20 mL/100gm/min [8].
L'autorégulation maintient le débit sanguin cérébral constant malgré les variations de pression de perfusion sur une plage de pression artérielle moyenne allant de 50 à 150 mmHg (Figure 19.2) [9,11]. En-dehors de la zone d'autorégulation, le flux devient pression-dépendant.
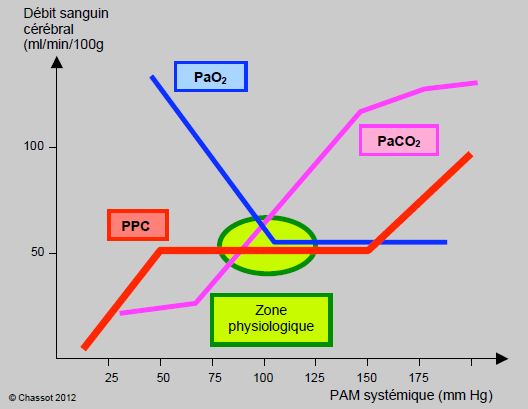
Figure 19.2 : Autorégulation du débit sanguin cérébral en fonction de la pression artérielle systémique moyenne (PAM), lors d'hypercapnie (PaCO2) et lors d'hypoxie (PaO2). La pression de perfusion cérébrale (PPC) reste stable sur une large plage d'autorégulation en-dehors de la zone physiologique, pour autant que la normoventilation soit respectée.
Cette régulation est rapide : le délai entre l'évènement déclenchant et la réponse physiologique n’est que de 10 à 60 secondes [1]. L'autorégulation est préservée à des niveaux de pression plus bas lorsque l'hypotension est provoquée par une vasoplégie que lorsqu'elle est due à une hypovolémie ; le risque cérébral est donc plus élevé dans le deuxième cas. En aval d’une sténose, les vaisseaux sont en vasodilatation maximale pour tenter de maintenir l’apport d’O2; le flux y est pression-dépendant. Il en est de même dans les collatérales. Plusieurs facteurs interfèrent avec l'autorégulation [6].
- L'hypertension artérielle raccourcit la plage de flux constant et la déplace vers le haut et vers la droite ; il est capital d'en tenir compte lors de l'anesthésie de patients hypertendus.
- La sympathectomie chimique ou cervicale déplace la courbe d'autorégulation vers la gauche et augmente la tolérance à l'hypotension.
- L’hypoxémie augmente le FSC lorsque la PaO2 est inférieure à 50 mmHg ; la vasodilatation induite devient maximale à 25 mmHg de PaO2.
- La PaCO2 est un puissant régulateur du FSC, qui augmente de 2 mL/100gm/min ou 3% pour chaque élévation de 1 mmHg entre 25 et 100 mmHg de PaCO2. En dessous de 25 mmHg, la vasoconstriction peut compromettre l'oxygénation cellulaire, notamment en cas de pathologie intracrânienne [13]. Les effets de l'hypocapnie tendent à s'atténuer avec les heures parce que le bicarbonate extracellulaire baisse avec la normalisation du pH interstitiel [4].
- Les agents halogénés sont des vasodilatateurs cérébraux.
- L'ischémie est un vasodilatateur puissant : les vaisseaux de la zone cérébrale en aval d'une sténose sont en vasodilatation maximale et le FSC y devient pression-dépendant. La réserve hémodynamique y est nulle : le FSC local ne peut plus augmenter si la pression de perfusion vient à chuter.
- Les variations des résistances vasculaires ne modifient le FSC que dans les zones saines ; une vasodilatation par hypercarbie détournera une partie du débit des zones déjà maximalement vasodilatées en aval d’une sténose au profit des zones non malades (syndrome de vol). On n’a jamais démontré que la vasoconstriction artérielle (hypocapnie) améliore le FSC régional des zones à risque chez l'homme. De ce fait, il est recommandé de ventiler les patients en normocapnie (PetCO2 : 35-38 mm Hg) pour la chirurgie carotidienne [2].
Malheureusement, le maintien de la PAM dans les limites supposées de l'autorégulation n'est pas une garantie d'adéquation de la perfusion cérébrale, car l'autorégulation est un phénomène dynamique qui varie d'un individu à l'autre et chez le même malade au cours du temps; sa courbe, qui peut avoir un plateau très étroit, ne peut pas être réellement prédite à partir de données comme l'âge ou les comorbidités [9]. Idéalement, il faudrait pouvoir déterminer la plage d'autorégulation de chaque malade pour définir la PAM optimale.
La saturométrie cérébrale (ScO2) est un moyen efficace de mettre en évidence la PAM minimale tolérable chez un patient (voir Surveillance neurologique, Spectroscopie infrarouge). Elle correspond au moment où la consommation cérébrale d’O2 devient dépendante de la pression artérielle, c'est-à-dire au moment où elle sort de la plage d'autorégulation cérébrale; malheureusement cette PAM varie de 45 à 90 mmHg selon les individus [10]. En reliant les variations de la PAM à celles du flux sanguin cérébral (Doppler transcrânien) et à celles de la ScO2, il est possible de déterminer les limites de l'autorégulation d'un malade. A l'intérieur de la plage d'autorégulation, il n'y a pas de corrélation entre la PAM et le flux cérébral ou la ScO2; le coefficient de corrélation est zéro. Lorsque la PAM est inférieure au seuil d'autorégulation, il y a au contraire corrélation et l'index tend vers 1 [3]. On peut ainsi démontrer que l'ampleur de l'écart de PAM en-dessous du seuil d'autorégulation (index > 0.4) et la durée passée dans cette zone d'hypotension sont corrélées au risque d'AVC, qui est presque cinq fois plus élevé (12.8% versus 2.7%) chez les patients dont l'autorégulation n'est pas normalement fonctionnelle et dont la PAM est en-dehors de ses limites physiologiques [10]. A défaut de pouvoir déterminer le seuil d'autorégulation de chaque malade, la chute de la ScO2 en dessous de sa valeur normale (60-65%) indique une baisse dangereuse du transport d'O2, donc la nécessité d'augmenter la PAM et l'oxygénation.
Le syndrome d’hyperperfusion cérébrale est un cas particulier de dysrégulation de la perfusion du cerveau qui peut survenir pendant les premières heures et les premiers jours après une thrombendartérectomie carotidienne [2,5]. Une fois la sténose levée, l’afflux massif de sang (+ 100%) dans une zone vasodilatée qui a perdu son autorégulation peut conduire à un oedème cérébral et/ou à des hémorragies focales si le patient souffre d'une poussée hypertensive [14]. En effet, le débit sanguin n’y est pas modulable, et il s’y associe une perméabilité capillaire anormale et des lésions hyperoxiques de reperfusion [12]. Cette perfusion luxuriante peut induire un AVC (voir Complications).
Le syndrome d’hyperperfusion cérébrale est un cas particulier de dysrégulation de la perfusion du cerveau qui peut survenir pendant les premières heures et les premiers jours après une thrombendartérectomie carotidienne [2,5]. Une fois la sténose levée, l’afflux massif de sang (+ 100%) dans une zone vasodilatée qui a perdu son autorégulation peut conduire à un oedème cérébral et/ou à des hémorragies focales si le patient souffre d'une poussée hypertensive [14]. En effet, le débit sanguin n’y est pas modulable, et il s’y associe une perméabilité capillaire anormale et des lésions hyperoxiques de reperfusion [12]. Cette perfusion luxuriante peut induire un AVC (voir Complications).
| Autorégulation cérébrale |
|
L'autorégulation maintient un flux sanguin cérébral (FSC) constant sur une plage de pression artérielle de 60 à 150 mmHg. En aval d’une sténose, les vaisseaux sont en vasodilatation maximale et ont perdu leur autorégulation; le flux y devient pression-dépendant. Il en est de même dans les collatérales (absence d'autorégulation). Plusieurs facteurs modifient l'autorégulation:
- Hypertension artérielle: déplacement des limites vers des pressions plus élevées
- Hypoxémie: augmentation du FSC
- Hypercapnie: augmentation du FSC (3%/mmHg); hypocapnie: vasoconstriction
- Ischémie: vasodilatation maximale
Syndrome de vol: l'administration d'un vasodilatateur artériel détourne une partie du débit des zones déjà maximalement vasodilatées en aval d’une sténose au profit des zones saines qui se vasodilatent.
|
© CHASSOT PG, Décembre 2010, dernière mise à jour, Décembre 2019
Références
- DAVIS DH, SUNDT TM. Relationship of cerebral blood flow to cardiac output, mean arterial pressure, blood volume, and alpha and beta blockade in cats. J Neurosurg 1980; 52:745-54
- HOWELL SJ. Carotid endarterectomy. Br J Anaesth 2007; 99:119-31
- JOSHI B, ONO M, BROWN C, et al. Predicting the limits of cerebral autoregulation during cardioplumonary bypass. Anesth Analg 2012; 114:503-10
- KOEHLER RC, TRAYSTMAN RJ. Bicarbonate ion modulation of cerebral blood flow during hypoxia and hypercapnia. Am J Physiol 1982; 243:H33-40
- MAHARAJ R. A review of recent developments in the management of carotid artery stenosis. J Cardiothorac Vasc Anesth 2008; 22:277-89
- MENG L, HOU W, CHUI J et al. Cardiac output and cerebral blood flow: the integrated regulation of brain perfusion in adult humans. Anesthesiology 2015; 123:1198-208
- MENON DK. Cerebral circulation. In: PRIEBE HJ, SKARVAN K. Cardiovascular physiology, London, BMJ Publishing Group, 1995 pp 198-223
- MICHENFELDER JD. Anesthesia and the Brain. Clinical, functional, metabolic and vascular correlates. Churchilll Livingstone, New-York, 1988, 4-21
- MOERMAN A, DE HERT S. Why and how to assess cerebral autoregulation ? Best Pract Res Clin Anaesthesiol 2019; 33:211-20
- ONO M, JOSHI B, BRADY K, et al. Risks for impaired cerebral autoregulation during cardiopulmonary bypass and postoperative stroke. Br J Anaesth 2012; 109:391-8
- POWERS WJ. Hemodynamics in ischemic cerebrovascular disease. Ann Neurol 1991; 29:231-40
- STONEHAM MD, THOMPSON JP. Arterial pressure management and carotid endarterectomy. Br J Anaesth 2009; 102:442-52
- STRINGER WA, HASSO AN, THOMPSON JR, et al. Hyperventilation-induced cerebral ischemia in patients with acute brain lesions: demonstration by Xenon-enhanced CT. Am J Neuroradiol 1993; 14:465-84
- VANPETEGHEM C, MOERMAN A, DE HERT S. Perioperative hemodynamic management of carotid artery disease. J Cardiothorac Vasc Anesth 2016; 30:491-500
