Malgré les avancées technologiques, l'étalon-or de la surveillance cérébrale reste le status neurologique du patient éveillé et collaborant ; c'est aussi le monitorage le plus économique. Cette surveillance de la fonction cérébrale n’est possible que sous anesthésie loco-régionale. En anesthésie générale, le monitorage repose exclusivement sur les techniques paracliniques (Tableau 19.3). Les AVC peropératoires surviennent essentiellement sur embolie (60-80% des cas) et moins souvent sur hypoperfusion ; les AVC postopératoires sont le plus souvent dus à un syndrome d’hyperperfusion cérébrale [12].
Status neurologique
La surveillance de l'état neurologique permet d'effectuer un test de clampage carotidien avec évaluation en continu de l'état de conscience et de la force musculaire dans la main controlatérale au côté clampé. L'ischémie cérébrale peut se traduire par tout un éventail de symptômes, par ordre de gravité:
- Petite dyslexie, élocution pâteuse, fatigue, nausée, vomissements, angoisse, sudation;
- Diminution de la force musculaire controlatérale;
- Dyslexie franche, troubles de l'idéation, perte de l'attention;
- Non-réponse aux ordres, plégie controlatérale;
- Aphasie, somnolence profonde, ronflement, état stuporeux;
- Convulsions;
- Coma.
Toute anomalie de comportement, nausée ou sommeil doivent faire suspecter en premier lieu une ischémie cérébrale.
Electro-encéphalographie
L'EEG ne reflète que l'activité corticale globale. Des altérations électriques sont visibles lorsque le flux sanguin cérébral a diminué de moitié ; l'EEG est isoélectrique pour un flux sanguin de 15-20 mL/100g/min. Une ischémie focale due à une embolie ou à un thrombus peut échapper à cette surveillance. L'ischémie corticale provoque une perte des signaux électriques rapides alpha (7-14 Hz) et béta (> 14 Hz), et une augmentation des signaux lents delta (0.5-3 Hz) et théta (4-7 Hz), puis une perte d'amplitude allant jusqu'au silence électrique [14]. Les modifications électriques surviennent avant les lésions cellulaires ; les déficits neurologiques sont probables lorsqu'elles durent plus de 10 minutes. L’EEG assure un suivi continu avec une bonne sensibilité pour l’ischémie.
Le système à 16 ou 20 canaux, encombrant et difficile à interpréter, est en général remplacé par un moniteur de fonction cérébral de type CSA (Compressed Spectral Array), qui affiche une analyse spectrale des ondes (transformation de Fourrier) et ne nécessite que quatre électrodes placées sur les apophyses mastoïdes et au milieu du rebord orbitaire frontal (voir Figure 19.5). Cette technique plus conviviale ne permet pas toujours de distinguer les ondes cérébrales des interférences comme l'activité cardiaque ou musculaire, l'effet des médicaments, de la température ou de la pCO2.
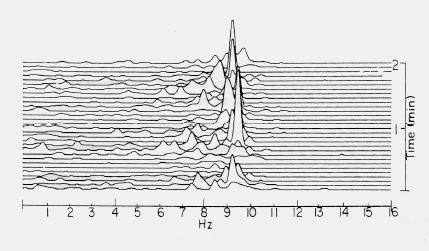
Figure 19.5 : Image d'analyse spectrale des ondes (transformation de Fourrier) fournie par un moniteur de fonction cérébral de type CSA (Compressed Spectral Array). Le nombre d'ondes d'une certaine fréquence apparaît sous forme de spectre de fréquence; dans ce cas, les ondes alpha prédominent.
Les potentiels évoqués auditifs (PEA) reflètent l’activité du tronc cérébral, qui n'est pas modifiée par les agents d'anesthésie. Bien que peu utilisés en clinique parce que compliqués, les PEA détectent adéquatement les souffrances ischémiques entraînant des déficits neurologiques lors de clampage carotidien [16] ; une diminution de plus de 50% de l'amplitude des potentiels évoqués est un signe fiable de risque neurologique.
Index bispectral (BIS™)
L'index bispectral analyse 4 variables d'un tracé EEG bipolaire (amplitude, fréquence, composition et cohérence de phase). Un algorithme (propriété du brevet et non explicité) les transforme en un nombre compris entre 0 et 100 qui décrit la puissance relative dans un espace à 4 phases des bandes de fréquences les plus élevées de l'EEG/EMG [14] ; ce chiffre représente la profondeur de l'anesthésie. Une valeur de 100 correspond à l'éveil et celui de 50 à une haute probabilité de sommeil. Le point critique entre amnésie et souvenir se trouve vers 65 ; l'échelle n'est toutefois par linéaire. La réponse dépend du type d'anesthésie. Sous propofol, la valeur du BIS prédit adéquatement la réponse au stimulus chirurgical, mais les opiacés ne montrent aucune cohérence dans leur relation dose-effet [18].
Le BIS™ est probablement utile pour éviter un réveil chez un patient curarisé, mais il n'est pas adapté à la chirurgie carotidienne. Bien que quelques rapports aient indiqué un effondrement de sa valeur lors d'épisodes de souffrance cérébrale ou d'AVC [20], le BIS™ est un moniteur global et non focal de l'activité cérébrale. Dans une étude portant sur 52 patients opérés en ALR, le BIS™ a affiché une valeur moyenne de 96 (± 2.9) [3]. Cinq patients ont présenté des épisodes d'ischémie cérébrale d'après leur status neurologique ; le BIS a affiché une valeur moyenne de 96.7 pendant ces épisodes. Cette absence de corrélation entre la valeur du BIS™ et l'état neurologique le rend donc inadapté à la surveillance du clampage carotidien.
Spectroscopie infrarouge
La spectroscopie infrarouge (Near-infrared spectroscopy ou NIRS) permet la mesure locale de la saturation cérébrale de l'hémoglobine en O2 (ScO2) (voir Chapitre 6, Oxymétrie cérébrale). Les deux diodes de chaque capteur sont écartées de 3-5 cm environ ; chaque capteur est placé sur l'angle fronto-temporal, de chaque côté du crâne. La longueur d'onde laser émise (758 – 929 nm) pénètre la boîte crânienne et se trouve dispersée par la substance cérébrale où une partie spécifique du spectre est absorbée par l'hémoglobine totale et une autre partie par l'hémoglobine oxygénée (HbO2). La quantité de lumière réfléchie et le spectre d'absorption permettent de calculer la teneur en O2 de la zone cérébrale explorée (voir Figure 19.6) [17].
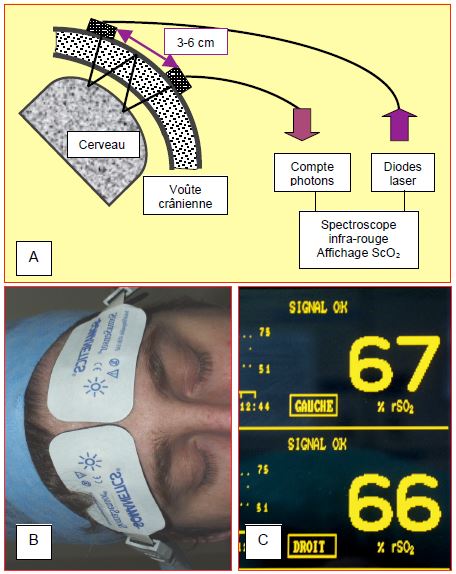
Figure 19.6 : Spectroscopie infrarouge et mesure de la saturation de l'hémoglobine cérébrale en oxygène (ScO2). A : Les deux diodes de chaque capteur sont écartées de 3 cm environ (appareil INVOS™); chaque capteur est placé sur l'angle fronto-temporal, de chaque côté du crâne. La longueur d'onde laser émise (758 – 929 nm) pénètre la boîte crânienne et se trouve dispersée par la substance cérébrale où une partie spécifique du spectre est absorbée par l'hémoglobine oxygénée (HbO2) et une autre par l'hémoglobine totale. La quantité de lumière réfléchie et le spectre d'absorption permettent de calculer la teneur en oxygène de la zone cérébrale explorée. B : électrodes de lecture en place au-dessus du rebord orbitaire sur la peau glabre du front ; elle doivent prendre l’angle fronto-temporal pour que les rayons des deux diodes soient concentriques. C : affichage de la ScO2 bilatérale.
Les valeurs affichées, combinaison de valeurs artérielles, capillaires et veineuses, sont très voisines de la saturation veineuse cérébrale (SjO2) parce que les trois quarts du sang cérébral sont dans le réseau veineux et parce que l'appareil utilise les composantes non-pulsatiles du spectre. La valeur normale oscille entre 60 et 75%; elle est en moyenne de 66% [1,11]. Bien que l’évolution du chiffre soit plus significative que sa valeur absolue, une ScO2 inférieure à 50% est clairement anormale. Il existe souvent une légère asymétrie entre les deux hémisphères, mais l’apparition d’une nouvelle asymétrie de plus de 10 points est pathologique [1]. Une ischémie survenant dans une autre région que celle examinée échappe cependant à la surveillance ; par contre, la technique permet de différencier l'état des deux hémisphères. La ScO2 s'élève en hyperoxie et en hypercapnie (respectivement par augmentation de l’apport d’O2 et par vasodilatation cérébrale) ; elle baisse en hypoxémie et en hypocapnie. Elle s’abaisse avec le débit cardiaque et lui est directement corrélée ; elle baisse également avec une augmentation de la pression veineuse (PEEP, Trendelenburg, subocclusion jugulaire par appui ou rotation excessive de la tête). Elle diminue par vasoconstriction artérielle (nor-adrénaline) [19].
Lors du clampage carotidien, la ScO2 s'abaisse en général de 5-15 points ; la mise en place d'un shunt peut faire remonter la valeur de 5-10 points [2]. La question majeure est celle de la définition d'un seuil en dessous duquel les déficits neurologiques sont certains. Celui-ci est encore mal établi. Une baisse de 16% de la ScO2 possède une valeur prédictive positive de 76% et une valeur prédictive négative de 99% pour détecter une ischémie cérébrale nécessitant la mise en place d'un shunt [13]. Une chute de 20 points ou plus a une sensibilité et une spécificité de 80% et une valeur prédictive négative de 98% pour l’apparition de troubles neurologiques [6], mais une valeur prédictive positive de seulement 37% pour la présence de déficits neurologiques postopératoires [9]. Un effondrement à des valeurs de 30-40% signe une souffrance grave mais est encore compatible avec une récupération neurologique [17]. Dans l'état actuel de nos connaissances, on peut suggérer les repères suivants, bien qu’ils n’aient pas encore été validés [6,9,19] :
- Baisse de 5-15 points : normal lors de clampage carotidien ;
- Baisse de < 20 points : faible probabilité de lésions neurologiques ;
- Baisse de > 20 points : seuil d’alerte ;
- ScO2 = 40%: limite de récupération neurologique certaine ;
- ScO2 ≤ 30%: seuil de probabilité de déficits neurologiques postopératoires.
En cours d’intervention, on cherche donc à maintenir la ScO2 entre 65% et 75% et à éviter une chute de plus de 20%. Lorsque la ScO2 baisse au-delà de ces limites, il faut immédiatement augmenter la pression artérielle pour améliorer la perfusion cérébrale. La vitesse de modification de la ScO2 a autant de valeur que le chiffre atteint ; plus la chute est rapide, plus la situation est grave et demande une correction rapide de la pression artérielle.
Doppler transcrânien
Le Doppler transcrânien (DTC) permet de mesurer le flux sanguin dans une grande artère, en général la cérébrale moyenne, selon l'équation: Q = V • π r2. Une fois le diamètre du vaisseau connu, la mesure de la vélocité (V) permet de calculer le flux (Q). Un Doppler ne mesure que la vélocité des hématies, non leur nombre. Son utilisation comme monitorage suppose que la vélocité du flux reflète effectivement le débit sanguin total, donc que le diamètre du vaisseau ne se modifie pas et que le capteur reste absolument stable. Les variations de l'Hb, de la viscosité, de la température, de la PaCO2, et les agents d'anesthésie interfèrent considérablement avec la mesure [4].
Alors que la valeur absolue du flux peut être incertaine, ses variations (ischémie ou hyperémie) et son sens (antérograde ou rétrograde) lors de clampage sont parfaitement surveillés par le DTC. Lors de syndrôme d’hyperperfusion cérébrale, la Vmax du flux sanguin est doublée 3 minutes après le déclampage [12]. Les embols sont aisément détectés pendant la chirurgie carotidienne; ils apparaissent sous forme de HITS (high-intensity transient signals) dont la morphologie donne une clef sur l'origine (bulle, athérome, etc) [15]. Toutefois, la corrélation avec les symptômes cliniques n'est fiable que pour les HITS détectés pendant la dissection et la fermeture, mais non pour ceux qui surviennent au clampage et au déclampage et qui sont les plus nombreux [5,12,16]. La fenêtre de lecture est inadéquate chez 10-15% des malades [12], et les signaux sont ininterprétables dans 21% des cas [10]. Le DTC, encombrant, instable et très opérateur-dépendant, ne s'est guère implanté dans le domaine clinique, bien qu’il soit la seule technique susceptible de détecter les embolies.
Pression distale
La mesure de la pression distale au clamp (stump pressure) est supposée refléter la pression résiduelle dans le lit vasculaire en aval, maintenue par les anastomoses du polygone de Willis. Elle devrait rester supérieure à 50 mm Hg [21]. On n'a cependant jamais pu trouver une corrélation fiable entre cette valeur et le débit sanguin cérébral ou l'aspect de l'EEG, ni avec les résultats cliniques [7,8].
| Surveillance neurologique |
|
Le status neurologique en anesthésie loco-régionale est la meilleure surveillance de la perfusion cérébrale.
L’EEG, le Doppler transcrânien et la saturométrie cérébrale (ScO2) sont les techniques de monitorage les plus fiables. La ScO2 a le meilleur rapport efficacité/complexité
- Valeur normale : 60 – 75%
- Clampage carotidien : chute habituelle de 5 – 15 points
- Baisse de < 20 points : absence probable de lésions neurologiques
- Baisse de > 20 points: seuil de risque neurologique
- Une chute rapide est un signe de risque neurologique
- Valeur persistante de ScO2 < 40%: déficits neurologiques probables
Les AVC sont principalement dus à une embolie athéromateuse ou à une thrombose locale (> 80% des cas) et plus rarement à une chute de pression à travers une sténose critique ou à une perfusion luxuriante (< 20% des cas)
|
© CHASSOT PG, Décembre 2010, dernière mise à jour, Décembre 2017
Références
- BUTLER E, CHIN M, ANEMAN A. Peripheral near-infrared spectroscopy: methodological aspects and a systematic review in post-cardiac surgical patients. J Cardiothorac Vasc Anesth 2017; 31:1407-16
- CUADRA SA, ZWERLING JS, FEUERMAN M, et al. Cerebral oximetry monitoring during endarterectomy: effect of carotid clamping and shunting. Vasc Endovasc Surg 2003; 37:407-13
- DEOGAONKAR A, VIVAR R, BULLOCK RE, et al. Bispectral index monitoring may not reliably indicate cerebral ischaemia during awake carotid endarterectomy. Br J Anaesth 2005; 94:800-4
- DOBLAR DD. Cerebrovascular assessment of the high-risk patient: The role of transcranial Doppler ultrasound. J Cardiothorac Vasc Anesth 1996; 10:3-14
- EDMONDS HL. Advances in neuromonitoring for cardiothoracic and vascular surgery. J Cardiothorac Vasc Anesth 2001; 15:241- 50
- EDMONDS HL, GANZEL BL, AUSTIN EH. Cerebral oximetry for cardiac and vascular surgery. Semin Cardiothorac Vasc Anesth 2004; 8:147-66
- HANS S, JAREUNPOON O. Prospective evaluation of electroencephylography, carotid artery stump pressure, and neurologic changes during 314 consecutive carotid endarterectomies performed in awake patients. J Vasc Surg 2007; 45:511-5
- MAHARAJ R. A review of recent developments in the management of carotid artery stenosis. J Cardiothorac Vasc Anesth 2008; 22:277-89
- MILLE T, TACHIMIRI ME, KLERSY C, et al. Near infrared spectroscopy monitoring during carotid endarterectomy: which threshold value is critical ? Eur J Vasc Endovasc Surg 2004; 27:646-50
- MORITZ S, KASPRZAK P, ARIT M, et al. Accuracy of cerebral monitoring in detecting cerebral ischemia during carotid endarterectomy. Anesthesiology 2007; 107:563-9
- NOLLERT G, SHINOKA T, JONAS RA. Near-infrared spectrophotometry of the brain in cardiovascular surgery. J Thorac Cardiovasc Surg 1998; 46:167-75
- PENNEKAMP CWA, MOLL FL, De BORST GJ. The potential benefits and the role of cerebral monitoring in carotid endarterectmy. Curr Opin Anaesthesiol 2011; 24:693-7
- PENNEKAMP CW, IMMINK RV, DEN RUIJTER HM, et al. Near-infrared spectroscopy to indicate selective shunt use during carotid endarterectomy. Eur J Vasc Endovasc Surg 2013; 46:397-403
- RAMPIL IJ. A primer for EEG signal processing in anesthesia. Anesthesiology 1998: 89:980-1002
- RINGELSTEIN EB, DROSTE DW, BABIKIAN VL, et al. Consensus on microembolus detection by TCD. Stroke 1998; 29:725-9
- ROWED DW, HOULDEN DA, BURKHOLDER LM, TAYLOR AB. Comparison of monitoring techniques for intraoperative cerebral ischemia. Can J Neurol Sci 2004; 31:347-56
- SCHWARTZ G, LITSCHER G. Transcranial cerebral oxymetry, transcranial Doppler sonography, and heart rate variability: useful neuromotitoring tools in anaesthesia and intensive care ? Eur J Anaesthesiol 2002; 19:543-9
- SEBEL PS, LANG E, RAMPIL IJ, et al. A multicenter study of bispectral electroencephylogram analysis for monitoring anesthetic depth. Anesth Analg 1997; 84:891-9
- STEPPAN J, HOGUE CW. Cerebral and tissue oxymetry. Best Practice Res Clin Anaesthesiol 2014; 28:429-39
- WELSBY IJ, RYAN JM, BOOTH JV, et al. The bispectral index in the diagnosis of perioperative stroke: A case report and discussion. Anesth Analg 2003; 96:435-7
- WHITELY D, CHERRY KJ. Predictive value of carotid artery stump pressures during carotid endartectomy. Neurosurg Clin N Am 1996; 7:723-32
