Délais préopératoires
Alors qu’il existe des recommandations claires pour les délais à respecter lors de traitement avec les héparines et les anti-vitamine K, on ne dispose pas de suffisamment de données sur les nouveaux anticoagulants oraux (NACO) pour pouvoir promulguer des règles concernant leur gestion périopératoire. Pour l’instant, on est contraint de se satisfaire de propositions formulées par des groupes d’experts ; elles sont basées sur la pharmacocinétique de ces substances (Tableau 3.10) [10,17]. Les délais d’interruption préopératoire minimaux habituellement proposés sont les suivants (risque hémorragique standard, fonctions hépatique et rénale normales) [6,8,15,17,22,24,30,35].
- Héparine non-fractionnée 4-6 h (pas d'interruption si perfusion pour SCA)
- HBPM prophylactique 12 h (24 heures si clairance créatinine < 50 mL/min)
- HBPM thérapeutique 24 h (48 heures si clairance créatinine < 50 mL/min)
- Fondaparinux (Arixtra®) 48-72 h (4-6 jours si clairance créatinine < 50 mL/min)
- Dabigatran (Pradaxa®) 48-72 h (3-5 jours si clairance créatinine < 50 mL/min)
- Apixaban (Eliquis®) 48-72 h (3-4 jours si clairance créatinine < 50 mL/min)
- Edoxaban (Savaysa®, Lixiana®) 48-72 h (3-5 jours si clairance créatinine < 50 mL/min)
- Rivaroxaban (Xarelto®) 5-10 mg 24-48 h (2-3 jours si clairance créatinine < 50 mL/min)
- Rivaroxaban (Xarelto®) 15-20 mg 48-72 h (3-4 jours si clairance créatinine < 50 mL/min)
- Sintrom®, Coumadine® 5 jours (contrôle INR à J-5 et J-1)
- Marcoumar® 10 jours (contrôle INR à J-10 et J-1)
- Désirudine (Iprivask®) 10 h
- Bivalirudine (Angiox®) 4-10 h
- Danaparoïde (Orgaran®) 48 h
- Argatroban (Argatroban Inj®) 4 h
Ces délais sont basés sur une attente correspondant à 3 demi-vies d’élimination (taux sérique baissé à 12.5%) pour les cas standards et à 5 demi-vies (taux sérique baissé à 3%) pour les cas à risque hémorragique élevé; en cas d’insuffisance rénale, ils sont doublés pour les substances éliminées par les reins [28]. A cause des risques inhérents à l’anesthésie loco-régionale, il est préférable d’attendre 5 demi-vies avant une ponction neuraxiale, soit 72 heures [9,14]. En comptant un délai de 3 demi-vies et en prenant les valeurs hautes pour la demi-vie plasmatique de chacune des substances, on peut recommander, lorsque la fonction rénale est normale, d’attendre 48 heures pour tous les nouveaux anticoagulants oraux (NACO), sauf pour le rivaroxaban aux doses de 5-10 mg/j dans les interventions simples chez des malades sans comorbidité où ce délai peut être ramené à 24 heures.
Comme les nouveaux anticoagulants ont une forte composante d'excrétion rénale (totale pour le fondaparinux et le dabigatran, moitié pour l'edoxaban, un tiers pour le rivaroxaban et un quart pour l'apixaban), les délais d'interruption préopératoire sont allongés en conséquence en cas d'insuffisance rénale modérée (clairance à la créatinine 30-50 mL/min) ou majeure (clairance à la créatinine 15-30 mL/min) [11,24].
- Fondaparinux: 4-6 jours (selon le risque hémorragique);
- Dabigatran: 3-5 jours (idem);
- Xabans: 3-5 jours (idem).
Les interventions mineures sans risque hémorragique (dentisterie, ophthalmologie, chirurgie de paroi, etc) se déroulent sans interruption des NACO, en prenant toutefois soin d’opérer lorsque le taux sérique est bas (entre 12 et 18 heures après la dernière prise). Pour davantage de détails sur ces substances, on se rapportera au Chapitre 8, Les anticoagulants.
Gestion périopératoire détaillée
La gestion des anticoagulants en préopératoire peut se résumer comme suit (Tableau 3.11) [1,8,10, 12,15,17,22,24,28].
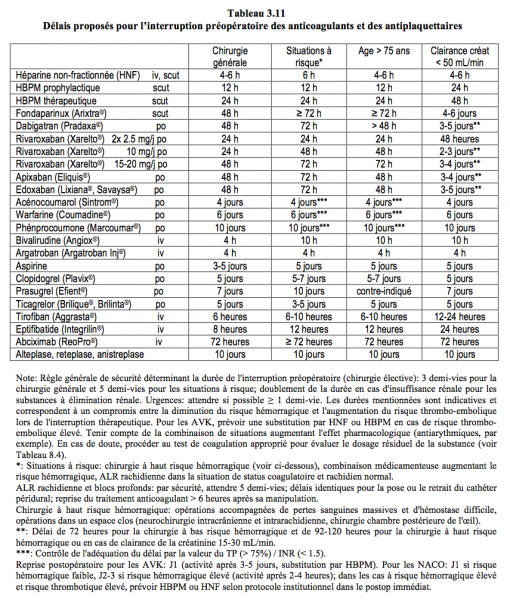
- Héparine non-fractionnée (HNF); interruption de la perfusion 4-6 heures préopératoires. En chirurgie cardiaque lors de syndrome coronarien aigu ou de thrombose de prothèse valvulaire: continuation de la perfusion jusqu’à l’induction. Idem pour la bivalirudine.
- Contrôle: aPTT, ACT.
- Antidote spécifique: protamine.
- Héparines de bas poids moléculaire (HBPM); la durée de l’interruption est fonction de la dose sous-cutanée.
- HBPM prophylactique (10’000-12’000 UI/24 h): interruption 12 heures.
- HBPM thérapeutique (≥ 20’000 UI/24 h): interruption 24 heures; éventuelle substitution par HNF intraveineuse pendant 12-20 heures.
- Contrôle de l’effet résiduel : effet anti-Xa.
- Antidote partiel: protamine.
- Délai doublé en cas d'insuffisance rénale.
- Fondaparinux (Arixtra®): interruption de 48 à 72 heures selon le risque hémorragique de la chirurgie.
- Délai étendu à 4-6 jours si la clairance de la créatinine est < 50 mL/min.
- Contrôle de l’effet résiduel : effet anti-Xa.
- Substitution par HNF intraveineuse réservée aux cas à très haut risque thrombo-embolique et délai prolongé.
- Pas d’antidote spécifique.
- Anti-vitamine K (AVK); arrêt préopératoire de 5 jours (warfarine, acénocoumarol) à 10 jours (phenprocoumone). Une valeur d’INR < 2.0 est en général suffisante pour procéder à une chirurgie à risque hémorragique modéré, alors qu’un INR < 1.5 est requis pour une chirurgie majeure. Contrôler l’INR 24 heures avant la chirurgie. L’interruption des AVK n’est pas nécessaire avant la chirurgie dermatologique, la dentisterie, l’ophthalmologie (cataracte), l’endoscopie ou la pose de pace-maker (algorithme décisionnel: voir Figure 8.15) [6].
- Substitution seulement si risque thrombo-embolique élevé (prothèse valvulaire cardiaque, anamnèse d'AVC, INR visé ≥ 3.0): HNF ou HBPM dès 48-72 heures après la dernière dose (voir ci-dessous). Dans les autres cas (INR visé < 3.0), la substitution n'est plus recommandée.
- Antidote spécifique: vitamine K (Konakion®) 2.5-5 mg iv/12 h en cas d’urgence; l’effet n’est obtenu qu’après 12 heures. Si opération élective et INR 1.5 - 2.0 : 1-2 mg vitamine K per os.
- Antidote non-spécifique (indiqué en cas d’hémorragie intra-crânienne ou d’hémorragie massive): complexe prothrombinique à 4-facteurs (PCC prothrombin complex concentrate) ; il est beaucoup plus efficace que le PFC et n’impose pas le risque d’une surcharge de volume [18].
- Dabigatran (Pradaxa®); adaptation du délai d’interruption préopératoire en fonction de la clairance de la créatinine et du risque hémorragique de l’intervention. Le risque hémorragique chirurgical est le même en arrêtant le dabigatran 48 heures avant l’intervention qu’en stoppant la warfarine pendant 5 jours [16]. Lors d'intervention sans interruption de l'anticoagulant, le risque hémorragique est 4 fois moindre sous dabigatran que sous warfarine [5].
- Délai d’interruption préopératoire: 48 ou 72 heures selon le risque hémorragique de la chirurgie (Cl créat > 50 mL/min), 3-5 jours si clairance créatinine < 50 mL/min.
- Contrôle de l’effet résiduel : temps de thrombine dilué (dTT, Hemoclot™), temps d'écarine; TT: sensible mais pas quantitatif.
- Antidote: idarucizumab (Praxbind®) (voir ci-après Antagonisme).
- Rivaroxaban (Xarelto®), apixaban (Eliquis®), edoxaban (Lixiana®); l’interruption du traitement pendant 48 heures est en général suffisante, vu leur courte demi-vie.
- Délai étendu à 72 heures en cas d’opération à risque hémorragique élevé ou d’ALR rachidienne.
- Délai supplémentaire de 24 heures si la clairance de la créatinine est < 50 mL/min ou si le patient est sous amiodarone (Cordarone®) [20].
- Délai diminué à 24 heures pour le rivaroxaban à 10 mg/j pour une opération simple chez un patient sans comorbidité.
- Délai de 24 heures pour le rivaroxaban à 2x 2.5 mg/j.
- Contrôle de l’effet résiduel : activité anti-Xa. TP prolongé : persistance de l’effet (non-quantitatif). TT, TPT, fibrinogène, facteur XIII et D-dimères ne sont pas influencés.
- Pas d’antidote spécifique pour l'instant (en préparation) ; les complexes prothrombiniques 4-facteurs sont probablement efficaces (voir ci-après Antagonisme).
La grande variabilité interindividuelle et l’effet de l’âge ou de l’insuffisance rénale induisent des variations de 1 à 4 dans le taux résiduel des xabans 12 à 24 heures après la dernière prise ; le taux de 50 ng/mL, considéré comme valeur limite autorisant la chirurgie, est atteint en 12 à 48 heures selon les patients; le seuil de sécurité pour la chirurgie hémorragique est à 30 ng/mL [10,25,26]. Si le taux est > 100 ng/mL, il est recommandé de prolonger le délai d'attente. Comme l’effet clinique est proportionnel à la concentration de l'agent, il n’y a pas lieu de prévoir de substitution puisque le malade est suffisamment anticoagulé.
En se basant sur l'estimation longue de leur demi-vie (environ 12 heures), on peut formuler une recommandation simple pour le délai d’interruption préopératoire des nouveaux anticoagulants oraux [1,8,10,24,28,36].
- Opération urgente: attendre au moins 1 demi-vie;
- Opération à risque hémorragique nul ou faible : pas d’interruption, mais préférence pour intervenir 8-10 heures après la dernière prise;
- Opération à risque hémorragique faible ou modéré: attendre 3 demi-vies (48 heures);
- Opération à risque hémorragique élevé: attendre 5 demi-vies (72 heures);
- Anesthésie loco-régionale (ALR) rachidienne, blocs profonds : attendre 5 demi-vies (72 heures) ;
- Chirurgie en cas d'insuffisance rénale: attendre > 5 demi-vies (3-5 jours) ;
- La substitution par une héparine n'est pas nécessaire.
Vu le manque d’expérience clinique avec les nouveaux anticoagulants et la non-disponibilité de leurs antagonistes sur le marché (sauf pour le dabigatran), il est nécessaire de rester extrêmement prudent avec les indications à l’ALR rachidienne chez les patients recevant l’un de ces médicaments. Environ 15% des patients conservent un taux résiduel efficace de NACO après 48 heures d'interruption [13]. Comme l'analgésie péridurale ou intrathécale n'est pas un geste thérapeutique et ne peut donc pas justifier une prise de risque, il est recommandé de respecter un délai de 72 heures sans prise de NACO [10]. Chez les malades dont le risque thrombotique est important, cette attente est excessive car elle fait courir un danger de thrombo-embolie.
| Gestion périopératoire des anticoagulants |
|
D’une manière générale, les délais d’interruption préopératoire sont basés sur la demi-vie de la substance ; ils sont doublés en cas d’insuffisance rénale pour les substances éliminées par les reins.
- Opération urgente : attendre au moins 1 demi-vie
- Opération à risque hémorragique modéré : attendre 3 demi-vies
- Opération à risque hémorragique élevé, ALR rachidienne : attendre 5 demi-vies
Une substitution par de l’HNF est envisagée seulement dans les cas à risque thrombo-embolique élevé si l’interruption dure > 48 heures.
Délais recommandés entre la dernière prise d’anticoagulant et l’acte chirurgical :
- Héparine non-fractionnée 4-6 h (pas d'interruption si perfusion pour SCA)
- HBPM (prophylactique) 12 h (24 heures si Cl créat < 50 mL/min)
- HBPM (thérapeutique) 24 h (48 heures si Cl créat < 50 mL/min)
- Fondaparinux 48-72 h (4-6 jours si Cl créat < 50 mL/min)
- Dabigatran 48-72 h (3-5 jours si Cl créat < 50 mL/min)
- Apixaban 48-72 h (3-4 jours si Cl créat < 50 mL/min)
- Edoxaban 48-72 h (3-5 jours si Cl créat < 50 mL/min)
- Rivaroxaban 5-10 mg 24-48 h (2-3 jours si Cl créat < 50 mL/min)
- Rivaroxaban 15-20 mg 48-72 h (3-4 jours si Cl créat < 50 mL/min)
- Sintrom® , Coumadine® 5 jours (contrôle INR à J-5 et J-1)
- Marcoumar® 10 jours (contrôle INR à J-10 et J-1)
En comptant un délai de 3 demi-vies et en prenant les valeurs hautes pour la demi-vie plasmatique de chacune des substances, on peut recommander, de manière simplifiée, d’attendre 48 heures pour tous les NACO, sauf pour le rivaroxaban dans les interventions simples chez des malades sans comorbidité où ce délai peut être ramené à 24 heures. La durée d'interruption est portée à 72 heures en cas de risque hémorragique élevé ou de loco-régionale rachidienne. Le délai pour la reprise postopératoire de l’anticoagulant dépend du risque hémorragique, de la qualité de l’hémostase et du degré de menace thrombo-embolique, mais il est en général de 12-48 heures.
|
Tests de laboratoire
Les valeurs des tests coagulatoires recherchées avant une intervention chirurgicale ou une anesthésie rachidienne (intrathécale, épidurale) sont les suivantes :
- INR < 1.5 ;
- TP > 75% ;
- aPTT ≤ 35 sec ;
- ACT < 120 sec ;
- Fibrinogène ≥ 1.5 g/L ;
- Thrombocytes ≥ 70’000/mcL.
En préopératoire, le degré d’anticoagulation obtenu par les différents médicaments est évalué par un certain nombre de tests (voir Tableau 8.4 et Chapitre 8, Monitorage) [6,33,35].

- Antivitamine K : TP et INR.
- Héparine non-fractionnée (HNF) : aPTT (dosages standards), ACT (dosages élevés).
- Héparines à bas poids moléculaire (HBPM) : effet anti-Xa (spécifique) ; aPTT (modification non-quantitative).
- Fondaparinux (Arixtra®) : effet anti-Xa calibré.
- Dabigatran (Pradaxa®) : effet anti-IIa, TT, Hemoclot™ (spécifiques); aPTT nonquantitatif.
- Rivaroxaban (Xarelto®), apixaban (Eliquis®), edoxaban (Lixiana®) : effet anti-Xa calibré (spécifique) ; TP (non-quantitatif, valable seulement en présence d’un réactif sensible au rivaroxaban comme la Néoplastine Plus, faible corrélation avec l'apixaban et l'edoxaban).
Avec les HBPM, le fondaparinux et les NACO, le dosage doit être effectué à distance du pic de concentration (8-12 heures après la dernière prise) [11]. Un TP ou un aPTT normal n’exclut pas que le malade soit encore sous l’effet de la substance anticoagulante; tout au plus, cela garantit qu'il ne soit pas sous un taux résiduel élevé. Le dosage de l'activité anti-Xa permet de déduire le taux sérique des xabans, mais il n’y a malheureusement pas de relation univoque entre la valeur quantitative des résultats de laboratoire et l’importance du risque hémorragique peropératoire [10,26].
Plusieurs médicaments prescrits simultanément à un NACO modifient le métabolisme de l'anticoagulant et en potentialisent l'effet: amiodarone, dronédarone, verapamil, érythromycine, anti-viraux, kétoconazole, itraconazole, posaconazole. D'autres au contraire en diminuent l'effet: rifampicine, carbamazépine, phénobarbital, phénytoïne [17,20,35]. Toute une série de substances naturelles fréquemment consommées interfèrent également avec la coagulation et peuvent entraîner un risque accru d’hémorragie, notamment par potentialisation des effets des anticoagulants et des antiplaquettaires: anis, clou de girofle, curcuma, gingko, gingembre, camomille, vitamine E, pamplemousse. Leur consommation doit être interrompue le plus tôt possible.
Antagonisme en cas d'hémorragie
Le renversement de l'anticoagulation est nécessaire en cas d'hémorragie grave ou d'intervention chirurgicale intermédiaire ou majeure. Un antagonisme prophylactique n’est recommandé que lors d’opérations à haut risque hémorragique chez des malades à faible risque thrombo-embolique. Les patients ne doivent pas être équilibrés uniquement en fonction des besoins peropératoires, car la normalisation de la coagulation présente un danger majeur d’accident vasculaire thrombo-embolique chez les malades anticoagulés (voir Chapitre 8 Antagonisme). Les anticoagulants classiques possèdent un antidote éprouvé qui permet d’en renverser l’effet.
- Héparine non-fractionnée (HNF): protamine. Un mg de protamine (100 UI) neutralise 1 mg d'héparine (100 UI).
- Héparines à bas poids moléculaire (HBPM): la protamine est un antagoniste partiel. Une neutralisation de 60% de l’effet anticoagulant est possible à raison de 1 mg de protamine pour 100 UI d’effet anti-Xa (dose maximale : 50 mg), à la condition d’être à moins de 8 heures après l’administration.
- Agents anti-vitamine K: vitamine K (Konakion®) intraveineuse (2.5-5.0 mg, éventuellement 10 mg) administrée en > 20 minutes; effet maximal après 12-24 heures.
Les nouveaux anticoagulants anti-Xa et anti-thrombine présentent moins de risque hémorragique que les AVK: réduction des hémorragies intracrâniennes de 51%, de l'ictus de 19% et de la mortalité de 10% [31]. Il est moins fréquemment nécessaire de devoir renverser leur effet parce que leur demi-vie ne dépasse pas 12 heures. Vu cette demi-vie assez courte, le temps est leur antagoniste le plus simple ; plus on attend, plus le risque de saignement diminue. En cas d’hémorragie persistante, on peut recourir à un renversement non-spécifique, après s’être assuré que la calcémie, l’équilibre acido-basique et la température du malade sont normaux (voir Chapitre 8, Facteurs de coagulation) [19,21,32].
- Complexe prothrombinique (PCC prothrombin complex concentrate); contient les facteurs II, IX, X (préparations à 3 facteurs) et du facteur VII (préparations à 4 facteurs). Dosage: 25-50 UI/kg. Permet le renversement partiel de l’effet des xabans sur les tests de coagulation in vitro, mais inefficace sur le dabigatran.
- Complexe prothrombinique activé (aPCC) et FEIBA® (Factor eight inhibitor bypass activity), contient les facteurs II, IX, X et VII dont une partie sous formes de facteurs activés. Dosage: 30-50 UI/kg. Meilleure alternative pour le renversement de l’effet du dabigatran, ils sont aussi plus efficaces que le PCC pour le renversement in vitro du rivaroxaban. Le PCC activé n'est recommandé que lors d'hémorragie mettant la vie en danger en l'absence d'antidote spécifique de l'anticoagulant.
- Facteur VII activé (rFVIIa, Novo-Seven®), 90 mcg/kg; le rFVIIa active le facteur X en Xa, ce qui génère davantage de thrombine. Bien qu’il normalise les tests de coagulation, le rFVIIa ne diminue pas significativement les pertes sanguines. Administré en excès, il présente un risque de thrombose. Aucune étude clinique n’a démontré de succès clair dans le renversement de l’effet des nouveaux anticoagulants. Le rFVIIa n'est plus recommandé pour le renversement des NACO [23].
- L’ordre d’efficacité croissant pour renverser l’effet des NACO sur les tests de coagulation est : rFVIIa < PCC < aPCC; toutefois l’effet est limité et ne dépasse pas 50% de correction.
Le PCC et le FEIBA sont les agents de premier choix dans les circonstances graves. Le plasma frais décongelé (PFC) est inefficace car il contient de trop faibles concentrations des facteurs et fait courir un risque de surcharge hémodynamique pour obtenir l’effet désiré (1.5-2 litres de PFC sont nécessaires pour normaliser le taux des facteurs). Or il ne s’agit pas, avec les NACO, de compenser la déplétion des facteurs comme dans le renversement des AVK, mais de surmonter leur inhibition par une substance circulante [19].
Bien que la plupart des tests standards soit modifiée, leur éventuelle normalisation par le traitement antagoniste n’assure malheureusement pas que l’hémostase soit normale en cours d’opération. D’autre part, l’administration de facteurs de coagulation peut améliorer le bilan hémorragique sans que les tests de laboratoire ne soient significativement modifiés [26]. Il n’existe donc pas de relation linéaire et fixe entre les résultats de laboratoire et le taux de saignement peropératoire.
A défaut de renverser l’effet anticoagulant, on peut tenter de freiner l’absorption digestive du produit avec du charbon actif si la dernière prise remonte à moins de 2-3 heures, ou d’éliminer la substance par filtration : hémodialyse pour le dabigatran, plasmaphérèse pour le rivaroxaban et l’apixaban. Enfin, il est possible d’atténuer les effets de l’anticoagulation par l’appoint d’un antifibrinolytique (acide tranexamique, 2 g iv) ou d’une stimulation de la production de facteur VIII (desmopressine 0.3 mcg/kg iv).
La préparation d'antidotes spécifiques pour les NACO avance à grands pas. Il en existe actuellement trois, dont un est déjà disponible [3,32].
- Idarucisumab (Praxbind®, actuellement commercialisé); liaison irréversible avec le dabigatran. Normalisation du TT et de l'ECT, cessation de l'hémorragie en 11 heures, hémostase chirurgicale normalisée dans 94% des cas [29].
- Début de l'action: < 5 minutes.
- Demi-vie: initiale 47 min, terminale 10.3 heures.
- Dosage: 2 x 2.5 g iv en 10 min à 15 minutes d'intervalle.
- Au fur et à mesure que le dabigatran circulant est neutralisé, le dabigatran distribué dans le liquide extracellulaire et dans les tissus rediffuse dans le plasma et oblige à administrer une nouvelle dose d'antagoniste; ce phénomène peut se répéter plusieurs fois.
- Andexanet alfa; fonctionne comme un leurre et séquestre les inhibiteurs du facteur Xa (xabans). L'activité anti-Xa est réduite de 90% en 5 minutes et l'effet dure 2 heures; l'hémorragie est réduite de 79% [7]. La substance est en voie de commercialisation (Annexa®) pour renverser l'effet du rivaroxaban, de l'apixaban et de l'edoxaban.
- Début de l'action: 2 minutes.
- Demi-vie: 6 heures.
- Dosage 1: 400 mg (bolus iv à 30 mg/min), puis perfusion 4 mg/min (480 mg) pour l'apixaban, ou pour le rivaroxaban à > 7 heures de la dernière prise.
- Dosage 2: 800 mg puis perfusion à 8 mg/min (960 mg) pour l'edoxaban, ou pour le rivaroxaban à < 7 heures de la dernière prise.
- Ciraparantag (aripazine); molécule polyvalente contenant 8 sites de fixation covalente, efficace pour renverser l'effet des xabans, de l'argatroban, du fondaparinux, du dabigatran et des héparines. Le temps de coagulation est normalisé en 10 minutes [2].
- Début de l'action: 5-10 minutes.
- Durée d'action de 24 heures.
- Dosage: 100-300 mg en bolus iv.
Le renversement de l'anticoagulation par ces antidotes est excessivement onéreux: une dose de PCC activé (50 UI/kg) dépasse CHF 5'000.-, et celle de Praxbind® s'élève à CHF 3'400.- [32].
Chez un malade qui saigne sous anticoagulants, l'élévation du TP et du TT, éventuellement du PTT, doit faire suspecter l'utilisation d'un NACO et commander un test anti-Xa et un dTT (Hemoclot™) pour s'en assurer. Répétés à 6 heures d'intervalle si la situation l'autorise, deux dosages successifs permettent de situer le malade sur la courbe d'élimination de la substance et de décider si un antagonisme est requis. La chirurgie est envisageable dès que le dosage de l'effet anti-Xa ou anti-IIa est < 50 ng/mL, ce qui peut être atteint par une simple attente si la situation le tolère. Il est capital de connaître le délai depuis la dernière prise du médicament, qui permet de savoir si l'on est au pic ou au nadir de la concentration circulante, l'âge et la fonction rénale du patient, qui permettent d'évaluer la vitesse d'élimination du produit, ainsi que ses comorbidités et comédications, qui permettent de juger des éventuelles interférences. Un algorithme permet de clarifier l'enchaînement des diverses mesures thérapeutiques (Figure 8.14).
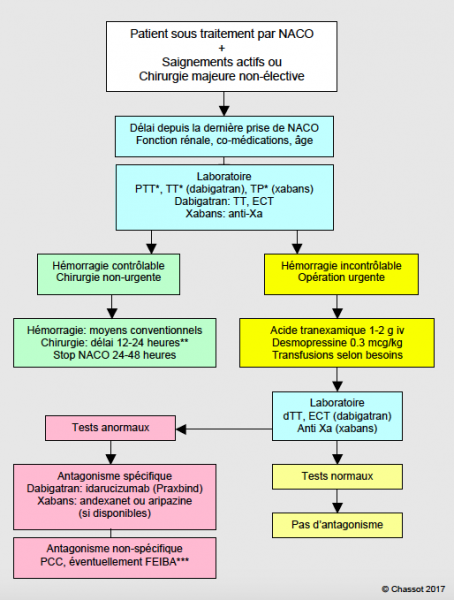
Figure 8.14: Algorithme de prise en charge des malades souffrant d'hémorragie ou devant subir une opération urgente hémorragipare lors d'utilisation des nouveaux anticoagulants oraux (NACO): dabigatran, rivaroxaban, apixaban ou edoxaban.
*: ces tests ont une valeur d'alerte, mais n'ont pas de valeur quantitative; en particulier, une valeur normale n'exclut pas la présence d'un taux significatif de la substance.
**: la demi-vie des NACO est en moyenne de 12 heures; après 24 heures, le taux plasmatique est de 25%, et un délai de 48 heures garantit l'absence d'effet (taux résiduel de 6-7%). La chirurgie standard est envisageable dès que le dosage de l'effet anti-Xa correspond à un taux plasmatique < 50 ng/mL, ce qui peut être atteint par une simple attente si la situation le permet. La chirurgie à risque hémorragique nécessite un taux < 30 ng/mL.
***: le PCC activé (FEIBA) et le rFVVa sont réservés aux hémorragies potentiellement létales.
Moyens conventionnels: compression locale et hémostase chirurgicale ou endoscopique, embolisation radio-interventionnelle, administration de volume (cristalloïdes, expandeurs plasmatiques), charbon actif si ingestion < 4 heures. dTT: temps de thrombine dilué (Hemoclot™). ECT: ecarin coagulation time.
|
Renversement de l’effet des anticoagulants
|
|
Le but est d’atteindre un niveau d’anticoagulation qui soit un compromis acceptable entre les pertes sanguines peropératoires et le danger de thrombo-embolie postopératoire. Le renversement prophylactique de l’anticoagulation n’est pas recommandé, sauf dans les opérations à haut risque hémorragique et chez les malades à faible risque thrombo-embolique. Il n’existe pas de relation directe entre les résultats de laboratoire et le taux de saignement peropératoire.
Antidotes spécifiques :
- Héparine non-fractionnée : protamine (1 mg protamine pour 1 mg héparine)
- HBPM : la protamine est un antagoniste partiel
- Agents anti-vitamine K : vitamine K (2.5-5 mg iv / 12 h)
Agents non-spécifiques : - Acide tranexamique (2 gm), desmopressine (0.3 mcg/kg)
- Complexe prothrombinique (facteurs II, IX, X et une dose variable de facteur VII)
- Complexe prothrombinique activé (aPCC), FEIBA® (facteurs II, IX, X et VII partiellement activés)
- Facteur VII activé (rFVIIa, Novo-Seven®) (mesure de sauvetage)
- Ordre d’efficacité (in vitro): PCC < rFVIIa < aPCC
Antidotes des nouveaux anticoagulants oraux (NACO): - Idarucizumab (Praxbind®) pour le dabigatran (déjà commercialisé)
- Andexanet alfa pour les xabans
- Ciraparantag pour le dabigatran, l'argatroban, les xabans et les héparines
|
Substitution
Lorsque l’anticoagulation est assurée pas un agent de longue durée (AVK) et ne peut pas être interrompue, comme c’est le cas dans la FA à haut risque ou la prothèse valvulaire mécanique, il est d’usage de relayer le traitement par une héparine de courte demi-vie pour limiter à la durée de l’intervention chirurgicale le temps pendant lequel le malade est hors de l’effet anticoagulant. Le but est de trouver le meilleur compromis entre le risque hémorragique chirurgical et le risque thrombo-embolique de la maladie.
Bien qu’elle soit traditionnellement considérée comme une règle de l’art, la substitution par une héparine est fortement remise en question, particulièrement pour les nouveaux anticoagulants [4]. En effet, les études récentes démontrent qu’elle augmente 3 à 5 fois le risque hémorragique sans mettre à l’abri des complications thrombotiques (incidence inchangée). Une méta-analyse portant sur 7'118 patients sous AVK ayant été substitués par une héparine en préopératoire montre que le risque de saignement mineur et majeur est accru (HR 5.4 et 3.6, respectivement), alors que le risque thrombo-embolique est inchangé (HR 0.84) [34]. Un registre prospectif de 2'179 patients sous NACO (rivaroxaban, apixaban et dabigatran) trouve une incidence d’évènements thrombo-emboliques similaire chez les patients substitués (1.6%) et chez ceux qui ne le sont pas (0.8%), mais des pertes sanguines cinq fois plus importantes chez les premiers (2.7%) par rapport aux seconds (0.5%) (OR 5.0) [37]. Dans l’état actuel de nos connaissances, la substitution n’est donc formellement indiquée que chez les malades à très haut risque thrombotique (score CHADS élevé, prothèse valvulaire) qui sont sous AVK. Dans les autres situations, elle est n’offre probablement aucun bénéfice et relève d’une décision au cas par cas. Elle est particulièrement malheureuse dans les circonstances qui sont des prédicteurs de risque hémorragique : hypertension, dysfonction rénale ou hépatique, ictus, anamnèse de saignements, INR labile, âge > 65 ans, alcool ou substance contrecarrant la coagulation (score HAS-BLED ≥ 3) [27].
La prise en charge périopératoire des patients sous AVK est basée sur une stratification du risque thrombo-embolique en 3 catégories (Figure 8.15 et Tableau 8.8) [9,22].
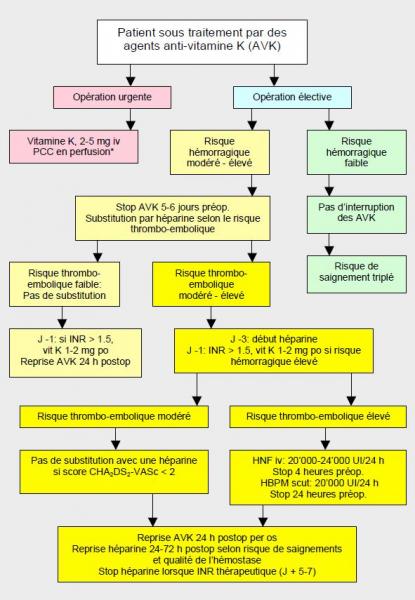
Figure 8.15: Algorithme de prise en charge des malades sous agents anti-vitamine K (AVK) en préopératoire de chirurgie non-cardiaque, basé sur le risque hémorragique chirurgical et sur le risque de la maladie thrombo-embolique (adapté d’après références 6,23). La substitution par une héparine n'est plus recommandée lorsque le risque thrombo-embolique est modéré (score CHA2DS2-VASc ≤ 2). PCC: prothrombin complex concentrate. *: selon pertes sanguines et non à titre prophylactique.

- Les opérations mineures ou non-hémorragiques (dentisterie, excision cutanée, cataracte, biopsie, endoscopie, pace-maker, etc) peuvent se dérouler sans interruption des AVK, bien que le taux de saignement soit 3 fois plus élevé. En périopératoire, l’INR visé est à la limite inférieure de la zone thérapeutique.
- Arrêt des AVK 5-6 jours avant les interventions à risque hémorragique intermédiaire ou majeur (Marcoumar® : arrêt 10 jours).
- Substitution avec une héparine 3 jours avant l’opération en fonction du risque thrombo-embolique.
- Cas à risque thrombo-embolique élevé : HNF 12-15 UI/kg/h en perfusion, sans bolus; arrêt 4-6 heures avant l’intervention. Alternative : HBPM à dose thérapeutique (250 UI/kg/24 h) en 2 doses quotidiennes sous-cutanées; arrêt 24 heures avant l’intervention ; si le risque hémorragique est élevé, la dernière administration (24 h préop) est une demi-dose.
- Cas à risque thrombo-embolique modéré : HBPM à dose thérapeutique (250 UI/kg/24 h) en 2 doses quotidiennes sous-cutanées; arrêt 24 heures avant l’intervention. Alternative dans les cas à risque hémorragique élevé: HBPM à dose prophylactique (10’000 UI/24h sous-cut); arrêt 12-24 heures avant l’intervention.
- Cas à risque thrombo-embolique faible : pas de substitution.
- Démarrage de la substitution dès que l’INR est ≤ 2.
- Interruption de l’HNF 4 heures et de l’HBPM 12-24 heures avant l’intervention.
- Risque embolique élevé (< 1 mois après une thrombose veineuse des membres inférieurs ou du petit bassin) et opération en urgence (substitution impossible): pose d’un filtre amovible sur la veine cave inférieure.
Les nouveaux anticoagulants oraux (dabigatran, rivaroxaban, apixaban) ont des demi-vies d’environ 12 heures nécessitant une interruption de 24-48 heures, voir 3-4 jours chez les personnes âgées et les insuffisants rénaux. Généralement, il n’y a pas lieu de mettre en route un relai avec une héparine pour ces substances, sauf dans les cas à très haut risque de thrombose mais ces derniers sont de préférence sous AVK [38]. La seule indication possible pour une substitution est la situation d'un très haut risque thrombotique (< 3 mois après embolie pulmonaire, par exemple) combiné à une longue interruption du NACO à cause d'une insuffisance rénale (3-5 jours); un relai par de l'héparine peut alors être justifié [10]. En cas de doute dans le cadre préopératoire, la meilleure attitude est de doser l’anticoagulant (effet anti-Xa pour le rivaroxaban, l'edoxaban et l’apixaban, Hemoclot™ pour le dabigatran). Si le taux est élevé, la substitution n’est pas nécessaire ; s’il est bas, l’attente est inutile et le malade est opérable sans délai.
| Substitution préopératoire des anticoagulants |
|
La substitution des AVK par une héparine est réservée aux cas à haut risque thrombo-embolique. Dans les autres situations, elle augmente 3 à 5 fois le risque de saignement sans diminuer le risque thrombo-embolique. Elle n’est pas conseillée dans les interventions à haut risque hémorragique ni chez les malades à bas risque thrombo-embolique. Elle n’est pas recommandée avec les nouveaux anticoagulants oraux (dabigatran, rivaroxaban, apixaban, edoxaban).
Dans les situations à risque thrombo-embolique élevé (thrombose veineuse profonde récente, FA CHADS2 > 4, prothèse mécanique mitrale), l’AVK est remplacé par une héparine de courte demi-vie. Le but n’est pas la normalisation de la coagulation, qui présenterait un danger majeur d’accident vasculaire, mais le meilleur compromis entre le risque hémorragique chirurgical et le risque thrombo-embolique de la maladie.
Substitution des AVK :
- Stop AVK 5 jours préop (Marcoumar 10 j)
- Substitution avec une héparine 3-5 jours avant l’opération
- Interruption de l’héparine 4-6 heures (HNF iv) à 24 heures (HBPM scut) préopératoires
|
© CHASSOT PG, DELABAYS A, SPAHN DR, Mars 2010, dernière révision Août 2019
Références
- ALBALADEJO P, BONHOMME F, BLAIS N, et al. Management of direct oral anticoagulants in patients undergoing elective surgeries and invasive procedures: update guidelines from the French Working Group on Perioperative Hemostasis. Anaesth Crit Care Pain Med 2017; 36:73-6
- ANSEL JE, BAKHRU SH, LAULICHT BE, et al. Use of PER977 to reverse the antocoagulant effet of edoxaban. N Engl J Med 2014; 371:2141-2
- ARBIT B, NISHIMURA M, HSU JC. Reversal agents for direct oral anticoagulants: a focused review. Int J Cardiol 2016; 223:244-50
- BARON TH, KAMATH PS, McBANE RD. Management of antithrombotic therapy in patients undergoing invasive procedures. N Engl J Med 2013; 368:2113-24
- CALKINS H, WILLEMS S, GERSTENFELD EP, et al. Uninterrupted Dabigatran versus Warfarin for ablation in atrial fibrillation. N Engl J Med 2017; 376:1627-36
- CHASSOT PG, BARELLI S, BLUM S, et al. Antiplatelet therapy and anticoagulation. In : MARCUCCI C, SCHOETKER P, editors. Perioperative haemostasis. Coagulation for anaesthesiologists. Heidelberg : Springer Verlag, 2015, 109-30
- CONOLLY SJ, MILLING TJ, EIKELBOOM JW, et al. Andexanet alfa for acute major bleeding associated with factor Xa inhibitors. N Engl J Med 2016; 375:1131-41
- DOHERTY JU, GLUCKMAN TJ, HUCKER WJ, et al. 2017 ACC Expert consensus decision pathway for periprocedural management of anticoagulation in patients with nonvalvular atrial fibrillation. J Am Coll Cardiol 2017; 69:871-98
- DOUKETIS JD, SPYROPOULOS AC, SPENCER FA, et al. Perioperative management of antithrombotic therapy : Antithrombotic therapy and prevention of thrombosis, 9th ed. American College of Chest Physicians Evidence-Based Clinical Practice Guidelines, Chest 2012 ; 141 (2 suppl) : e326S-50S
- DUBOIS V, DINCQ AS, DOUXFILS J, et al. Perioperative management of patients on direct oral anticoagulants. Thromb J 2017; 15:14
- FERRANDIS R, CASTILLO J, DE ANDRES J, et al. The perioperative management of new direct oral anticoagulants: a question without answer. Thromb Haemost 2013; 110:515-22
- FLEISHER LA, FLEISCHMANN KE, AUERBACH AD, et al. 2014 ACC/AHA Guideline on perioperative cardiovascular evaluation and management of patients undergoing noncardiac surgery: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. Circulation 2014; 130:e278-e333
- GODIER A, MARTIN AC, LEBLANC I, et al. Peri-procedural management of dabigatran and rivaroxaban: duration of anticoagulant discontinuation and drug concentrations. Thromb Res 2015; 136:763-8
- GOGARTEN W, VANDERMEULEN E, VAN AKEN H, et al. Regional anaesthesia and antithrombotic agents: recommendations of the European Society of Anaesthesiology. Eur J Anaesthesiol 2010; 27:999-1015
- GSLA/ AGLA. Groupe de Travail Lipide et Athérosclérose, Société Suisse de Cardiologie. 2017 Antithrombotiques. Aperçu pratique sur l'utilisation des antithrombotiques lors de maladies cardiovasculaires. www.gsla.ch
- HEALEY JS, EIKELBOOM J, DOUKETIS J, et al. Periprocedural bleeding and thromboemblic events with dabigatran compared with warfarin. Circulation 2012; 126: 343-8
- HEIDBUCHEL H, VERHAMME P, ALINGS M, et al. Updated European Heart Rythm Association Practical Guide on the use of non vitamin K oral anticoagulants in patients with non-valvular atrial fibrillation. Europace 2015; 17: 1467-507
- HICKEY M, GATIEN M, TALJAARD M, et al. Outcomes of urgent warfarin reversal with frozen plasma versus prothrombin complex concentrate in the emergency department. Circulation 2013; 128:360-4
- KAATZ S, KOUIDES PK, GARCIA DA ; et al. Guidance on the emergent reversal of oral thrombin and factor Xa inhibitors. Am J Hematol 2012 ; 87:S141-S145
- KASERER A, SCHEDLER A, JETTER A, et al. Risk factors for higher-than-expected residual rivaroxaban plasma concentrations in real-life patients. Thromb Haemost 2018; 118:808-17
- KOZEK-LANGENECKER SA, AHMED AB, AFSHARI A, et al. Management of severe perioperative bleeding : Guidelines from the European Society of Anaesthesiology. First update 2016. Eur J Anaesthesiol 2017 ; 34 : 332-95
- KRISTENSEN SD, KNUUTI J, SARASTE A, et al. 2014 ESC/ESA Guidelines on non-cardiac surgery: cardiovascular assessment and management. Eur Heart J 2014; 35:2383-431
- LEVY JH, AGENO W, CHAN NC, et al. When and how to use antidotes for the reversal of direct oral anticoagulants: guidance from the SSC of the ISTH. J Thromb Haemost 2016; 14:623-7
- MAR PL, FAMILTSEV D, EZEBOWITZ MD, et al. Periprocedural management of anticoagulation in patients taking novel oral anticoagulants: Review of the literature and recommendations for specific populations and procedures. Int J Cardiol 2016; 202:578-85
- MUECK W, LENSING AWA, AGNELLI G, et al. Rivaroxaban. Population pharmacokinetic analyses in patients treated for acute deep-vein thrombosis and exposure simulations in patients with atrial fibrillation treated for stroke prevention. Clin Pharmacokinet 2011; 50:675-86
- MUECK W, SCHWERS S, STAMPFUSS J. Rivaroxaban and other novel oral anticoagulants : pharmacokinetics in healthy subject, specific patient populations and relevance of coagulation monitoring. Thrombosis Journal 2013; 11:10
- OMRAN H, BAUERSACHS R, RÜBENACKER S, et al. The HAS-BLED score predicts bleeding during bridging of chronic oral anticoagulation: results from the national multicenter BNK Online bRiDging REgistRy (BORDER). Thromb Haemost 2012; 108:65-73
- PERNOD G, ALBALADEJO P, GODIER A, et al. Management of major bleeding complications and emergency surgery in patients on long-term treatment with direct oral anticoagulants, thrombin or factor Xa inhibitors : proposals of the Working Group on Perioperative Haemostasis (GIHP) – March 2013. Arch Cardiovasc Dis 2013 ; 106 :382-93
- POLLACK CV, REILLY PA, BERNSTEIN R, et al. Idarucisumab for dabigatrab reversal. N Engl J Med 2015; 373:511-20
- RAVAL AN, CIGARROA JE, CHUNG MK, et al. Management of patients on non-vitamin K antagonist oral anticoagulants in the acute care and periprocedural setting. Circulation 2017; 135:e604-e633
- RUFF CT, GIUGLIANO RP, BRAUNWALD E, et al. Comparison of the efficacy and safety of new oral anticoagulants with warfarin in patients with atrial fibrillation: a meta-analysis of randomized trials. Lancet 2014; 383:955-62
- RUFF CT, GIUGLIANO RP, ANTMAN EM. Management of bleeding with non-vitamin K antagonist oral anticoagulants in the era of specific reversal agents. Circulation 2016; 134:248-61
- SAMAMA MM, CONTANT G, SPIRO TE, et al. Laboratory assessment of rivaroxaban : a review. Thrombosis Journal 2013; 11:11
- SIEGAL D, YUDIN J, KAATZ S, et al. Periprocedural heparin bridging in patients receiving vitamin K antagonists : systematic review and meta-analysis of bleeding and thromboembolic rates. Circulation 2012 ; 126 :1630-9
- SPAHN DR, BEER JH, BORGEAT A, CHASSOT PG, et al. New oral anticoagulants in anesthesiology. Transf Med Hemother 2019; 46:282-93
- TURPIE AG, KREUTZ R, LLAU J, et al. Management consensus guidance for the use of rivaroxaban - an oral, direct factor Xa inhibitor. Thromb Haemost 2012; 108:876-86
- WESTENDORF JB, GELBRICHT V, FORSTER K, et al. Peri-interventional management of novel oral anticoagulants in daily care : results from prospective Dresden NOAC registry. Eur Heart J 2014 ; 35:1888-96
- WYSOKINSKI WE, McBANE RD. Periprocedural bridging management of anticoagulation. Circulation 2012 ; 126 :486-90
