Le système α-adrénergique est présent essentiellement dans la musculature lisse des vaisseaux, où il induit une vasoconstriction, et ne présente qu’un rôle mineur dans la contraction myocardique (Figure 5.5) ; il représente moins de 10% de tous les récepteurs adrénergiques du coeur. Toutefois, son effet inotrope positif devient significatif en cas d’insuffisance ventriculaire, lorsque le taux de récepteurs α est diminué [3]. Le récepteur α est lié à une protéine G particulière (Gq) qui active la phospholipase C (PL-C), laquelle active un 2ème messager spécifique, l’inositol-triphosphate (IP3) conduisant à l’activation de la PK-C (voir Tableau 5.1). Cette voie est donc indépendante de celle des récepteurs β ; elle reste fonctionnelle lorsque les récepteurs β sont désensibilisés (β-blocage, insuffisance ventriculaire chronique) [8]. La phospholipase C est également activée par l’angiotensine II et l’endothéline qui ont un effet vascoconstricteur sur les vaisseaux périphériques, et un effet stimulant sur la synthèse protéique et l’hypertrophie des cellules myocardiques [2]. La surexpression de la protéine Gq est typiquement présente dans la cardiomyopathie dilatative [6].
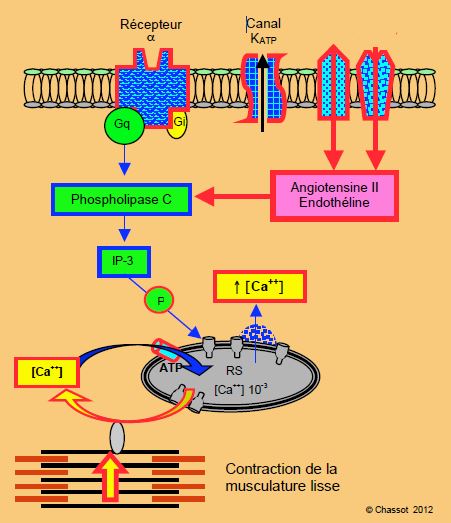
Figure 5.5 : Schématisation de la stimulation α. Par l’intermédiaire de la protéine Gq, le récepteur α active la phsopholipase C et le 2ème messager IP-3 (inositol-triphosphate) ; il s’ensuit une libération du Ca2+ à partir du réticulum sarcoplasmique (RS), sans activation des canaux L. L’augmentation de la [Ca2+]i provoque la contraction de la musculature lisse. La phospholipase C peut être activée par d’autres récepteurs membranaires, tels ceux de l’angiotensine II et de l’endothéline. Dans le cœur, les récepteurs α ont un effet inotrope positif ; ils représentent le 10% des récepteurs catécholaminergiques du ventricule ; cette proportion augmente en cas de régulation à la baisse des récpteurs β (insuffisance ventriculaire).
Le système cholinergique comprend un récepteur muscarinique (M2) sensible à l’acétylcholine circulante (Figure 5.6). La stimulation de ce système, qui passe par la protéine G inhibitrice (Gi), a pour effet d'augmenter la synthèse de NO•, de freiner la libération de cAMP et de stimuler celle de cGMP. Ce dernier a un effet inotrope négatif et vasodilatateur car il abaisse la [Ca2+]i [7]. Dans le nœud du sinus, il inhibe la dépolarisation spontanée et provoque une bradycardie.
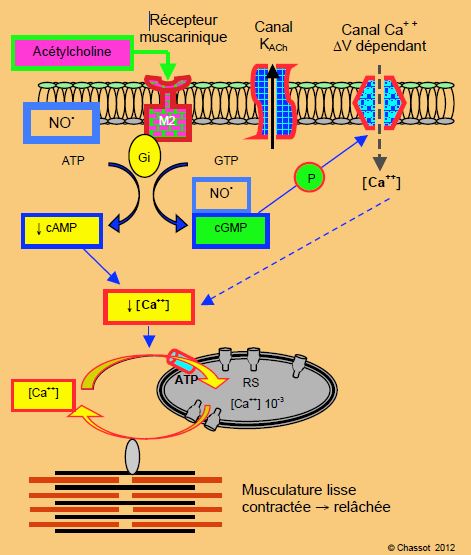
Figure 5.6 : Schématisation de la stimulation cholinergique. L’acétylcholine se fixe sur le récepteur M2, couplé à une protéine G inhibitrice (Gi) ; il s’ensuit une sécrétion de NO• et de GMPc et une baisse de AMPc. Le résultat est une diminution de la [Ca2+]i. Le résultat est un effet inotrope négatif dans le ventricule, une bradycardie au niveau du noeud sinusal (inhibition de la dépolarisation spontanée par l’ouverture du canal KG) et une vasodilatation dans les vaisseaux.
Le NO• est libéré par l’endothélium vasculaire lorsque le flux sanguin est augmenté ou la charge cardiaque accrue. Il facilite la transmission cholinergique à la terminaison nerveuse et dans la cellule par la production de cGMP qui est le principal transmetteur parasympathique ; il inhibe le trafic de Ca++ intracellulaire. L’exercice et l’entraînement augmentent la production de NO• [4] ; il est possible que de petites "bouffées" de NO• soient libérées pendant la diastole pour la prolonger et améliorer le remplissage ventriculaire [5]. La sécrétion permanente de NO• par l’endothélium est un élément essentiel dans le maintien actif de la vasodilatation physiologique des vaisseaux pulmonaires.
Il existe donc de multiples réseaux de signalisation intracellulaire dont le but est de régler finement les variations de la concentration en Ca++ ionisé. Ils permettent d’amplifier les signaux faibles et de limiter les signaux excessifs, ce qui assure à la cellule un fonctionnement stable malgré les oscillations du milieu. Leur redondance garantit une grande sécurité de fonctionnement. Contrôler cet équilibre des stimulations sympathique et parasympathique pendant le stress chirurgical est une des tâches majeures de l’anesthésiste. En effet, le degré d’activité du système sympathique est un des prédicteurs majeurs de mortalité [1].
| Stimulations α-adrénergique et cholinergique |
|
Les récepteurs α provoquent une augmentation de la [Ca2+]i et une contraction de la musculature lisse des vaisseaux. Dans le cœur, ils ont un effet inotrope positif indépendant de la voie des récepteurs β.
La stimulation cholinergique (acétylcholine, NO•) libère le GMPc et diminue la [Ca2+]i; elle conduit à une relaxation de la musculature lisse et à un effet inotrope négatif.
Le NO• est sécrété par l'endothélium vasculaire proportionnellement à la tension de paroi, à la pulsatilité et aux forces de cisaillement. Il provoque une vasodilatation.
|
© CHASSOT PG Août 2010, dernière mise à jour Novembre 2018
Références
- ESLER M, LAMBERT G, BRUNNER-LA ROCCA HP, et al. Sympathetic nerve activity and neurotransmitter release in humans: translation from pathophysiology into clinical practice. Acta Physiol Scand 2003; 177:275-84
- GRAHAM RM, PEREZ DM, HWA J, et al. -adrenergic receptor subtypes. Molecular structure, function and signaling. Circ Res 1996; 78:737-49
- HWANG KC, GRAY CD, SWEET WE, et al. 1-adrenergic receptor coupling with Gh in the failing human heart. Circulation 1996; 94:718-26
- PATTERSON DJ. Nitric oxide and the autonomic regulation of cardiac excitability. Exp Physiol 2001; 86:1-9
- PINSKY DJ, PATTON S, MESAROS S, et al. Mechanical transduction of nitric oxide synthesis in the beating heart. Circ Res 1997; 81:372-6
- ROTH DM, GAO MH, LAI C, et al. Cardiac-detected adenyl cyclase expression improves heart function in murine cardiomyopathy. Circulation 1999; 99: 3099-104
- SEARS CE, et al. Cardiac neuronal nitric oxide synthase isoform regulates myocardial contraction and calcium handling. Circ Res 2003; 92:e57-e59
- VAGO T, BEVILACQUA M, NORBIATOR G. Identification of an adrenergic receptors on sarcolemma from normal subjects and patients with idiopathic dilated cardiomyopathy. Circ Res 1989; 64:474-81
