Le rationnel de l'anesthésie loco-régionale (ALR) ou de l'anesthésie combinée est triple:
- Diminuer la réponse neuro-endocrine sympathique au stress;
- Diminuer l'hypercoagulabilité périopératoire;
- Diminuer le stress postopératoire (tachycardie, hypertension, douleur, hypoventilation).
D'une manière générale, les marqueurs de la réaction de stress sont abaissés chez les malades qui ont une péridurale thoracique: noradrénaline, adrénaline, cortisol, taux de lactate sont diminuées dans le sinus coronaire [7]. La fibrinolyse est accrue, moins de fibrine est formée [17]. Selon le niveau, les effets de l'anesthésie rachidienne ne sont pas identiques. Il faut distinguer la péridurale thoracique haute (C7-D4), la péridurale médio-thoracique (D5-D10), et la péridurale lombaire. Le niveau recommandé pour la chirurgie de l'aorte abdominale est D8-D11.
L'analgésie thoracique haute (C7-D4) vasodilate le réseau coronarien et diminue l'angor, induit une bradycardie, améliore la fonction systolique et diastolique chez les coronariens [3,19,20]. Toutefois, la sympathectomie cardiaque peut diminuer la contractilité myocardique lorsque celle-ci est dépendante de la stimulation sympathique centrale [8]. Le bloc sympathique thoracique provoque une vasodilatation systémique et une hypotension. Chez les patients éveillés, ces effets sont compensés par une réaction sympathique réflexe dans les territoires non bloqués, pouvant d'ailleurs entraîner secondairement une augmentation de la postcharge. Sous anesthésie générale, par contre, on peut assister à une hypotension liée à une absence de réflexe vasoconstricteur dans les zones non bloquées et à une cardiodépression supplémentaire par les agents d'anesthésie [1].
Dans une péridurale lombaire ou thoracique basse (< D6), l'hypotension n'est pas accompagnée d'une baisse de consommation d'O2 myocardique par sympathectomie cardiaque; elle peut même être aggravée par la stimulation sympathique des segments supérieurs non bloqués par l'ALR [21]. Le flux coronarien en aval d'une sténose peut alors diminuer à cause de l'hypotension, quand bien même la demande en O2 augmente, aggravant ainsi la situation [11]. Avec une péridurale thoracique haute, au contraire, la diminution du flux coronarien est accompagnée d'une diminution de la demande en O2; l'équilibre du rapport DO2/VO2 est maintenu. Le même degré d'hypotension dans une ALR thoracique ne cause pas d'altération ischémique de la cinétique segmentaire à l'échocardiographie alors qu'il le fait dans une ALR lombaire (Figure 18.46) [18].
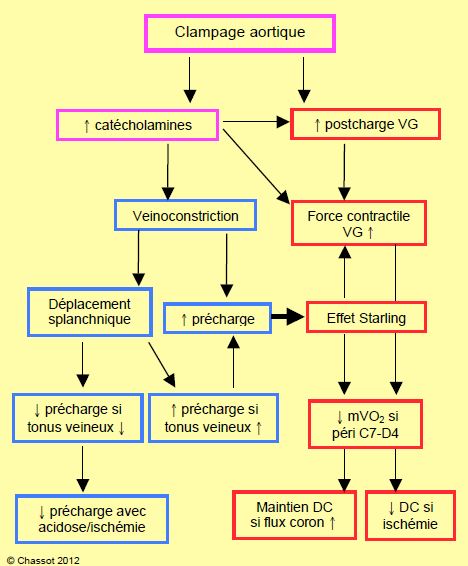
Figure 18.46 : Effets hémodynamiques du clampage aortique. L'utilisation d'une péridurale en peropératoire diminue la sécrétion de catécholamines et la veinoconstriction (cadres bleus), donc la précharge; d'où augmentation des besoins liquidiens. Du côté artériel (cadres rouges), la baisse des catécholamines endogènes diminue certes la postcharge du VG, mais aussi sa contractilité. Ceci s'acompagne d'une baisse de la mVO2 en cas de bloc C7-D5, mais non en cas de bloc inférieur à D6; il y alors un risque d'ischémie myocardique.
Les études comparatives randomisées de l'anesthésie combinée et de l'anesthésie générale seule dans le cadre de la chirurgie aortique abdominale donnent des résultats conflictuels ou des avantages peu significatifs pour la péridurale [1,2,16,23,24]. Hormis une extubation précoce, l'anesthésie combinée ne crée aucune différence dans la mortalité, la morbidité ou le devenir des patients [12,13,15]. Toutefois, dans le sous-groupe des cas à haut risque cardiaque chez qui l'intervention est longue et difficile, la péridurale continue peut diminuer l'incidence de complications pulmonaires (14% versus 28%), cardiaques (10% versus 18%) et cérébrales (0.5% versus 5%) [2,13]. Il ressort également de certaines études que le taux de complications pulmonaires, de thromboses veineuses et de reprises chirurgicales pour obstruction de pontages est diminué dans les groupes qui bénéficient d'une ALR [6,22]. Mais si la morbidité cardiaque est abaissée dans plusieurs publications, cela paraît davantage en relation avec la qualité de l'analgésie postopératoire, qui est indéniable, qu'avec la sympathectomie peropératoire [1,4,13].
La situation est plus défavorable à l'anesthésie générale dans le cadre des endoprothèses. Bien qu'il n'y ait aucune étude propective randomisée comparant l'anesthésie générale (AG), l'anesthésie loco-régionale (ALR) et l'anesthésie locale (AL), il ressort de la littérature que la morbi-mortalité périopératoire tend à être plus basse sous AL/ALR que sous AG, bien que de multiples facteurs peuvent biaiser ces comparaisons [10]. Toutefois, le peu de douleur postopératoire après intervention endovasculaire ne justifie pas la mise en place d'une péridurale.
Le clampage aortique occasionne de nombreux déséquilibres hémodynamiques (Figure 18.46). Le blocage sympathique de la péridurale diminue la poussée hypertensive en amont du clamp, mais baisse la pression résiduelle en aval et augmente considérablement les besoins liquidiens peropératoires pour compenser le stockage dans le réseau veineux. Le degré de veinodilatation dépend de l'étendue du bloc et de l'incorporation ou non du réseau splanchnique dans la zone vasodilatée. En effet, cette dernière fonctionne comme un réservoir qui stocke le sang si elle fait partie des territoires bloqués; si elle en est en-dehors, elle bénéficie de la vasoconstriction réflexe des territoires non bloqués et relargue le volume dans la circulation. L'utilisation d'anesthésiques locaux en péridurale pendant l'opération augmente considérablement les besoins liquidiens, ce qui tend à prolonger l’iléus postopératoire à cause de l’œdème tissulaire diffus. En outre, il est fréquemment nécessaire de mettre en route une perfusion de dopamine et/ou de noradrénaline pour contrebalancer les effets de la sympathectomie, et de donner un diurétique pour rétablir l'équilibre liquidien [14]. Avec une péridurale fonctionnelle, l'hypotension est accentuée au déclampage.
Le bénéfice de la péridurale pour l’antalgie postopératoire est incontestable, mais son bilan en peropératoire est mitigé. L'utilisation optimale de la péridurale consiste à monter le bloc dès la fermeture du péritoine postérieur, de manière à bénéficier de l'analgésie maximale au moment du réveil du patient sans en avoir les inconvénients hémodynamiques en cours d’intervention. Seuls les cas à haut risque d'ischémie myocardique bénéficient de l'utilisation peropératoire continue du bloc, parce qu’il diminue la nocivité de la stimulation sympathique [13]. Même si on ne l'utilise que pour le postopératoire, la péridurale doit être mise en place avant l'intervention, de manière à pouvoir faire un status neurologique immédiat et à maintenir un délai d'au moins une heure entre la pose du cathéter et l'administration d'héparine.
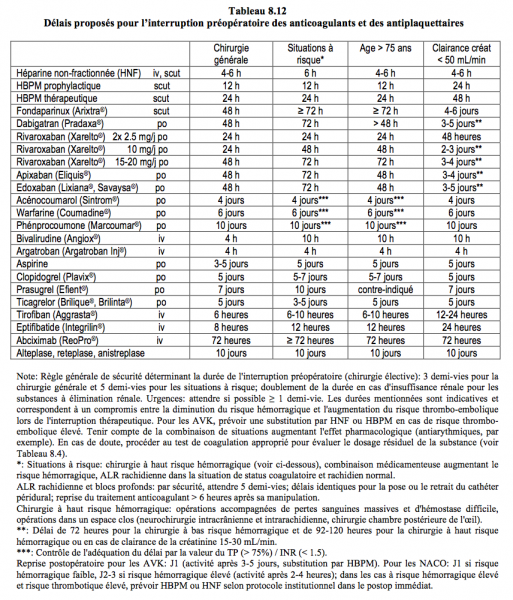
De nombreux malades vasculaires sont sous antiplaquettaires. L’arrêt préopératoire de la bithérapie (aspirine + clopidogrel, prasugrel ou ticagrelor) pendant 5-7 jours est obligatoire pour réaliser une ALR rachidienne, qui n’est possible que chez les patients sous aspirine seule (< 300 mg/j) (Tableau 8.12) [9]. L’interruption des antiplaquettaires fait courir un risque majeur d’infarctus, de thrombose de stent et de mortalité en périopératoire (taux d’infarctus 20-60%, mortalité moyenne 35%). Or la protection offerte par l’ALR rachidienne est très modeste dans ce contexte: la péridurale thoracique haute ne diminue la morbidité cardiaque que de 40%, et l’ALR réalisée en dessous de D6 n’a pas d’effets significatifs sur le risque cardiovasculaire. Dans les deux cas, la mortalité n’est pas modifiée. Il est donc évident que le risque encouru à l’arrêt des antiplaquettaires est largement supérieur au bénéfice escompté de l’ALR. L’interruption des antiplaquettaires au seul titre de pouvoir pratiquer une péridurale est injustifiée, même si le confort du patient et l’analgésie postopératoire sont de moindre qualité [5].
| Anesthésie combinée (AG + péridurale) |
|
Absence de contre-indication (coagulopathie, antiplaquettaires); mise en place avant l’induction.
Délai entre ponction en héparinisation: > 1 heure.
Ponction péridurale D8-D11. L’anesthésie de ce niveau ne s’accompagne pas d’une sympathicolyse cardiaque ni d’une vasodilatation en amont du clamp.
Avantage: confort postopératoire, extubation précoce, diminution des complications ventilatoires.
Désavantage: augmente les besoins liquidiens et l’instabilité hémodynamique au clampage aortique.
Utilisation optimale: monter le bloc dès la fermeture du péritoine postérieur (analgésie maximale au moment du réveil sans les effets hémodynamiques au clampage).
La bithérapie antiplaquettaire (aspirine + clopidogrel, prasugrel ou ticagrelor) est une contre-indication formelle à la péridurale, car les risques cardiovasculaires à l’arrêt de ces médicaments sont largement supérieurs au bénéfice escompté de l’ALR.
|
© CHASSOT PG, TOZZI P, BETTEX D, Octobre 2010, Dernière mise à jour, Avril 2018
Références
- BARON JF, BERTRAND M, BAVRE E, et al. Combined epidural and general anesthesia versus general anesthesia for abdominal aortic surgery. Anesthesiology 1991; 75:611-8
- BEATTIE WS, BADNER NH, CHOI P. Epidural analgesia reduces postoperative myocardial infarction: a meta-analysis. Anesth Analg 2001; 93:853-8
- BLOMBERG SG. Long-term home self-treatment with high thoracic epidural anesthesia in patients with severe coronary artery disease. Anesth Analg 1994; 79:413-21
- BODE RH, LEWIS KP, ZARICH SW, et al. Cardiac outcome after peripheral vascular surgery: comparison of regional and general anesthesia. Anesthesiology 1996; 84:3-13
- CHASSOT PG, DELABAYS A, SPAHN DR. Perioperative antiplatelet therapy: the case for continuing therapy in patients at risk of myocardial infarction. Br J Anaesth 2007; 99:316-28
- CHRISTOPHERSON R, BEATTIE C, FRANK SM, et al. Perioperative morbidity in patients randomized to epidural or general anesthesia for lower extremity vascular surgery. Anesthesiology 1993; 79:422-34
- FAWCETT WJ, EDWARDS RE, QUINN AC, et al. Thoracic epidural analgesia started after cardiopulmonary bypass: adrenergic, cardiovascular and respiratory sequelae. Anaesthesia 1997; 52:294-9
- GOERTZ AW, SEELIG W, HEINRICH H, et al. Influence of high thoracic epidural anesthesia on left ventricular contractility assessed using the end-systolic pressure-length relationship. Acta Anaesthesiol Scand 1993; 37:38-44
- GOGARTEN W, VANDERMEULEN E, VAN AKEN H, et al. Regional anaesthesia and antithrombotic agents: recommendations of the European Society of Anaesthesiology. Eur J Anaesthesiol 2010; 27:999-1015
- KARTHIKESALINGAM A, THRUMURTHY SG, YOUNG EL, et al. Locoregional anesthesia for endovascular aneurysm repair. J Vasc Surg 2012; 56:510-9
- MERGNER GW, STOLTE AL, FRAME WB, LIM HJ. Combined epidural analgesia and general anesthesia induce ischemia distal to a severe coronary artery stenosis in swine. Anesth Analg 1994; 78:37-45
- NORRIS EJ, BEATTIE C, PERLER BA, et al. Double-masked randomized trial comparing alternate combinations of intraoperative anesthesia and postoperative analgesia in abdominal aortic surgery. Anesthesiology 2001; 95:1054-67
- PARK WY, THOMPSON JS, LEE KK. Effect of epidural anesthesia and analgesia on perioperative outcome: A randomized, controlled Veteran Affairs cooperative study. Ann Surg 2001; 234:560-9
- RANER C, BIBER B, LUNDBERG J, et al. Cardiovascular depression by isoflurane and concomitant thoracic epidural anesthesia is reversed by dopamine. Acta Anaesthesiol Scand 1994; 38:136-43
- RIGG JR, JAMROZIK K, MYLES PS, et al. Design of the multicenter Australian study of epidural anesthesia and analgesia in major surgery.: the MASTER trial. Control Clin Trials 2000; 21:244-56
- RIGG JRA, JAMROZIK K, MYLES PS, et al. Epidural anaesthesia and analgesia and outcome of major surgery: a randomised trial. Lancet 2002; 259:1276-82
- ROSENFELD BA, BEATTIE C, CHRISTOPHERSON R, et al.the effects of different anesthetic regimens on fibrinolysis and the development of postoperative arterial thrombosis. Anesthesiology 1993; 79:435-43
- SAADA M, CATOIRE P, BONNET F, et al. Effect of thoracic epidural anesthesia combined with general anesthesia on segmental wall motion assessed by transesophageal echocardiography. Anesth Analg 1992; 75:329-35
- SCHMIDT C, HINDER F, VAN AKEN H, et al. The effect of high thoracic epidural anesthesia on systolic and diastolic left ventricular function in patients with coronary artery diasease. Anesth Analg 2005; 100:1561-9
- SCHMIDT C, ROOSENS C, STRUYS M, et al. Contractility in humans after coronary artery surgery. Echocardiographic assessment with preload-adjusted maximal power. Anesthesiology 1999; 91:58-70
- TANIGUCHI M, KASABA T, TAKASAKI M. Epidural anesthesia enhances sympathetic nerve activity in the unanesthetized segments in cats. Anesth Analg 1997; 84:391-7
- TUMAN KJ. Periopoerative cardiovascular risk: assessment and management. Anesth Analg 2001; 92:S106-12
- WIJEYSUNDERA DN, BEATTIE WS, AUSTIN PC, et al. Epidural anaesthesia and survival after intermediate-to-high risk non-cardiac surgery: A population-based cohort study. Lancet 2008; 372:562-9
- YEAGER MP, GLASS DD, NEFF RK, et al. Epidural anesthesia and analgesia in high risk surgical patients. Anesthesiology 1987; 66:729-36
