L’échocardiographie transoesophagienne (ETO) occupe une place privilégiée dans la chirurgie valvulaire, car elle y a un impact très important [1,7,8].
- Elle oriente l’anesthésiste et l’opérateur sur la meilleure technique pour assurer l’équilibre hémodynamique et optimaliser l’intervention chirurgicale. En chirurgie valvulaire, le taux de modification du plan thérapeutique décidée sur la foi de l’ETO peropératoire est de 11-14%, alors qu'elle est en moyenne de 7% dans l'ensemble de la chirurgie cardiaque [2,4,7,9]. De plus, dans 6-8% des cas, l’ETO met en évidence une lésion cardiaque non suspectée à l’évaluation préopératoire et justifiant une correction supplémentaire non planifiée [5,13].
- Avant la CEC, elle permet d’apprécier l’anatomie fonctionnelle du coeur, c’est-à-dire la manière dont les structures se sont adaptées à la valvulopathie et le degré de décompensation encouru par le myocarde (voir Figure 11.14). En cas de polyvalvulopathie, cet examen permet de juger des lésions prédominantes, et contribue à définir quelle est la pathologie primaire et quelles sont les lésions secondaires ou fonctionnelles.
- Après la CEC, elle permet un contrôle immédiat de la qualité de la reconstruction valvulaire et du fonctionnement des prothèses ; elle met en évidence d’éventuels défauts résiduels. Elle justifie retour en CEC pour corriger une anomalie (fuite paravalvulaire, plastie inadéquate) dans 2-6% des cas [2,4,5,7]; cette reprise dans le même temps opératoire évite une réopération ultérieure dont la mortalité serait plus élevée.
- Pour l’anesthésiste, l’ETO offre un monitorage inégalé de la volémie dans des situations où les pressions de remplissage sont de mauvais repères à cause de la dysfonction diastolique et de la valvulopathie. Elle permet une analyse très pointue de la fonction ventriculaire malgré le remodelage des cavités et malgré les variations de charge et de performance systolique en cours d’interventions. Elle permet de diagnostiquer des effets hémodynamiques comme une sténose dynamique de la chambre de chasse du VG, qui sont indiscernables par une autre méthode.
- L’ETO fait intégralement partie de certaines interventions parce que cette imagerie est nécessaire au placement de canules ou de prothèses particulières et à la visualisation instantanée de l'acte chirurgical (implantation de prothèses stentless ou de prothèses endovasculaires, chirurgie minimalement invasive, plasties percutanées, etc).
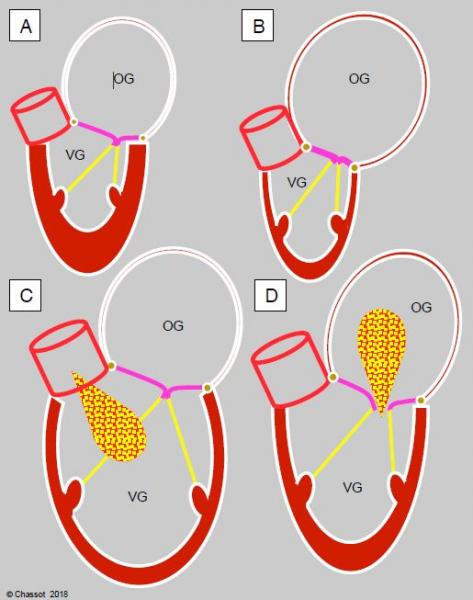
Figure 11.14 : Lors de valvulopathie, la silhouette des chambres cardiaques indique le remodelage des cavités gauches en fonction des contraintes hémodynamiques et permet de déterminer quelle est la pathologie dominante. A : sténose aortique ; HVG concentrique et dilatation de l’OG. B : sténose mitrale ; petit VG et gigantesque OG. C : insuffisance aortique ; dilatation massive du VG, dilatation modérée de l’OG. D : insuffisance mitrale ; dilatation du VG et de l’OG.
L'ETO peropératoire est une recommandation formelle lors de plasties valvulaires, lors de mise en place de prothèse sans monture ou d'homogreffe, et en cas d'endocardite; elle est souhaitable, mais pas indispensable, pour la mise en place de prothèse mécanique ou de bioprothèse montée [10,15].
L’examen doit toujours être complet: morphologie et fonction des deux ventricules, anatomie des valves, flux couleur et Doppler spectral, calcul des gradients et des surfaces d'ouverture. Toute divergence entre les différents éléments doit trouver une explication. Les mesures de flux étant dynamiques, elles sont tributaires de l'état circulatoire du patient, qui est notablement modifié par l’anesthésie. Les insuffisances, par exemple, diminuent de 1 à 2 degrés sur une échelle de quatre du simple fait de l’anesthésie générale [6]. Toute quantification d’une régurgitation doit se faire après avoir rétabli une hémodynamique normale, au besoin par un vasopresseur artériel. Lorsque le malade est arythmique, les mesures doivent être effectuées sur des cycles cardiaques dont la durée de la diastole correspond à une fréquence d’environ 70 battements/minute; elles doivent être répétées et moyennées sur 3-5 mesures.
Après une plastie valvulaire, l’ETO est essentielle pour juger de la reconstruction: étanchéité, prolapsus résiduel, restriction au flux antérograde, obstruction dynamique de la CCVG, etc. Une fuite résiduelle doit être testée dans des conditions hémodynamiques sévères (PAM 90-100 mmHg). Le contrôle immédiat d’une plastie mitrale a une excellente valeur prédictive à moyen terme, car il n’y a pas de changement évolutif significatif dans l’importance de la régurgitation entre la valeur trouvée en fin de CEC et celle diagnostiquée au sixième mois postopératoire [3,12]. Après la mise en place d’une prothèse valvulaire, l'ETO devra répondre à plusieurs questions:
- Les fuites sont-elles quantitativement normales ?
- Existe-t-il une fuite paravalvulaire ?
- L'ouverture est-elle libre et la fermeture présente-t-elle une coaptation normale ?
- Les flux et les gradients sont-ils dans les normes pour le type de prothèse ?
- Quel est l'effet du remplacement d'une valve sur le fonctionnement des autres ? Faut-il intervenir sur d'autres valves ?
- Existe-t-il une obstruction dynamique de la chambre de chasse ?
- La fonction ventriculaire est-elle adéquate ?
- Est-il apparu des altérations de la cinétique segmentaire ?
Les corrections mitrales et aortiques impliquent l'ouverture des cavités gauches, cavités dans lesquelles l'air s'infiltre aisèment. Au cours de la mise en charge, il est expulsé avec le flux sanguin et donne lieu à des embolies artérielles, principalement dans les coronaires et dans la circulation cérébrale. Comme leur échogénicité est très élevée, les bulles d'air sont très bien visibles à l'échocardiographie (Figure 11.29). Ce sont de petites taches brillantes et oblongues, dont le long axe est perpendiculaire à celui des ultrasons. Elles dansent dans le flux et s'accumulent dans les régions supérieures des cavités, où elles forment des zones extrêmement échogènes accompagnées d'un important cône d'ombre (Vidéo).
Vidéo: Accumulation de microbulles dans le VG et l'OG en fin de CEC, avant la mise en charge.
Les ultrasons sont très performants dans la détection de l'air, puisqu'ils voient des bulles de l'ordre de 20 à 50 μm de diamètre. Malheureusement, ils ne permettent pas une quantification précise, mais seulement une évaluation grossière de la quantité d'air en circulation. Ce phénomène est fréquent après chirurgie valvulaire, puisque de l'air est visible à l'ETO dans 73 - 100% des cas [14]. Les endroits préférentiels d'accumulation sont [11]:
Vidéo: Accumulation de microbulles dans le VG et l'OG en fin de CEC, avant la mise en charge.
Les ultrasons sont très performants dans la détection de l'air, puisqu'ils voient des bulles de l'ordre de 20 à 50 μm de diamètre. Malheureusement, ils ne permettent pas une quantification précise, mais seulement une évaluation grossière de la quantité d'air en circulation. Ce phénomène est fréquent après chirurgie valvulaire, puisque de l'air est visible à l'ETO dans 73 - 100% des cas [14]. Les endroits préférentiels d'accumulation sont [11]:
- Les veines pulmonaires supérieures droite et gauche;
- La partie haute du septum interauriculaire sur son versant gauche;
- L'angle mitro-aortique;
- Le septum apical du ventriculaire gauche (en position de Trendelenburg);
- Le sinus de Valsalva droit de l'aorte;
- Pour évaluer l'importance de l'embolisation systémique, on peut observer les bulles dans l'aorte descendante et pivotant la sonde d'ETO vers l'arrière.
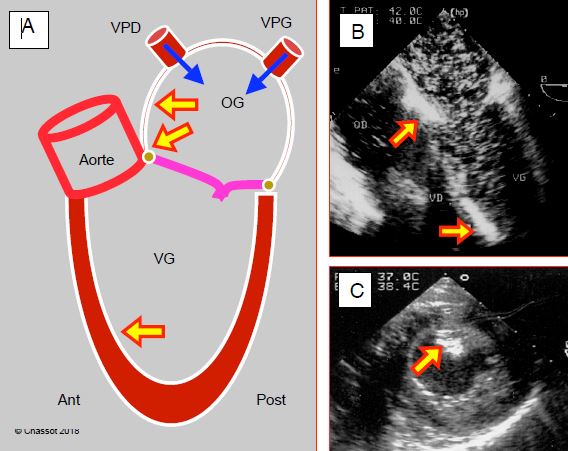
Figure 11.29 : Accumulation d’air dans le cœur gauche en fin de CEC. A : l’air provient de la cardiotomie gauche et des veines pulmonaires droite (VPD) et gauches (VPG) ; il a tendance à s’accumuler aux endroits surélevés : angle entre le septum interauriculaire et le toit de l’OG, angle mitro-aortique, septum interventriculaire antéro-apical (en position de Trendelenburg). B : vue 4 cavités avec d’innonbrables bulles dans l’OG et le VG, ainsi que deux zones d’accumulation contre le septum interauriculaire et dans les trabéculations du septum interventriculaire antéro-apical. C : embolisation d’air dans le muscle papillaire postérieur (territoire de la coronaire droite).
Un certain nombre de manoeuvres permettent de vidanger les poches d'air et d'empècher leur embolisation dans des vaisseaux critiques.
- Maintien d'une aspiration continue par la canule de cardioplégie en place dans la racine de l'aorte ascendante;
- Secousses et manipulations du coeur;
- Roulis de la table d'opération;
- Position de Trendelendburg;
- Hyperinflation et compression pulmonaire;
- Stimulation inotrope;
- Vidange auriculaire par ponction directe à l'aiguille et aspiration;
- Vidange ventriculaire par ponction apicale ou transseptale.
Souvent, les dernières bulles se délogent lors des changements de position du patient, comme au moment de sa mise au lit. Elles peuvent être la source de perturbations hémodynamiques abruptes souvent mal interprétée; il s'agit le plus souvent d'une ischémie dans le territoire de la CD ou des pontages aorto-coronariens veineux, voir d'un choc cardiogène.
Quelle qu'en soit la quantité, l'air doit être éliminé dans toute la mesure du possible, car il peut être responsable d'une morbidité importante lorsqu'il embolise par voie systémique. Le premier site d'embolisation est la coronaire droite, qui émerge de l'aorte sur sa face antérieure droite. C'est pour cette raison anatomique qu'une ischémie inféro-postérieure est souvent diagnostiquée à l'ECG peu après la sortie de pompe (sus-décalage ST en DII). L'air s'introduit très facilement dans les pontages aorto-coronariens veineux, car ils sont implantés à la face antérieure de l'aorte ascendante. La plupart du temps, cette embolisation se résout spontanément en augmentant la pression de perfusion, mais elle peut conduire à un infarctus postérieur. Le troisième site d'embolisation est la carotide droite, qui se trouve dans l'axe de l'aorte ascendante. Toutefois, il n'existe pas de données dans la littérature actuelle qui établissent une corrélation directe entre la présence ou la quantité d'air dans le coeur gauche et les déficits neurologiques postopératoires.
En cours de remplacement valvulaire aortique (RVA), des débris de valve ou d'athérome aortique peuvent aisément se fourvoyer dans les ostia coronariens, occasionnant une image d’ischémie tronculaire avec surélévation du segment ST à la sortie de CEC. Après chirurgie mitrale, on peut rencontrer une akinésie latérale étendue sur lésion de l'artère circonflexe occasionnée par des points de fixation implantés trop au large de l'anneau dans sa partie latérale.
| Place de l'ETO en peropératoire |
|
Intérêt de l'ETO dans la chirurgie valvulaire:
- Evaluation de la volémie et de la fonction ventriculaire indépendante de la compliance et du remodelage
- Modification de la stratégie chirurgicale sur la base de l'ETO pré-CEC dans 6-8% des cas
- Contrôle immédiat de la reconstruction valvulaire ou du fonctionnement de la prothèse (retour en CEC dans 2-6% des cas)
- Visualisation de l'acte chirurgical en temps réel dans les implantations valvulaires ou les plasties percutanées
- Débullage des cavités gauches
- Mise en évidence immédiate de complications liées à la chirurgie
- Diagnostic d'une obstruction dynamique de la chambre de chasse
|
© CHASSOT PG, BETTEX D, Août 2011, dernière mise à jour Août 2018
Références
- CHALIKI HP, CLICK RL, ABEL MD. Comparison of intraoperative transesophageal echocardiographic examination with the operative findings: prospective review of 1918 cases. J Am Soc Echocardiogr 1999; 12:237-40
- CLICK RL, ABEL MD, SCHAFF HV. Intraoperative transesophageal echocardiography: 5-year prospective review of impact on surgical management. Mayo Clin Proc 2000; 75:241-7
- CZER LSC, MAURER G. Intraoperative echocardiography in mitral and tricuspid valve repair. Echocardiography 1990; 7:305-12
- DESJARDINS G, CAHALAN M. The impoact of routine trans-oesophageal echocardiography (TOE) in cardiac surgery. Best Pract Res Clin Anaesthesiol 2009; 23:263-71
- ELTZSCHIG HK, ROSENBERGER P, LÖFFLER M, et al. Impact of intraoperative transesophageal echocardiography on surgical decisions in 12,566 patients undergoing cardiac surgery. Ann Thorac Surg 2008;85 :845-52.
- GREWAL KS, MALKOWSKI MJ, PIRACHA AR, et al. Effect of general anesthesia on the severity of mitral regurgitation by transesoophageal echocardiography. Am J Cardiol 2000; 85:199-203
- MICHELENA HI, ABEL MD, SURI RM, et al. Intraoperative echocardiography in valvular heart disease: An evidence-based appraisal. Mayo Clin Proc 2010; 85:646-55
- MICHEL-CHERQUI M, FISCHLER M. Echocardiographie peropératoire en chirurgie cardiaque. In: VIGNON P et al, éd. Echocardiographie Doppler chez le patient en état critique. Paris: Elsevier-Masson, 2008, 433-80
- MISHRA M, CHAUHAN R, SHARMA KK, et al. Real-time intraoperative transesophageal echocardiography – How useful ? Experience of 5’016 cases. J Cardiothorac Vasc Anesth 1998; 12:625-32
- NISHIMURA RA, OTTO CM, BONOW RO, et al. 2014 AHA/ACC Guideline for the management of patients with valvular heart disease. Circulation 2014; 129:e521-e643
- ORIHASHI K, HONG Y, KEEHN L, et al. Location of retained intracardiac air in coronary artery bypass grafting using transesophageal echocardiography. Anesthesiology 1990; 73(3A):A430
- REICHERT SLA, VISSER CA, MOULIJN AC, et al. Intraoperative transesophageal color-coded Doppler for evaluation of residual regurgitation after mitral valve repair. J Thorac Cardiovasc Surg 1990; 100:756-63
- SUTTON DC, KLUGER R. Intraoperative transoesophageal echocardiography: Impact on adult cardiac surgery. Anaesth Intensive Care 1998; 26:287-93
- TINGLEFF J, JOYCE F, PETTERSON G. Intraoperative echocardiographic study of air embolism during cardiac operations. Ann Thorac Surg 1995; 60:673-7
- VAHANIAN A, ALFIERI O, ANDREOTTI F, et al. Guidelines on the management of valvular heart disease (version 2012). The Joint Task Force on the Management of Valvular Heart Disease of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J 2012; 33:2451-96
