La conservation des poches de sang (28 à 42 jours) s'accompagne d'une cascade de phénomènes qui modifient considérablement l'efficacité de la transfusion, et dont l’impact est directement lié à la durée de conservation.
- Plus les poches de sang vieillissent, plus elles deviennent acides, moins elles contiennent de 2,3-DPG et d'ATP, et plus la kaliémie augmente (le taux de K+ peut atteindre 28 mmol/L à 20 jours) [19]. Le pHi du receveur diminue lorsque la poche transfusée est âgée de plus de quinze jours [14].
- Des déclencheurs de la réaction inflammatoire systémique s'accumulent dans le milieu de conservation: cytokines, lipides, histamine, antigènes solubles; ces substances sont les principales responsables de la réaction fébrile non-hémolytique; elles vont induire un SIRS et perturber les réactions immunitaires [9]. La déleucocytation diminue l'intensité de ces réactions, qui sont en général déclenchées par des cellules de la lignée blanche.
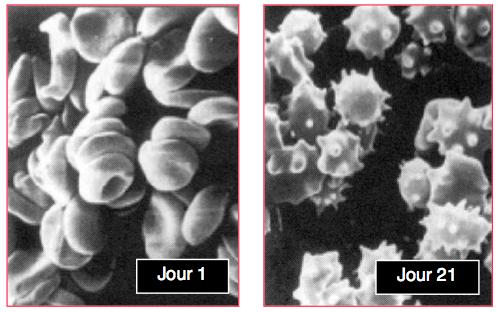
- Les globules rouges (GR) perdent progressivement leur forme biconcave pour devenir sphériques, crénelés et couverts de spicules [10]; ils deviennent rigides et perdent leur capacité à se déformer pour se glisser dans les capillaires (Figure 28.2).
Figure 28.2 : Images de globules rouges au premier et au 21ème jour de conservation [10].
- Leur déformabilité diminue de manière irréversible avec la durée de stockage [7]. Des débris cellulaires s'accumulent dans les poches et finissent par obstruer les plus petits capillaires. Les érythrocytes conservés en milieu artificiel ont tendance à adhérer à l'endothélium lorsque le flux sanguin est continu; ce comportement est d'autant plus marqué que le sang est âgé [22].
- Le taux de 2,3-DPG diminue rapidement dans les conserves de globules rouges; il passe de 20 mcg/L (taux normal) à 0 en une semaine. De ce fait, la courbe de dissociation de l'Hb est déplacée vers la gauche (la P50 passe de 25 à 10 mmHg), donc l'affinité de l'O2 pour l'Hb augmente et la libération de ce dernier dans les capillaires diminue: elle passe de 25% (normal) à 6% pour du sang de 28 jours [6]. La capacité des globules rouges âgés de 4 semaines à pourvoir les tissus en O2 est diminuée de 400% par rapport à celle du sang frais: la tension tissulaire en O2 (PtiO2) passe de 14.4 à 3.5 mmHg [22]. Toutefois, les valeurs des gaz sanguins artériels et veineux ne sont pas modifiées, puisque l'affinité de l'Hb pour l'O2 est augmentée. Chez le receveur, le 2,3-DPG remonte à 50% de sa valeur en 24 heures; l'apport d'O2 aux cellules s'améliore à ce moment, mais ce peut être trop tard pour un malade choqué en dette d'O2 systémique [16].
- Contrairement à la ventilation hyperoxique (FiO2 0.8-1.0), la transfusion de sang âgé n'améliore pas la PO2 tissulaire de patients anémiques (Hb < 85 g/L) en postopératoire [21]. La supériorité du sang frais par rapport au sang âgé pour libérer l'O2 dans les tissus a été contestée dans une étude sur la récupération des fonctions neurocognitives par retransfusion du sang prélevé à des sujets subissant une hémodilution aiguë [26]: on n’a pas trouvé de différence entre le sang frais (< 5 heures) et le sang âgé (≥ 3 semaines) dans les résultats des tests neurocognitifs. Peut-être le 2,3-DPG n'est-il pas le seul élément en cause dans l'oxygénation tissulaire.
Ces altérations liées à l'âge des poches transfusées ont un impact significatif en clinique. Elles sont un facteur de risque indépendant de morbidité et de mortalité postopératoires lorsque l'on compare des groupes appariées de malades transfusés ou non. Dans une série de 321 patients polytransfusés parce que subissant des opérations cardiaques itératives, l'âge des conserves de sang s'est avéré être directement lié à la mortalité à court et à long terme, à l'incidence de dysfonction rénale et à la durée de séjour hospitalier (Figure 28.3) [1].
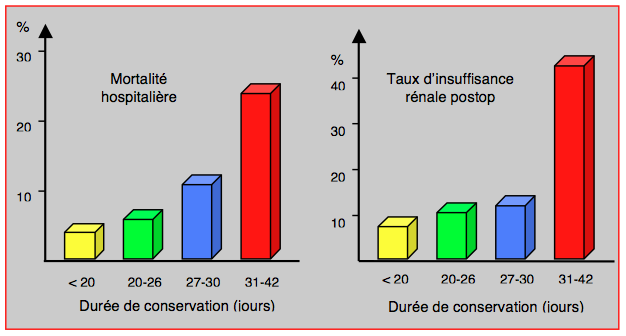

Figure 28.3 : Mortalité et taux d'insuffisance rénale aiguë chez des malades transfusés en fonction de l'âge des poches de sang [1]. L'effet de l'âge n'est significatif qu'au-delà de 27 jours de conservation, mais les poches de 4 semaines et plus ne sont pas utilisées en clinique. L'âge n'a donc pas d'incidence dans les conditions cliniques habituelles.
Le même effet se retrouve à une moindre échelle chez les patients de chirurgie cardiaque à bas risque [13]. L'âge des conserves de sang (> 21 jours) est aussi impliqué dans l'incidence des infections majeures et des défaillances multi-organiques [17]; le risque de pneumonie nosocomiale augmente de 1% par jour de conservation. Une étude de l’impact de 8'802 transfusions chez 2'872 patients de chirurgie cardiaque révèle que les poches de GR âgés de > 14 jours sont associées à un excès de mortalité périopératoire, d’insuffisance rénale et de sepsis par rapport à celles qui datent de < 14 jours [11].
Cependant, ces travaux datent d'une bonne dizaine d'années. Les publications plus récentes sont moins pessimistes: une étude en chirurgie cardiaque [15] et une méta-analyse portant sur 3 études randomisées et sur 24 études observationnelles [24] ne retrouvent aucun effet délétère lié à l’âge des érythrocytes transfusés. Les progrès réalisés dans la préparation et la conservation du sang ont modifié le paysage. Ces dernières années, quatre études comparatives en chirurgie générale, en soins intensifs et en chirurgie cardiaque ont démontré que l’âge des conserves de sang (< 8 jours ou > 22 jours) n’occasionnait aucune différence dans la mortalité ni dans la morbidité des patients à 1, 3 et 6 mois [4,12,18,20]. Récemment, un travail portant sur une population générale de 20'858 patients n'a trouvé aucun effet de l'âge des conserves de sang (13 jours vs 23.6 jours) sur la mortalité des malades (OR 1.04), quelle que soit la gravité de la chirurgie ou de l'affection [8]. Cette divergence s'explique aussi par le fait que les travaux démontrant une aggravation des dégâts collatéraux de la transfusion par la longue conservation des GR sont en général conduits chez des patients à haut risque. D'autre part, l'effet néfaste observé est probablement biaisé par le fait que les malades qui reçoivent de vieux flacons sont en général ceux qui reçoivent le plus grand nombre de concentrés érythrocytaires. Or ces conclusions ne s'appliquent pas aux transfusions massives [3]. Les données actuelles permettent d'affirmer que la durée de conservation des poches de sang n'affecte pas les résultats cliniques [2].
L'augmentation de l'affinité Hb-O2 du sang âgé et la diminution de sa capacité à libérer l'O2 dans les tissus n'a peut-être pas que des inconvénients. En effet, la libération de l'O2 devient très dépendante du gradient entre la PO2 du sang et celle des tissus, ce qui conduit à une libération préférentielle dans les tissus dont la PtiO2 est la plus basse [23]. L'O2 est en quelque sorte dirigé vers les régions hypoxiques. D'ailleurs, les études ABC et CRIT (voir plus loin) n'ont pas décelé de différences dans la morbidité des malades qui soit liée à l'âge des conserves de sang, qui était dans ces études de 16 et 21 jours respectivement [5,25].
| Durée de conservation du sang |
| Plus la durée de conservation du sang s’allonge, moins le transport d’O2 est efficace ; mais l’âge des conserves de sang ne paraît pas influencer la survie ni la morbidité des patients, quelle que soit leur catégorie de risque. |
© CHASSOT PG, MARCUCCI C, SPAHN DR. Juin 2011; dernière mise à jour, Novembre 2018
Références
- BASRAN S, FRUMENTO RJ, COHEN A, et al. The association between duration of storage of transfused red blood cells and morbidity and mortality after reoperative cardiac surgery. Anesth Analg 2006; 103:15-20
- BOER C, MEESTERS MI, MILOJEVIC M, et al. 2017 EACTS/EACTA Guidelines on patient blood management for adult cardiac surgery. J Cardiothorac Vasc Anesth 2018; 32:88-120
- CARSON JL, GUYATT G, HEDDLE NM, et al. Clinical practice guidelines from the AABB: red blood cell transfusion thresholds and storage. JAMA 2016; 316:2025-35
- COOPER DJ, McQUILTEN ZK, NICHOL A, et al. Age of red cells for transfusion and outcomes in critically ill adults. N Engl J Med 2017; 377:1858-67
- CORWIN HL, GETTINGER A, PEARL RG, et al. The CRIT study: Anemia and blood transfusion in the critically ill – Current clinical practice in the United States. Crit Care Med 2004; 32:39-52
- FITZGERALD RD, MARTIN CM, DIETZ GE, et al. Transfusing red blood cells stored in citrate phosphate dextrose adenine-1 for 28 days failed to improve tissue oxygenation in rats. Crit Care Med 1997; 25:726-32
- FRANK SM, ABAZYAN B, ONO M, et al. Decreased erythrocyte deformability after transfusion and the effects of erythrocyte storage duration. Anesth Analg 2013; 116:975-81
- HEDDLE NM, COOK RJ, ARNOLD DM, et al. Effect of short-term vs long-term blood storage on mortality after transfusion. N Engl J Med 2016; 275:1937-45
- HO J, SIBBALD WJ, CHIN-YEE IH. Effects of storage on efficacy of red cell transfusion: When is it not safe ? Crit Care Med 2003; 31:(Suppl):S687-97
- HOVAV T, YEDGAR S, MANNY N, et al. Alteration of red cell aggregability and shape during blood storage. Transfusion 1999; 39:277-81
- KOCH CG, LI L, SESSLER DI, et al. Duration of red-cell storage and complications after cardiac surgery. N Engl J Med 2008; 358:1229-39
- LACROIX J, HEBERT PC, FERGUSSON DA; et al. Age of transfused blood in critically ill adults. N Engl J Med 2015; 372:1410-8
- LEAL-NOVAL SR, JARA-LOPEZ I, GARCIA-GARMENDIA JL, et al. Influence of erythrocyte concentrate storage time on postsurgical morbidity in cardiac surgery patients. Anesthesiology 2003; 98:815-22
- MARIK PE, SIBBALD WJ. Effect of stored blood transfusion on oxygen delivery in patients with sepsis. JAMA 1993; 269:3024-9
- McKENNY M, RYAN T, TATE H, et al. Age of transfused blood is not associated with increased postoperative adverse outcome after cardiac surgery. Br J Anaesth 2011; 106: 643-9
- NAPOLITANO LM, CORWIN HL. Efficacy of red blood cell transfusion in the critically ill. Crit Care Clin 2004; 20:255-68
- OFFNER PJ, MOORE EE, BIFFL WL, et al. Increased rate of infection associated with transfusion of old blood after severe injury. Arch Surg 2002; 137:711-7
- SAAGER L, TURAN A, DALTON JE, et al. Erythrocyte storage duration is not associated with increased mortality in noncardiac surgical patients. Anesthesiology 2013; 118:51-8
- STEHLING L, SIMON TL. The red blood cell transfusion trigger: Physiology and clinical studies. Arch Pathol Lab Med 1994; 118:429-36
- STEINER ME, NESS PM, ASSMANN SF, et al. Effects of red-cell storage duration on patients undergoing cardiac surgery. N Engl J Med 2015; 372:11419-29
- SUTTNER S, PIPER SN, KUMLE B, et al. The influence of allogeneic red blood cell transfusion compared with 100% oxygen ventilation on systemic oxygen transport and skeletal muscle oxygen tension after cardiac surgery. Anesth Analg 2004; 99:2-11
- TSAI AG, CABRALES P, INTAGLIETTA M. Microvascular perfusion upon exchange transfusion with stored red blood cells in normovolemic anemic conditions. Transfusion 2004; 44:1626-34
- TSAI AG, VANDEGRIFF KD, INTAGLIETTA M, WINSLOW RM. Targeted O2 delivery by low-P50 hemoglobin: a new basis for O2 therapeutics. Am J Physiol Heart Circ Physiol 2003; 285:H1411-9
- VAMVAKAS EC. Meta-analysis of clinical studies of the purported deleterious effects of “old” (versus “fresh”) red blood cells: are we at equipoise ? Transfusion 2010; 50:600-10
- VINCENT JL, BARON JF, REINHART K, et al. Anemia and blood transfusion in critically ill patients (ABC). JAMA 2002; 288:1499-507
- WEISKOPF RB, FEINER J, HOPF H, et al. Fresh blood and aged stored blood are equally efficacious in immediately reversing anemia-induced brain oxygenation deficits in humans. Anesthesiology 2006; 104:911-20