Il est possible d'enregistrer en continu le flux sanguin dans l'aorte descendante au moyen d'une échographie Doppler par voie transoesophagienne. Le capteur Doppler est monté à l’extrémité d’une petite sonde introduite par la bouche jusqu’au niveau D5-D6 (35-40 cm depuis l’arcade dentaire) (Figure 6.35A).

Figure 6.35A : Doppler oesophagien; sonde d'échographie Doppler en place dans l'oesophage moyen, tournée en direction postérieure vers l'aorte descendante.
Lorsqu’il est dirigé vers l’aorte descendante, le capteur y enregistre la vélocité sanguine. Pour calculer le DC, il mesure le volume systolique (VS), qui est égal au produit de la section de l’aorte et de l’intégrale des vélocités du flux (ITV) :
VS (cm2) = Sao (cm2) • ITV (cm)
où : Sao : surface transversale de l’aorte descendante
ITV : intégrale des vélocités, ou distance parcourue pendant le temps d’éjection dans un cylindre idéal de même diamètre ; c’est la moyenne spatiale des vélocités sur toute la surface de section du vaisseau (∫Vao(t)dt), ou le produit de la vélocité (cm/s) et du temps (sec).
Le diamètre de l’aorte descendante est connu par un nomogramme en mémoire dans l’appareil ; sa valeur est fonction de l’âge, du poids et de la taille du patient. Un seul modèle (HemoSonic100™) mesure le diamètre réel de l’aorte au moyen d’un capteur TM adjoint au capteur Doppler. L’équation Doppler (voir Chapitre 25, Echocardiographie Doppler) permet à l’appareil de mesurer l’ITV en corrigeant pour l’angle de lecture entre le faisceau d’ultrasons et le flux dans l’aorte (45°) (Figure 6.35B).
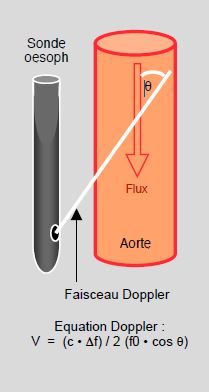
Figure 6.35B : Doppler oesophagien; le faisceau Doppler analyse le flux aortique sous un angle (θ) de 45° à 60° dont le cosinus rentre dans le calcul de l’équation Doppler. Cette équation permet de calculer la vélocité du flux (V) par la modification de la fréquence des ultrasons enregistrés (Δf) par rapport à la fréquence émise par la sonde (f0) ; "c" est la vélocité des ultrasons dans le milieu ambiant (1'540 m/s).
Comme ce Doppler analyse le flux après le départ des vaisseaux de la gerbe aortique, il ne représente que les deux tiers du volume éjecté; un facteur de correction (x 1.3) est introduit dans les calculs pour obtenir le débit cardiaque global [4]. L'impossibilité de connaître l'anatomie de l'aorte limite l'application de cette technique aux patients dont le status vasculaire thoracique est normal. Il existe trois modèles sur le marché : CardioQ™ (sonde à usage unique), HemoSonic100™ et Waki TO™.
L'affichage spectral du flux aortique donne plusieurs renseignements (Figure 6.36).
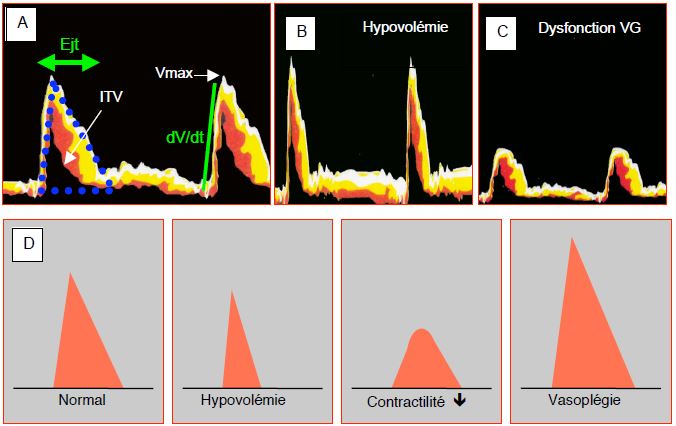
Figure 6.36 : Affichage spectral d’enregistrements du flux dans l'aorte. A: hémodynamique normale. ITV : intégrale des vélocités, équivalant de la surface sous la courbe du flux (pointillé bleu). Ejt : durée de l’éjection. Vmax : vélocité maximale du flux. dV/dt : pente ascensionnelle du flux. B: enregistrement en hypovolémie; la pente ascentionnelle est raide car l'éjection du VG est rapide, la surface de la courbe est étroite et la durée du flux raccourcie, car le volume systolique est bas. C: image du flux lors de dysfonction du VG; la pente ascentionnelle est faible, la vélocité globale diminuée, la courbe très élargie et la durée du flux allongée, traduisant l'éjection ralentie et le bas volume systolique du VG dysfonctionnant. D: représentations schématiques du flux aortique dans quatre situations différentes.
- Vélocité (Vmax) du flux systolique.
- Durée d’éjection (durée du flux) Téj ; elle est corrigée pour la fréquence cardiaque par multiplication avec la racine carrée de l’intervalle RR.
- Volume systolique : VS = 1.3 • (Sao • ITV).
- Débit cardiaque (DC = VS • FC) ; il est calculé en continu.
- Pente ascensionnelle du flux (dV/dt, accélération moyenne du flux): indice de performance systolique.
- L’information conjointe de la pression artérielle permet de calculer les RAS.
- L'ECG simultané permet de calculer les Systolic time intervals (voir Monitorage fonction systolique VG).
En fonction de la forme et de l’évolution de l’image spectrale du flux aortique, il est possible d’apprécier les modifications de la volémie, de la fonction ventriculaire et des résistances artérielles [11].
- Une baisse de fonction inotrope se traduit par une diminution de la Vmax, de la pente ascentionnelle du flux (dV/dt) et de la surface sous la courbe (ITV) ; la durée d’éjection (Téj) est allongée (valeur normale : 250-350 msec) ; l'aspect de la courbe est émoussé.
- Une hypovolémie provoque une diminution de la durée d’éjection (Téj) et un rétrécissement de la surface sous la courbe (ITV) ; la Vmax est normale ou légèrement modifiée.
- Une augmentation des résistances diminue la Vmax et la durée d’éjection, mais redresse la pente ascentionnelle; la vasoplégie augmente la vélocité maximale et la surface sous la courbe.
- Aucune mesure n’est spécifique de la volémie, de la résistance artérielle ou de la contractilité ; le diagnostic est basé sur la combinaison des différentes variables et de leur évolution.
- Comme le diamètre moyen de l'aorte ne change pas au cours de l'examen ou de l'opération, la simple variation de l'ITV renseigne sur l'évolution de la fonction et de la volémie.
Cette technique a été très utilisée pour guider l'administration liquidienne peropératoire (Goal-directed fluid administration) en visant un maintien du volume systolique dont elle permet un bon suivi, même si la précision en valeur absolue est discutable (voir Monitorage de la volémie) [7]. Des aliquots liquidiens (cristalloïdes ou colloïdes) sont administrés dès que le VS diminue de plus de 10% ; la restitution est répétée jusqu’à ce que l’addition liquidienne ne provoque plus d’augmentation du VS parce que le malade est sur la partie plate de sa courbe de Starling. Cette prise en charge a permis une réduction du séjour hospitalier et de la morbidité postopératoire [1], et même une diminution de mortalité chez des polytraumatisés [5].
La corrélation des mesures avec les valeurs de thermodilution est modeste : la variation est de 3.3 à 5.0 L/min (médiane 4.2 L/min); le coefficient de corrélation est de 0.75-0.80 et le taux d'erreur de 40-50% [6,10,11]. La sensibilité est meilleure pour les DC élevés (97%) que pour les DC bas (71%) [4]. Bien que facile à maîtriser, la technique demande une courbe d’apprentissage d’une douzaine de patients [10]. Sa valeur tient essentiellement à la possibilité de suivre l’évolution hémodynamique d’un patient, car les mesures fournies sont modérément fiables en valeur absolue. Elle est insuffisante comme seule technique de mesure du débit cardiaque pour assurer la prise en charge des patients en chirurgie cardiaque [8].
Le DOe souffre de plusieurs sources d’erreurs majeures [2,11] :
- L’image du flux dépend étroitement de la position de la sonde, qui doit viser l’aorte dans son plus grand diamètre.
- Le profil des vélocités du sang dans l'aorte est supposé plat, homogène et laminaire.
- L’imprécision sur le diamètre aortique, qui est estimé de manière aveugle puisqu’il n’y a pas d’image échocardiographique de l’aorte descendante. L'aorte est supposée circulaire et rectiligne; les mesures ne sont pas fiables en cas de pathologie aortique (anévrysme, sténose, athéromatose, tortuosité, etc).
- L’aorte est pulsatile et change de dimension entre la systole et la diastole ; une erreur sur l’évaluation du rayon est élevée au carré lors du calcul de la surface.
- Le DOe suppose un rapport fixe entre le flux supra-aortique (tête et membres supérieurs) et le flux infrathoracique, ce qui n’est pas le cas en cas de choc hémorragique, de vasoplégie ou de clampage de l’aorte abdominale. Il surestime le DC en cas d’anesthésie combinée à cause du flux excessif dans la partie inférieure du corps qui est vasodilatée par la rachianesthésie ou la péridurale [9].
Le DOe est donc un instrument utile pour le suivi d’un patient dont les conditions de base ne sont pas significativement modifiées. Il perd toute valeur en cas de forte variation des RAS, d'anesthésie rachidienne, de clampage aortique ou de contre-pulsion intra-aortique; il n'est pas fiable en cas de coarctation, de scoliose, d'insuffisance aortique majeure et de syndrome de Leriche. Il est contre-indiqué en cas de lésions oro-pharyngées ou oesophagiennes [11].
Echocardiographie
L’échocardiographie transthoracique (en soins intensifs) ou transoesophagienne (en peropératoire) permet de calculer le débit cardiaque de manière peu invasive selon plusieurs méthodes. La plus utilisée est le calcul du volume systolique par le produit de l’intégrale des vélocités (ITV) du flux aortique et de la surface d’ouverture en systole ; la mesure se fait dans la chambre de chasse du VG ou à travers la valve aortique : VS (cm3) = ITV (cm) x SAo (cm2) (voir Figure 6.56 et Chapitre 25 Volume systolique et débit cardiaque). Cependant, cette mesure est lente, complexe et peu précise [3]. D’autre part, elle est ponctuelle et inadaptée à un suivi continu. Elle ne peut en aucun cas remplacer un appareil dédié à la mesure du débit cardiaque comme le cathéter pulmonaire ou le PiCCO. Par contre, l’échocardiographie est le meilleur moyen de quantifier la fonction ventriculaire droite ou gauche, et d’évaluer les pathologies valvulaires ou myocardiques ; elle est également très performante pour le diagnostic différentiel de l’hypotension réfractaire et de l’hypovolémie.
| Doppler oesophagien |
|
Un capteur placé dans une sonde oesophagienne mesure le flux dans l’aorte descendante. Le volume systolique est : VS (cm3) = Sao (cm2) • ITV (cm) où ITV est l’intégrale des vélocités aortiques. Le système permet de calculer le VS, le DC, la durée d’éjection, la Vmax du flux et son accélération. L’affichage de l’image spectrale du flux aortique illustre les modifications de la volémie, de la performance ventriculaire gauche et des résistances artérielles. Cet appareil est fréquemment utilisé pour gérer l’administration liquidienne dirigée en fonction des modifications du VS.
|
© CHASSOT PG Août 2010, dernière mise à jour Août 2017
Références
- ABBAS SM, HILL AG. Systematic review of the literature for the use of oesophageal Doppler monitor for fluid replacement in major abdominal surgery. Anaesthesia 2008 ; 63 :44-51
- BERNARDS J, MEKEIRELE M, HOFFMANN B, et al. Hemodynamic monitoring: to calibrate or not to calibrate ? Part 2 – Non-calibrated techniques. Anaesthesiol Intens Ther 2015; 47:501-16
- BETTEX DA, HINSELMANN V, HELLERMANN JP, JENNI R, SCHMID ER. Inaccuracy of cardiac output determination by transoesophageal echocardiography. Anaesthesia 2004; 59:1184-92
- BOULNOIS JLG, PECHOUX T. Non-invasive cardiac output monitoring by aortic blood flow measurement with the Dynemo 3000. J Clin Monit Comput 2000; 16:127-40
- CHYTRA I, PRADL R, BOSMAN R, et al. Doppler-guided fluid management decreases blood lactate levels in multiple trauma patients: a randomised controlled trial. Crit Care 2007; 11:R24
- DICORTE CJ, LATHAM P, GREILICH P, et al. Esophageal Doppler monitor determination of cardiac output and preload during cardiac operations. Ann Thorac Surg 2000; 69:1782-6
- GAN TJ, SOPPITT A, MAROOF M, et al. Goal-directed intraoperative fluid administration reduces length of hospital stay after major surgery. Anesthesiology 2002; 97:820-6
- JAEGGI P, HOFER CK, KLAGHOFER R, et al. Measurement of cardiac output after cardiac surgery by a new transesophageal Doppler device. J Cardiothorac Vasc Anesth 2003; 17:217-20
- LAOUSSE E, ASEHOUNE K, DARTAYET B, et al. The hemodynamic effects of pediatric caudal anesthesia assessed by esophageal Doppler. Anesth Analg 2002; 94:1165-8
- LEFRANT JY, BRUELLE P, AYA AGM, et al. Training is required to improve the reliability of esophageal Doppler to measure cardiac output in critically ill patients. Intensive Care Med 1998; 24:347-52
- SCHOBER P, LOER SA, SCHWARTE LA. Perioperative hemodynamic monitoring with transesophageal Doppler technology. Anesth Analg 2009; 109:340-53
