D’une manière générale, les indices de risque et les investigations cardiologiques ont une bonne valeur prédictive négative mais une faible valeur prédictive positive, car l’impact de l’évaluation préopératoire est limitée par plusieurs facteurs [4].
- Faible prévalence des évènements dans la population générale ;
- Variabilité dans les définitions et les critères utilisés pour quantifier les pathologies et les complications ;
- Identification des facteurs de risque limitée à un nombre restreint, qui peut englober des entités différentes ;
- Effet de la durée d’une maladie non quantifié ;
- Evènements peropératoires inconnus au moment de l’évaluation ;
- Biais statistiques et différences méthodologiques entre les études.
L’insuffisance cardiaque, par exemple, peut être causée par une ischémie, une valvulopathie, une arythmie ou une cardiomyopathie. Classée sous le même terme, cette disparité n’est pas prise en compte par un indice de risque, alors que l’impact sur le devenir et la prise en charge périopératoire sont très différents selon les étiologies.
La plupart des indices ne tient pas compte de la durée d’évolution d’une maladie ni de sa gravité, mais seulement de sa présence ou de son anamnèse par un jeu de "oui/non". Or les affections cliniques se présentent comme un continuum, non comme une dichotomie dont le seuil de séparation est forcément arbitraire. Plusieurs points méritent d’être relevés.
Théorème de Bayes
La probabilité de découvrir une lésion pathologique par une investigation spécifique est fonction directe de la probabilité d’existence de cette maladie dans la catégorie clinique à laquelle appartient le patient ; c’est une application du théorème de Bayes [19]. On n’obtient que des informations très limitées en soumettant à des tests d’effort des individus qui présentent une probabilité très haute ou très basse d’être porteur de la maladie recherchée. Par exemple, l’absence d’angor, d’infarctus anamnestique, de diabète et d’insuffisance cardiaque classe le malade, quel que soit son âge, dans une catégorie dont le risque de souffrir de pathologie coronarienne est inférieur à 4% [23]. Un angor atypique n'a que 12% de chance de correspondre à une coronaropathie chez la femme de moins de 40 ans, alors que le risque est de 94% chez l'homme de plus de 60 ans qui présente un angor classique [22]. Une modification du segment ST à l’effort chez un jeune sportif en pleine santé n’est très probablement pas un marqueur de maladie coronarienne, mais un faux positif ou l’effet d’un tonus sympathique élevé; dans ce cas, l’investigation pouvait être évitée car il était prévisible que ses conclusions n’entraîneraient aucune sanction thérapeutique. A l’inverse, un examen cherchant à prouver l’existence d’une coronaropathie est inutile lorsque la probabilité d’existence de cette maladie est très élevée et que la prise en charge en tiendra compte quoiqu’il en soit. La portée d’un examen de dépistage est donc la plus efficace dans la catégorie de risque intermédiaire, car c’est là où l’on a le plus de chance de faire des découvertes inattendues conduisant à une sanction thérapeutique.
Etant donné leur très faible incidence de complications, les interventions mineures chez des patients stables ne réclament pas d’investigations préopératoires car il est peu probable que ces dernières modifient la prise en charge [18]. Les tests d’effort sont également inutiles chez les patients à risque intermédiaire qui ont une bonne capacité fonctionnelle (> 5 MET), même en cas de chirurgie majeure. Ils ne sont indiqués que si la capacité d’effort est réduite (< 4 MET) ou si les patients présentent des facteurs de risque majeurs (cardiopathie instable). De toute manière, ils n'ont de sens que si leurs résultats modifient la prise en charge périopératoire [10,18]. Le dosage des troponines et des BNP/NT-proBNP chez les malades à risque permet de restreindre les investigations cardiologiques aux patients dont les valeurs sont supérieures au seuil de signification (respectivement 92 et 300 ng/L) (Figure 3.8) [15,25,31].
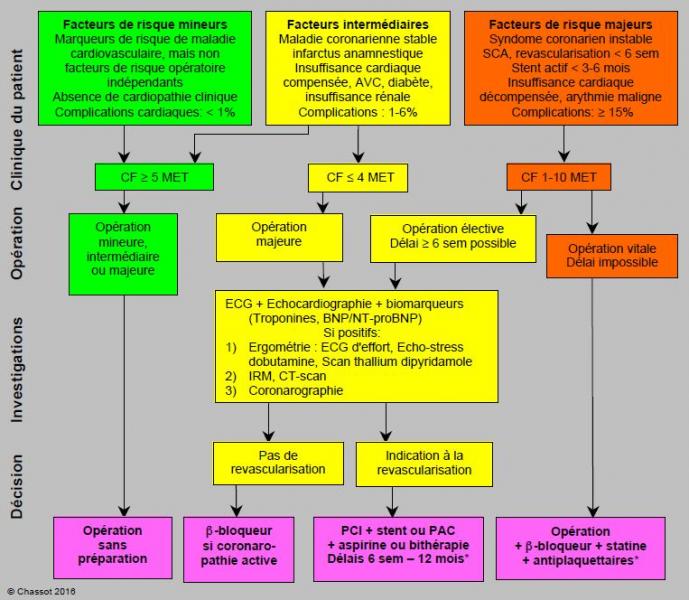
Figure 3.8 : Algorithme d'évaluation du patient ischémique ou à risque coronarien pour la chirurgie non-cardiaque (modifié d'après référence 6). Les patients à risque mineur et intermédiaire avec une bonne capacité à l'effort peuvent subir une intervention sans investigation ni préparation particulière. Des investigations cardiologiques sont indiquées chez les patients à risque intermédiaire avec une mauvaise performance à l'effort lors d'opération majeure et chez les patients à risque majeur (cardiopathie instable), pour autant que les délais le permettent. L'ECG, l'échocardiographie et les biomarqueurs sont une étape intermédiaire qui permet de sélectionner les malades chez qui les investigations cardiologiques sont le plus utiles. La revascularisation coronarienne impose des délais importants (variables selon le mode de revascularisation) avant de procéder à la chirurgie. Complications cardiaques: ischémie myocardique, infarctus, défaillance ventriculaire, arythmie grave, décès cardiovasculaire. Dans le syndrome coronarien instable, le risque de thrombose coronarienne à l'arrêt des antiplaquettaires (aspirine + clopidogrel/prasugrel/ticagrelor) est en général plus grave que celui d'hémorragie chirurgicale sur continuation de ces derniers. MET: équivalent métabolique. PCI: Percutaneous Coronary Intervention. PAC: pontage aorto-coronarien. SCA: syndrome coronarien aigu. *: voir Tableaux 3.9A et 3.9B.
Cardiopathie ischémique
Le but des investigations cardiologiques consiste à améliorer le pronostic à long terme des malades. Ces investigations n'ont de sens que si elles ont une probabilité certaine de conduire à un traitement étiologique de la maladie coronarienne, et que si les délais imposés par l’éventuelle revascularisation peuvent être respectés. En-dehors de ces conditions, elles relèvent d'un rituel anxiolytique et d'un gaspillage financier. Les études qui ont montré l’effet cardioprotecteur des β-bloqueurs, des antiplaquettaires et des statines ont fait évoluer la prise en charge préopératoire : alors que l’on cherchait auparavant à stratifier le risque par de multiples examens qui retardaient l’intervention, on s’est acheminé ces dernières années vers un paradigme pro-actif donnant la priorité à une pharmacoprotection optimale et ne proposant des investigations ergométriques que pour déceler le petit groupe (4-5%) de patients qui a des chances de bénéficier à long terme d’une revascularisation [5]. On peut omettre les tests d’effort chez des malades souffrant de coronaropathie stable puisque leur devenir postopératoire est identique, qu’ils soient revascularisés ou pris en charge avec une thérapie médicale optimale [20].
D’autre part, plusieurs facteurs se conjuguent pour limiter l’impact des investigations cardiologiques sur le devenir postopératoire des patients coronariens.
- Bien qu’il identifie les patients à risque, le test d’effort prédit mal la localisation et l’étendue de l’ischémie peropératoire [10].
- La moitié des accidents cardiaques postopératoires est lié à la thrombose d’une plaque instable ; or la présence de cette dernière échappe aux tests d’effort ou aux tests pharmacologiques car ele représente une sténose hémodynamiquement peu importante tant qu’elle ne thrombose pas [9,12].
- En cas de coronaropathie stable sans anamnèse d’infarctus, la mortalité et le taux d’infarctus après chirurgie vasculaire ne sont pas diminués chez les patients revascularisés par rapport à ceux traités médicalement, même si leur coronaropathie est sévère [13,20].
- La morbi-mortalité cumulée de la revascularisation préopératoire et de la chirurgie non-cardiaque est très généralement plus élevée que celle de la chirurgie non-cardiaque accompagnée d’un traitement médical optimal, et le retard imposé à l’intervention prévue peut être une source de complications ou de décès intercurrents [6,7].
- La moitié des récidives d'accidents ischémiques survient en-dehors du vaisseau impliqué en premier lieu; l'évolution de la maladie coronarienne a donc autant de poids que le risque lié à un vaisseau sténosé ou stenté [8,12].
Un test d'effort a trois fonctions : mesurer la capacité fonctionnelle, rechercher une ischémie, et déceler un potentiel arythmique. D'une manière générale, la valeur prédictive négative de ces tests est bonne (> 90%), voire excellente (> 98% pour l'ESD), mais leur valeur prédictive positive oscille entre 20% (ECG d'effort) et 38% (ESD) [16]. Ceci s'explique par la faible incidence des évènements ischémiques périopératoires (< 10% des cas) et par leur caractère multifactoriel. D’une manière générale, les tests pharmacologiques ont une meilleure valeur discriminative que les tests d’exercice. L’écho de stress à la dobutamine est probablement le test de la plus grande spécificité [2]. Le test d’effort préopératoire n’est indiqué qu’en cas d’angor instable ou d’arythmies majeures ; chez les patients à haut risque (≥ 3 facteurs de risque dans l’indice de Lee), il peut identifier les patients qui bénéficient d’un traitement cardioprotecteur périopératoire [1].
Effet sur les organes-cibles
Le risque opératoire représenté par le diabète, l’athéromatose ou l’hypertension ne tient pas tant à l’affection elle-même qu’à leurs effets sur les organes-cibles, c’est-à-dire à la présence d’ischémie myocardique, d’ictus ou d’insuffisance rénale. Pour être efficace, un indice doit accorder davantage d’importance aux complications qu’à la maladie elle-même. Ainsi la créatiniémie est un critère de risque bien plus performant que la valeur de la pression artérielle, parce qu’elle traduit l’importance des dégats causés par l’HTA.
La durée de la maladie a bien plus de poids sur le devenir du patient que l’estimation de sa prévalence, parce que la dysfonction organique s’aggrave avec le temps d’exposition à cette maladie [4,11]. D’autre part, l’atteinte polyorganique progressive potentialise les effets délétères de l’affection. La durée d’exposition à l’affection de base est la raison pour laquelle l’âge avancé est un facteur de risque en soi [7].
Importance des évènements peropératoires
Lorsqu’on tente de mettre en rapport des éléments préopératoires (indices de risque, tests fonctionnels) avec le devenir postopératoire (infarctus, décompensation, mortalité), on scotomise les évènements peropératoires comme la durée réelle de l’intervention, les déplacements liquidiens, les épisodes de bas débit cardiaque, l’hémorragie et les transfusions. Or ces évènements ne sont pas réellement prévisibles, ni en importance ni en durée. Plusieurs études prospectives ont démontré une nette amélioration de la prédictibilité du devenir postopératoire lorsque ceux-ci sont pris en compte. La valeur de la courbe ROC passe ainsi à 0.76 - 0.81 [17,24,26] lorsqu’on inclut dans le modèle l’importance de l’hypotension artérielle (baisse de > 25% de la PA), sa durée (> 15 minutes), la tachycardie (> 100 batt/min) ou les transfusions (> 1 unité). Une PAM inférieure à 55 mmHg est directement liée à l’incidence d’insuffisance rénale et de lésion myocardique postopératoires de manière proportionnelle à sa durée (OR 1.32 à 1.82) [28].
L’hypotension, la transfusion et la tachy-bradycardie réduisent de moitié la portée de l’évaluation préopératoire mais triplent le risque postopératoire [24]. A elle seule, l’anémie aiguë (chute de l’Hb > 35%) supprime l’effet cardioprotecteur des béta-bloqueurs et augmente le risque de complications cardiaques postopératoires [3].
Impact
Le choix des tests tient aussi à leur chance de déboucher sur des modifications décisionnelles. Aucun examen ne doit être envisagé s'il ne répond pas à une question spécifique, ni si ses résultats ne vont pas modifier la prise en charge du patient. Un examen qui ne conduit à aucune sanction thérapeutique est un examen inutile ! Par sanction thérapeutique, il faut entendre plusieurs éléments: introduction d'un nouveau traitement médical, indication à une intervention supplémentaire (revascularisation coronarienne, remplacement valvulaire), modification de la stratégie opératoire (opérations étagées, interventions a minima), modification de la technique d’anesthésie et du suivi postopératoire (séjour en soins intensifs), ou contre-indication à l’intervention prévue. Ainsi il est inutile d'investiguer un patient dont l'âge ou les délais opératoires contre-indiquent toute intervention coronarienne, même s'il présente de l'angor clinique. Une coronographie n’a de sens que si elle peut conduire à une revascularisation percutanée ou chirurgicale. Elle est inutile s'il existe des contre-indications à ces options thérapeutiques. Il s’avère aujourd’hui que les indications aux investigations cardiologiques ou à la revascularisation coronarienne préopératoires sont identiques à celles définies en cardiologie en-dehors du contexte chirurgical [14,21,27,29,30].
| Tests cardiologiques préopératoires |
| Un test préopératoire doit répondre à une question précise Un test sans conséquence thérapeutique est un test inutile Les tests d’effort ont une haute valeur prédictive négative mais une faible valeur prédictive positive La durée et les complications organiques d’une affection sont des déterminants plus significatifs que sa prévalence Les incidents peropératoires potentiels sont inconnus au moment de l’évaluation préopératoire La préparation pharmacologique préopératoire a davantage d’impact sur le devenir des patients que les tests préopératoires Les indications aux investigations cardiologiques ou à la revascularisation coronarienne préopératoires sont identiques à celles définies en cardiologie en-dehors du contexte chirurgical |
© CHASSOT PG, DELABAYS A, SPAHN D, Mars 2010, dernière mise à jour, Août 2019
Références
- BAUER S, CAYNE NS, VEITH FJ. New developments in the preoperative evaluation and perioperative management of coronary artery disease in patients undergoing vascular surgery. J Vasc Surg 2010; 51:242-51
- BEATTIE WS, ABDELNAEM E, WIJEYSUNDERA DN, BUCKLEY DN. A meta-analytic comparison of preoperative stress echocardiography and nuclear scintigraphy imaging. Anesth Analg 2006; 102:8-16
- BEATTIE WS, WIJEYSUNDERA DN, KARKOUTI K, et al. Acute surgical aneamia influences the cardioprotective effects of beta-blockade: a single-center, propensity-matched cohort study. Anesthesiology 2010; 112:25-33
- BICCARD BM, RODSETH R. Utility of clinical risk predictors for perioperative cardiovascular risk prediction. Br J Anaesth 2011; 107:133-43
- BOERSMA E, POLDERMANS D, BAX JJ et al. Predictors of cardiac events after major vascular surgery. Role of clinical characteristics, dobutamine echocardiography and -blocker therapy. JAMA 2001; 285:1865-73
- CHASSOT PG, DELABAYS A, SPAHN DR. Preoperative evaluation of patients with, or at risk of, coronary artery disease undergoing non-cardiac surgery. Brit J Anaesth 2002; 89:747-59
- CHASSOT PG, MARCUCCI C, DELABAYS A, SPAHN DR. Perioperative antiplatelet therapy. Am Fam Physician 2010; 82:1484-9
- DAWOOD MM, GUPTA DK, SOUTHERN J, et al. Pathology of fatal perioperative myocardial infarction: implications regarding physiopathology and prevention. Int J Cardiol 1996; 57:35-44
- ELLIS SG, HERTZER NR, YOUNG JR, et al. Angiographic correlates of cardiac death and myocardial infarction complicating major non-thoracic vascular surgery. Am J Cardiol 1996; 77:1126-28
- FLEISHER LA, FLEISCHMANN KE, AUERBACH AD, et al. 2014 ACC/AHA Guideline on perioperative cardiovascular evaluation and management of patients undergoing noncardiac surgery: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. Circulation 2014; 130:e278-e333
- FORD MK, BEATTIE WS, WIJEYSUNDERA DN. Systematic review: prediction of perioperative cardiac complications and mortality by the revised cardiac risk index. Ann Intern Med 2010; 152:26-35
- GIROUD D, LI JM, URBAN P, et al. Relation of the site of acute myocardial infarction to the most severe coronary arterial stenosis at prior angiography. Am J Cardiol 1992; 69:729-32
- GODET G, RIOU B, BERTRAND M, et al. Does preoperative coronary angioplasty improve perioperative cardiac outcome ? Anesthesiology 2005; 102:739-46
- HAMM CW, BASSAND JP, AGEWALL S, et al. ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation. Eur Heart J 2011; 32:2999-3054
- JAMES S, JHANJI S, SMITH A, et al. Comparison of the prognostic accuracy of scoring systems, cardiopulmonary exercise testing, and plasma biomarkers: a single-centre observational pilot study. Br J Anaesth 2014; 112:491-7
- KERTAI MD, BOERSMA E, BAX JJ, et al. A meta-analysis comparing the prognostic accuracy of six diagnostic tests for predicting perioperative cardiac risk in patients undergoing major vascular surgery. Heart 2003; 89:1327-34
- KHETERPAL S, O’REILLY M, ENGLESBE MJ, et al. Preoperative and intraoperative predictors of cardiac adverse events after general, vascular, and urological surgery. Anesthesiology 2009; 110:58-66
- KRISTENSEN SD, KNUUTI J, SARASTE A, et al. 2014 ESC/ESA Guidelines on non-cardiac surgery: cardiovascular assessment and management. Eur Heart J 2014; 35:2383-431
- L’ITALIEN GJ, PAUL SD, HENDEL RC, et al. Development and validation of a Bayesian model for perioperative cardiac risk assesment in a cohort of 1081 vascular surgical candidates. J Am Coll Cardiol 1996; 27:779-86
- McFALLS EO, WARD HB, MORITZ TE, et al. Coronary artery revascularization before elective major vascular surgery. N Engl J Med 2004; 351:2795-804
- MONTALESCOT G, SECHTEM U, ACHENBACH S, et al. 2013 ESC Guidelines on the management of stable coronary artery disease. Eur Heart J 2013; 34:2949-3003
- MORROW DA, GERSH BJ, BRAUNWALD E. Chronic coronary artery disease. In: ZIPES DP, et al, eds. Braunwald's heart disease. A textbook of cardiovascular medicine, 7th edition. Philadelphia, Elsevier-Saunders, 2005, 1281-354
- PAUL SD, EAGLE KA, KUNTZ KM, et al. Concordance of preoperative clinical risk with angiographic severity of coronary artery disease in patients undergoing vascular surgery. Circulation 1996; 94:1561-6
- REGENBOGEN SE, EHRENFELD JM, LIPSITZ SR, et al. Utility of the surgical Apgar Score. Validation in 4119 patients. Arch Surg 2009; 144:30-6
- RODSETH RN, BICCARD BM, LE MANACH Y, et al. The prognostic value of pre-operative and post-operative B-type natriuretic peptides in patients undergoing noncardiac surgery. J Am Coll Cardiol 2014; 63:170-80
- SABATE S, MASES A, GUILERA N, et al. Incidence and predictors of major perioperative adverse cardiac and cerebrovascular events in non-cardiac surgery. Br J Anaesth 2011; 107:879-90
- STEG PG, JAMES SK, ATAR D, et al. ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation. Eur Heart J 2012; 33:2569-619
- WALSH M, DEVEREAUX PJ, GARG AX, et al. Relationship between intraoperative mean arterial pressure and clinical outcomes after noncardiac surgery. Anesthesiology 2013; 119:507-15
- WIJNS W, KOHL P, DANCHIN N, et al. Guidelines on myocardial revascularization. The Task Force on myocardial revascularization of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J 2010; 31:2501-55
- WINDECKER S, KOHL P, ALFONSO F, et al. 2014 ESC/EACTS Guidelines on myocardial revascularization. Eur Heart J 2014; 35:2541-619
- ZARINSEFAT A, HENKE P. Update in preoperative risk assessment in vascular surgery patients. J Vasc Surg 2015; 62:499-509
