La consommation cérébrale d'oxygène (CMRO2) est de 3.5 mL O2/100gm/min, ce qui représente une extraction d'O2 de 30% par les neurones. Si le FSC baisse, la fonction cérébrale est maintenue par accroissement de l’extraction jusqu'à un maximum de 60% [7]. Lorsqu'une substance modifie le FSC dans le même sens et dans la même proportion que la CMRO2, l'adéquation des apports cellulaires est garantie. Si le FSC augmente davantage que la CMRO2 (comme avec les halogénés, par exemple), le flux devient luxuriant et le risque de vol significatif. L’effet des principaux agents d’anesthésie est mentionné dans le Tableau 19.2.
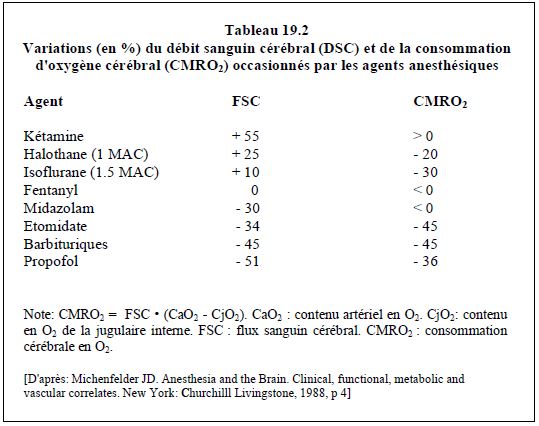
Les halogénés sont des vasodilatateurs cérébraux [5]. Cette vasodilatation peut être atténuée par une hypocapnie, alors que la vasodilatation due au N2O n'est pas modifiée par l'hyperventilation [9]. La réduction maximale de la CMRO2 par l'isoflurane (- 50%) est obtenue à 2 MAC (2.3 %). Le desflurane et le sevoflurane ont des effets voisins de ceux de l'isoflurane. Le pentothal et le propofol réduisent la CMRO2 jusqu'à jusqu'à 50%, entraînant un EEG isoélectrique; les agents intraveineux ne modifient pas le FSC, l'autorégulation, le couplage entre le flux et le métabolisme ni la réponse au CO2 [6].
Lorsque survient une lésion ischémique, la nécrose occupe la partie centrale du territoire concerné, qui est entouré par une zone de lésion fonctionnelle potentiellement réversible et récupérable avec une thérapeutique appropriée (pénombre). En normothermie, un arrêt total de la circulation locale de plus de 5 minutes conduit à des lésions définitives, mais si une perfusion, même très faible, peut être maintenue, la fonction cellulaire est potentiellement récupérable ; celle-ci va dépendre de la pression de perfusion cérébrale, de la consommation d'O2 et du réseau collatéral. La récupération est meilleure si la PAM est élevée (vasopresseurs), la CMRO2 abaissée (agents d'anesthésie) et la collatéralisation bien développée (partiellement améliorée par les vasopresseurs).
Un certain nombre d’éléments peut modifier le retentissement cérébral d’une interruption momentanée du flux sanguin dans une zone ischémiée du cerveau.
- Alors qu’elle n’a aucune influence dans l’accident cérébral hémorragique aigu, l’hyperglycémie (> 8 mmol/L) augmente de trois fois (RR 3.28) la mortalité à 30 jours dans l’infarcissement ischémique [2]. Lors d'une diminution de l'apport d'O2, l'hyperglycémie conduit la cellule à produire du lactate, ce qui crée une acidose cellulaire accompagnée d'hyperosmolarité ; celle-ci est plus délétère que le manque de substrat. D’autre part, le cerveau dépendant étroitement d’un apport glucidique constant, toute neuroglucopénie est associée à une aggravation des lésions cérébrales. La cible recommandée est donc 6-8 mmol/L.
- Le flux est pression-dépendant en aval d'une sténose parce que le lit vasculaire y est maximalement vasodilaté ; les collatérales débitent en fonction de leur pression d'alimentation. Il est donc logique de maintenir une pression supérieure à la normale dans la situation critique d'une ischémie cérébrale aiguë [4]. Lors de clampage carotidien, la routine habituelle est de régler la PAM à 20% au-dessus de sa valeur normale pour le malade, en général au moyen d'un vasoconstricteur alpha (bolus de néosynéphrine, perfusion de nor-adrénaline) [11]. Une pression de perfusion suffisante est la première mesure de protection cérébrale.
- Une certaine protection cérébrale peut être obtenue par des agents d'anesthésie comme le thiopental ou le propofol, par du mannitol, du magnésium ou des stéroïdes, et par une hypothermie modérée (voir Chapitre 18, Protection cérébrale) [10]. Toutefois, ces mesures ne s'appliquent guère au clampage de la carotide, particulièrement lorsque l'intervention a lieu sous anesthésie loco-régionale.
- Pour raccourcir le temps d'ischémie si le clampage de la carotide est mal toléré (voir Clampage carotidien), l'opérateur peut utiliser un shunt de Javid qui permet de maintenir une perfusion pendant l'endartérectomie et la suture de l'artériotomie (Figure 19.3). Les risques majeurs de ce shunt sont l'embolisation accidentelle de fragments athéromateux, notamment à partir de plaques ulcérées, ainsi que les déchirures intimales distales, les lésions de clampage, l'embolie de bulles d'air et la thrombose du shunt sur torsion. Le débit du shunt correspond à environ 20% du débit normal d'une carotide interne. Deux périodes de clampage de 2-3 minutes sont nécessaires pour l’introduire et pour l’extraire. Le shunt n'offre une protection que dans les situations où les troubles neurologiques sont liés à une hypoperfusion et non à une embolisation, ce qui représente moins du quart des cas [1]. Le rapport entre les avantages et les défauts du shunt reste un domaine controversé ; l'étude NASCET n’a pas pu démontrer que le shunt, avec un taux de placement de 40%, soit un facteur de protection contre les AVC [3]. L’indication essentielle est un signe d’hypoperfusion cérébrale pendant le clampage carotidien, ce qui représente environ 15% des cas [8].
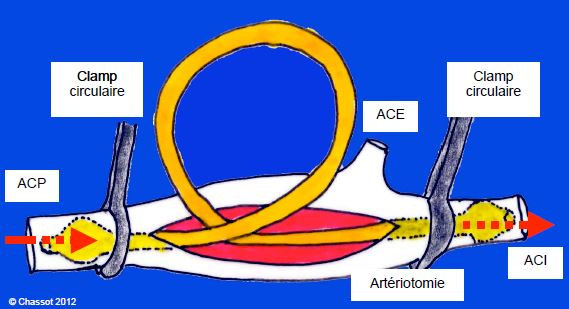
Figure 19.3 : Shunt de Javid. Le shunt en Silastic™ est introduit par l'artériotomie proximalement dans l'artère carotide primitive (ACP) et distalement dans la carotide interne (ACI); il est muni de deux renflements aux extrémités pour rendre le clampage étanche (clamp circulaire). L’artère carotide externe (ACE) est clampée au moyen d’un lac. La durée entre le clampage du vaisseau, l'artériotomie, l'introduction du shunt et l'ouverture de celui-ci est d'environ 2-3 minutes. Avant les derniers points de suture de l'artériotomie, la carotide primitive est à nouveau clampée, le shunt est retiré, la carotide interne est purgée a retro, la suture terminée et le vaisseau déclampé. La durée de ce deuxième clampage est 1-2 minutes.
| Consommation cérébrale d'O2 |
|
CMRO2 normale: 3.5 mL O2/100gm/min; extraction d'O2: 30-60%
Facteurs améliorant le pronostic d'une zone ischémiée du cerveau, où la vasodilatation est maximale et le flux pression-dépendant:
- Normoglycémie
- Hypertension artérielle (PAM + 20% de la norme du patient)
- Normoxie, normocapnie
- Protection cérébrale (hypothermie, propofol, magnésium, nimodipine)
Lorsque le clampage carotidien est mal supporté, on peut rétablir un flux cérébral (environ 20% du flux normal) au moyen d'un shunt de Javid.
|
© CHASSOT PG, Décembre 2010, dernière mise à jour, Décembre 2017
Références
- ACKERSTAFF RGA, VANDEVLASAKKER CJW. Monitoring of brain function during carotid endarterectomy: An analysis of contemporary methods. J Cardiothorac Vasc Anesth 1998; 12:341-7
- CAPES SE, HUNT D, MALMBERG K, et al. Stress hyperglycemia and prognosis of stroke in nondiabetic and diabetic patients: A systematic overview. Stroke 2001; 32:2426-32
- FERGUSON GG, ELIASZIW M, BARR HW, et al. The North American Symptomatic Carotid Endarterectomy Trial (NASCET): surgical results in 1415 patients. Stroke 1999; 30:1751-8
- GRANTON JT, GELB AW. Neuroprotection during carotid endarterectomy. Semin Cardiothorac Vasc Anesth 2002; 6:21-5
- HANSEN TD, WARNER DS, TODD MM, et al. Effects of nitrous oxide and volatile anaesthetics on cerebral blood flow. Brit J Anaesth 1989; 63:290-5
- MENON DK. Cerebral circulation. In: PRIEBE HJ, SKARVAN K. Cardiovascular physiology, London, BMJ Publishing Group, 1995 pp 198-223
- MICHENFELDER JD. Anesthesia and the Brain. Clinical, functional, metabolic and vascular correlates. Churchilll Livingstone, New-York, 1988, 4-21
- PENNEKAMP CWA, MOLL FL, De BORST GJ. The potential benefits and the role of cerebral monitoring in carotid endarterectmy. Curr Opin Anaesthesiol 2011; 24:693-7
- SCHELLER MS, TODD MM, DRUMMOND JC. Isoflurane, halothane and regional cerebral blood flow at various levels of paCO2 in rabbits.Anesthesiology 1986; 64:598-604
- SECO M, EDELMAN JJB, VAN BOXTEL B, et al. Neurologic injury and protection in adult cardiac and aortic surgery. J Cardiothorac Vasc Anesth 2015; 29:185-95
- STONEHAM MD, THOMPSON JP. Arterial pressure management and carotid endarterectomy. Br J Anaesth 2009; 102:442-52
