Une décélération brutale cisaille l'aorte aux endroits situés entre ses parties libres et ses portions fixées, c'est-à-dire au niveau des ostia coronaires (35 % des cas), à l'isthme juste après le départ de la sous-clavière gauche (50% des cas), et, rarement, à la jonction entre l'aorte ascendante et le tronc brachio-céphalique ou au hiatus diaphragmatique. Environ 20% des traumatismes thoraciques fermés autopsiés ont une rupture aortique [11,17]. C’est la lésion cardiovasculaire la plus fréquente dans cette pathologie (voir Chapitre 18 Rupture traumatique) [16]. Pour que la rupture ait lieu, il faut que le moment de la décélération maximale coïncide avec la télésystole ou la protodiastole d'un cycle cardiaque. A ce moment, en effet, le ventricule s’est vidé, alors que l'aorte ascendante et la crosse sont pleines du volume systolique; ces dernières sont donc plus lourdes et sont projetées par leur masse cinétique dans la direction du mouvement. Au contraire, le coeur vide et l'aorte descendante fixée à la colonne ont peu d'énergie cinétique et sont décélérés comme le reste de l'organisme. La lésion cause la mort de 15 % des traumatismes thoraciques fermés, pour une incidence de 0.5% des traumas thoraciques [11]. Elle est immédiatement fatale pour 85% des patients, notamment lorsque la déchirure a lieu à la racine de l'aorte, car l'hémorragie intrapéricardique cause une tamponnade foudroyante [7]. Chez les survivants, la déchirure isthmique (2 cm après le départ de la sous-clavière gauche) est de loin la plus fréquente (90 % des cas chirurgicaux); ces rescapés ont une mortalité de 30% pendant les 6 premières heures, de 50% à 24 heures et de 90% dans les 4 mois [7]. La rupture peut survenir en deux temps, parfois espacés de plusieurs semaines. Passé ce délai, elle peut évoluer vers le faux-anévrysme chronique, mais les risques de rupture persistent, même s'ils sont faibles. La triade diagnostique classique se retrouve dans plus de la moitié des cas:
- Hypertension dans les membres supérieurs;
- Diminution du pouls et de la pression dans les membres inférieurs;
- Elargissement médiastinal radiologique, épanchement pleural (en général gauche).
On rencontre également: douleurs rétrosternales ou interscapulaires, dysphagie, dyspnée, raucité de la voix, douleurs ischémiques des membres inférieurs. Les éléments prédicteurs d'une rupture aortique sont l'élargissement du médiastin, l'hypotension (PAsyst < 90 mmHg), la contusion pulmonaire, l'hémothorax, une fracture de l'omoplate gauche et une fracture pelvienne [10]. Le diagnostic est suspecté par la clinique, par l’échocardiographie transoesophagienne et par l’élévation des D-dimères (> 500mcg/L). Il est établi par le CT-scan spiralé [13]. On distingue habituellement 4 stades de gravité dans la lésion pariétale aortique (Figure 17.26) [1,15].
- Stade I: déchirure intimale minime, minuscule hématome pariétal (< 1 cm);
- Stade II: déchirure > 1 cm, hématome pariétal > 1 cm;
- Stade III: pseudo-anévrysme, déchirure circonférentielle;
- Stade IV: rupture pariétale, dissection, extravasation de produit de contraste.
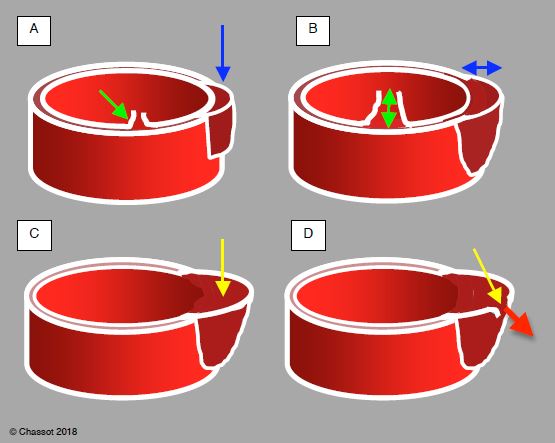
Figure 17.26 : Stades de lésion traumatique aortique. A: minime déchirure intimale (flèche verte), hématome intrapariétal de < 1 cm d'épaisseur (flèche bleue). B: la déchirure (flèche verte) et l'hématome (flèche bleue) mesurent > 1 cm. C: pseudo-anévrysme; la structure de la paroi a disparu, seule l'adventice contient le volume sanguin de l'aorte (flèche blanche). D: la paroi est rompue et le sang fuit vers l'extérieur (flèche jaune).
Le traitement comporte une prise en charge médicale (béta-bloqueur, hypotenseur, réanimation) et un volet chirurgical d'urgence [5,14,17].
- Aorte ascendante: remplacement en CEC le plus rapidement possible;
- Aorte descendante et isthme: endoprothèse d'urgence ou après stabilisation; remplacement chirurgical si l'endoprothèse est inadaptée;
- Lésion de degré I (rupture intimale de < 1 cm): traitement médical, chirurgie secondairement si la lésion progresse;
- Lésions associées: en cas de grave polytraumatisme, elles peuvent obliger à temporiser dans l'indication chirurgicale; la mortalité est alors très élevée (≥ 35%).
Les petites lésions intimales qui maintiennent l'intégrité de la paroi (degré I) peuvent être observées et traitées médicalement, car 85% d'entre elles se résolvent spontanément [14]. Elles sont opérées secondairement en cas d'évolution anormale. Les lésions de l'aorte ascendante réclament une intervention chirurgicale immédiate en CEC par sternotomie, afin de remplacer l'aorte ascendante par un greffon tubulaire. En cas d'insuffisance aortique associée (25% des cas), l'opération s'accompagne d'un remplacement valvulaire (opération de Bentall). Le traitement interventionnel des lésions de l'aorte descendante est moins urgent; il consiste en endoprothèse ou remplacement à ciel ouvert par thoracotomie gauche.
La mortalité opératoire est de 12-20%; elle est en partie liée aux lésions associées [17]. Dans les stades I et II, la survie après chirurgie ou endoprothèse s'élève jusqu'à 100%, mais au stade III elle est de 95% [6]. Dans le stade IV, la mortalité globale reste de 10-20%; le risque de paraplégie est de 5-15%, et celui d'insuffisance rénale de 27% [4]. La mortalité du traitement médical est de 50% en-dehors du stade I [6]. Quand elle est possible, l'endoprothèse est considérée comme la technique de préférence, parce qu'elle présente le même taux de complication mais une mortalité plus faible que la chirurgie à ciel ouvert (mortalité environ 6% versus 15%) [2].
Investigations
Les possibilités d’investigation sont limitées par le temps et par l'état critique du patient. L'ETO et le CT-scan sont les examens de première ligne. Le CT-scan spiralé offre une bonne définition de ce type de lésion, mais n'apporte aucun élément fonctionnel; il impose un déplacement du malade. L’IRM est très difficile, voire impossible, dans les conditions d'un malade choqué, multiperfusé et ventilé. L'aortographie n’est indiquée que s'il est nécessaire de visualiser les axes vasculaires (carotides, aorte abdominale, coronographie). Un signe pathognomonique à la radiographie du thorax est le déplacement de la sonde gastrique par l’hématome.
L'innocuité de l'ETO, sa rapidité, sa disponibilité au déchocage et son apport au diagnostic hémodynamique (volémie, fonction myocardique, tamponnade, lésion valvulaire, etc) en font l'examen de choix à réaliser en premier lieu dans les traumatismes thoraciques fermés graves (Figure 17.27) ( 427-7 Tr Ao isthm 1) ( 427-7 Tr Ao isthm 2). La seule contre-indication est la fracture instable de la colonne cervicale. Dans le cas du traumatisme thoracique, sa sensibilité (95%) et sa spécificité (90%) sont supérieures à celles de l'arcographie, mais inférieures à celles du CT-scan et de l’IRM [3]. L’ETO est pénalisé par la non-visibilité de l’aorte ascendante distale, de la crosse proximale et la mauvaise lecture des gros vaisseaux. A part leur taille, il n’existe aucun moyen de différencier les petites ruptures endothéliales bénignes de celles qui vont évoluer en quelques heures vers la dissection et la déchirure [4] (voir Chapitre 25, ETO au déchocage).
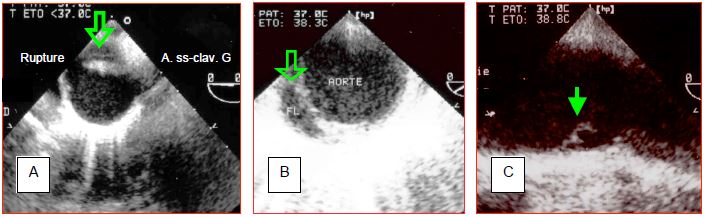
Figure 17.27 : Images ETO de rupture traumatique de l'aorte isthmique. A : coupe transverse de l'aorte au niveau du départ de l'artère sous-clavière gauche. Une rupture pariétale est visible sur la gauche de l'écran; la flèche indique le faux-anévrysme créé par la rupture. B : coupe transverse de l’isthme aortique avec présence d’une déchirure pariétale. C: coupe longitudinale de l'aorte descendante; une fine déchirure intimale (lesion degree I) est bien visible (flèche).
La valeur d’une technique d’examen est définie par la compétence de celui qui l’utilise. Bien que l’échocardiographie soit très séduisante, l’interprétation des images en est complexe et parfois difficile. Une formation accélérée, permettant simplement d’évaluer la fonction ventriculaire, la volémie et certains diagnostics d’urgence comme la tamponnade (FEEL : Focused Echo Evaluation for Life support, FEER : Focused Echocardiographic Examination in Resuscitation, FATE : Focused Assessment with Transthoracic Echocardiography), présente un risque évident d’interprétation inadéquate face à des images aussi délicates que celles des traumatismes vasculaires thoraciques. Cet examen de triage rapide manque totalement de sensibilité pour identifier des lésions aussi fines que celle d’une rupture aortique.
Chirurgie
D’une manière générale, les lésions de l’aorte ascendante sont une indication à la chirurgie d’emblée : excision de la déchirure d’entrée, remplacement de l’aorte ascendante par une prothèse tubulaire et matelassage de la dissection distale, accompagnée ou non d’intervention sur la valve aortique (plastie, resuspension, prothèse, Bentall). L'opération a lieu par sternotomie et la canule artérielle est placée en position fémorale ou sous-clavière droite. Il n'y a pas d'indication pour les endoprothèses dans l'aorte ascendante. Les lésions de la crosse aortique sont volontiers gérées par une opération hybride (voir Chapitre 18 Opérations hybrides). La mortalité opératoire oscille entre 10% et 20%; elle est en partie liée aux lésions associées [12,17].
La réparation chirurgicale d’une rupture de l’isthme aortique consiste traditionnellement en une résection de la zone contuse et réanastomose avec ou sans interposition d’une prothèse tubulaire. L’opération a lieu par thoracotomie gauche, nécessite un tube à 2-lumières, saigne beaucoup et comporte un risque de paraplégie proportionnel à la durée du clampage et à la longueur de la prothèse. La mortalité opératoire voisine 15-20%, et le taux de paraplégie 8-15% [9,16] ; ce dernier est abaissé à 3% en cas de perfusion distale continue (CEC partielle fémoro-fémorale) et de drainage lombaire (voir Chapitre 18 Protection médullaire). Cependant, l’avènement des techniques endovasculaires a modifié radicalement la prise en charge initiale des ruptures isthmiques. En effet, la mise en place d’une endoprothèse en urgence évite la thoracotomie, l’exclusion pulmonaire, le clampage aortique et l’héparinisation. La mortalité et le taux de paraplégie sont presque la moitié de ceux enregistrés avec l'intervention à ciel ouvert (9% et 2-3%, respectivement), mais le risque d'AVC tend à être plus élevé [2,18,19]. Il arrive fréquemment que l’ancrage proximal de la prothèse recouvre l’origine de la sous-clavière gauche [4]. Toutefois, on manque de recul pour connaître les résultats à long terme des interventions endovasculaires (voir Chapitre 18 Endoprothèses de l’aorte thoracique). Comme la plupart de ces opérations ont lieu chez de jeunes adultes, on ignore si le matériel prosthétique vieillit prématurément et si le gain en morbi-mortalité persiste à long terme [16]. Néanmoins, l'endoprothèse est maintenant la technique de choix pour les lésions traumatiques de l'aorte descendante [5].
Anesthésie
La prise en charge anesthésique d’un syndrome aortique aigu consiste à limiter le stress de paroi sur l’aorte, à assurer la réanimation et à définir au plus vite les options thérapeutiques.
- Baisse de la pression artérielle avec un vasodilatateur systémique (nitroprussiate, clevidipine);
- Baisse du dP/dt par un béta-bloqueur (esmolol, labetalol);
- Antalgie, sédation, éventuellement anesthésie et intubation;
- Réanimation liquidienne, transfusions et facteurs de coagulation selon besoins.
Ceci est valabe pour les lésions de l'aorte ascendante et pour celles de l'aorte descendante. Toute chirurgie urgente de l’aorte thoracique, même par endoprothèse, est un acte opératoire à haut risque hémorragique et neurologique, qui demande un équipement complet (voir Chapitre 18 Anesthésie pour la chirurgie de l'aorte ascendante et Anesthésie pour la chirurgie de l’aorte descendante) [8]. La plupart des interventions pour traumatisme aortique porte sur l'isthme de l'aorte (jonction entre la crosse et la descendante), ce qui implique quelques spécificités.
- Voies veineuses de gros diamètre.
- Cathéter artériel : cathéter radial droit et cathéter fémoral (pression artérielle en amont et en aval du clampage).
- Voie centrale : une voie centrale multilumière est suffisante pour les endoprothèses ; l’introducteur et le cathéter pulmonaire de Swan-Ganz sont requis en cas de chirurgie à ciel ouvert.
- ETO : l’échocardiographie est une aide précieuse pour guider le placement des endoprothèses. D’autre part, elle permet de diagnostiquer des lésions qui auraient échappé à l’examen initial au déchocage (tamponnade, hypokinésie, rupture de cordage, foramen ovale perméable, CIV, fistule coronaire, etc). Elle est essentielle pour monitorer la fonction bi-ventriculaire et la volémie; c’est le meilleur moyen pour le diagnostic différentiel d'une hypotension réfractaire peropératoire.
- Drain lombaire pour décompression du LCR.
- Intubation : tube 2-lumière gauche en cas de thoracotomie, tube endotrachéal simple en cas d’endoprothèse.
- A disposition : phentolamine, adénosine, dobutamine + noradrénaline.
La situation réclame de contrôler en permanence la pression artérielle systémique au moyen de vasodilatateur ou de vasconstricteur, mais non avec des agents d’anesthésie (risque de réveil ou d’anesthésie excessivement profonde).
- Maintien d’une pression de perfusion compatible avec la survie des organes (cerveau, cœur, reins, foie) mais en limitant tout dérapage vers l’hypertension à cause du risque de déchirure aortique.
- Pendant le clampage aortique : maintenir une pression de perfusion adéquate pour la moëlle en-dessous du clamp (≥ 70 mmHg) tout en évitant une poussée hypertensive en amont de celui-ci.
- Pendant le déploiement de l’endoprothèse thoracique : abaisser momentanément la pression artérielle avec phentolamine, adénosine ou pacing ventriculaire rapide (pace-maker ventriculaire à 160-200 batt/min).
| Rupture traumatique de l’aorte (traumatisme thoracique fermé) |
|
Survient aux endroits de cisaillement en cas de décélération rapide: racine de l’aorte, isthme. Mortalité: 30% à 6 heures, 50% à 24 heures. Symptômes: douleurs, compression, hypotension aux membres inférieurs, état de choc.
Examens d’urgence : CT-scan, ETO.
Prise en charge: beta-bloqueur, hypotenseur, réanimation.
Le traitement est chirurgical d’emblée (chirurgie à ciel ouvert ou endoprothèse):
- Aorte ascendante: chirurgie par sternotomie et remplacement de l'aorte par un tube (± RVA)
en CEC
- Aorte descendante: endoprothèse par voie percutanée de préférence, remplacement de l'aorte
par thoracotomie gauche si l'anatomie n'est pas favorable à l'endoprothèse
Par rapport à la chirurgie à ciel ouvert, l’endoprothèse diminue la mortalité, le nombre de transfusions, le taux de paraplégie mais pas celui d’AVC; le résultat à très long terme est inconnu.
Anesthésie: maintenir un équilibre entre l’hypotension artérielle nécessaire à limiter le risque de rupture aortique et une pression de perfusion suffisante pour les organes (cerveau, coeur, foie, reins)
- Pendant le clampage aortique: pression en aval du clamp ≥ 70 mmHg (perfusion médullaire)
- Déploiement d’endoprothèse: baisser la pression < 50 mmHg (phentolamine, adénosine,
pacing ventriculaire rapide)
|
© BETTEX D, CHASSOT PG, Janvier 2008, Dernière mise à jour, Avril 2018
Références
- AZIZZADEH A, KEYHANI K, MILLER CC, et al. Blunt traumatic aortic injury: initial experience with endovascular repair. J Vasc Surg 2009; 49:1403-8
- BOTTET B, BOUCHARD F, PEILLON C, BASTE JM. When and how should we manage thoracic injuries in the modern era ? Interact CardioVasc Thorac Surg 2016; 23:970-5
- CHIRILLO F, TOTIS O, CAVARZERANI A, et al. Usefulness of transthoracic and transesophageal echocardiography in recognition and management of cardiovascular injuries after blunt chest trauma. Heart 1996; 75:301-6
- COADY MA, IKONOMIDIS JS, CHEUNG AT, et al. Surgical management of descending thoracic aortic disease: open and endovascular approaches. Circulation 2010; 121:2780-804
- ERBEL R, ABOYANS V, BOILEAU C, et al. 2014 ESC Guidelines on the diagnosis and treatment of aortic diseases. Eur Heart J 2014; 35:2873-926
- FORCILLO J, PHILIE M, OJANGUREN A, et al. Outcomes of traumatic injury in a primary open surgical approach paradigm. Trauma Mon 2015; 20:e18198
- GODWIN JD, TOLENTINO CJ. Thoracic cardiovascular trauma. J Thorac Imag 1987; 2:32-44
- GUTSCHE JT, SZETO W, CHEUNG AT. Endovsascular stenting of thoracic aortic aneurysm. Anesthesiol Clin 2008; 26:481-99
- JAHROMI AS, KAZEMI K, SAFAR HA, et al. Traumatic rupture of the thoracic aorta: cohort study and systematic review. J Vasc Surg 2001; 34:1029-34
- MOSQUERA VX, MARINI M, MUNIZ J, et al. Traumatic aortic injury score: an easy and simple score for early detection of traumatic aortic injuries in major trauma patients with associated blunt chest trauma. Intensive Care Med 2012; 38:1487-96
- NEWMAN RJ, JONES IS. A prospective study of 413 consecutive car occupants with chest injuries. J Trauma 1984; 24:129-33
- NIENABER CA, POWELL JT. Management of acute aortic syndromes. Eur Heart J 2012; 33:26-35b
- RANASINGHE AM, BONSER RS. Biomarkers in acute aortic dissection and other aortic syndromes. J Am Coll Cardiol 2010; 56:1535-41
- SANDHU H, LEONARD SD, PERLICK A, et al. Determinants and outcomes of nonoperative management for blunt traumatic aortic injuries. J Vasc Surg 2018; 67:389-98
- SIMEONE A, FREITAS M, FRANKEL HL. Management options in blunt aortic injury: a case series and literature review. Am Surg 2006; 72:25-30
- SINGH KE, BAUM VC. The anesthetic management of cardiovascular trauma. Curr Opin Anesthesiol 2011; 24:98-103
- SUN X, HONG J, LOWERY R, et al. Ascending aortic injuries following blunt trauma. J Card Surg 2013; 28:749-55
- TANG GL, TEHRANI HY, USMAN A, et al. Reduced mortality, paraplegia and stroke with stent graft repair of blunt aortic transection : a modern meta-analysis. J Vasc Surg 2008; 47:671-5
- XENOS ES, ABEDI NN, DAVENPORT DL, et al. Meta-analysis of endovascular vs open repair for traumatic descending thoracic aortic rupture. J Vasc Surg 2008; 48:1343-51
