Au moment de la mise en charge, le rythme cardiaque est très souvent instable pour plusieurs raisons (voir Chapitre 20 Types d’arythmies) [1].
- L’hyperkaliémie résiduelle de la cardioplégie est la cause de blocs de conduction variables;
- L’inhomogénéité du retour à une conduction normale après cardioplégie et hypothermie est le terreau pour des arythmies de réentrée (FA, TV);
- L’ischémie aiguë (embolie coronarienne d’air ou de fragments athéromateux) entraîne diverses formes d’arythmies ventriculaires;
- Après revascularisation coronarienne adéquate, les arythmies de reperfusion peuvent être particulièrement rebelles au traitement;
- Les lésions chirurgicales du tissu de conduction conduisent à des blocs momentanés ou permanents; leur incidence s'élève jusqu’à 10% après remplacement de la valve aortique [80];
- La stimulation béta par des agents inotropes est arythmogène.
La fibrillation auriculaire (FA) est fréquente après chirurgie cardiaque (10-40% des cas). Elle supprime l’activité propulsive de l’oreillette et abaisse le débit cardiaque par diminution de la précharge télédiastolique du ventricule. Bien que des oreillettes dilatées et faiblement contractiles soient peu utiles hémodynamiquement, le maintien du rythme sinusal garantit une meilleure stabilité électrique, diminue le risque d’embolie systémique et peut éviter l’anticoagulation [4]. Le traitement de la FA est indiqué chez les patients qui étaient en rythme sinusal avant l’intervention et chez ceux qui ne la tolèrent pas du point de vue hémodynamique [6].
- Cardioversion (2-10 J par palettes internes, 50-150 J par voie transthoracique) ;
- Magnésium (MgCl2 10-20 mmoles ou 2-4 g iv) ;
- Amiodarone (Cordarone® 2.5-5 mg/kg iv en 20 min, puis 15 mg/kg en 24 heures) ;
- Esmolol (Brevibloc® 0.5 mg/kg iv en 1 min ; perfusion 0.05-0.2 mg/kg/min);
- Vernakalant (Brinavess®) (3 mg/kg iv en 10 min), première substance de classe I et III à sélectivité auriculaire qui soit efficace après chirurgie cardiaque.
Il est habituel que le cœur fibrille après le déclampage aortique. Cette fibrillation peut se résoudre spontanément, mais il est coutumier de devoir défibriller le patient avec un choc de 5 à 10 J par des palettes internes. Si le premier choc est inefficace, on adjoint du Mg2+ (2-4 g) et de la lidocaïne (1.5 mg/kg) par la voie centrale ou par la CEC. On augmente la puissance jusqu’à 50 J (maximum) au cours de chocs itératifs. L’amiodarone est le premier choix pharmacologique en cas d’instabilité : dose de charge 150-300 mg iv lent, suivi de 150 mg additionnels en perfusion [5]. Il est important de normaliser tous les éléments métaboliques: électrolytes, pH, glycémie, ventilation, etc. Il arrive parfois que les lésions de reperfusion myocardique se traduisent par des tachycardies et des fibrillations ventriculaires à répétition. Il est capital de persister à défibriller le patient, même des dizaines de fois si nécessaire, car ces lésions de reperfusion sont totalement réversibles après quelques heures. La fibrillation réfractaire peut aussi être interrompue par la cardioplégie, mais ceci implique un retour en pompe.
Les arythmies et les blocs rendent souvent nécessaire un entraînement électro-systolique. Comme les arythmies peuvent se déclencher de manière soudaine à n’importe quel moment dans le postopératoire, il est de routine de placer des électrodes épicardiques connectées à un pace-maker après toute opération cardiaque. Les électrodes sont fixées sur l’épicarde en évitant les amas graisseux. Elles sont montées selon deux possibilités.
- Système unipolaire : l’anode (pôle négatif) est fixée à l’épicarde et la cathode dans le tissu sous-cutané ;
- Système bipolaire : anode et cathode sont placées très proches sur l’épicarde ; ce système demande moins d’énergie de stimulation ; il est moins sensible aux interférences électriques.
L’électrode épicardique est implantée sur la chambre de chasse droite (CCVD) parce que le résultat hémodynamique est supérieur par rapport au placement apical : amélioration de la FE, normalisation de l’axe du QRS, préservation du mouvement de torsion du VG [3]. La seule exception est la cardiomyopathie hypertrophique obstructive (CMO) où la stimulation de la chambre de chasse peut entraîner une obstruction dynamique en systole. En cas de dilatation ventriculaire et de retard de conduction, la mise en place de deux électrodes de stimulation, une sur la CCVD et une en position postéro-basale sur le VG, permet une resynchronisation des deux ventricules, mais les pace-makers externes provisoires n’ont pas les capacités régulatrices des boîtiers implantés (voir Chapitre 20 Resynchronisation).
Réglage du pace-maker
Les réglages du pace-maker sont variables de cas en cas, mais oscillent en général autour des mêmes valeurs de base (voir Chapitre 20, Réglages) [2].
- Fréquence : 80 batt/min ; en cas de rythme spontané, 10 batt/min au dessus de la fréquence intrinsèque ;
- Intervalle AV : 150 ms ; 100-225 ms selon la meilleure augmentation de précharge par la contraction auriculaire ;
- Energie d’activation (output) au double du seuil de stimulation observé ; max : 15 mA ;
- Sensibilité (sensing) à la moitié du seuil, ou à 2 mV ;
- Modes de stimulation habituels des pace-makers externes temporaires (Tableau 7.9) :
- DOO (entraînements auriculaire et ventriculaire asynchrones à fréquence fixe) ;
- VOO (entraînement ventriculaire asynchrone à fréquence fixe) ;
- DVI (inhibition de la stimulation ventriculaire en cas d’activité ventriculaire, pas de sensing auriculaire) ;
- VVI (entraînement ventriculaire sur demande, inhibé par la détection d’une activité ventriculaire) ;
- DDD (entraînement et détection auriculaire et ventriculaire ; stimule le ventricule après un délai préfixé, en synchronisation avec l’activité auriculaire).

Le rythme sinusal est toujours préférable à un rythme ventriculaire, car la contraction auriculaire augmente le volume systolique de 20-45%. En mesurant l’importance de la composante A du flux mitral (surface sous la courbe), l’échocardiographie trans-oesophagienne est très utile pour juger de l’efficacité de la contraction auriculaire et pour établir le meilleur délai AV (Figure 7.50).
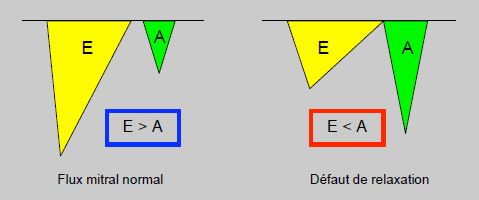
Figure 7.50 : Flux mitral tel qu’il apparaît à l’ETO. Le flux protodiastolique E est lié à la relaxation active du VG, le flux A est dû à la contraction auriculaire. La surface sous la courbe de chaque composante E et A est proportionnelle à la quantité de sang qui passe à travers la mitrale. Normalement, le flux A n’apporte que 20% du remplissage ventriculaire (E > A). En cas de dysfonction diastolique par défaut de relaxation, la composante E diminue et la composante auriculaire prend davantage d’importance ; elle apporte 30-45% du remplissage télédiastolique du VG ; le flux A est plus important que le flux E (E < A). Les patients qui présentent ce type de dysfonction diastolique bénéficient grandement du rythme sinusal. L’ETO est très utile pour juger de l’adéquation hémodynamique du rythme cardiaque et pour guider le réglage du pace-maker (mode de stimulation, délai AV).
Si la contraction auriculaire est hémodynamiquement inefficace (dissociation électro-mécanique auriculaire), il n’y a pas lieu d’insister sur le maintien du rythme sinusal, sauf pour la stabilité électrique et l’absence d’anticoagulation.
Pour tester les seuils de stimulation (output), on règle la fréquence à ≥ 10 batt/min au dessus de la fréquence propre du patient et la sensibilité à sa valeur maximale. On augmente progressivement la puissance de stimulation (mA) jusqu’à ce que la cavité concernée capture la stimulation et affiche un complexe QRS sur l’ECG. Lorsqu’on teste une sonde auriculaire, le tracé affiche une configuration QRS fine de type sinusal, alors que l’image est celle d’un QRS large (type ESV) lorsqu’on teste une sonde ventriculaire. Dans les deux cas, le rythme cardiaque subit un brusque saut de fréquence de ≥ 10 batt/min. Si les seuils sont trop élevés, on inverse les électrodes. La puissance de stimulation est ensuite fixée au double du seuil observé, mais pas > 15 mA.
La sensibilité (sensing) est le réglage qui permet au pace-maker de capter le plus faible signal électrique possible en provenance du cœur. Un seuil bas correspond à une haute sensibilité. Pour la tester, la fréquence est réglée 10 batt/min en dessous de la fréquence propre du malade, le réglage de l’émission (mA) est placé au minimum et le réglage de la sensibilité est placé à sa plus haute valeur (10-12 mV) ; le pace-maker, qui est en mode VVI, AAI ou DDD, ne stimule pas. Lorsqu’on diminue progressivement la sensibilité, le voyant correspondant commence à clignoter pour chaque onde R. La sensibilité est ensuite fixée à la moitié du seuil observé. Si le patient n’a pas de rythme propre, la sensibilité est réglée d’office à 2 mV. Une autre manière de procéder est de démarrer par la valeur de sensing la plus basse et de l’augmenter progressivement, donc de rendre le pace-maker moins sensible, jusqu’à ce que le voyant lumineux cesse de clignoter et que le pace-maker stimule de manière asynchrone [2].
| Réglage du pace-maker |
|
Electrodes épicardiques et boîtier externe temporaire après toute opération de chirurgie cardiaque. Electrode monopolaire (anode active sur l’épicarde, cathode dans le sous-cutané) ou bipolaire (anode et cathode à 1-2 cm sur l’électrode)
Seuil : valeur de puissance minimale (output) à laquelle le pace-maker entraîne la cavité concernée (< 15 mA)
Sensibilité (sensing) : amplitude minimale des signaux que le pace-maker reconnaît comme une activité électrique cardiaque (réglage par défaut : 2 mV)
Fréquence : 70-80 batt/min
Synchronisation AV : stimulations successives de l’oreillette et du ventricule ; délai moyen : 150 msec
|
© CHASSOT PG, GRONCHI F, Avril 2008, dernière mise à jour, Avril 2018
Références
- CHIOLERO R, BORGEAT A, FISCHER A. Postoperative arrhythmias and risk factors after open heart surgery. J Thorac Cardiovasc Surg 1991; 39:81-4
- CHUA J, SCHWARZENBERGER J, MAHAJAN A. Optimization of pacing after cardiopulmonary bypass. J Cardiothorac Vasc Anesth 2012; 26:291-301
- DE COCK CC, GIUDICI MC, TWISK JW, et al. Comparison of the haemodynamic effects of right ventricular outflow tract pacing with right ventricular apex pacing. A quantitative review. Europace 2003; 5:275-8
- MAESEN NIJS J, MAESSEN J, et al. Postoperative atrial fibrillation: a maze of mechanisms. Europace 2012; 14:159-74
- NEUMAR RW, OTTO CW, LINK MS, et al. Part 8: Adult Advanced Cardiovascular Life Support: 2010 American Heart Association Guidelines for cardiopulmonary resuscitation and emergency cardiovascular care. Circulation 2010; 122:S729-S767
- PHILIP I, BERROËTA C, LEBLANC I. Perioperative challenges of atrial fibrillation. Curr Opin Anesthesiol 2014; 27:344-52
