La fonction diastolique représente la capacité du ventricule à accommoder un remplissage adéquat sous un régime de pression basse et sur un vaste éventail de conditions de charge, au repos comme à l’exercice. Le défaut de ce mécanisme, ou dysfonction diastolique, est une entité hétérogène dont on peine à trouver un processus physiopathologique commun à toutes les formes. Les anomalies décelées à l'échocardiographie, à l'IRM ou au cathétérisme sont souvent mal corrélées à la symptomatologie clinique. Classiquement, l'insuffisance diastolique est liée à une hypertrophie ventriculaire gauche et caractérisée par une dilatation de l'OG, mais la moitié des malades ne présente ni l'une ni l'autre. Parmi la multitude des pistes, une série d'éléments sont associés à la dysfonction diastolique du VG [1,15,23,28].
- Structure fonctionnelle du myocarde.
- Rigidification de de la connectine (titin) par hypophosphorylation (la connectine est une molécule géante et élastique qui forme le squelette du myofibrille); l'élasticité ventriculaire est diminuée.
- Défaut de relaxation protodiastolique dû à la persistence d'une haute concentration en Ca2+ intracytoplasmique par manque de recapture par le réticulum sarcoplasmique; la libération incomplète des ponts actine-myosine empêche la relaxation normale des myofibrilles.
- Dépense énergétique excessive à cause du maintien d'une tension diastolique anormale.
- Hypertrophie ventriculaire avec remodelage de type concentrique (augmentation de l'épaisseur de paroi par rapport à la taille de la cavité); volume systolique réduit à cause de l'exiguïté de la cavité ventriculaire.
- Matrice extracellulaire du myocarde.
- Accumulation de collagène; la paroi ventriculaire perd sa souplesse et s'épaissit.
- Fibrose intersticielle.
- Fonction vasculaire: dysfonction endothéliale liée à un syndrome inflammatoire systémique.
- Réduction de la densité microvasculaire associée à la fibrose.
- Augmentation de la rigidité des parois artérielles, élévation de la pression pulsée (PP = PAsyst – PAdiast) et de l'élastance artérielle (Ea = Pts/VS).
- Augmentation de l'onde de pression artérielle réfléchie.
- Perte de la vasodilatation artérielle à l'effort.
- Hypertension artérielle pulmonaire disproportionnée par rapport à l'hypertension veineuse due à l'élévation de la POG, particulièrement à l'effort.
- Symptomatologie clinique.
- Surcharge de volume, stase pulmonaire.
- Dyspnée d'effort; dyspnée au repos dans les cas avancés (défaillance diastolique).
- Comorbidités.
- Obésité, diabète.
- BPCO et syndrome d'apnée du sommeil.
- Insuffisance rénale (clairance de la créatinine < 60 mL/min).
- Biomarqueurs.
- BNP et NT-proBNP modérément élevés (200-250 pg/mL).
- Absence d'une autre pathologie cardiaque pouvant entrainer une gêne diastolique: valvulopathie, dilatation du VG, péricardite, défaillance du VD avec basculement du septum interventriculaire dans le VG, etc.
Trois groupes de patients aux phénotypes différents se détachent dans cet ensemble hétéroclite. Ils ont été constitués grâce à des logiciels utilisés pour mettre en évidence des corrélations au sein de grandes bases de données, en analysant 67 éléments cliniques, hémodynamiques, plasmatiques, électrocardiographiques et échocardiographiques. Chacun des groupes phénotypiques contient environ un tiers des patients [26].
- Groupe 1: patients jeunes (≤ 60 ans), souffrant d'une dysfonction diastolique modérée et présentant un taux de BNP encore normal;
- Groupe 2: patients obèses, diabétiques, souffrant fréquemment d'apnée du sommeil, avec un défaut de relaxation protodiastolique très important mais une dilatation modérée de l'OG;
- Groupe 3: patients plus âgés (≥ 70 ans) présentant un remodelage ventriculaire majeur (HVG, fibrose), une dilatation majeure de l'OG, une dysfonction rénale, une hypertension pulmonaire et une dysfonction du VD.
Le pronostic est très différent selon les groupes. La mortalité est respectivement de 4%, 15% et 24% (HR 1.0, 4.0 et 6.5) et le taux d'hospitalisation pour insuffisance congestive de 17%, 34% et 48% [26].
Dysfonction diastolique
La dysfonction diastolique (DD) est caractérisée par une anomalie des indices échocardiographiques du remplissage ventriculaire qui reste cliniquement asymptomatique au repos ou à l’effort modéré. Dans l’insuffisance diastolique (ID), la situation évolue vers une stase en amont du VG, avec dilatation auriculaire et élévation chronique des pressions de remplissage (POG > 16 mmHg), en présence d’une fonction systolique préservée (FE > 0.5) et en l'absence de valvulopathie. Cliniquement, l'ID se caractérise par la dyspnée; c'est l'insuffisance cardiaque congestive à fonction systolique conservée (HFpEF : heart failure with preserved ejection fraction), responsable de 40-50% des insuffisances cardiaques congestives. Alors qu'une dysfonction diastolique est toujours présente en cas d’insuffisance ventriculaire systolique, la fonction systolique est par définition conservée dans l'insuffisance diastolique. Toutefois, une évaluation plus sophistiquée que la simple fraction d'éjection, comme la déformation systolique longitudinale ou la torsion ventriculaire, mettent en évidence une certaine atteinte fonctionnelle en systole [10,13]. D'autre part, la FE baisse d'environ 1% par an au cours de l'évolution d'une insuffisance diastolique [19].
Une hypothèse plausible à l'étiologie de la cardiomyopathie diastolique la relie à un défaut en biodisponibilité du NO endothélial dans les microvaisseaux coronariens, qui est corrélé avec un état inflammatoire systémique comme on le rencontre dans la sénescense, l’obésité, l’hypertension, le diabète, le syndrome métabolique, le BPCO et l’insuffisance rénale, comorbidités qui lui sont étroitement associées [27]. Le manque de NO lève l’inhibition physiologique de l’hypertrophie et de la fibrose, dont le développement rend le myocarde rigide. Le processus consiste en un excès dans le dépôt de collagène et en une altération dans la structure de la connectine, gigantesque molécule qui constitue l’armature des filaments d’actine et de myosine [23]. Cette étiologie se retrouve à l’identique dans le vieillissement des fibres cardiaques ; la dysfonction diastolique est en quelque sorte une "presbycardie" exagérée. La rigidité du myocarde influence l’éjection systolique, car elle empêche le VG d’atteindre un petit volume en télésystole et réduit de ce fait le volume systolique à l’effort. La faible disponibilité en NO se traduit également par un défaut de vasodilatation artériolaire à l’exercice qui contribue à la rigidité vasculaire, à l’hypertension artérielle et à l’instabilité hémodynamique [7]. Le syndrome inflammatoire est attribué à une élévation chronique du tonus sympathique central [31].
Les trois processus de relaxation active, élasticité et distensibilité sont altérés dans la dysfonction diastolique. Ainsi, le remplissage du VG ne dépend plus de son effet de succion et de sa souplesse, mais de la pression auriculaire qui doit pousser le sang dans le ventricule. La relaxation active, qui s’accélère normalement à l’effort, ne permet plus un remplissage rapide et la capacité d’exercice s’effondre ; la POG augmente au point de frôler la stase pulmonaire. Le flux protodiastolique est lent et s’arrête à mi-ventricule [14]. Au lieu de 20% normalement, le remplissage par la contraction auriculaire contribue pour 40-50% au remplissage total [7]. Mais les trois fonctions de l’OG (réservoir-tampon, conduit passif et pompe active) sont progressivement altérées, et le remplissage du VG dépend de plus en plus de la POG ; la FE de l’OG (normal 25-40%) est abaissée [19,25]. L'excès de collagène et de fibrose interstitielle rigidifie et épaissit la paroi ventriculaire, ce qui a deux conséquences: 1) la tension de paroi et la pression de remplissage augmentent en télédiastole pour le même volume ventriculaire, et 2) le volume systolique diminue parce que le ventricule est moins compressible en télésystole (volume résiduel plus grand).
Schématiquement, les modifications de la performance diastolique peuvent se classer en trois catégories, selon une grille de lecture basée sur les modifications du flux mitral et du flux veineux pulmonaire à l’échocardiographie (Figure 25.203) [18,33].
- Le défaut de relaxation protodiastolique, caractéristique de l’hypertrophie ventriculaire (hypertension artérielle, sténose aortique), du vieillissement, de l’ischémie, de l’obésité, du syndrome d’apnée du sommeil et de l’effet lusitrope négatif de certaines substances. La POG est normale au repos mais s’élève à l’effort. Le défaut de relaxation est une altération fréquente et bénigne, mais qui peut évoluer vers la restriction dans 10% des cas.
- La restriction par perte de compliance ventriculaire (défaut d’élasticité et de distensibilité), caractéristique des cardiomyopathies restrictives, des infiltrations (collagénoses, amyloïdose, œdème post-CEC) et de la dilatation majeure du ventricule. La POG est élevée au repos, et l’effort est extrêmement limité. Il s'agit d'une situation sévère de mauvais pronostic, conduisant à l’oedème pulmonaire, même si la fonction systolique est conservée.
- Entre les deux, se trouve une catégorie de pseudonormalisation, ainsi nommée parce que la silhouette du flux mitral (rapport E/A) paraît normale à cause d’une élévation déjà significative de la POG ; la clinique est intermédiaire entre les deux situations précédentes.
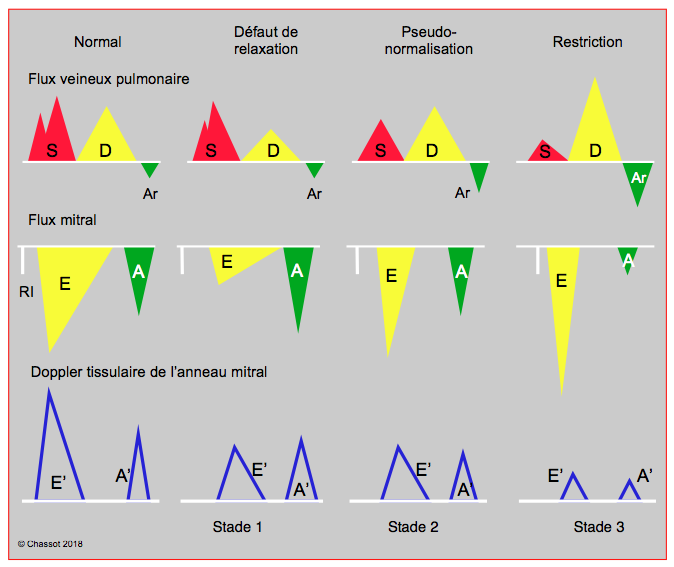
Figure 25.203 : Modifications du flux veineux pulmonaire, du flux mitral et de la vélocité de l’anneau mitral selon l'évolution de la dysfonction diastolique. Stade I, défaut de relaxation : allongement de la phase de relaxation isovolumétrique (tRI > 220 msec), diminution de vélocité du flux mitral passif (E), augmentation de la contribution auriculaire (flux A ?). Peu de modification sur le flux veineux pulmonaire. Diminution de la vélocité de l’anneau mitral. Stade 2, pseudo-normalisation : l'augmentation progressive de la pression auriculaire gauche rétablit le gradient de pression OG – VG; la vélocité du flux E augmente et retrouve sa valeur normale, mais sa morphologie est pathologique: pente d'accélération et de décélération accentuée (tDE < 150 msec), raccourcissement de la relaxation isovolumétrique (tRI < 200 msec). La composante S du flux veineux pulmonaire diminue parce que la POG augmente. Diminution de la vélocité de l’anneau mitral. Stade 3, restriction : c'est la situation la plus grave; le ventricule devient tellement rigide et la pression auriculaire tellement haute que la vélocité du flux E devient très élevée et sa décélération très brutale (tDE < 100 msec); l'onde A de la contraction auriculaire est minime parce que le ventricule n'est plus distensible en fin de diastole. La composante S du flux veineux pulmonaire est minime, le remplissage auriculaire a lieu en diastole, le reflux dû à la contraction auriculaire augmente car le VG n’est pas distensible et la vidange par la mitrale est minime. La vélocité de l’anneau mitral est minime.
Lors de dysfonction diastolique, la rigidité du ventricule se traduit par une fixité du volume diastolique, par un déplacement vers le haut et vers la droite de la courbe de compliance, et par un redressement de la phase de recrutement de la courbe de Starling (voir Figure 5.47). Cela implique trois conséquences cliniques.
- Au même volume de remplissage correspond une pression plus élevée que la norme ; un malade peut être hypovolémique avec une PVC et une PAPO normales. Comme la courbe de compliance est redressée, la même variation de volume se traduit par davantage de variation dans la pression de remplissage. L’individu devient intolérant aux variations de volémie.
- La modulation du volume télédiastolique est très limitée; le volume systolique (VS) devient très dépendant de la précharge parce que la courbe de Starling est très verticale. Le VS est donc très sensible aux variations de la pression intrathoracique ; la ventilation en pression positive et la PEEP baissent significativement le VS et la pression artérielle. Le même degré d’hypovolémie provoque une hypotension plus profonde.
- La normocardie est impérative pour maintenir le volume systolique ; la tachycardie, la bradycardie et la perte du rythme sinusal abaissent le débit cardiaque. En cas de tachycardie, le ventricule ne peut pas accélérer son remplissage pour compenser le raccourcissement de la diastole ; en cas de bradycardie, il ne peut pas se dilater pour augmenter le VS. En cas de rythme nodal ou de FA, le remplissage par la contraction auriculaire est perdu; or celui-ci contribue pour 40-50% au remplissage total, vu le défaut de relaxation protodiastolique.
A défaut de pour pouvoir construire des courbes pression-volume (voir Figure 5.76) en clinique, on a recours à l'échocardiographie Doppler, qui permet, de manière non-invasive, d'étudier la vitesse des flux intracardiaques et leurs morphologies (voir Chapitre 25, Fonction diastolique). Pour autant que les valves auriculo-ventriculaires soient normales, la dysfonction diastolique se traduit par des modifications des flux de remplissage que l'on peut observer dans les veines pulmonaires et les veines caves, ou à travers la valve mitrale et la valve tricuspide (Figure 5.79) [21]. L'évolution de la dysfonction diastolique est bien observable sur les modifications du flux mitral (Figure 5.80) [20].
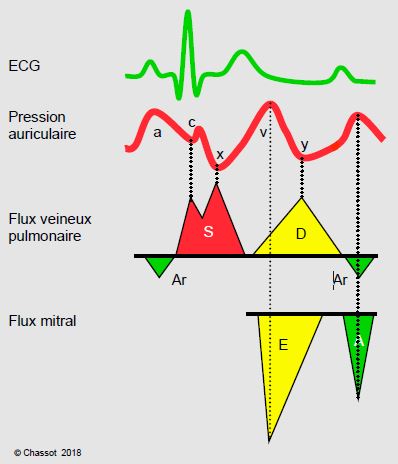
Figure 5.79 : Pressions et flux de remplissage du VG. Les flux sont représentés par leurs vélocités pendant un cycle cardiaque. La vélocité est fonction du gradient de pression instantané entre la cavité d'amont et la cavité d'aval. Les pics de flux veineux pulmonaire correspondent aux moments où la pression dans l'OG est la plus basse; le flux veineux pulmonaire comprend une composante systolique (S) bifide (S1 : descente a-c, S2 : descende x), une composante diastolique (D, descente y) et une composante rétrograde pendant la contraction auriculaire (Ar) vu l'absence de valve dans les veines pulmonaires. Le flux mitral comprend une composante proto-diastolique (E) et une composante produite par la contraction auriculaire (A). La couleur rouge marque la phase systolique, la jaune la phase proto-mésodiastolique, et la verte la phase de la contraction auriculaire. Ce schéma est basé sur les données d’échocardiographie transoesophagienne (ETO); le flux veineux pulmonaire apparaît en dessus de la ligne de base car il se rapproche du capteur alors que le flux mitral apparaît en dessous de la ligne de base car il s’en éloigne.
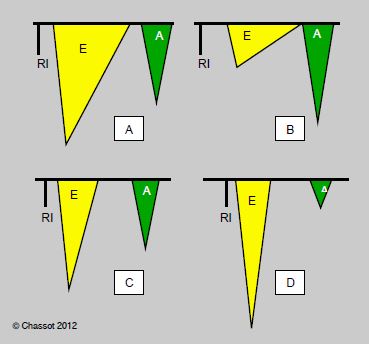
Figure 5.80 : Modifications du flux mitral selon l'évolution de la dysfonction diastolique en ETO (le flux mitral apparaît en dessous de la ligne de base car il s’éloigne par rapport au capteur situé dans l’oesophage). A: Flux normal. B: Défaut de relaxation; allongement de la phase de relaxation isovolumétrique, diminution de vélocité du flux mitral passif (E), augmentation de la contribution auriculaire (flux A 28). C: Pseudo-normalisation; l'augmentation progressive de la pression auriculaire gauche rétablit le gradient de pression OG – VG; la vélocité du flux E augmente et retrouve sa valeur normale, mais sa morphologie est pathologique: pentes d'accélération et de décélération accentuées, raccourcissement de la relaxation isovolumétrique. D: Restriction; c'est la situation la plus grave; le ventricule devient tellement rigide et la pression auriculaire tellement haute que la vélocité du flux E devient très élevée et sa décélération très brutale; l'onde A de la contraction auriculaire est minime parce que le ventricule n'est plus distensible en fin de diastole. RI : phase de relaxation isovolumétrique.
- Défaut de relaxation : allongement de la phase de relaxation isovolumétrique, diminution de vélocité du flux mitral E, diminution de la vélocité du déplacement de l'anneau mitral (E'), augmentation de la contribution auriculaire (flux A) au remplissage, rapport E/A inversé (E/A < 1) (Figure 5.81).
- Pseudo-normalisation : l'augmentation progressive de la pression auriculaire gauche rétablit le gradient de pression OG – VG ; la vélocité du flux E augmente et retrouve sa valeur normale, mais sa morphologie est pathologique (pente d'accélération et de décélération accentuées) ; la relaxation isovolumétrique est raccourcie.
- Restriction : c'est la situation la plus grave ; le ventricule devient tellement rigide et la pression auriculaire tellement haute que la vélocité du flux E devient très élevée et sa décélération très brutale ; l'onde A de la contraction auriculaire est minime parce que le ventricule n'est plus distensible en fin de diastole (rapport E/A > 2). Par contre, la proportion du flux qui recule dans les veines pulmonaires pendant la contraction auriculaire est très importante (augmentation du flux A rétrograde) (Figure 5.82).
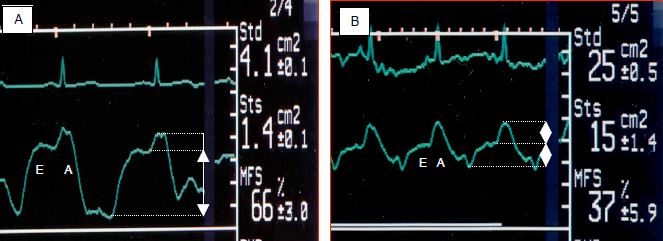
Figure 5.81 : Contribution de la contraction auriculaire au remplissage diastolique du ventricule gauche. La courbe représente l'évolution de la surface ventriculaire au cours du cycle cardiaque au moyen de la définition automatique des contours endocavitaires à l'échocardiographie transoesophagienne (AQ™). A: situation normale; la majeure partie du remplissage a lieu pendant l'onde E; l'onde A représente moins de 20% du gain en volume télédiastolique. B: insuffisance diastolique; l'onde A est responsable de la moitié du remplissage.
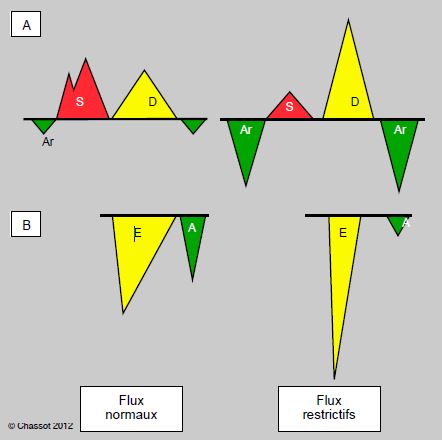
Figure 5.82 : Flux dans les veines pulmonaires (A) et à travers la valve mitrale (B) en situation normale et lors d'insuffisance diastolique restrictive sévère. Au cours de la contraction auriculaire, le flux rétrograde (Ar) dans les veines pulmonaires est faible; la majeure partie du flux (A) coule à travers la valve mitrale car le ventricule est très compliant. Lors de restriction, le flux rétrograde (Ar) est plus important que le flux antérograde (A), à cause de non-distensibilité du VG.
Comme elle est directement proportionnelle au gradient de pression entre l'amont et l'aval du point de mesure, la vélocité d'un flux de remplissage est tributaire de la pression qui règne dans les veines pulmonaires et dans l'OG (ou dans les veines caves et dans l'OD). Il existe donc des interférences de mesure majeures entre la fonction diastolique d'une part, et la volémie ou la précharge d'autre part (voir Chapitre 25 Flux de remplissage). Pour éviter ce piège, on peut utiliser des techniques échocardiographiques peu dépendantes de la précharge qui sont spécifiques d'une phase de la diastole.
- Relaxation active protodiastolique: vitesse de propagation du flux mitral à l'intérieur du VG (Figure 25.199);
- Elasticité mésodiastolique: pente de décélération du flux E mitral (tDE, Figure 5.74);
- Distensibilité télédiastolique: différence entre la durée de l’onde A rétrograde dans les veines pulmonaires et celle de l’onde A antérograde à travers la valve mitrale.
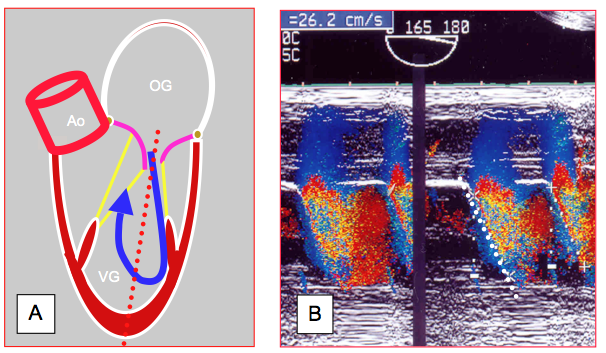
Figure 25.199 : propagation du flux mitral. A : l’axe du flux mitral est dirigé vers la paroi latéro-postérieure et fait un angle d’environ 20° avec le long-axe du VG (pointillé rouge). B : Pendant la phase de relaxation protodiastolique, il se forme un gradient de pression important entre l’OG et l’apex du VG. Plus ce gradient est élevé, plus le flux se propage rapidement à l’intérieur du VG. En mode TM couleur, la pente de vélocité du flux est d’autant plus importante que la relaxation est plus efficace (normal : > 50 cm/s). En cas de défaut de relaxation, cette pente diminue, dans le cas présent à 26 cm/s.
Le rapport E/E’ entre la vélocité maximale du flux mitral protodiastolique (E) et celle du mouvement simultané de l’anneau mitral (E’) permet une évaluation de la POG, qui est > 18 mmHg lorsque ce rapport est > 15 [2,18]. Associé à la durée de décélération du flux mitral (Etd), ce rapport permet également de construire un algorithme simple pour stratifier les patients selon le degré de leur atteinte diastolique (Figure 5.83) [30].
- Vélocité E’ ≥ 10 cm/s : situation normale;
- Vélocité E’ < 10 cm/s :
- E/E’ < 8, Etd > 200 ms : défaut de relaxation;
- E/E’ 9-12, Etd 130-150 ms : pseudonormalisation;
- E/E’ > 13, Etd < 120 ms : restriction.

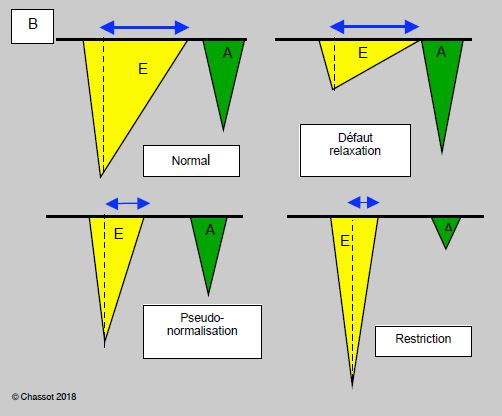
Figure 5.83: Données écho Doppler en cas de dysfonction diastolique. A: Rapport E/E’ entre la vélocité maximale (Vmax) du flux mitral protodiastolique E (Doppler spectral) et celle du mouvement de l’anneau mitral E’ en protodiastole (Doppler tissulaire, DT) à l’ETO. La Vmax du flux mitral augmente lorsque la POG s’élève, puisque cette dernière est la pression d’amont de ce flux. En cas de dysfonction diastolique, la vélocité de l’anneau mitral diminue (ce qui est le cas dans la figure), car elle traduit le défaut de relaxation longitudinale du VG. Le rapport E/E’ sera donc élevé. Lorsque ce rapport est bas (< 8), la relaxation et le remplissage sont normaux, et la PAPO est basse. S’il est > 15, la PAPO est > 18 mmHg (r = 0.82). L’âge et l’hypovolémie peuvent augmenter ce rapport de manière disproportionnée à la POG. B: durée de la phase de décélération du flux E (double flèche bleue) dans les 3 catégories de dysfonction diastolique.
La prévalence de la dysfonction diastolique est de 20% en chirurgie vasculaire, de 50% chez les malades de plus de 70 ans, et de 30-70% chez les patients cardio-chirurgicaux [11,33]. La dysfonction diastolique est le premier élément qui apparaît lors d'ischémie aiguë: la phase de relaxation est immédiatement prolongée [12]. L'atteinte diastolique est beaucoup plus marquée dans l'ischémie par demande excessive d'O2 (demand ischemia), telle l'exercice ou l'élévation de postcharge (clampage de l'aorte, par exemple), que dans l'ischémie par apport insuffisant (supply ischemia lors d'hypotension ou d’occlusion coronarienne) [34]. Ce ralentissement de la relaxation diminue encore la perfusion coronaire, car la contraction persiste en phase protodiastolique, comprime les vaisseaux intra-myocardiques et raccourcit le temps de perfusion efficace. Lors d'un infarctus, l'élasticité du ventricule commence par augmenter parce que la paroi s'amincit et que le ventricule se dilate; elle diminue lors de la phase de cicatrisation et de fibrose en fonction de l'étendue de la lésion [22].
L’élévation de la POG produit le même degré d’hypertension pulmonaire postcapillaire que lors de défaillance systolique gauche ou de pathologie mitrale ; elle est également accompagnée d’une hypertension artérielle pulmonaire réactionnelle dans la moitié des cas (voir Hypertension pulmonaire) [7]. Tous ces phénomènes se retrouvent à des degrés divers dans le vieillissement (voir Chapitre 21 Le patient âgé). La pathologie diastolique a été décrite essentiellement pour le VG, mais la rigidité atteint également le VD ; toutefois, la dysfonction diastolique droite est difficile à diagnostiquer.
| Dysfonction diastolique |
|
La dysfonction diastolique est caractérisée par une élévation des pressions de remplissage pour les mêmes volumes ventriculaires. Elle se subdivise en deux entités.
- Défaut de relaxation protodiastolique, fréquent et bénin (âge, HVG, ischémie)
- Défaut de distensibilité holodiastolique, rare et de mauvais pronostic (cardiomyopathie restrictive, infiltrations, œdème)
La dysfonction diastolique a quatre conséquences hémodynamiques. - Pression de remplissage plus élevée pour le même volume (PVC et PAPO ↑)
- Volume télédiastolique fixe
- Volume systolique et pression artérielle très dépendants de la précharge
- Volume systolique et pression artérielle très dépendants de la normocardie
La dysfonction diastolique est diagnostiquée par la présence de: - Fonction systolique conservée
- Remodelage concentrique du VG
- Rapport E/A du flux mitral anormal
- E/E' > 15
- Décélération du flux mitral E > 200 ms ou < 120 ms
- BNP et NT-proBNP modérément élevés
|
Insuffisance diastolique
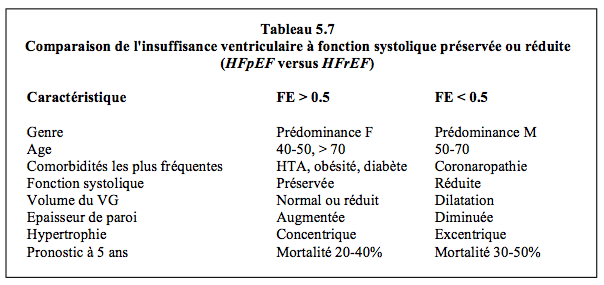
L'insuffisance diastolique se définit comme une défaillance congestive symptomatique du VG avec dilatation de l'oreillette gauche et stase en amont, mais sans altération de la fonction systolique (FE > 0.5) [33]. Le tableau clinique se traduit par une accumulation de liquide interstitiel pulmonaire, un frein aux échanges gazeux et une dyspnée, d'abord à l'effort puis au repos. Au niveau du VD, elle cause une hépatomégalie, de l'ascite et des oedèmes périphériques. L'insuffisance diastolique à fonction systolique préservée (HFpEF) représente 40-50% des cas d'insuffisance cardiaque congestive [6,32]. Par rapport à celle de l’insuffisance systolique, qui est de 10-15%, la mortalité annuelle de l’insuffisance diastolique est inférieure d’un tiers : 5-12% (OR 0.68) ; par rapport à la population générale, par contre, sa présence augmente de 2.5 fois le risque de décès [6,16,33]. Elle est plus fréquente chez la femme que chez l’homme. Elle est un facteur de mortalité en cas de choc septique et de chirurgie cardiaque [5,8,17]. En chirurgie générale, elle double le risque d'accident cardiovasculaire et triple la mortalité postopératoire [11]. Elle augmente les difficultés hémodynamiques au sortir de CEC [9]. L'insuffisance diastolique se développe très tôt dans l'évolution de l'hypertrophie du VG sur hypertension, alors que l'insuffisance systolique est plus tardive (Tableau 5.7) [1,29].
Il est difficile de mettre en évidence cliniquement une insuffisance diastolique. Il s'agit avant tout d'un diagnostic de présomption basé sur la présence de dyspnée. On ne peut l'objectiver que par une échocardiographie, une ventriculographie ou une IRM. Comme cette notion est importante pour la prise en charge hémodynamique périopératoire des patients chirurgicaux, il faut garder à l'esprit les situations dans lesquelles la diastole est très probablement perturbée.
- Augmentation de la masse myocardique et du réseau collagéno-fibreux : hypertrophie concentrique du VG (hypertension artérielle, sténose aortique, cardiomyopathie hypertrophique).
- Perte de myocytes et augmentation des fibrocytes: nouveau-né, vieillard, ischémie aiguë, infarctus étendu, cardiomyopathie restrictive.
- Infiltrations myocardiques : collagénoses, amyloïdose, œdème post-CEC.
- Augmentation de la tension de paroi ventriculaire : insuffisance cardiaque systolique avec dilatation ventriculaire.
- Hypertrophie ventriculaire droite (BPCO, hypertension pulmonaire).
- Syndrome inflammatoire-métabolique : obésité, diabète, syndrome métabolique, insuffisance rénale.
- Comorbidités : apnée du sommeil, anémie, cachexie.
- Pathologie péricardique.
La baisse de compliance modifie la relation qui lie la pression et le volume. La courbe étant déplacée vers le haut et vers la droite, au même volume correspond une pression plus élevée (voir Figure 5.76). Un patient peut devenir sévèrement hypovolémique avec des POD et POG normales. A l’inverse, une faible surcharge de volume augmente substantiellement la POG et peut conduire à la stase et au pré-œdème pulmonaire. Peu perceptible cliniquement sauf à l'effort, l'insuffisance diastolique est très sensible aux modifications des conditions de remplissage cardiaque et des régimes de pression endothoracique parce que la pente de la courbe de Starling est ici très verticale. Aux mêmes variations de pression ou de volume endothoracique correspondent des variations très grandes du volume systolique qui se traduisent par d’amples variations de la pression artérielle sous ventilation contrôlée en pression positive (IPPV) (voir Figure 5.97). L’insuffisance diastolique va induire des perturbations hémodynamiques majeures lors de modifications apparemment peu significatives des régimes de pression et de précharge (intolérance à l'hypovolémie). Lors de l’induction de l’anesthésie et de la curarisation, elle retentit durablement sur le débit systolique et la pression artérielle (voir Interaction cardio-respiratoires, Effets hémodynamiques). D'autre part, les difficultés du remplissage ventriculaire imposent une contrainte de temps à la diastole. La tachycardie ne peut pas compenser adéquatement la baisse du volume systolique, parce que le manque de souplesse du ventricule ne permet pas de raccourcir la diastole ; le débit cardiaque baisse. La bradycardie n’est pas mieux supportée, car le volume télédiastolique n’augmente pas malgré la longueur de la diastole à cause de la non-distensibilité du ventricule ; le débit cardiaque baisse également. Vu son manque de distensibilité, le ventricule dépend largement de la contraction auriculaire pour atteindre son Vtd optimal.
L’impact hémodynamique de l'insuffisance diastolique porte sur quatre points.
- Modification de la compliance (relation P-V diastolique):
- Pressions de remplissage élevées;
- Stase pulmonaire, dyspnée;
- Hypovolémie à PVC ou PAPO normales;
- Elévation excessive des pressions de remplissage lors d’hypervolémie.
- Dépendance accentuée de la précharge:
- Intolérance à la baisse de précharge (hypovolémie);
- Variations respiratoires très marquées de la PA en IPPV.
- Intolérance à la tachycardie et à la bradycardie (incompétence chronotrope):
- Lenteur du remplissage ventriculaire (le débit baisse en cas de tachycardie);
- Fixité du volume télédiastolique à cause de la rigidité du ventricule (le débit baisse en cas de bradycardie car le Vtd ne peut pas augmenter).
- Dépendance de la systole auriculaire:
- Contraction auriculaire fournissant jusqu’à 50% du remplissage ventriculaire;
- Volume systolique très abaissé en cas de perte du rythme sinusal.
Les critères diagnostiques de l’insuffisance congestive à fonction systolique préservée sont basés sur la présence de dyspnée, sur l'absence de dysfonction systolique et sur certains signes admis comme pathognomoniques [1,16,18,24].
- Symptômes d’insuffisance cardiaque congestive (stase, dyspnée);
- FE > 0.5;
- Dilatation de l’OG (surface > 15 cm2/m, volume > 32 mL/m2);
- Pression télédiastolique du VG > 16 mmHg; alternative : PAPO > 15 mmHg;
- Rapport E/E’ > 15 (rapport entre la vélocité maximale du flux mitral protodiastolique E et celle du mouvement de l’anneau mitral E’ à l’échocardiographie) (voir Figure 5.83) [2];
- Durée de décélération du flux mitral > 200 ms ou < 120 ms;
- NT-proBPN > 220 pg/mL, BNP > 200 pg/mL;
- Absence de valvulopathie ou d'autre pathologie cardiaque.
Les patients étant souvent asymptomatiques au repos, il est possible que les valeurs échocardiographiques ne deviennent pathologiques qu'à l'effort, lorsque le retour veineux est augmenté. Dans ce cas, elles deviennent anormales au cours d'un écho de stress à la dobutamine, alors qu'elles ne devraient normalement pas se modifier à l'exercice [1].
Sur une courbe de PAPO, la non-distensibilité télédiastolique se manifeste par une onde "a" proéminente (voir Figure 6.23) ; l’importance de l’onde "v" est fonction de la compliance de l’oreillette gauche. La distension de l’OG caractéristique de l’insuffisance diastolique (> 32 mL/m2) est le marqueur d’une élévation chronique de la POG. En cardiologie comme après chirurgie cardiaque, elle est directement associée à la fibrillation auriculaire, dont l’incidence augmente de 4 fois (OR 4.1) [3,4].
| Insuffisance diastolique |
|
Environ 40-50% des insuffisances cardiaques congestives caractérisées par une stase et une dyspnée sont des insuffisances diastoliques à fonction systolique conservée (FE > 0.5).
L'insuffisance diastolique est fréquente en cas de: HVG concentrique, âge avancé, ischémie, dilatation VG/VD, HVD. Elle est pathognomonique de: nouveau-né, infiltrations (fibrose, œdème), cardiomyopathie restrictive, restriction péricardique.
Impact hémodynamique en clinique.
- Pression de remplissage élevée (PVC, PAPO 28)
- Dépendance accentuée de la précharge, intolérance à l'hypovolémie et à l’hypervolémie
- Intolérance à la bradycardie et à la tachycardie
- Dépendance du rythme sinusal
Même paucisymptomatique, l'insuffisance diastolique double le risque cardiovasculaire et triple la mortalité opératoire.
Critères diagnostiques de l'insuffisance diastolique:
- Symptomatologie de stase gauche (dyspnée)
- Fonction systolique conservée
- Remodelage concentrique du VG
- Dilatation de l'OG
- Ptd VG > 16 mmHg
- Rapport E/A du flux mitral anormal
- E/E' > 15
- Décélération du flux mitral E > 200 ms ou < 120 ms
- BNP et NT-proBNP modérément élevés
|
© CHASSOT PG Août 2010, dernière mise à jour Novembre 2019
Références
- ABBATTE A, ARENA R, ABOUZAKI N, et al. Heart failure with preserved ejection fraction: refocusing on diastole. Intern J Cardiol 2015; 179:430-40
- ARQUES S, ROUX E, LUCCIONI R. Current clinical applications of spectral tissue Doppler echocardiography (E/E’ ratio) as a noninvasive surrogate of left ventricular diastolic pressures in the diagnosis of heart failure with preserved left ventricular systolic function. Cardiovasc Ultrasound 2007; 5:16
- ASHES CM, YU M, MEINERI M, et al. Diastolic dysfunction, cardiopulmonary bypass, and atrial fibrillation after coronary artery bypass graft surgery. Brit J Anaesth 2014; 113:815-21
- BARDIA A, MONTEALEGRE-GALLEGOS M, MAHMOOD F, et al. Left atrial size: An underappreciated perioperative cardiac risk factor. J Cardiothorac Vasc Anesth 2014; 28:1624-32
- BERNARD F, DENAULT A, BABIN D, et al. Diastolic dysfunction is predictive of difficult weaning from cardiopulmonary bypass. Anesth Analg 2001; 92:291-8
- BERRY C, DOUGHTY RN, GRANGER C, et al. The survival of patients with heart failure with preserved or reduced left ventricular ejection fraction: an individual patient data meta-analysis. Eur Heart J 2012; 33:1750-7
- BORLAUG BA. The pathophysiology of heart failure with preserved ejection fraction. Nat Rev Cardiol 2014; 11:507-15
- BRUTSAERT DL, SYS SU, GILLEBERT TC. Diastolic dysfunction in post-cardiac surgical management. J Cardiothor Vasc Anesth 1993; 7(suppl 1):18-20
- DENAULT AY, COUTURE P, BUITHIEU J, et al. Left and right ventricular diastolic dysfunction as predictors of difficult separation from cardio-pulmonary bypass. Can J Anesth 2006; 53:1020-9
- DUNLAY SM, ROGER VL, WESTON SA, et al. Longitudinal changes in ejection fraction in heart failure patients with preserved and reduced ejection fraction. Circul Heart Fail 2012; 5:720-6
- FLU WJ, VAN KUJIK JP, HOEKS SE, et al. Prognostic implications of asymptomatic left ventricular dysfunction in patients undergoing vascular surgery. Anesthesiology 2010; 112:1316-24
- GROSSMAN W. Diastolic dysfunction in congestive heart failure. N Engl J Med 1991; 325:1557-64
- KRAIGHER-KRAINER E, SHAH AM, GUPTA DK, et al. Impaired systolic function by strain imaging in heart failure with preserved ejection fraction. J Am Coll Cardiol 2014; 63:447-56
- KUMAR R, CHARONKO J, HUNDLEY WG, et al. Assessment of left ventricular diastolic function using 4-dimensional phase-contrast cardiac magnetic resonance. J Comput Assist Tomogr 2011; 35:108-12
- LEWIS GA, SCHELBERT EB, WILLIAMS SG, et al. Biological phenotypes of heart failure with preserved ejection fraction. J Am Coll Cardiol 2017; 70:2186-200
- McMURRAY JJ, ADAMOPOULOS S, ANKER SD, et al. ESC Guidelines for the diagnosis and treatment of acute and chronic heart Failure. Eur Heart J 2012; 14:803-69
- MUNT B, JUE J, GIN K, et al. Diastolic filling in human severe sepsis: an echocardiographic study. Crit Care Med 1998; 26:1829-33
- NAGUEH SF, SMISETH OA, APPLETON CP, et al. Recommendations for the evaluation of left ventricular diastolic function by echocardiography: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. J Am Soc Echocardiogr 2016; 29:277-314
- NICOARA A, JONES-HAYWOOD M. Diastolic heart failure: diagnosis and therapy. Curr Opin Anesthesiol 2016; 29:61-7
- NISHIMURA RA, HOUSMANS PR, HATLE LK, TAJIK AJ. Assessment of diastolic function of the heart: Background and current application of Doppler echocardiography. Part I: physiologic and pathophysiologic features. Mayo Clin Proc 1989; 64:71-81
- NISHIMURA RA, HOUSMANS PR, HATLE LK, TAJIK AJ. Assessment of diastolic function of the heart: Background and current application of Doppler echocardiography. Part II: clinical studies. Mayo Clin Proc 1989; 64:181-204
- PAGEL PS, GROSSMANN W, HAERING M, WARLTIER DC. Left ventricular diastolic function in the normal and diseaesed heart. Anesthesiology 1993; 79:836-54 (Part I) et 79:1104-20 (Part II)
- PAULUS WJ, TSCHÖPE C. A novel paradigm for heart failure with preserved ejection fraction. J Am Coll Cardiol 2013; 62:263-71
- PAULUS WJ, TSCHÖPE C, SANDERSON JE, et al. How to diagnose diastolic heart failure: A consensus statement on the diagnosis of heart failure with normal left ventricular ejection fraction by the Heart Failure and Echocardiographic Associations of the European Society of Cardiology. Eur Heart J 2007; 28:2539-50
- SENNI M, PAULUS WJ, GAVAZZI A, et al. New strategies for heart failure with preserved ejection fraction: the importance of targeted therapies for heart failure phenotypes. Eur Heart J 2014; 35:2797-811
- SHAH SJ, KATZ DH, SELVARAJ S, et al. Phenomapping for novel classification of heart failure with preserved ejection fraction. Circulation 2015; 131:269-79
- SHAH SJ, KITZMAN DW, BORLAUG BA, et al. Phenotype-specific treatment of heart failure with preserved ejection fraction. Circulation 2016; 134:73-90
- SHARMA K, KASS DA. Heart failure with preserved ejection fraction. Mechanisms, clinical features, and therapies. Circ Res 2014; 115:79-96
- SMITH VE, SCHULMAN P, KARIMEDDINI MK, et al. Rapid ventricular filling in left ventricular hypertrophy: II: Pathologic hypertrophy. J Am Coll Cardiol 1985; 5:869-74
- SWAMINATHAN M, NICOARA A, PHILLIPS-BUTE BG, et al. Utility of a simple algorithm to grade diastolic dysfunction and predict outcome after coronary artery bypass graft surgery. Ann Thorac Surg 2011; 91:1844-51
- TOLEDO C, ANDRADE D, LUCERO C, et al. Cardiac diastolic and autonomic dysfunction are aggravated by central chemoreflex activation in heart failure with preserved ejection fraction rats. J Physiol 2017; 595:2479-95
- VASAN RS, LARSON MG, BENJAMIN EJ, et al. Congestive heart failure in subjects with normal versus reduced left ventricular ejection fraction: prevalence and mortality in a population-based cohort. J Am Coll Cardiol 1999; 33:1948-55
- ZILE MR, BRUTSAERT DL. New concept in diastolic dysfunction and diastolic heart failure: Part I. Diagnosis, prognosis, and measurement of diastolic function. Circulation 2002; 105:1387-93
- ZILE MR, SMITH VE. Relaxation and diastolic properties of the heart. In: FROZZARD H.A, ed. The heart and cardiovascular system, Scientific Foundations, 2nd edition. New York, Raven Press, 1991, pp 1353-1367
